
摘要:自组装多肽是指能够在一定条件下, 通过π-π堆积、静电相互作用等分子间作用力, 形成组装体的多肽类材料. 此类材料具有良好的生物相容性和可控性, 能够形成颗粒、纤维和凝胶等纳米结构, 发挥特定的形貌学功能, 广泛应用在生物医学等领域. 为了满足药物递送、疾病诊疗等需求, 需要在多肽上进行修饰. 由于多肽的组装特性及其自身的生物功能, 修饰后的组装肽在组装能力和生物医学应用方面更具有优势, 所以如何进行自组装肽的功能化修饰一直是研究热点. 多肽修饰位点一般在两端的羧基和氨基, 以及氨基酸侧链上的活性基团. 为了降低修饰难度或避免影响目标分子的生物活性, 可以通过连接单元来修饰某些功能基团. 因此根据修饰方法可以分为直接修饰和间接修饰. 综述了近期自组装多肽的功能化修饰方法及相关应用.
自组装生物材料由于其在生物医学成像、药物递送及疾病诊疗方面的应用潜力受到广泛关注, 成为近年研究中的前沿领域之一[1-2]. 蛋白质、多肽等生物分子自组装过程广泛存在于自然界生物体的生理活动中, 其组装体具有良好的生物相容性, 以及在生物体内的可控组装功能, 能够实现在病灶区域的聚集和滞留. 近几十年来, 学者们在对氨基端、天然多肽、蛋白质的认识中得到了启示, 构建了自组装多肽[3]. 典型的自组装多肽KLVFF, 其序列来自于阿尔茨海默症相关的β-淀粉样蛋白[4-5], 除此以外, 人们从天然蛋白中筛选了许多有自组装潜力的多肽序列. 多肽自组装的推动力主要包括π-π堆积、静电相互作用、氢键和疏水作用等, 这些因素使得多肽组装形成特定的纳米结构[6]. 学者们在对天然自组装多肽的研究发现, 序列为FF的二肽具有良好的自组装能力, 这是由于侧链苯环的π-π堆积作用, 学者们根据FF为组装核心设计出了功能各异的自组装分子. 组装体中多肽的二级结构通常为β-片层和α-螺旋, 而组装体的形貌多样, 用途也不同[7]. 此外, 自组装多肽具有组装诱导滞留效应(AIR)[8], 即多肽在生物体中由于内源性的因素发生组装, 可以长效滞留在病灶区域, 增强聚集和效果, 降低对正常组织的毒性. 同时, 有些小分子本身也有自聚集的倾向, 比如含有大共轭π-体系的叶绿素分子[9-10], 通过修饰到自组装多肽上, 既可以发挥成像作用还可以增强目标分子组装能力.
近年学科融合的发展使得自组装多肽更多的被应用于生物、医学领域[11], 自组装多肽特点启发我们利用多肽自组装策略解决当前小分子药物存在的问题, 例如对病灶区域识别能力和富集能力差、体内循环中容易被降解、对于正常细胞和组织的毒副作用比较大等, 因此如何将这些功能性分子修饰在多肽上是一个值得我们研究的问题. 为了使自组装多肽可以在更广泛的领域应用, 在选择修饰方法的时候, 需要充分考虑功能分子的活性基团、空间位阻、合成效率、分子功能等, 所以选择适合的合成方法可以使多肽修饰事半功倍. 本文将通过对目前现有自组装多肽, 尤其是以FF二肽组装核心的多肽的修饰进行总结, 为之后的研究提供方法和思路.
自组装多肽的功能化修饰位点主要包括主链氨基和羧基, 以及侧链的氨基[12]、羧基[13]、羟基[14]和巯基[15]等. 如图1所示, 修饰方式主要分为两种: 一是直接修饰, 即功能分子与多肽直接共价偶联, 或是将活性基团活化以后将分子直接与多肽共价偶联. 此方法中的功能分子主要包括: (1)药物分子, 将药物分子直接修饰在多肽上, 实现药物的精准递送和疾病的治疗; (2)探针分子, 利用自组装多肽的AIR效应, 实现探针在病灶部位的高效富集, 增强成像的信噪比; (3)烷基链, 利用烷基链调节亲疏水平衡, 增强组装能力; (4)聚合物, 聚合物位阻大, 阻碍多肽组装, 但在特定的策略中需要聚合物的特性; (5)糖, 糖在生物体内参与多种生理活动, 糖肽自组装体能够通过多价配位效应、酶剪切等方式参与生理活动; (6)其他分子, 除了上述类型, 还有很多其他对多肽组装有价值的小分子. 我们将择其中应用较为普遍的进行讨论. 二是间接修饰, 即利用连接单元将功能分子与多肽连接. 一些分子有较大的空间位阻, 或者由于自身没有可以高效与多肽进行连接的活性基团, 需要引入其它分子作为连接单元。

1 直接修饰
1.1 药物分子修饰
利用小分子药物对病灶区域的识别、治疗和其自身的亲疏水等特性, 将其与自组装多肽材料共价偶连, 能够延长药物滞留, 增强药效, 降低毒副作用. 为了更方便地将药物分子连在多肽上, 需要将药物分子的某些官能团进行活化[16].
例如苯丁酸氮芥(CRB)又称瘤可宁, 是一种常用的抗癌药物. CRB具有的正苯丁酸基, 能够通过标准固相合成法(SPPS)共价连接到多肽的N端, 即使用苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸盐(HBTU)作为偶联剂, 将CRB的羧基活化后, 与多肽游离的氨基端反应生成酰胺键. 2020年, 梁春惠等[17]设计了一种新的自组装短肽CRB-YpYY, 将CRB作为递送药物和封端基团, 通过酰胺缩合共价结合到磷酸化短肽YpYY的氨基端, 替代了常用的萘和芴类封端基团. CRB-YpYY被肿瘤区域过表达的碱性磷酸酶剪切, 变为CRB-YYY, 原位自组装形成凝胶. 比起游离的CRB分子, 这种凝胶展现出更好的肿瘤抑制效果. 这种利用药物分子替代常用封端基团的方法, 为功能化短肽凝胶因子的设计提供了新的思路.
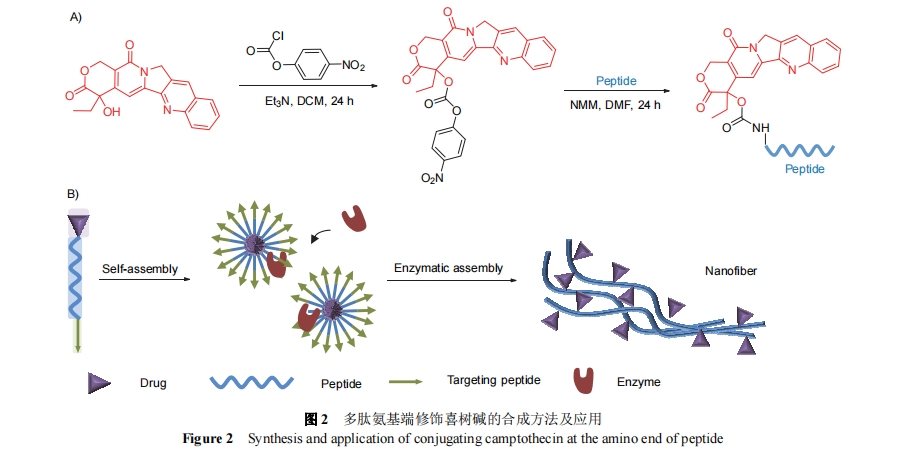
喜树碱(CPT)作为抗癌药物对肠胃癌、肝癌和头颈癌具有很好的治疗效果. 王浩课题组[18]通过对喜树碱的羟基进行活化, 使其能够很方便地通过固相合成共价结合到多肽裸露的氨基上. 如图2所示, 喜树碱与对硝基氯甲酸苯酯(npc)在碱性环境中反应得到CPT-npc, 使喜树碱可以更容易地与多肽相连. 喜树碱分子上的羟基被硝基氯甲酸苯酯活化后, 进一步通过固相合成接到多肽裸露的氨基端. 将药物分子修饰在多肽上后, 全长分子可以形成组装体, 这种组装体的亲水性更加可控, 并能在特定区域发生酶响应, 释放药物, 达到药物精准递送和缓释的目的. 2019年, 程冬炳等[18]利用该方法设计了CPT-LFPR分子, 分子由喜树碱和带有靶向和剪切序列的自组装多肽组成. 该分子能够靶向实体瘤, 进入细胞后分子被剪切, 剩下带有药物分子的组装序列, 自组装成纤维, 长期滞留在病灶区域并持续释放游离的药物分子. 这种方式可以减少抗癌药物对人体的副作用, 同时自组装多肽的AIR效应可以使药物缓慢释放, 提高治疗效果.
-硝基-2,1,3-苯并氧杂噁二唑(NBD)作为一种环境敏感的荧光基团, 在疏水环境中荧光增强, 可以结合自组装用于特定区域成像. 徐兵课题组[19]使用NBD-Cl, 合成了k(NBD)模块, 即NBD-ɛ-D-赖氨酸, 可直接通过固相合成共价结合到多肽裸露的氨基端. 合成过程如图3所示, 先利用Boc基团保护的赖氨酸与NBD的亲核取代反应, 及后续的去保护反应获得中间体k(NBD), 再通过偶联反应进行多肽修饰.
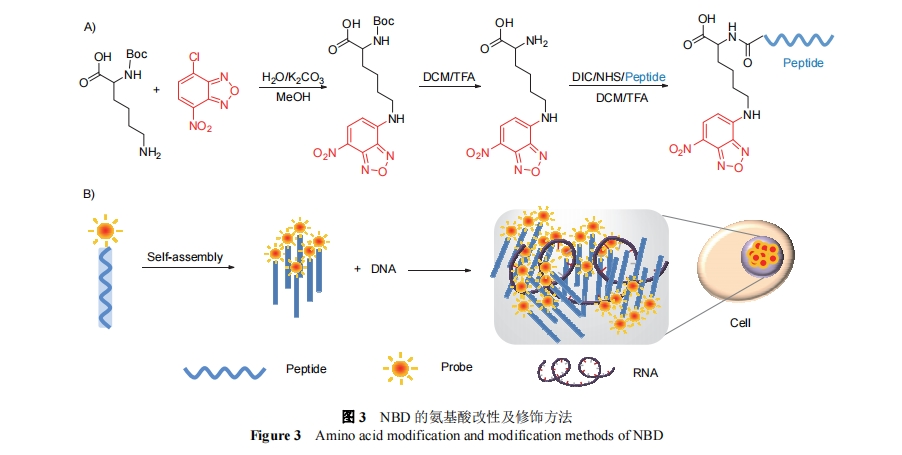
2019年, 徐兵和王怀民等[19]使用该方法, 将NBD修饰到多肽上, 设计了一种和胸腺嘧啶共价结合的肽衍生物D-2, 其包含可以促进组装的苯丙氨酸序列FF和能够与三磷酸腺苷特异性结合的天冬氨酸氨基酸序列KKFKLKL. D-2能通过自组装形成寡聚体, 与RNA结合后进一步组装形成复合物, 纤维中的胸腺嘧啶引发DNA复制过程中的DNA损伤, 从而诱导细胞凋亡, 整个过程可以通过观察NBD的荧光来进行监测. 同年, 梁春惠等[20]使用相同合成条件和步骤, 得到了NBD-β-丙氨酸, 设计了一种细胞摄取和核积累增强的自组装多肽分子Comp. 2. 分子由三部分构成: NBD-β-丙氨酸、磷酸化多肽序列FFpYG和抗肿瘤多肽序列TSFAEYWNLLSP. Comp. 2在ALP酶切后自组装形成凝胶, 能够发挥持续的抗肿瘤效果.
1.2.1 近红外荧光探针
由于细胞与组织的自发荧光在近红外区域最小, 使用近红外探针进行成像, 能够显著提升组织穿透能力, 提供更高的特异性和灵敏度. 王浩课题组[21]合成了一种氯取代的近红外菁类染料Cy-Cl, 合成方法如图4所示, Cy-Cl能够与多肽的侧链巯基在pH=7.5的Tris-Cl缓冲液中, 发生亲核取代反应, 经纯化后得到Cy修饰的自组装多肽, 并实现对多种疾病的检测. 2019年, 赵小小等[22]基于此合成方法, 设计了一种原位自组装荧光探针, 用于对微小肿瘤的检测. 分子通过血液到达肿瘤相关成纤维细胞时, 被细胞过表达的成纤维细胞活化蛋白α (FAP-α)剪切, 触发原位自组装, 实现肿瘤部位的高效富集, 增强了探针的灵敏度和成像能力, 对于2 mm的微小肿瘤也有良好的成像效果.
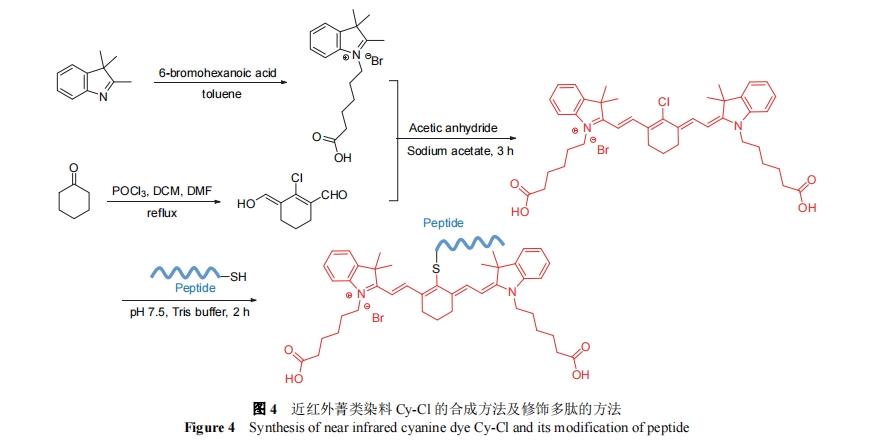
2020年, 安红维等[23]利用Cy-Cl分子设计了一种原位自组装近红外多肽探针, 用于肾癌肿瘤的成像. 探针分子包括三个模块: (1) RGD肽段, 用于靶向肾癌细胞过表达的αvβ3整合素; (2) PLGYLG肽段, 能够被肿瘤区域过表达的金属基质蛋白酶2/9 (MMP-2/9)剪切; (3) Cy修饰的YLGFFC肽段, 也是酶剪切后的残基, 可以组装形成具有β-片层结构的纳米纤维. 利用组装体的肿瘤特异性排泄延迟(TER)效应, 实现了对肾癌肿瘤的高灵敏度成像. 相比于传统探针, 使用该探针进行肾癌实体瘤切除的术中导航有利于肿瘤的完全切除, 并减少术后复发.
1.2.2 聚集诱导发光类(AIE)荧光探针
具有聚集诱导发光(aggregation-induced emission, AIE)特性的探针分子近年受到广泛关注, 与通常荧光分子聚集以后荧光容易淬灭相反, 此类探针分子在溶液中几乎不发光, 但聚集状态下呈现发光增强的现象[24]. 基于这种特性, AIE单元与自组装多肽结合能够得到性能优越的荧光探针. 首先, AIE类分子通常具有大共轭体系, 其强疏水性提供了组装驱动力, 分子间π-π相互作用能够稳定组装体, 这强化了多肽探针的组装能力. 其次, AIE现象增强了组装体与游离分子荧光的对比度, 能显著提升信噪比, 而多肽的组装恰好可以促进AIE分子聚集. 因此相比于其他的荧光探针修饰, AIE类荧光团修饰的自组装多肽在成像诊断等医疗应用方面有显著优势[25⇓-27].
王浩课题组[28]首次合成了一种双芘分子(BP), 具有AIE性质, 此分子具有双芘结构, 可形成J型纳米聚集物. BP的合成过程如图5所示, 在三氯化铝存在下, 通过Friedel-Crafts酰基化反应将芘和烷基(芳基)二氯合成了BP, 再对其进行羧基衍生, 得到的产物能够通过固相合成与多肽游离氨基通过酰胺键共价连接. 2016年, 杨培培等[29]报道了一种可以形成超分子结构的分子BKP, 第一次将BP用于自组装多肽材料. BKP分子由BP分子、KLVFF组装多肽序列和聚乙二醇(PEG)三部分组成, 其中BP分子的疏水性质和π-π堆积有利于整个多肽分子的组装, 而PEG链可平衡整个分子的亲疏水性质. 该工作研究了PEG链的长度对自组装过程以及最终组装产物形态的影响.
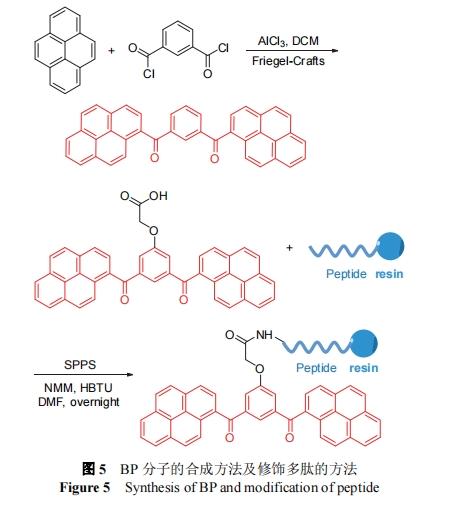
2017年, 杨培培等[30]报道了一种能用于肿瘤部位构建巢状主体的自组装多肽分子BP-KLVFF-His6-PEG, 该分子的设计与前面的工作相似, 不同于加入His6模块, 这个模块由六个组氨酸组成, 它的侧基带正电, 在肿瘤微酸性的环境下发生质子化, 疏水性增强, 促使组装发生. 分子注射进入荷瘤小鼠体内, 能够在肿瘤微酸环境下响应触发组装, 最终形成纤维结构. 有趣的是, 组装体能够捕获游离的尼罗红(NR)、吲哚菁绿(ICG)和阿霉素(DOX)等小分子, 作为客体嵌入β-片层, 使得肿瘤部位的荧光强度提升到7.5倍. 2020年, 樊禹等[31]利用类似的策略, BP修饰的多肽自组装纳米材料还被用于模拟人体防御素-6、层粘连蛋白和血小板, 并用于病灶区域的成像.
1.3 脂肪链修饰
脂肪链是结构简单的疏水性单元, 可以用于调控自组装多肽的亲疏水平衡, 修饰后的多肽能形成更加可控的组装体. 脂肪链修饰非常简单方便, 通常使用固相合成就能很方便地将脂肪酸偶联到多肽上[32-33]. 2013年, Sur等[34]设计了一种能够影响神经元分化和成熟的细胞外基质, 这种细胞外基质实际上是由一种肽两亲体PA组装形成的纤维组成的. PA由十六烷基和一段亲水多肽KKKGKDD组成. 在水环境中, 十六烷基更倾向于聚集在内部形成疏水区域, 亲水多肽会裸露在外, 由于多肽序列中含有带电氨基酸, 疏水内核与静电相互作用使得分子组装成β-片层结构, 组装成规整的纤维. 研究中使用PA组装成的基质, 实现了对海马神经元在发育的调控. 2019年, Sato等[35]利用烷基化修饰的D、L型V3A3K3组装肽, 研究了多肽的手性对细胞毒性和细胞膜结合能力的影响.
同时, 对多肽进行类脂质修饰, 能够增强组装体成颗粒能力, 用于药物递送. 2020年, 徐兵课题组[36]设计了一种肽-脂质缀合物Flag-(C16)2, 这个分子由肽段DYKDDDDK和类脂质部分NH2-Gly-(C16)2连接合成, 在体外组装成胶束, 中间包载了一种抗生素氯霉素. NH2-Gly-(C16)2的合成如图6所示, 物质的量比为1∶1的二环己基碳二亚胺和N-羟基琥珀酰亚胺(NHS)与芴甲氧羰基(Fmoc)保护的甘氨酸(Gly)反应, 活化Gly的羧基, 十六烷基胺的氨基与氨基酸上的羧基反应, 得到NH2-Gly-(C16)2, 再通过相同的方式将NH2-Gly-(C16)2与多肽相连. 当分子包载药物进入体内, 亲水多肽序列可以被癌细胞线粒体上的酶剪切, 类脂质体则与线粒体膜融合, 使药物进入线粒体, 从而达到对癌细胞的杀伤作用. 由于烷基链的加入使多肽分子可以形成类脂质体的纳米组装体, 这种分子设计也可用于药物包载和递送, 当递送至特定部位, 酶的作用可以使组装体的形貌发生改变, 释放药物.

修饰烷基链有时不止是用来调节亲疏水平衡, 还可以有其他应用. 2018年, 张义铭等[37]设计了一种二乙炔(DA)修饰肽DA-EGGGGH, 用于金属离子的裸眼检测. 分子中多肽序列部分的EGG可以增加多肽端头的亲水性, GGH则用于与锌和铜离子配位, 触发组装. 10,12-二十五碳二炔酸被修饰在多肽的氨基端, 使分子含有二炔单元, 当分子组装以后, 通过紫外线照射, 二炔之间发生聚合反应, 产生蓝色的聚乙二炔. 由于该分子只有在金属离子存在时才能自组装成为凝胶, 再对其进行紫外照射才能显示出蓝色, 这种特性可以用于金属离子快速、灵敏的裸眼检测.
1.4 聚合物修饰
聚乙二醇(PEG)是一种低毒、低免疫源性的化合物, 是两亲性组装分子的常用修饰单元, 能够增强被修饰分子亲水端亲水能力, 减少材料递送损失, 延长分子在体内循环时间, PEG-NHS能够方便地通过固相合成偶联到多肽上, 得到PEG化多肽[38]. 2017年, 乔增莹等[39]设计了一种肿瘤部位响应产生毒性的自组装肽-聚合物偶联物P—S—H, 包括一个疏水的聚合物骨架(P), PEG修饰的金属基质蛋白酶-2(MMP-2)响应片段GPLGIAGQC (S)和pH响应肽HLAH (H). 在体外中性环境下P—S—H以P为疏水核, S为核壳, 形成纳米颗粒, 进入体内后在肿瘤的微酸环境(pH≤6.5)和过表达的MMP-2作用下, HLAH肽对酸性环境的响应及酶切序列对MMP-2的响应, 导致PEG保护层脱落. 最终形成氢离子包裹的带正电的纳米粒子, 这种粒子能够有效地内化到细胞中, 并破坏线粒体, 导致细胞凋亡.
同年, 乔圣林等[40]报道了一种内源性刺激诱导聚合(eSIA)策略. 研究中使用的温敏聚合物其相转变在37 ℃以下, 并且每个单元的支链末端都有一个炔基, 可以与酶相应多肽侧链的巯基发生迈克尔加成反应. 聚合物与1.3 equiv.的多肽和2.1 equiv.的三乙胺在二甲基亚砜中反应, 37 ℃下搅拌反应12 h, 透析袋纯化以后得到产物. 多肽修饰得到新聚合物的相转变温度在37 ℃以上, 当在生物体内遇到内源性的酶, 多肽被剪切脱离聚合物骨架, 相转变温度重新回到37 ℃以下, 生物体的体温使聚合物组装成纳米颗粒. 这种策略十分巧妙, 可以用于肿瘤成像.
1.5 糖基修饰
糖在人体内参与多种生命活动, 例如甘露糖可以靶向巨噬细胞, 同时糖上的羟基大大提高了整个分子的亲水性. 所以通过化学修饰, 将糖基偶联到多肽上可以进行多种应用[41-42]. 杨志谋课题组[43]利用化学方法合成了糖酪氨酸Fmoc-Tyr-[β-D-Glc(OAc)4]-OPfp, 作为氨基酸模块用于固相合成制备糖肽. 合成方法如图7所示, 首先用五氟苯酚对Fmoc-Tyr-OH的羧基进行保护, 得到Fmoc-Tyr-OPfp. 保护后的氨基酸可以直接与β-D-半乳糖五乙酸酯反应, 酪氨酸侧基上的羟基与糖上的乙酰基发生反应, 得到糖修饰的氨基酸. 终产物使用固相合成法偶联到多肽上, 在固相合成结束后脱除糖上乙酰基保护及五氟苯酚保护基, 最终通过固相合成将糖氨基酸连接到多肽上. 这种糖肽的糖苷键可以被酶剪切, 剪切后分子亲疏水发生改变, 多肽剪切残基能够形成纳米组装体.
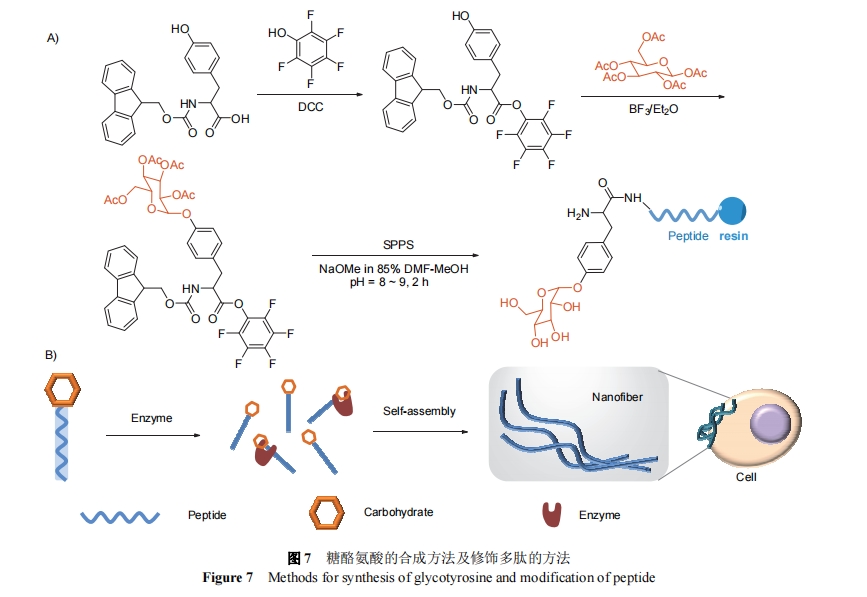
2019年, 徐腾焱等[43]使用该方法设计并合成了一种能在衰老细胞选择性组装形成凝胶的酶响应糖肽衍生物, 其能够在衰老细胞处受到过表达的β-半乳糖苷酶(β-Gal)剪切, 自组装性成凝胶. 凝胶进一步诱导衰老细胞细胞凋亡, 起到清除衰老细胞的作用.
1.6 其他小分子
除了上述分子, 其他小分子单元的引入也会对自组装多肽产生很大影响, 我们对于其中常见的、应用较为广泛的单元进行总结如下.
1.6.1 磷酸修饰
碱性磷酸酶(ALP)具有脱磷酸作用, 在多种癌细胞表面过表达, 被广泛用于控制两亲性肽的自组装. 磷酸分子基团体积小, 但有极强的亲水性, 多肽中引入磷酸基团会导致分子整体亲水性增加. 徐冰课题组[44]设计了一种合成磷酸化氨基酸的方法. 合成方法如图8所示, 酪氨酸与P2O5和磷酸的作用下反应, 得到磷酸化的酪氨酸, 磷酸酪氨酸的氨基与芴甲氧羰酰琥珀酰亚胺(Fmoc-OSu)在水相中反应, 对氨基酸的氨基进行保护, 最终得到Fmoc保护的磷酸酪氨酸. 通过固相合成法, 能够方便地将其作为氨基酸模块结合到多肽上, 得到磷酸修饰肽[44]. 在碱性磷酸酶的作用下, 磷酸基团从分子上脱落, 分子的亲疏水发生改变, 促使剪切残基形成组装体并聚集在细胞表面, 发挥相应的生物功能.
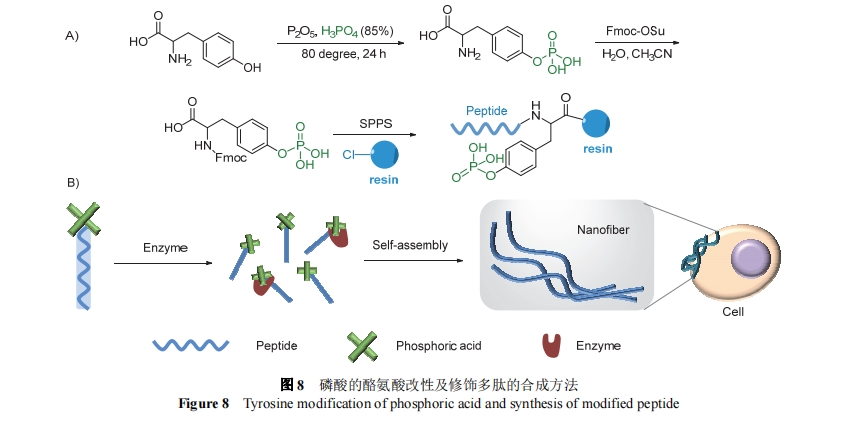
2018年, 战捷等[45]设计了一种肝癌细胞特异性摄取的自组装材料NBD-GFFpY-ss-ERGD, 这种分子分为三个模块: 荧光分子NBD作为探针基团, 磷酸化肽段GFFpY可以被肝癌细胞表面过表达的ALP剪切后组装成纳米颗粒, ERGD靶向肽模块通过二硫键与组装序列连接, 当纳米颗粒进入细胞, 胞内过表达的谷胱甘肽对二硫键进行剪切, 组装成纤维. 该分子通过肝癌细胞的多次识别, 实现了肝癌细胞对材料的特异性摄取, 为肝癌诊断和治疗超分子纳米材料的设计提供了一个有用的策略.
2019年, 冯赵骞琦等[46]利用磷酸修饰肽设计了一种自组装分子, 该分子能够对前列腺酸性磷酸酶(PAP)响应抑制性前列腺癌细胞(CRPC)生长. 在CRPC过表达的PAP作用下, 分子能够通过脱去磷酸基团, 触发自组装形成纤维, 抑制CRPC生长. 这个工作是第一个利用前列腺癌标志物PAP催化多肽自组装从而选择性抑制CRPC的例子, 这一策略为CRPC提供了一种潜在的替代疗法. 同年, 王宇涵等[47]利用该方法合成了一种化合物NBD-GFFpYG-CCK6, CCK-6能够特异性识别肿瘤细胞, 经由肿瘤部位过表达的ALP剪切, 触发自组装性成凝胶, 从而有效抑制了肿瘤细胞增殖.
2020年, Yang等[48]将富含色氨酸的短肽磷酸化, 设计了一种溶酶体累积分子. 富含色氨酸的多肽易于溶酶体累积, 相比于富含苯丙氨酸的疏水性多肽, 该分子细胞毒性较低. 这为利用色氨酸替换强疏水氨基酸进行自组装多肽研究提供了依据. 同年, 徐兵课题组[49]设计了一种能够递送药物硼替佐米(BTZ)的载体分子, 该分子可以在肿瘤细胞内特异性性释放磷酸化载体, 分子的组成包括两部分: (1) AVPI肽段, 能够选择性靶向凋亡蛋白抑制剂(IAPs), 进而诱导细胞凋亡; (2) Nap-pYFF, 通过ALP响应触发组装. 载体分子与BTZ体外组装形成胶束颗粒, BTZ包裹在疏水核内部, 胶束表面的磷酸基团能够特异性识别肿瘤细胞表面的ALP颗粒, 通过内吞作用进入细胞内部, 酶剪切后的颗粒形貌转变形成纤维, 释放BTZ, 同时纤维表面的AVPI与癌细胞中的IAPs结合, 促使癌细胞凋亡. 有趣的是, 这种递送方式大大降低了BTZ对正常细胞的毒性, 为低毒的药物递送提供了一种新方式.
1.6.2 萘基团修饰
含萘单元(Nap)可以作为多肽的封端基团, 利用萘的π-π相互作用提升短肽的自组装和成胶能力. 2-萘乙酸能够直接通过固相合成方便地偶联到多肽上[50⇓-52]. 2017年, 罗子超等[53]设计了一种Nap封端的自组装D肽Nap-GFFY, 它可以组装形成三维纳米纤维网络, 能截留卵清蛋白(OVA), 发挥疫苗佐剂的效果. 相比于游离的OVA, 疫苗佐剂大大增强了免疫效果. 同时, 实验还验证了用生物素、Fmoc或吩噻嗪(PTZ)替代Nap进行封端, 将导致疫苗佐剂效果下降. 这一发现表明, 适当的芳香封端集团对GFFY的疫苗佐剂效力至关重要.
2019年, 商宇娜等[54]设计了一种新的肽基超分子蛋白胶(Nap-GFFYK(γE)2-NH2), 此化合物与蛋白质结合后, 迅速折叠成β-片层结构, 与蛋白质共同组装成纳米纤维和水凝胶. 这种超分子蛋白胶可以与葡萄糖氧化酶/辣根过氧化物酶(GOx/HRP)和GOx/细胞色素c (cyt c)共组装, 形成纳米纤维, 显著增强串联酶反应的催化活性, 显示出该超分子蛋白凝胶在构建多种蛋白复合物以及超分子治疗发展方面的巨大潜力.
2 多肽间接修饰
当功能分子单元与多肽连接需要通过连接基团偶联时, 这种修饰方式可以称作间接修饰. 为了实现某些生物功能或设计分子设计, 需要在多肽上连接不同种类的功能分子. 但由于有些功能分子空间位阻较大, 或者功能分子单元自身没有能与多肽反应的官能团等因素, 需要引入其他分子单元, 一端与多肽连接, 另一端与功能分子单元连接来达到目的. 多肽间接修饰的方法众多, 对其中较为常见的方法进行了介绍.
2.1 通过炔基和叠氮基团修饰
点击化学(Click chemistry)是一种简单高效的反应方式, 其中有代表性的就是叠氮-炔基基团之间的Husigen环加成反应, 这种方法可以被用在多肽修饰上[55]. 如图9所示, 王浩课题组[56]通过固相合成在多肽氨基端上连接己缺酸, 用叠氮乙酸对小分子进行改性, 叠氮修饰的多肽和带炔基的小分子发生点击反应, 连接处生成一个三唑, 得到最终产物. 利用这种方法对多肽进行修饰的优点在于: 分子利用高、反应条件温和、最终产物在复杂的生理环境中仍然保持稳定, 且可以根据分子设计对连接基团的碳链长度进行调整, 适合难与多肽高效偶联的小分子.
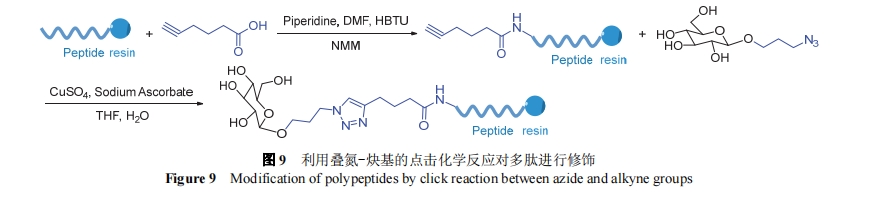
2020年, 费越等[57]通过类似的方法将作为一氧化氮供体的呋喃类分子单元与多肽相连, 一氧化氮供体通过叠氮和炔基基团之间的点击化学反应修饰在多肽上, 这种修饰方法有一定的灵活性, 即叠氮和炔基基团修饰的位置可以互换. 同年在卢士兆等[58]的工作中, 也通过叠氮基团和炔基的点击化学反应, 将聚集诱导发光(AIE)分子四苯乙烯两端连接多肽序列, 多肽片段中的FF有极强的自组装能力, 形成组装体以后, 中间的四苯乙烯聚集并且荧光被点亮. 可以用于胰腺肿瘤的成像.
2015年, 陈国钦等[59]报道了一种近红外荧光开启型探针[DBT-2(EEGK-maleimide)], 这种探针分为三部分: (1)分子中部是一个环境敏感单元4,7-二(2-噻吩基)-2,1,3-苯并噻二唑(DBT), (2)DBT两端为亲水平衡的多肽序列EEGK, (3)马来酰亚胺基团作为封端基团. 通过固相合成的方法, 将叠氮乙酸连接在多肽上. 马来酸酸酐先与丙氨酸连接, 再通过NHS进行修饰, 活化羧基端, 将其连接在赖氨酸的侧链氨基上. 最终, 通过炔基和叠氮基团的点击化学反应进行连接, 得到最终产物. 此分子在溶液中荧光很弱, 当遇到游离的巯基蛋白后, 分子和蛋白质组装成纳米粒子, 形成了疏水区域, 使DBT的荧光被点亮, 这种方法可以用于检测细胞中蛋白质硫醇. 同样使用这种方法的还有陈超等[60]的工作, 说明此方法有很好的普适性.
生物复杂环境下的反应和组装条件较为苛刻,需要化学反应高效和快速, 点击化学能够满足以上需求. 2019年, 王子琦等[61]提出了识别-反应-聚集(RRA)的级联策略用于肾癌的治疗. 分子P1-DBCD由一段有靶向功能的多肽和含有炔基的DBCD单元组成, 当其进入体内后会特异性靶向肾癌细胞. 分子P2-N3是一段含有组装序列KLVFF的多肽, 其氨基端修饰己炔酸作为连接单元, 侧链连接荧光分子Cy. 当P1-DBCD靶向在细胞表面以后, P2-N3到达肿瘤区域通过点击化学快速与P1-DBCD结合成为一个分子, 扩展了疏水单元, 在细胞表面组装成纤维使癌细胞的细胞膜受到扰动, 从而使得癌细胞对化疗药物DOX的敏感性增加. 由此看来, 这种多肽修饰的方法也可以在复杂生物环境中发生, 为自组装多肽的应用提供了新思路.
2.2 通过酸酐修饰
一些分子上存在羟基、氨基等能与羧基反应的基团时, 可以选择使用环状酸酐作为连接单元对多肽进行修饰. 在一定条件下, 羟基进攻酸酐的羰基碳, 发生开环的亲核取代反应生成酯基, 另一端的羧基暴露出来, 可以通过固相合成与多肽进行连接.
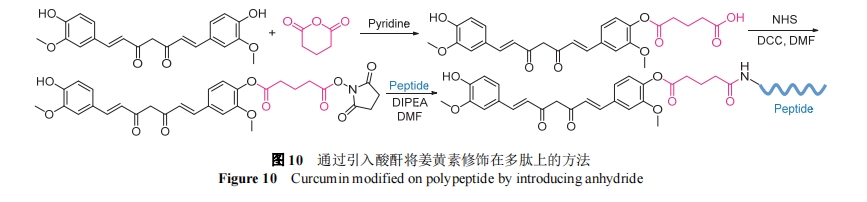
姜黄素(Curcumin)是一种酚类抗氧化物质, 对肝癌细胞有明显的抑制作用, 但其水溶性差, 无法广泛应用. 2017年, 陈国钦等[62]合成了一种可以形成水凝胶的多肽衍生物, 用于肝癌的治疗. GA-GFFYK(Cur)E-ss- ERGDd的骨架由一段组装序列GFFYK和亲水序列ERGD构成, 两段多肽通过二硫键相连, 多肽氨基端连接了甘草次酸(GA)作为靶头, 能够靶向肝癌细胞. 如图10所示, 姜黄素先与戊二酸酐反应, 利用二环己基碳二亚胺(DCC)和琥珀酰亚胺对产物的羧基进行活化, 通过固相合成与多肽连接. 该分子中的二硫键能被癌细胞中的谷胱甘肽识别并还原, 二硫键断裂, 残基组装成组装体, 缓慢释放姜黄素. 2018年, 徐华娥等[63]首次报道了可以自组装的多肽类分子Curcumin-FFE-CS-EE, 用于肿瘤治疗. 分子由两段多肽和姜黄素构成, 自组装短肽与亲水短肽通过二硫键连接, 姜黄素通过戊二酸酐与多肽连接(图10). 此多肽分子可以在谷胱甘肽(GSH)的作用下二硫键发生断裂, 亲疏水被打破以后多肽自组装形成纳米纤维和水凝胶. 这种凝胶作为增敏剂, 与放疗联合使用显著降低了大肠癌的肿瘤体积.
2017年, 孙占一等[65]设计了能够组装成纳米颗粒的分子Pam3CSK4-K5. 该分子为两亲性分子, 多肽氨基端和侧链连接的三个烷基链作为疏水端, 通过PEG单元连接寡聚赖氨酸K4和K5作为亲水端. 该分子通过静电相互作用和疏水作用, 自组装成纳米颗粒. 再与三种免疫刺激剂作用, 形成自组装纳米免疫刺激剂 (SANIs). SANIs可以用于肿瘤的免疫疗法, 抑制肿瘤生长.
3 总结与展望
近年来, 自组装多肽被广泛应用于生物、医学等研究领域, 其优势在于多肽不但可以通过氢键等分子间相互作用进行有序排列, 形成规整可控的组装体, 还可以通过生物体的内源性因素推动其在原位进行组装. 因此, 我们可以把自组装多肽作为一个良好的载体, 通过共价结合或者包载的方式与功能分子结合, 提升药物和探针等分子的效果.
在需要对多肽进行功能化修饰的时候, 选择适合的修饰方法可以使工作事半功倍, 即根据修饰分子的功能、空间位阻、是否有适合与多肽相连接的官能团等条件选择相应的修饰方法. 直接修饰方法的优势在于合成步骤少, 通常可以利用固相合成法进行修饰, 大大减少了合成难度; 但部分功能分子缺乏与多肽直接反应的基团, 无法直接修饰, 或直接修饰反应效率和产物纯度较低. 相比之下间接修饰反应效率高, 反应条件温和, 有着良好的普适性, 适用于难以直接与多肽发生反应或是需要与多肽之间保持一定距离的分子; 然而这种方法需要引入连接单元, 并且产物中功能分子基团和多肽之间会存在较大的距离, 合成步骤也相对更多.
综上所述, 根据功能分子的特点和功能需求选择恰当的修饰方式, 是自组装多肽修饰的关键所在, 也是未来发展新的自组装多肽功能化衍生面临的挑战. 近年来, 越来越多的学者从事自组装多肽的生物应用研究, 这对自组装多肽的功能化修饰提出了更高的要求. 因此需要不断拓展新的自组装多肽功能化修饰方法, 为自组装多肽衍生物的合成及应用提供新的选择和方向.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。