
摘要 对环肽进行了分类, 并对具代表性的经典型、DKP (Diketopiperazine, 哌嗪二酮)型、醚桥型、烯桥型、单硫及多硫醚型、刚性桥型、仲(叔)胺型、Mannich 碱型、联苯型及 Freidinger 型环肽的合成方法逐一进行了描述.
近几十年来从自然界、机体内或化学合成得到的大量肽化合物, 以高生物活性、低毒副作用的特点引起了药物化学家的高度关注. 许多情况下, 直链肽的分子柔曲性(flexibility)造成的构象易变使其与受体结合的强度及选择性受到影响. 此外, 机体内的氨肽酶及羧肽酶也很方便地从直链肽两个端基逐步切割肽链, 使之降解. 因此肽链的环化改造, 使其构象限定(constrained conformation)是改善肽分子生物稳定性、提高生物活性的理想途径之一. 不少研究已经证明, 从直链的先导结构肽改为环肽后使原有的生物活性提高十几倍至几万倍. 许多具有抗菌、抗病毒、抗肿瘤、免疫调节等活性的天然产物肽往往含有不同类型的主链环化结构. 本文拟从环肽的系统分类入手, 对一些链环(loop)中不同桥连结构的环肽特征及合成方法进行综述.
1 环肽分类
如何对在自然界起着重要作用的环肽进行分类, 至今尚无一个权威的、严格的标准. 本文从以下几个不同的角度进行归类:
1.1 从酰胺键角度分类
从酰胺键角度可将环肽分为均环肽(Homodetic cyclopeptides)和杂环肽(Heterodetic cyclopeptides)两类. 均环肽指主链环均由酰胺键连接, 因此桥连结构单一; 杂环肽指主链环中除了酰胺键外, 还有其它桥连结构, 因此又包括多种类型.
1.2 按来源分类
从来源角度可按图 1 对环肽进行分类:
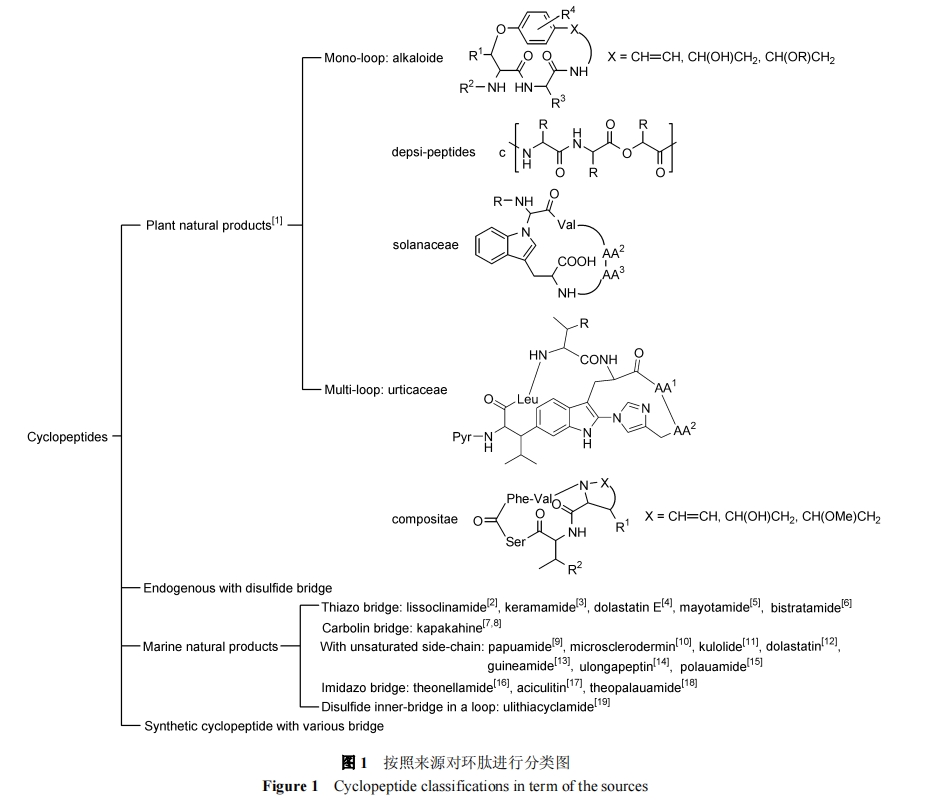
1.3 按桥头位置分类
按桥头位置可将环肽分为 7 类, 见图 2.
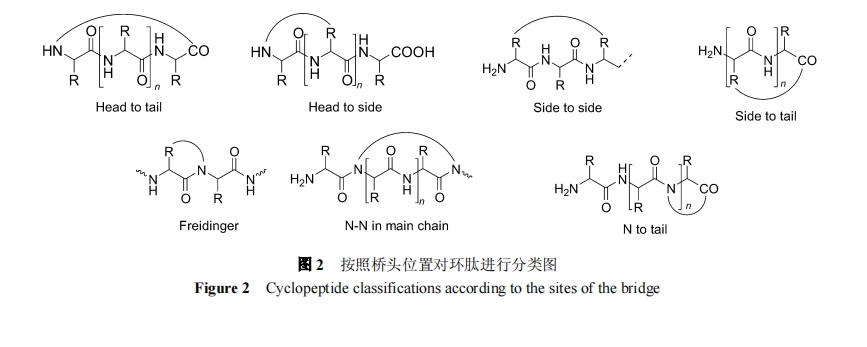
1.4 按桥连结构分类
按桥连结构可将环肽分为经典环肽和非经典环肽经典环肽又包括内酰胺桥、内酯桥和二硫桥; 非经典环肽包括醚桥、烯桥、单硫或多硫桥、刚性支架桥、胺桥、联苯桥、Mannich 碱桥、PNA (Peptide nucleic acid, 肽核酸)桥等.
1.5 按主链环数分类
按主链环数将环肽分为单 loop 型, 双 loop 型和多loop 型.
2 经典环肽合成
已有的各种环肽化合物中, 以内酰胺(又称均环肽)、二硫键或内酯键(depsi-)为桥连结构的环肽占绝大多数, 而且它们的合成方法比较常见、经典. 因此这三种环肽又被称为经典环肽.
2.1 内酰胺为桥的环肽合成
此类环肽的合成例很多, 总体上可以存在两个方式: (1)使用缩合剂的羧基活化型; (2)无缩合剂的分子内氨解型. 前者对均相溶液法及固相法都适用, 后者多用于固相合成. 已有文献记载的内酰胺环肽合成非常多, 下面仅介绍一些有代表性的方法.
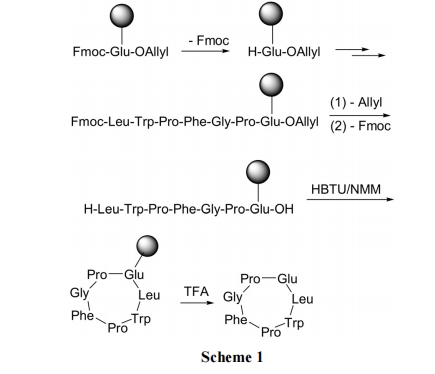
2.1.1 侧链连接固相法
利用谷氨酸(或天冬氨酸)的侧链COOH与固相载体形成酯键连接. 随后先脱除 Fmoc, 使谷氨酸的 α-氨基游离, 以便向 N 端组装肽链. 全部缩合完成后, 用钯试剂脱除 C 端 Allyl, 使谷氨酸的羧基游离; 再脱除 N 端的Fmoc, 使肽链N端氨基游离. 最后在缩合剂HBTU作用下, N 端及 C 端缩合形成内酰胺键形成环肽(Scheme 1)[20].
2.1.2 溶液假稀释法
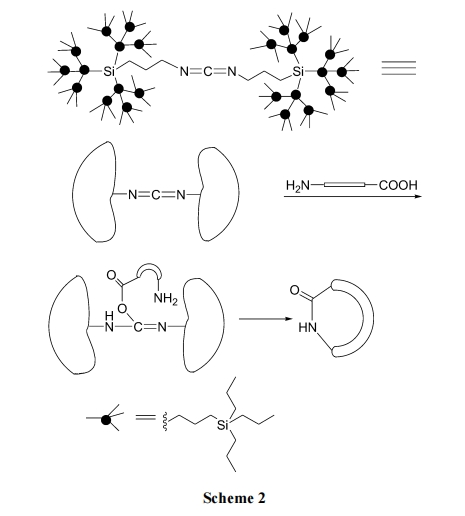
在传统溶液法进行分子内环合反应时, 为了避免分子间的缩合必需使反应物在溶液中尽量稀释. 然而这种高度稀释的条件会造成反应时间延长、副反应较多, 也给后处理带来不方便. 针对这种情况, Amore 等[21]使用一种空间位阻大的树突状硅烷取代的碳二亚胺作为缩合 剂 , 代 替 常 规 试 剂 DCC (N,N-dicyclohexylcarbodiimide, 二环己基碳二亚胺)进行溶液方式的内酰胺环肽合成, 得到纯度很高的目标产物(Scheme 2).
2.1.3 固相分子内氨解法
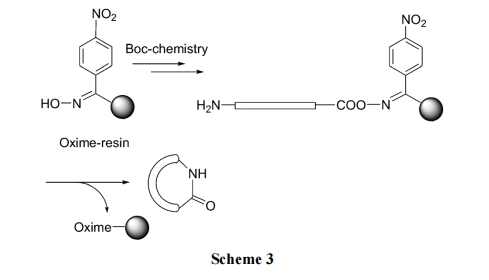
由于羧酸肟酯(RCOON=R')键对亲核试剂高度敏感, 可以使用以肟为 linker 的固相载体, 制备头-尾键合的内酰胺环肽. 最后一步环合不用缩合剂可以同时完成分子内氨解及脱除固相载体(Scheme 3)[22].
2.1.4 固相保险连接型分子内氨解法
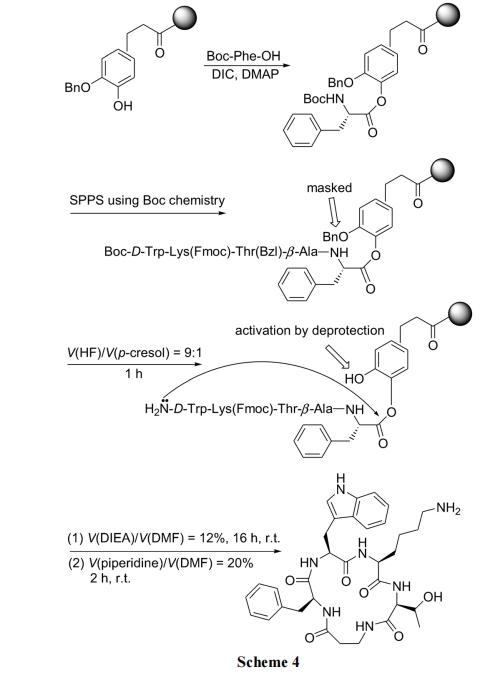
保险连接(Safety-catch linker)的特点是在目标结构的合成中非常稳定. 只有经特定的结构转化, 该 linker被活化后才发生裂解反应[23]. 下面的环肽合成以邻苄氧苯酚为保险树脂 linker 结构, 在肽链组装完成后脱除linker 上的苄基, 使邻位的酚酯键活化. 此时肽链 N 端氨基很容易进攻酚酯键, 发生分子内氨解, 得到环肽产物(Scheme 4)[24].
2.1.5 分子内硫酯交换/分子内氨解法
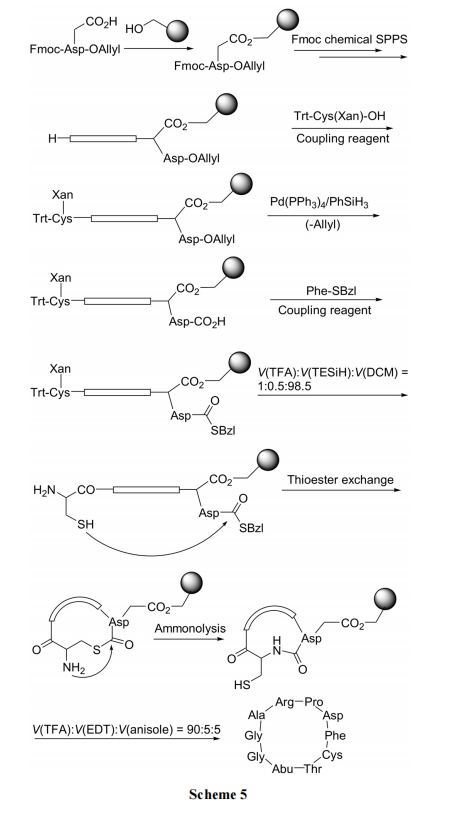
主要合成步骤依次为: (1)使 Fmoc-Asp-OAllyl 的侧链 COOH 与羟基树脂键合为苄酯型 linker; (2)脱除Fmoc, 并向 N 端组装肽链; (3)在 N 端引入 Trt-Cys(Xan)作为硫酯交换及氨解反应的前体结构; (4)脱除 C 端Asp-OAllyl 上的 Allyl 使 COOH 游离进而与 Phe-SBzl缩合, 形成硫酯交换反应的底物结构; (5)脱除 N 端 Cys上的两个保护基, 使 α-NH2及 SH 游离; (6)在 pH 7.5 条件下进行分子内硫酯交换及氨解反应, 形成内酰胺环肽; (7) TFA 切除 Asp 侧链上的固相载体, 使产物游离, 总收率高达 80% (Scheme 5)[25].
2.1.6 伪 Pro 协助寡肽环化法
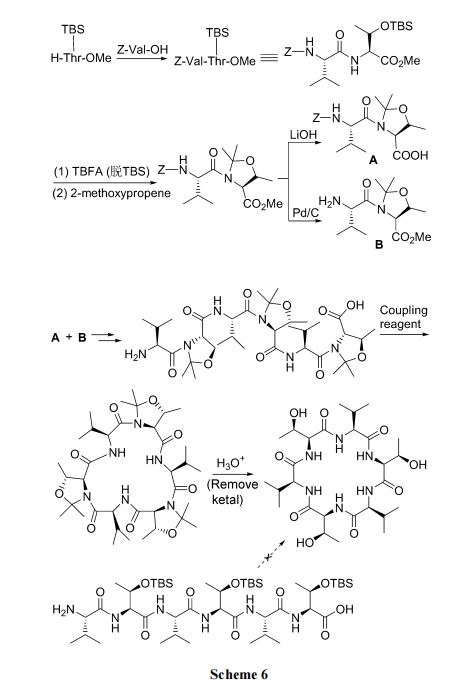
不含 Pro 或 Gly 的短链肽因张力影响很难被环化. 为此可以在组装肽链时把目标序列中的 Thr 残基用丙酮保护, 暂时生成五元环, 使其模拟 Pro 的转折诱发结构(turn inducer), 达到减弱寡肽链张力、易于环化的目的. 待环肽形成后, 经温和酸处理脱除丙酮保护基团, 恢复Thr 的结构. 此方式使产物总收率由<5%提高到 80%以上(Scheme 6)[26].
2.2 二硫桥环肽合成
此种环肽合成的方法学也很成熟. 主要合成方式为先组装肽链, 然后脱除半胱氨酸及其它残基上的侧链保护基. 最后用适当的氧化条件, 如空气, H2O2, I2, Hg2+盐, Fe3+盐, DMSO 等将游离的 SH 氧化为二硫键. 应该注意的是在溶液中进行分子内氧化反应时必须控制游离肽的浓度不宜过高, 一般在 1 mmol/L之下. 否则会存在分子间搭桥的副反应. 这就是保证分子内成键的高稀释原则. 相比之下, 固相合成发挥的假稀释效应(Pseudo-dilution effect)可以基本保证分子内氧化环合[27]. 当目标结构中含有两对以上二硫键时, 如何正确搭桥便成为关键. 下面将介绍几种不同的合成策略, 解决正确形成二硫键(主链 Folding)的问题.
2.2.1 热力学同步合环法
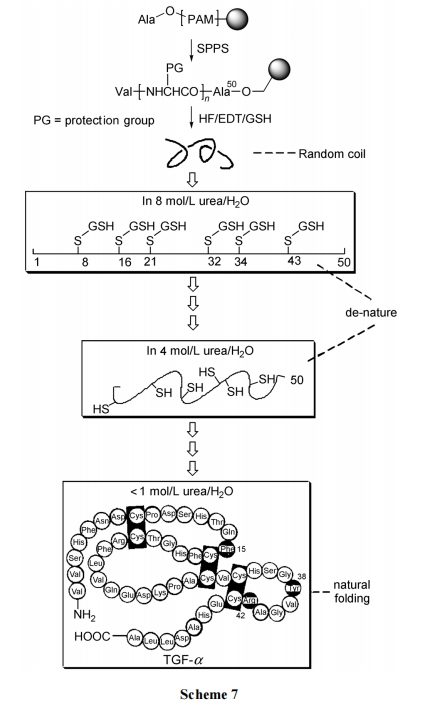
以固相肽合成方式合成转移生长因子(TGF)-α(含50 个残基、6 个半胱氨酸)为例. 其中 6 个半胱氨酸的侧链巯基均用 MBzl(对甲基苄)保护. 最后一步用 HF 裂解, 在切除树脂的同时也把包括 MBzl 在内的全部侧链保护脱除. 由于在 HF 裂解试剂中加入足量的还原型谷胱甘肽(GSH), 有效地阻止了 TGF-α 游离肽 6 个 Cys 残基间的随意键合. 然后使开链型的粗产品处在高浓度(8 mmol/mL)的脲素水溶液中, 迫使 TGF-α 分子链伸展开, 呈“变性”(de-nature)状态. 再将此溶液置于透析袋中, 随着袋外溶液脲素浓度逐步降低, 使结合态的 GSH 被透析清除的同时, TGF-α 链也由原来的伸展式 de-nature状态逐步自然卷曲. 其根据是内源性的TGF-α具有的卷曲状态(由三对二硫键形成)应该是自然形成的最低能量状 态 . 研究已证明 , TGF-α 的三对二硫键是以Cys8-Cys21, Cys16-Cys32, Cys34-Cys43 的形式存在的. 因此, 长时间、缓慢地进行正确的二硫键搭桥是一个热力学控制过程. 如果氧化反应条件过强、时间过快, 可能出现错误搭桥的情况. 这种不正确的 Folding 会导致生物活性的丧失(Scheme 7)
2.2.2 正交保护/分步合环法
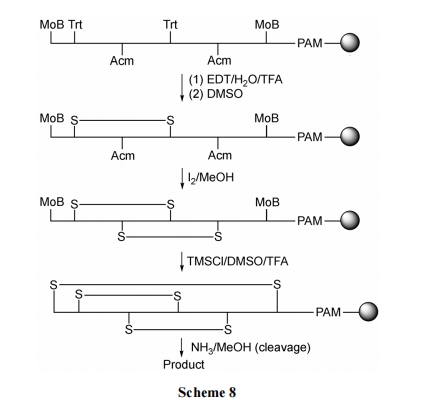
采用对脱除反应敏感性不同的保护基, 分别保护不同位点 Cys 上的侧链巯基, 使多种 Cys 在不同化学环境中分阶段进行选择性配对搭桥, 是正交保护/分步合环的基本原理. 此种方式的实施应注意以下几点: (1)因为要经历多次氧化成环反应, 为尽量减少分子间搭桥的机会, 应以固相环合方式为宜. (2)需要桥连的一对 Cys 必需用同种保护基. (3)各对 Cys 的侧链保护基必需与其它Cys 的保护基不同, 而且它们的脱除反应敏感性差别愈大愈好, 以便互不干扰, 发挥正交效应. (4)全部(或除一对 Cys 以外)Cys 保护基的脱除反应不应造成固相载体上 linker 键的提前裂解. Scheme 8 给出了含三对二硫键的肽合成情况, 其中一对用弱酸敏感的 Trt(三苯甲基)保护; 第二对用强酸敏感的 MoB(对甲氧基苄)保护. 它们之间属于酸梯度差敏感方式. 第三对用 Acm 保护, 它与前两种保护基互为正交敏感方式.
2.2.3 多米诺硫酯交换法
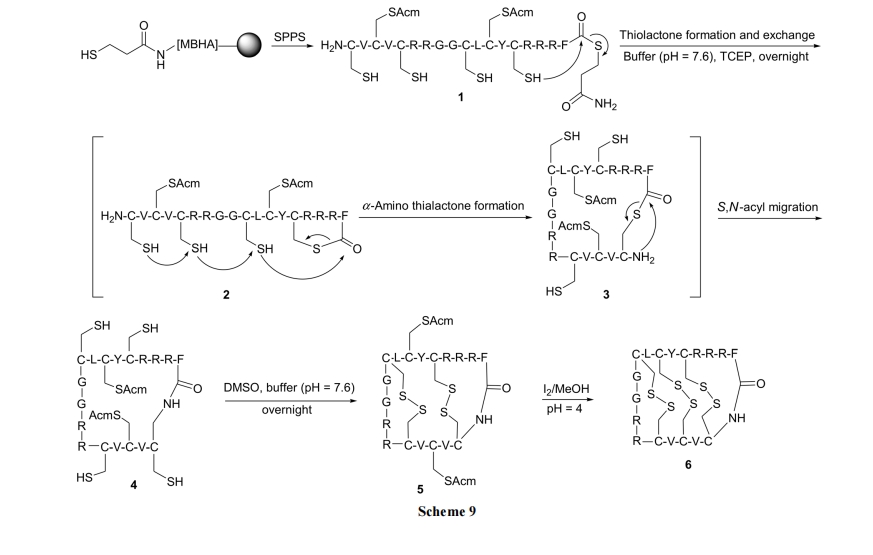
Tam 教授[28]建立了一种方便、可行、巧妙地制备多重二硫桥环肽的合成方法. 此种目标环肽的前体必须在N 端具有一个 Cys 残基, 在 C 端含有硫酯结构, 而且在肽链中间必需含有一个或以上的 Cys 残基. 如中间体 1, 在 pH 为 7.6 的水溶液中, 首先发生链中最接近 C 端的SH进攻C端硫酯键的硫酯交换反应得到中间体2. 随后发生从 C 至 N 方向的多次硫酯交换反应, 就像拉链(又称多米诺)效应, 直到 N 端最后一个 SH 成为硫酯. 当然, 中间的Cys残基又恢复到游离SH状态成为中间体3. 此时肽链的 N 端与 C 端相连, 因此 N 端 Cys 的 NH2很容易对最后一个硫酯进行分子内氨解反应, 生成内酰胺环肽 4. 在 4 中, 由于环的张力影响, 链中相邻的 SH 很难形成二硫键. 而位置相对较远离的两个 SH 之间则可以形成热力学上有利的二硫桥(如 5)的结构. 最后一对带有 Acm 保护的两个巯基在脱除 Acm 后, 也成为二硫桥, 得到多 loop 型环肽产物 6 (Scheme 9).
2.3 酯环肽(Cyclo-depsipeptides)合成
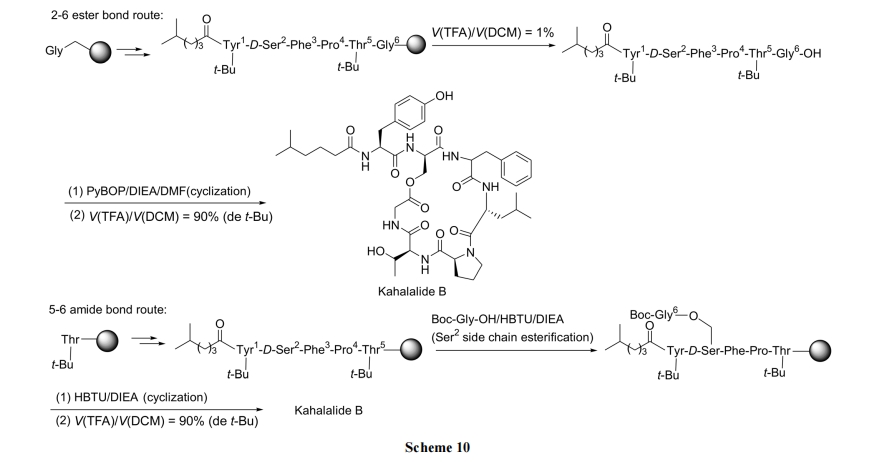
2.3.1 Kahalalide B 的合成
在天然产物环酯肽 Kahalalide B 的合成中采用了两种合成路线, 均得到了目标产物(Scheme 10)[29].
2.3.2 Kahalalide A 的合成
与上例的 Kahalalide B 相似, 本例目标化合物也是含一个内酯键的环肽[30]. 从下面的逆合成分析可以设计出先构建含酯键的直链肽, 最后以酰胺键的形式关环(Scheme 11).
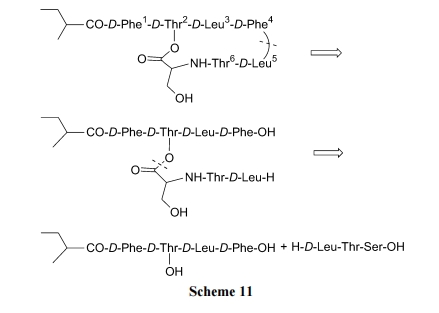
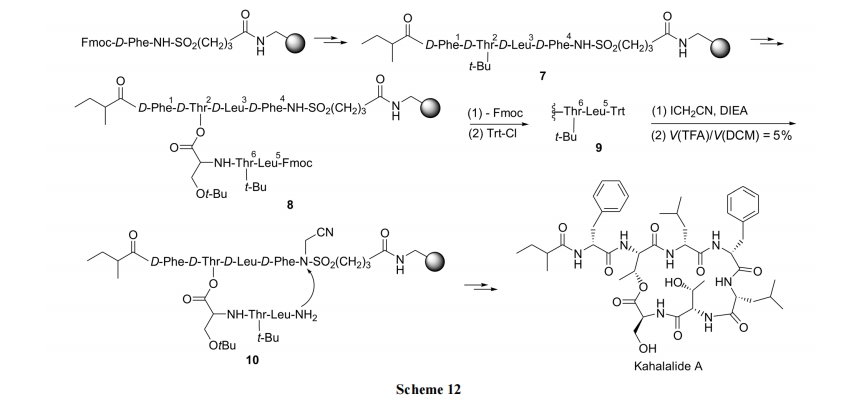
与上不同的是, 本合成采用固相保险型 linker 载体, 先将Phe4与磺酸型树脂键合, 经几步缩合得到五肽中间体 7. 脱除 7 中 Thr 侧链 t-Bu 后使 OH 游离, 以便与 Ser7生成酯键. 随后再接上 Thr6及 D-Leu5, 得到直链型全序列结构 8. 由于脱除 Fmoc 的试剂六氢吡啶会干扰活化后的磺酰胺 linker 与 D-Leu5 的氨基之间的氨解(最后一步)反应, 所以要在活化磺酰胺键之前先使 D-Leu5 上的Fmoc 转化为 Trt, 成为中间体 9. 然后用 ICH2CN 将磺酰胺的 N 原子烷基化, 使保险 linker 活化. 再用 TFA 脱除N 端的 Trt, 得环化前体 10. 最后在 DIEA 作用下发生分子内氨解 , 同 时 切 除 树 脂 得到产物 Kahalalide A (Scheme 12).
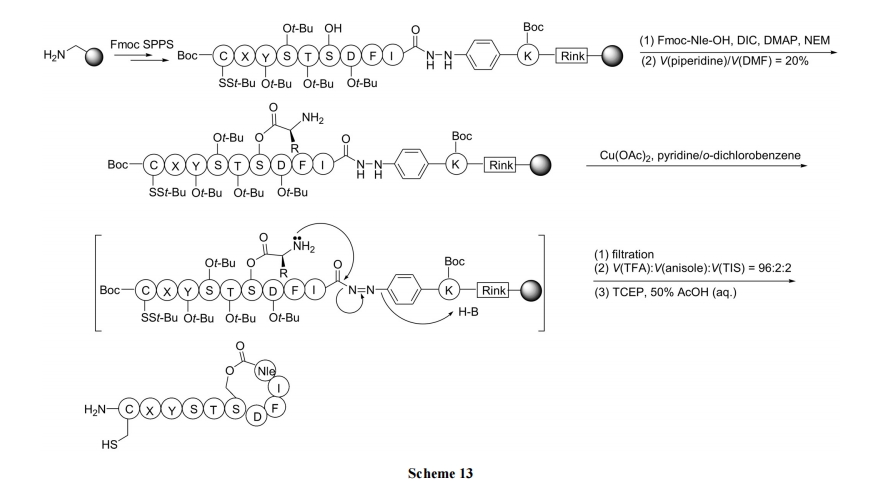
2.3.3 自动诱导肽 AIP 的合成
本例合成的目标化合物 AIP (auto-inducing peptide, 自动诱导肽)为侧-尾以酯键成环的化合物. 该合成策略的特点是: (1)以酰肼为特殊裂解型 linker; (2)在 linker 上首先键合的不是肽链 C 末端的第一个残基, 而是第二个残基; (3) C 端第一个残基与肽链中间 Ser 残基的侧链OH 以酯键相连. 设计此种合成方式的依据在于酰化苯肼 linker 对于肽合成中的反应条件耐受性很强, 甚至在酸、碱环境中也很稳定. 然而此种 linker 结构对氧化条件, 如 Cu2+, I2, NBS 等非常敏感, 极易受到亲核基团的进攻而裂解. 因此, Ser 侧链上残基的 NH2可以方便地对酰肼 linker 进行分子内 SN2 反应, 形成酰胺键, 同时切除树脂(Scheme 13)[31].
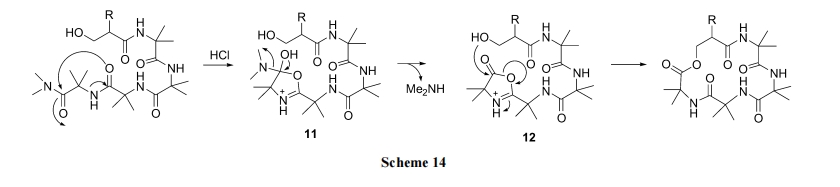
2.3.4 噁唑酮酯交换法
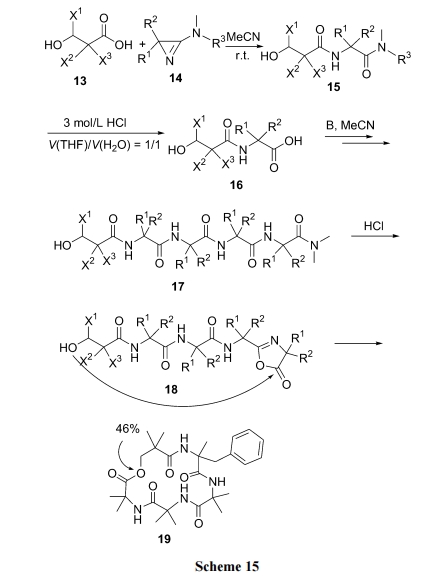
Heimgartner 等[32]设计了一种名为“直接酰胺环化(direct amide cyclization)”的合成路线, 制备了由 α,α-双取代残基组成的酯环肽. 其原理是直链肽 C 端的二甲基酰胺结构在无 水 HCl 催 化 下 , 先生成一个“azirine/oxazolone”过渡态 11 及 12. 后者受到同分子链N 端羟基的进攻, 使 oxazolone 五元环解体, 同时与 OH形成分子内酯键(Scheme 14).
从中可以看出, α,α-双取代氨基酸的介入是非常重要的, 它们确保了肽链 N 端羟基向 C 端的接近, 利于酯环的形成. Koch 等[33]利用此方式合成了一些酯环肽 19, 环化产率达 46% (Scheme 15).
2.3.5 Ugi 反应衍生法
以醛、乙腈羧酸酯、胺三种组分(四种功能基)为底物进行的 Ugi 反应, 也可以得到含一个酯键的酯环肽产物. 其中, 先由 CHO, NC, NHR 三种功能基缩合, 生成噁唑中间体 20. 再经分子内羧酸酯诱发的重排, 经螺烷型双噁唑中间体 21, 最后生成环酯键(Scheme 16) [34].

3 DKP 环肽衍生物合成
3.1 二肽酯的分子内氨解
无论是均相溶液法制备的二肽酯, 还是以酯键为linker 的固相载体上的二肽, 当 N 端的保护基被脱除后, 在弱碱或 HOAc 的催化下很容易发生游离 NH2 对分子内的 C 末端酯键的氨解反应(Scheme 17).
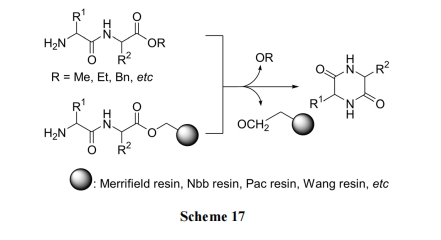
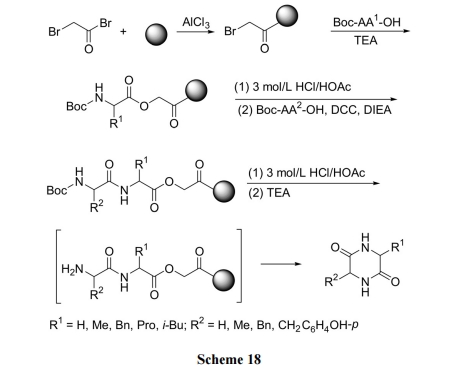
值得指出的是上述反应在经典的以苄酯键为 linker的固相肽合成中是一个可导致(三肽以上的)全合成失败的严重副反应. 我们[35]正是利用这个副反应, 以 Pac 树脂为载体制备了多种收率理想的 DKP 环二肽产物(Scheme 18)
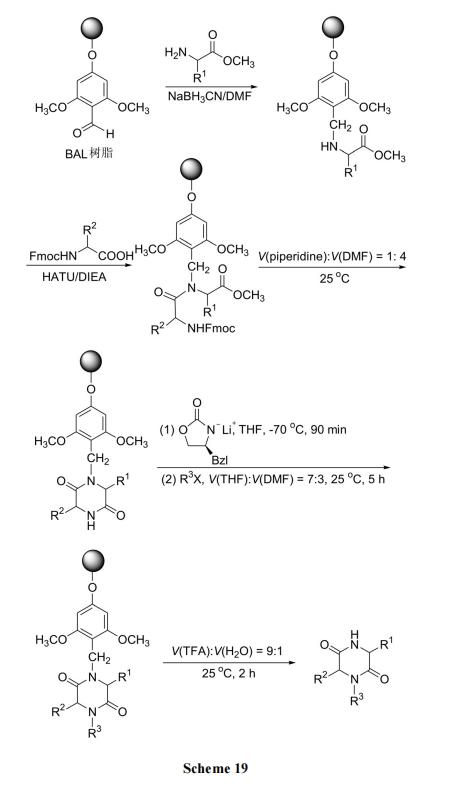
3.2 BAL 树脂为载体的二肽分子内环化
固相生成 DKP 的方式一般基于 DKP 前体的羧基与树脂的 linker 以酯键形式直接相连, 因此氨基进攻酯键发生分子内环化时形成 DKP 并同时从树脂上切割. 而以 BAL 树脂为载体的 DKP 合成是通过 linker 与 DKP前体的氨基相连, 所以是先形成 DKP, 后进行树脂切割, 即两步反应分开进行. 这样, 在生成 DKP 后, 通过洗涤除去溶液中的杂质, 切割后得到高纯度的产物[36](Scheme 19).
3.3 醛与氨基酸的还原烷基化途径合成 DKP 衍生物
连在 Wang 树脂上的第一个氨基酸的 NH2与相应的醛先缩合成 Schiff 碱, 后者在还原剂 Na(OAc)3BH 作用下, 生成N烷基化中间体22. 随后用另一个Boc-氨基酸对 22 的仲胺进行酰化得 23. 脱除后者的 Boc 后再于甲苯中加热, 发生分子内氨解并同时切除树脂, 得到 N 上有取代的 DKP 产物[37] (Scheme 20). 除了上面的 Na(OAc)3BH 外, 还可以使用 NaCNBH3 为还原剂, 固相载体可用 PAM 树脂代替较昂贵的Wang 树脂, 得到了收率更满意的产物[38].
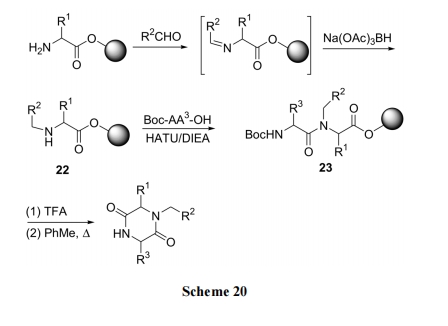
3.4 N,N'-双取代 DKP 衍生物的合成
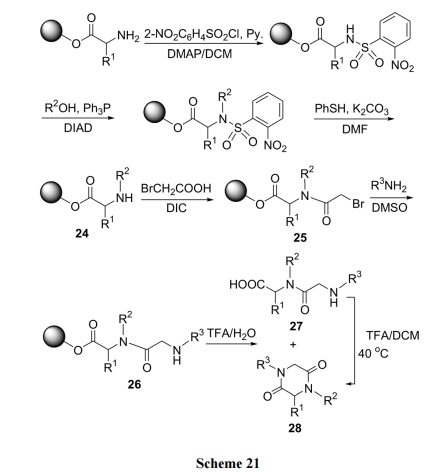
用 2-硝基苯磺酰氯对树脂上第一个氨基酸的 NH2进 行 临 时保护 , 剩 下一个 H 原 子 确 保 在 随 后 的Mitsunobu 反应得到 N 单取代产物 24. 脱除 N 上磺酰基后再被溴乙酰化, 得中间体25. 经SN1反应将25转化为N 取代的甘氨酰二肽 26. 后者在 TFA-H2O 催化下生成直链二肽 27 及 DKP 环二肽 28 的混合物. 在三氟乙酸酐(TFAA)/DCM及温热下, 27可完全转化为目标产物28[39](Scheme 21).
3.5 Ugi 反应途径合成 DKP 衍生物
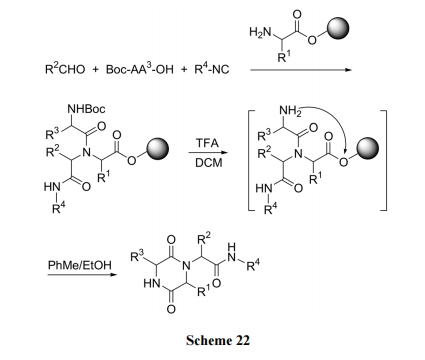
Ugi 反应是用醛、酸、胺及异腈 4 种反应底物进行多组分一锅反应(MCR). 由于反应底物类型多, 因此产物具有很好的结构多样性. 尤其是固相反应方式, 可以简化反应后的纯化过程, 即除了挂在固相载体上的缩合产物外, 其它剩余的几种反应物均可过滤除去[40](Scheme 22).
3.6 并环 DKP 衍生物的合成
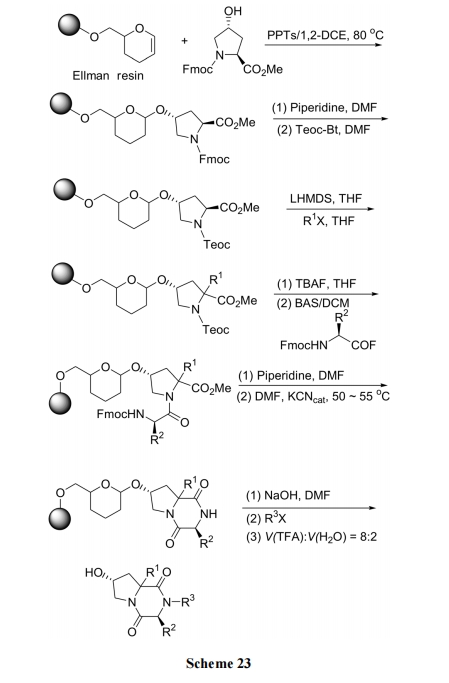
许多高活性的 DKP 型天然产物及人工设计合成的DKP 衍生物的结构远比上述合成例的产物要复杂得多, 它们往往具有并环的骨架结构. 此类化合物的合成已有一些文献报道[41,42]. 下面的合成是脯氨酸的五元环为制备 DKP 并环前的支架结构. 首先将两端保护的羟脯氨酸 Fmoc-Hyp-OMe 的侧链 OH 与 Ellman 树脂的双键发生加成反应而键连上. 随后使 Hyp 残基上 α-碳烷基化, 再用第二种氨基酸与 Hyp 接成二肽. 脱除第二位残基的N 保护后, 使游离 NH2进攻 Hyp 的甲酯键, 发生分子内氨解, 生成 DKP 并环结构(Scheme 23) [42].
3.7 烯侧链 DKP 的合成
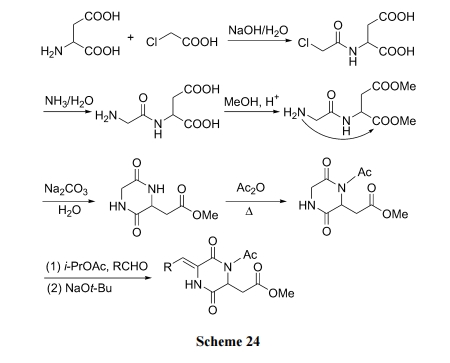
首先用廉价的氯乙酸与游离的天冬氨酸缩合, 再用氨水与氯发生 SN2 反应制得 Gly-Asp 二肽. 后者在酸性甲醇环境中使 Asp 的羧基甲酰化, 最后经分子内氨解生成 DKP 型产物. 全部合成的最大特点是不用经典的肽缩合试剂, 也没有任何保护与脱保护的反应, 因此成本低、适于大生产[43] (Scheme 24).
3.8 肽双分子缩合法
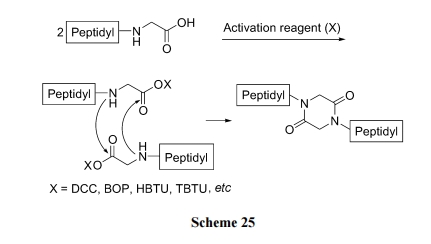
前面介绍的各种合成中, 一般均要经历二肽分子内氨解形成 DKP 环途径. 其实肽作为单体的双分子缩合也是一种合成 DKP 结构的合理方式. 因为这种方式得到的 DKP 衍生物具有 N,N'-双取代的结构特点. 此种合成需要反应物的 C 末端含有 Gly 残基, 因为其它残基的α-碳原子上均有侧链取代, 位阻加大不易发生双分子反应. 研究发现, 许多寡肽经双分子缩合形成的DKP双倍肽链结构后, 其原有的活性可获得提高. 因此含DKP环的 双 侧 肽化合物的 设 计 与合成具有一定 意 义 [44](Scheme 25).
3.9 螺环 DKP 串连肽的合成
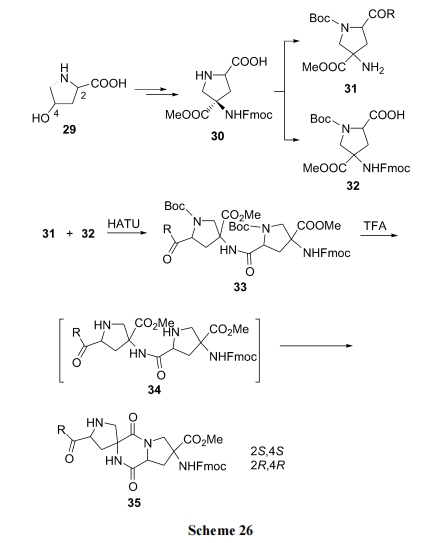
以羟脯氨酸(29)为原料, 经多步转化生成关键中间体 30, 再将 30 分别转换为氨基组分 31 及羧基组分 32. 两个组分缩合为二肽 33 之后, 脱除由 32 衍生的结构段上的 Boc, 使仲氨基游离得 DKP 前体结构 34. 随后在碱或酸催化下, 发生二肽分子内氨解, 生成一种五元环与DKP 连为螺环的产物 35. 这就是螺环 DKP 串连肽中的一个单元结构[45] (Scheme 26).
4 含醚桥环肽合成
从桥连结构看, 醚环肽又分为脂-芳混醚型及芳醚型两大类, 并以前者为多数. 根据醚桥的生成方式, 有Scheme 27 所示反应途径.
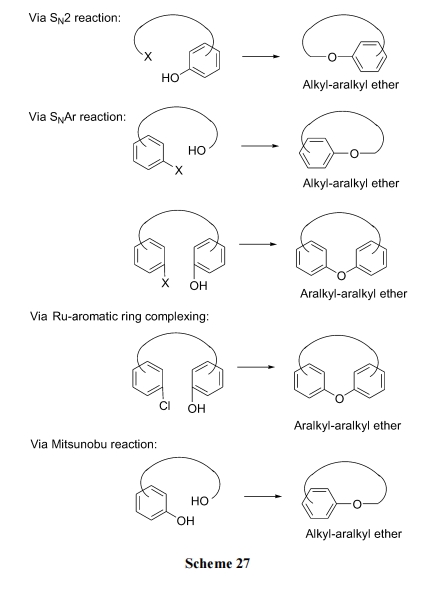
在合成策略上与酯环肽相似, 醚环肽的合成顺序上也存在两种情况: (1)先制备肽链主体结构, 最后以醚键的生成实现合环. (2)先制备含醚结构的片段, 最后以酰胺键(或其它键)的生成实现合环.
4.1 混醚环肽合成
天然产物醚环肽 Sanjoinine G1 的骨架上含有两个肽键及一个芳烃/烷烃混合醚键. 在逆合成分析这个十四元环的目标结构时, 可以确定两个成环键位置 a 与 b (Scheme 28). 因此存在两条路线可以完成此环肽的合成.
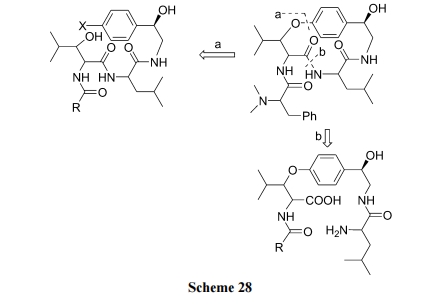
路线(a), 先制备含有混醚结构的直链肽, 最后进行酰胺键方式关环(Scheme 29)[46].
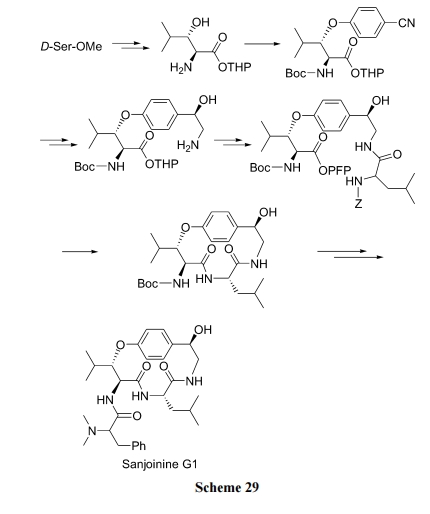
路线(b), 先制备肽链, 最后经 SNAr 反应使氟代苯与侧链上的仲醇之间脱一分子 HF 生成混醚键(Scheme 30)
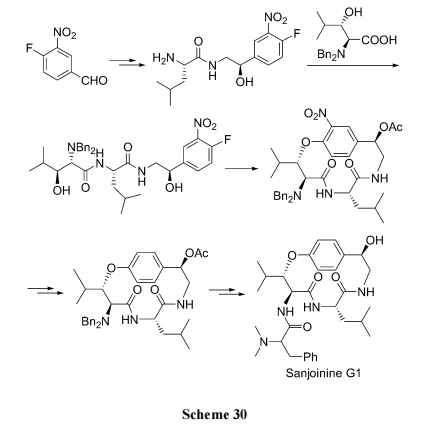
利用 Mitsunobu 反应制备 混醚环拟肽(Scheme 31)[47].
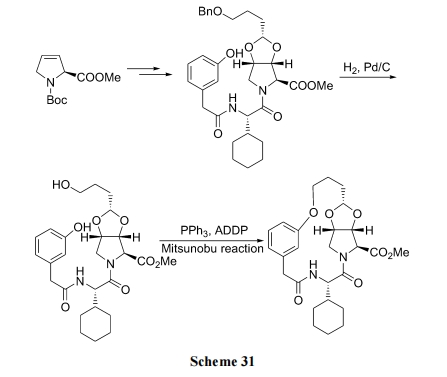
利用肽链中 Tyr 的侧链酚羟基与分子内另一位点侧链上的溴原子之间的SN2反应生成混醚环肽是比较简便的合成方式(Scheme 32)[48].
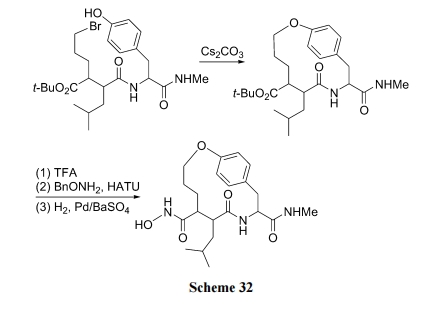
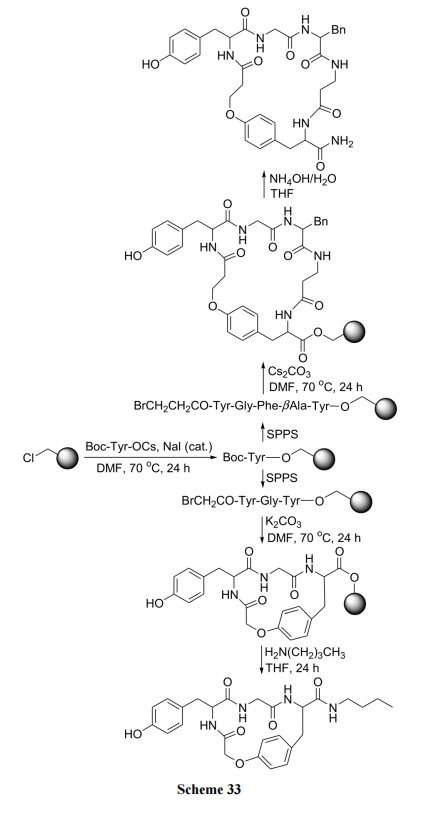
王德心等[49]以肽链 N 端的溴乙酰及 C 端的 Tyr 为两个桥头, 经固相肽合成方式首先制备含这两种桥头结构的直链肽中间体, 最后以 K2CO3为碱催化剂方便地构建了一些混醚环肽产物(Scheme 33).
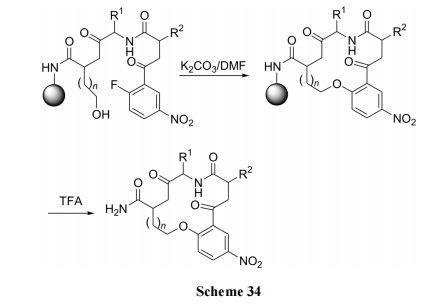
与上例合成不同的是将卤原子连在苯环上, 羟基位于同分子的烷基链上. 由于对位硝基的影响, F 原子有较高的反应活性, 用 K2CO3的碱性条件即可完成混醚键环合(Scheme 34)[50].
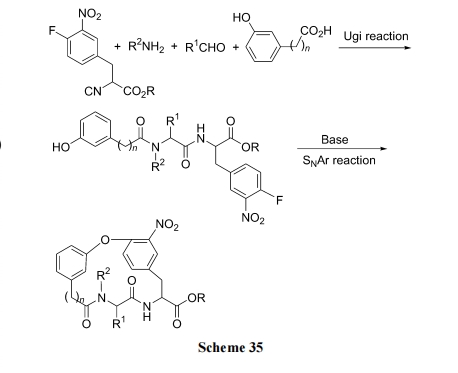
4.2 芳醚环肽合成
首先以具有邻硝基氟苯取代的异腈及其它的三种组分进行 4CR (four-component reaction)方式的 Ugi 缩合反应, 制得含酚羟基及邻硝基氟苯的直链肽中间体. 随后在碱催化下发生分子内 SNAr 反应, 得到芳醚环肽产物(Scheme 35)[51].
除了上例合成中引入邻、对位 NO2或 CN 可以活化芳卤原子的活性外, 钌试剂与氯苯形成 η6-芳烯络合物过渡态的方式提高苯环上氯原子的反应活性. 具体路线是先使 Boc-Phe(4-Cl)OH 与钌试剂形成活化络合物 36, 然后在羧基方向组装肽结构得中间体 37, 后者在 Na 试剂催化下, 除去 HCl 生成芳醚键. 最后经光解反应除去络合的钌盐, 得目标产物(Scheme 36)[52].
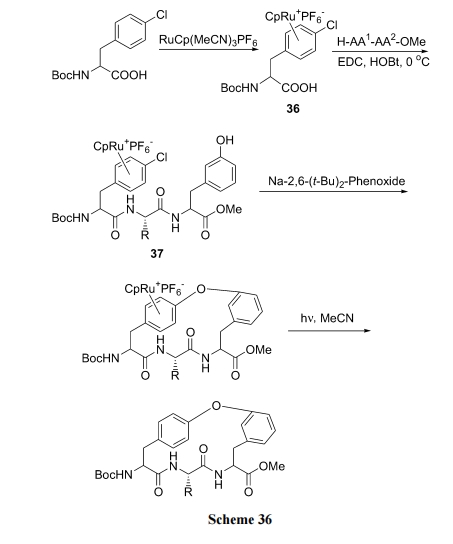
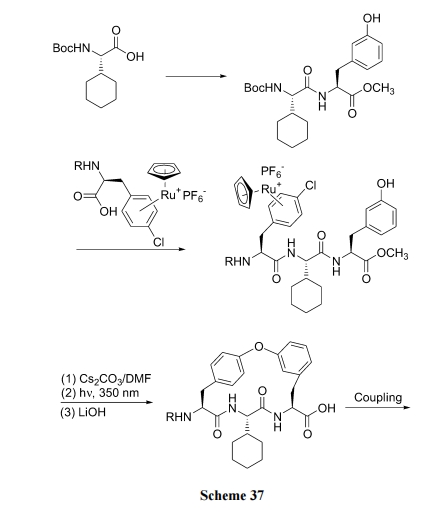
还可用 Cs2CO3/DMF 与钌试剂-氯苯络合物反应完成此步环合(Scheme 37)[53].
5 单硫及多硫醚环肽合成
除了前面介绍的经典二硫桥以外, 属于硫醚桥结构的还有单硫醚桥—S—、亚甲二硫醚桥—SCH2S—及连三硫桥—S—S—S—等形式. 其中以单硫桥较为多见, 它们又分为烷烃单硫醚及芳烷混硫醚两种. 因各种硫醚桥的结构不同, 制备方法可分为以下几种: (1)含单硫醚片段的其它键(以 CONH 为主)的环合; (2) SN2 反应方式, 以肽链中 Cys 残基侧链的巯基为—S—的前体结构, 以同分子内的卤原子为亲核基团; (3) SNAr 反应方式, 以Cys 侧链的巯基及同分子内芳环上的氟原子为环合反应的桥头组分.
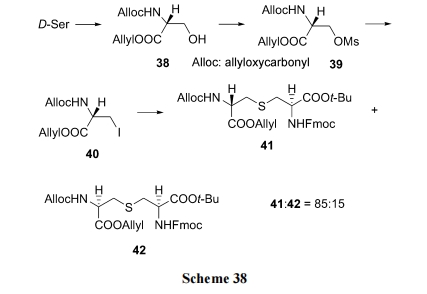
5.1 预制单硫醚中间体的环肽合成
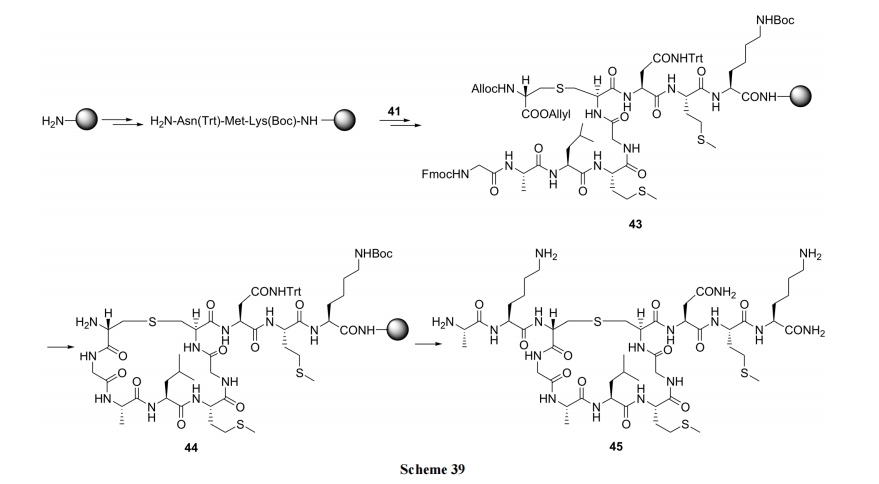
Tabar 等[54]建立了一条可以制备产物的立体选择性较高的合成路线. 以 D-丝氨酸为原料, 先后经两侧保护、羟基甲磺酸酯化、碘取代得到重要中间体侧链碘代丙氨酸(40). 后者在碱存在下, 与双保护的半胱氨酸发生 SN2 反应, 得到一对产率差别明显的以单硫醚为桥的双丙氨酸衍生物 Lanthionine (41). 后者作为一个关键构件往往用于一类名为 Lantibiotics 的天然产物肽合成(Scheme 38). Tabar 实验室则将 41 用于天然产物 Nisin C环类似物 45 的固相合成(Scheme 39)[55].
5.2 以 SN2 反应方式关环制备单硫醚环肽
以SN2反应方式关环是制备单硫醚环肽最常用的策略. 其中提供硫原子的结构多为肽链中的 Cys 残基, 而含卤原子的结构为侧链衍生的溴烷链或 N 端溴乙酰(或氯乙酰). 碱催化是必需的反应条件, 一般的叔胺[三乙胺、N-甲基吗啉或 DBU (1,8-diazabicyclo[5.4.0]-undec-7- ene)]足以保证 SN2 反应的进行. DBU 催化的关环见 Eq. 1[56]; 三乙胺/水催化的关环见 Eq. 2[57].
5.3 在肽链 N 端引入对位硝基氟代苯
由于硝基的拉电子效应, 使对位 F 原子活化, 足以与 SH 发生 SNAr 反应, 生成芳烷混硫醚键(Scheme 40)[58].
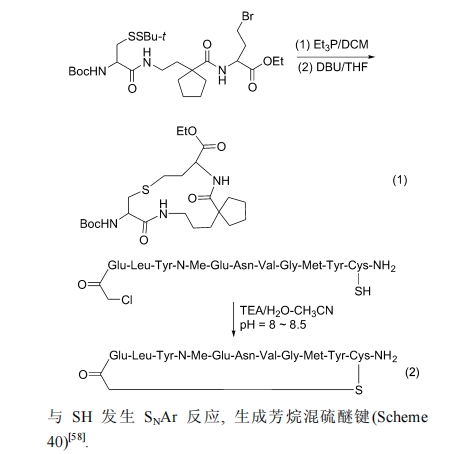
5.4 Michael 加成法
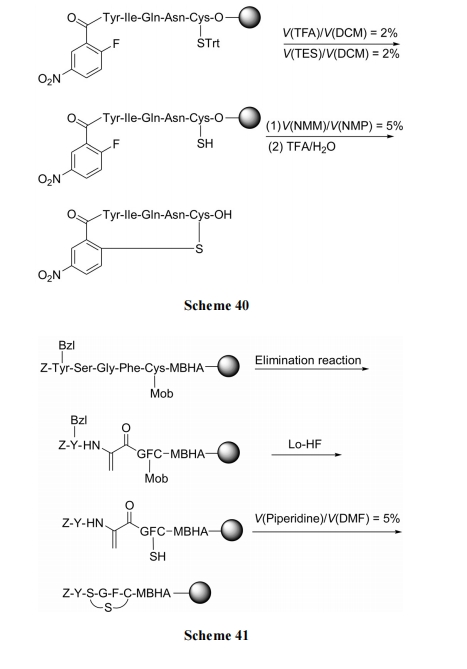
在肽链中适当位点的 Ser 残基上进行消除反应, 生成脱氢丙氨酸(Dha), 然后与肽链上的游离 SH 发生Michael 加成得到单硫醚环肽, 最后再脱除侧链保护及切除载体. 此种方式又被认为是模拟生物合成的一种途径(Scheme 41)[59].
5.5 利用 N 端的溴乙酸对二硫键型 linker 进行环化裂解
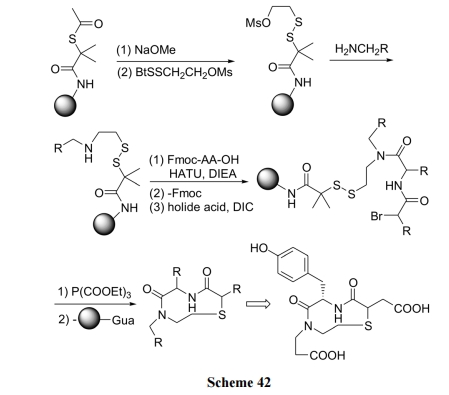
本例合成的特点是利用 N 端的溴乙酸对二硫键型linker 进行环化裂解反应. 产物具有典型的 β-turn 拟肽结构(Scheme 42)[60].
5.6 生成亚甲二硫醚(SCH2S)键
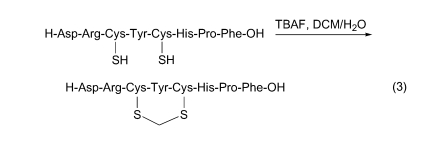
肽链中含两个巯基是制备连二硫键环肽的结构基础. 但如果在相转移催化剂四丁基氟化铵存在下, 可以活化溶剂 CH2Cl2, 使后者生成卡宾并介于两个硫原子之间, 生成亚甲二硫醚(SCH2S)键(Eq. 3)[61].
5.7 连三硫桥环肽的合成
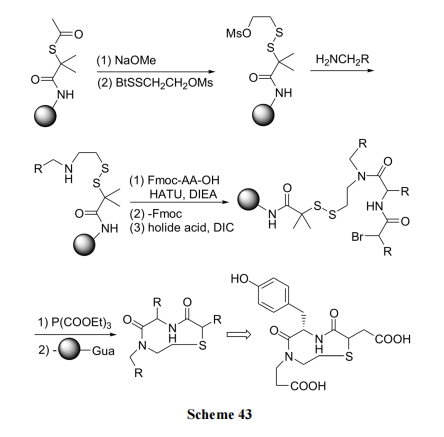
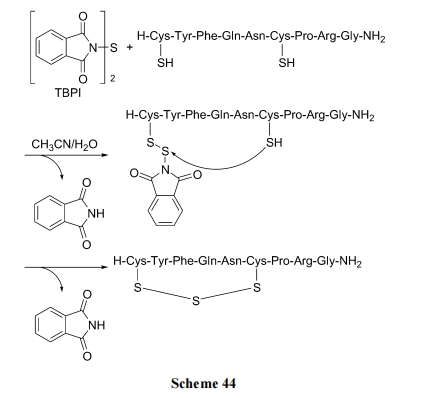
连三硫桥环肽存在一些天然产物中, 它们具有的抗菌及细胞毒活性已经引起化学家的关注. 制备这种环肽的基本原理是以含有两个 Cys 残基的肽为底物结构, 其中的一个Cys上的巯基先与专门的硫醚化试剂生成混连二硫键或混连三硫键. 然后再接受分子内另一个巯基的进攻, 发生硫交换反应, 生成连三硫键环肽. 以 TBPI (N,N'-硫双邻苯二甲酰亚胺)为硫醚交换剂见 Scheme 43[62]. 以 Mpa(甲氧酰连三硫丙酸)为硫醚交换剂, 见 Scheme 44[63].
5.8 多连硫醚环肽的合成
近年发现一些含有5个甚至更多的连硫醚的天然产物, 因此化学家开始对多连硫醚环肽的合成进行了研究. 比较有代表性的一种方法就是先构建含有两个半胱氨酸残基的肽链 46. 然后与一种商品可购的硫化试剂BTH ([Bu4N]2S6)在水溶液中反应, 可以方便地制得从二硫桥到五硫桥的环肽 47. 其中 BTH 的用量及反应时间不同, 可以控制硫桥的长度(Eq. 4)[64].
6 含烯键环肽合成
已知的方法中, 多数是将含烯键构件引入肽链, 然后再进行分子内关环复分解(RCM)反应或分子内 Heck反应, 实现环合
6.1 分子内 RCM 反应方式
该方式的先决条件是先组建肽链上两个桥头前体均含双键的中间体. 后者在有机钌(Ru)型的Grubbs试剂作用下发生分子内 RCM 反应, 使肽链环化.
6.1.1 双侧链 O 原子上烯丙醚的 RCM 环合
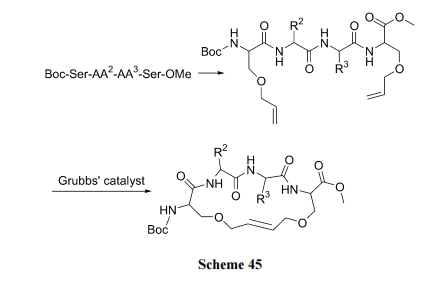
肽链上的两个 Ser, Thr 或 Tyr 残基上的羟基经适当的转化反应(如 SN2, SNAr 或 Mitsunobu 反应)引入两个烯丙侧链. 然后经 Grubbs 试剂催化, 发生分子内 RCM 反应生成烯环肽(Scheme 45)[65].
6.1.2 两个残基 α-碳上烯戊基侧链的 RCM 环合
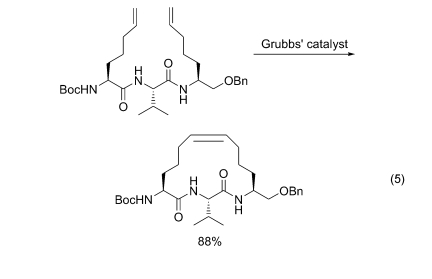
从先预制的含烯丙基侧链的氨基酸或其衍生物为单体, 参与肽链组装后经 Grubbs 试剂催化, 得到相应的烯环肽[66](Eq. 5)
6.1.3 肽链中两个 N 原子上烯丁基间的 RCM 环合
肽链中两个 N 原子上烯丁基间的 RCM 环合见Scheme 46[67].
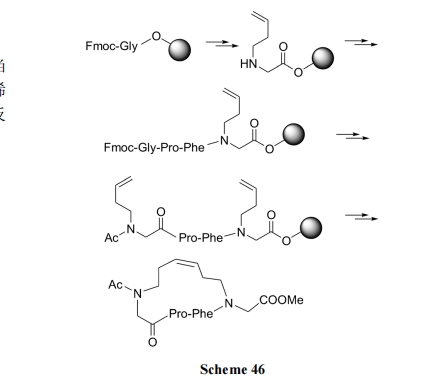
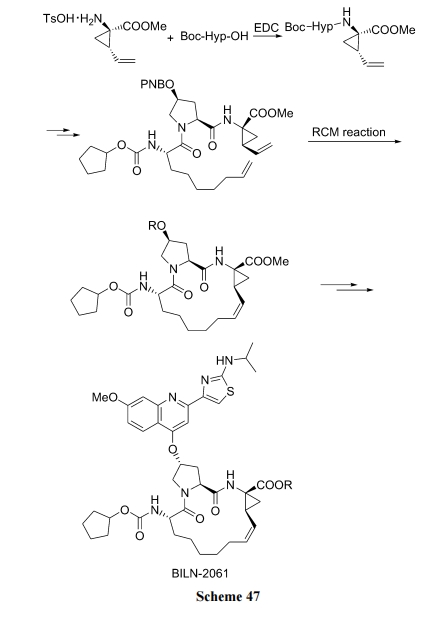
6.1.4 拟肽链上不对称双烯的 RCM 环合
已进入临床的 HCV 蛋白酶抑制剂 BILN-2061 是一种拟肽环合的化合物. 其环上的双键桥就是在侧链庚烯与侧链环己烯之间的 RCM 反应形成的, 此反应生产批量已高达 400 kg 以上[68] (Scheme 47).

6.2 经 Heck 反应合成烯环肽
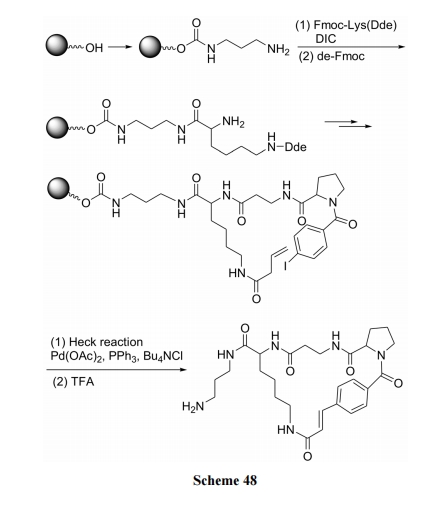
烯或炔键上的不饱和碳原子发生芳烃取代是 Heck反应的特点. 因此在肽链的不同位置分别引入烯(或炔)键及碘代苯, 作为合环的前体结构. 然后在钯催化剂作用下, 发生分子内 Heck 反应, 生成含烯(或炔)桥的环肽产物.
烯丁酰与对甲酰碘苯的键合见 Scheme 48[69]; 烯丙酰与间碘代苄胺的键合见 Scheme 49[70].

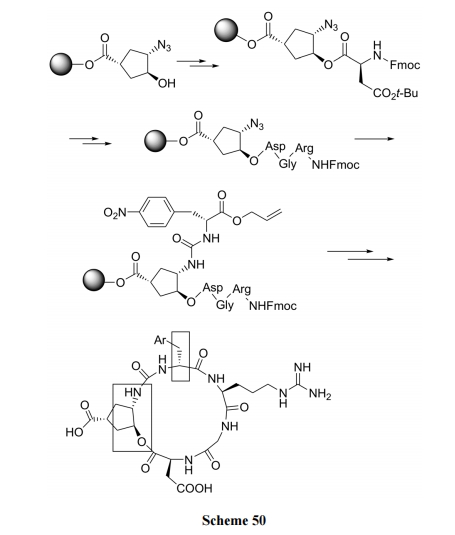
7 刚性桥环肽合成
7.1 三取代环戊烷为桥
首先将三取代环戊烷通过羧基与羟基树脂键连, 随后先后在互为邻位的羟基及叠氮上分别组装肽链的 N端段及 C 端段. 最后进行 COOH 与 NH2缩合成为含环戊烷刚性环的内酰胺关环肽[71] (Scheme 50).
7.2 含三嗪环结构的环肽
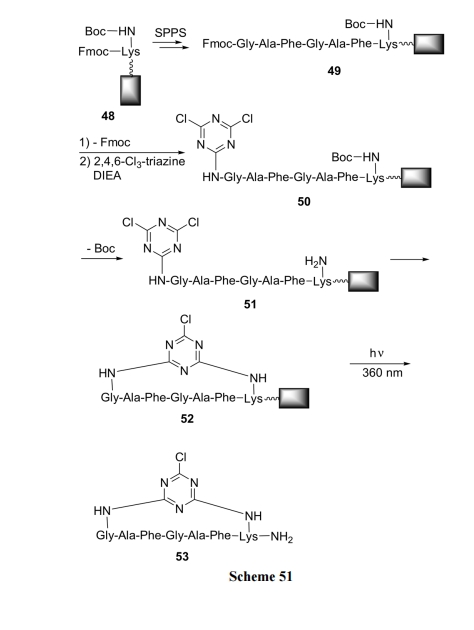
用正交保护方式的 Fmoc-Lys(Boc)作为组装肽链及环化的基础. 首先将 Fmoc-Lys(Boc)通过适当的间隔(Spacer)结构与固相载体连接成为 48. 然后脱除 Fmoc, 进行直链肽序列组装得到中间体 49. 脱除肽链 N 端的Fmoc 之后, 将游离的 NH2 与三氯三嗪上的一个氯原子进行 SN2 反应. 虽然三氯三嗪分子中的 Cl 非常活泼, 但因固相载体的假稀释效应, 使三氯三嗪分子只有一个Cl与肽的NH2反应, 得到50. 随后脱除赖氨酸侧链上的Boc, 使NH2游离, 成为51. 在碱的作用下, 三嗪环上的第二个 Cl 原子与赖氨酸侧链 NH2发生分子内的 SN2 反应, 生成三嗪环嵌入的环肽 52[72] (Scheme 51).
7.3 并四氢呋喃双环结构的环肽
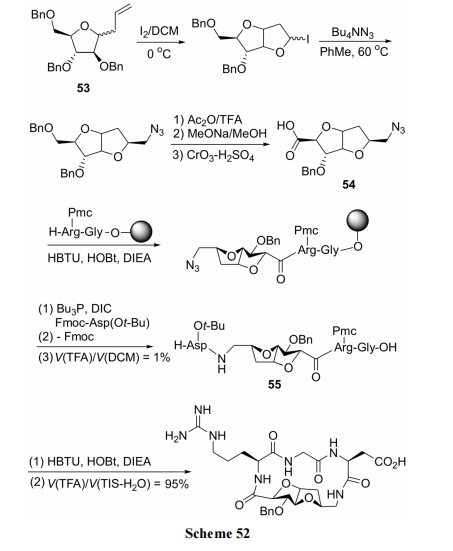
首先把刚性结构的双并四氢呋喃先与肽链结合, 最后由支架两侧的氨基酸残基完成内酰胺环合. 具体合成以戊糖衍生物 53 为原料, 经几步转化反应得到二并四氢呋喃支架型中间体 54. 随后与二肽树脂键合. 再将二并四氢呋喃 N 端的叠氮基转化为 NH2, 以便与 FmocAsp(O-t-Bu)-OH 缩合, 制得环化前体结构 55. 最后用经典的肽缩合条件完成含 RGD 片段的环肽制备(Scheme 52)[73].
7.4 对二苄介入的环肽
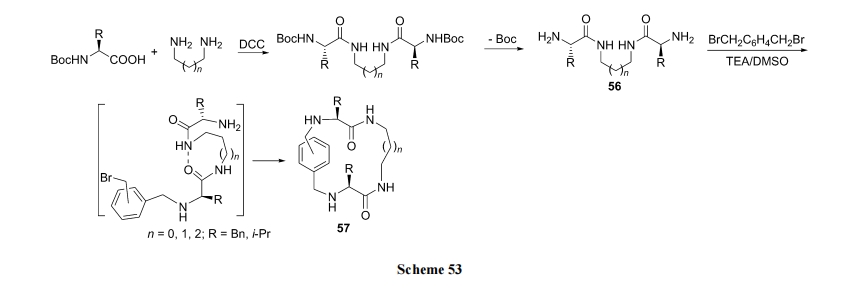
首先以双倍物质的量的氨基酸对 α,ω-二胺进行双端酰化, 继以脱除两端氨基酸上 N 保护基, 得到关键中间体56. 然后进行对位(或间位)二溴苄与56的两个NH2之间的 SN2 反应(分两步), 最终得到二苄结构嵌入的双仲胺环肽 57[74] (Scheme 53).
7.5 金刚烷介入的酯环肽
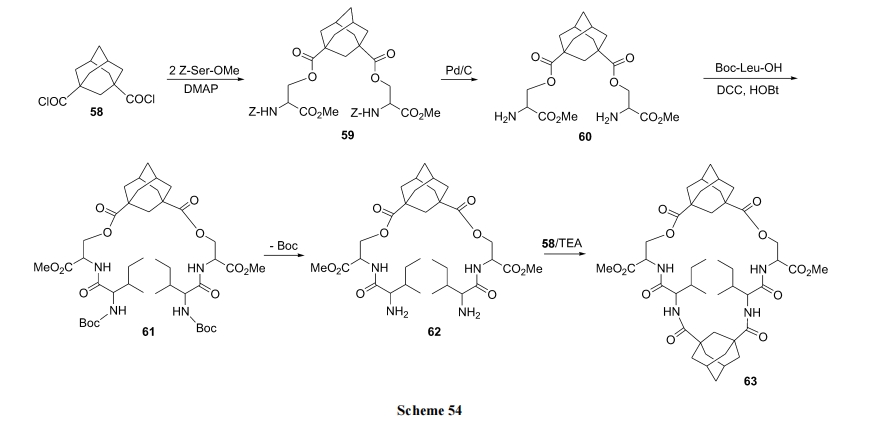
金刚烷介入的酯环肽见 Scheme 54[75].
8 仲、叔胺桥环肽合成
仲、叔胺桥环肽合成主要有以下三种方法: 首先预制含仲(叔)胺的中间体, 后进行主链环合[76,77]; ArF 及H2NAr 之间的键合关环[78]以及溴乙酰与侧链上 NH2 的键合关环
9 Freidinger 局部环肽
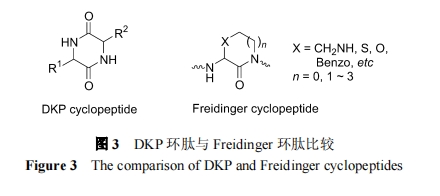
DKP 是头-尾相连的内酰胺环二肽化合物. 相比之下, Freidinger是一个残基的α-碳原子与右侧相邻残基的氮原子桥连的另一类环二肽化合物(图 3).两者均可在肽链中增加了刚性结构因素, 后者的结构多样性远远超过 DKP 环肽, 因此有利于开发结构上更像药(drug like)的活性化合物.
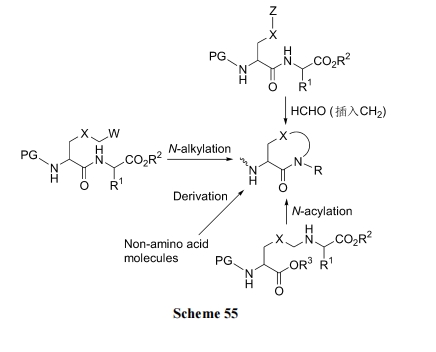
合成 Freidinger 环肽的方法非常广泛, 本文作者已经系统地进行了归纳[80]. 从宏观策略讲, Freidinger 环肽的合成基本由 Scheme 55 所示 4 种路线实现.
10 其它结构环肽合成
10.1 联苯桥环肽
与普通有机小分子联苯化合物合成相似, 此类环肽的环合方法也是以两个碘代苯(为桥头)之间的 Suzuki 反应、Ullmann 反应或氧化偶联等反应为多见[81].
10.2 Mannich 碱环肽
肽链上如果含有 Tyr 残基, 其酚羟基的 α-位可以作为活泼氢的供体与胺及醛发生 Mannich 缩合. 实际上肽链 N 端氨基即是现成的胺组分, 环合时只需外加的醛构件即可制得 Mannich 碱型环肽[82].
10.3 PNA 环肽
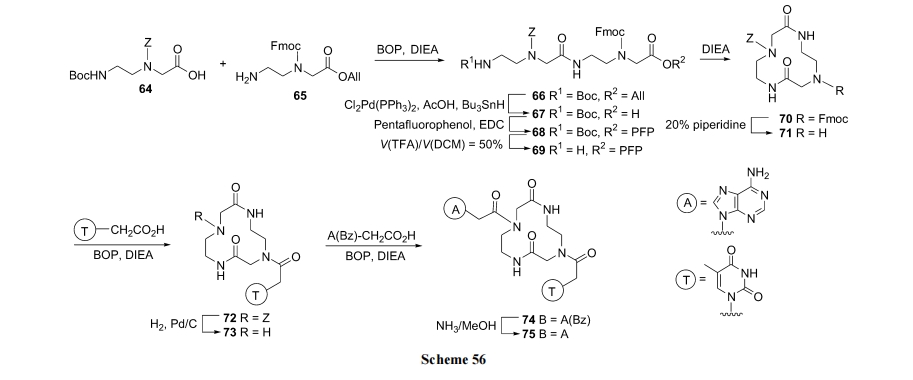
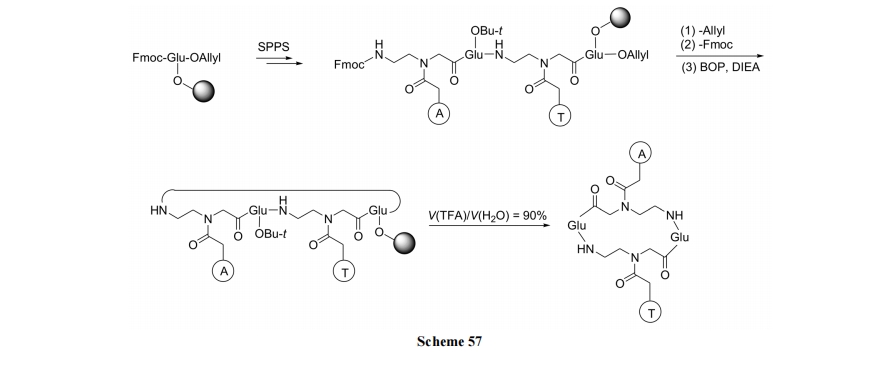
PNA 是以氨乙基-(N-碱基乙酰)-甘氨酰为残基串连形成的杂交肽. 其环化策略可分为先制备环肽链, 后键连碱(Scheme 56)[83]及先制备含碱基的直链肽, 后环合(Scheme 57) [84]两种.
10.4 双 loop 环肽
许多天然产物肽及人工合成的先导活性肽以含有两个链环(loop)为结构特征. 这些化合物的桥连结构各有不同, 在同一分子内两个 loop 之间共用的桥结构(内侧桥)与外侧桥的桥结构往往是不相同的. 多数情况下, 内侧桥由二硫键或杂环构成; 外侧桥往往是酰胺键或酯键结构(Scheme 58).
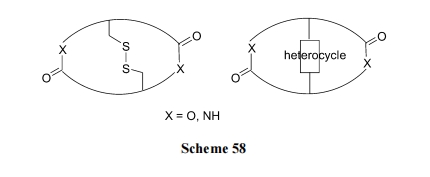
10.3.1 天然产物肽 Triostin A 类似物的合成
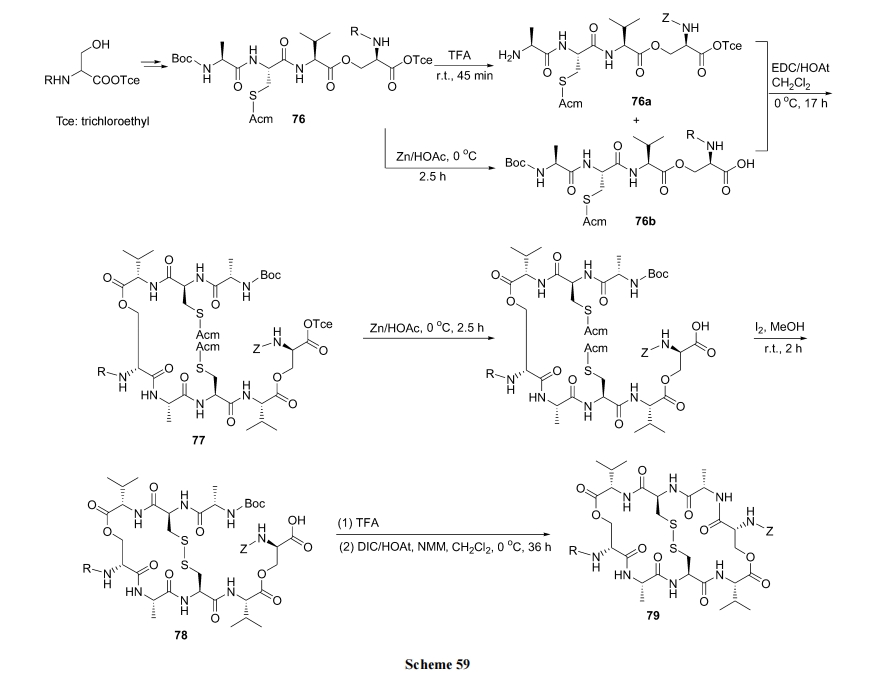
首先制备含 Cys 的全保护酯四肽 76. 然后的反应顺序是两个分子的 76 进行酰胺键缩合成为 77, 分子内形成二硫键(内侧桥)得到中间体 78. 最后一对桥头形成酰胺键(外侧桥), 完成双 loop 79 的构建(Scheme 59)[85].
10.3.2 天然产物肽[Ala7]-Phalloidin 的合成
本合成例目标化合物是以吲哚环为内侧桥, 以酰胺键为外侧桥的双loop环肽. 主要的合成步骤是先制备含内侧桥的片段, 然后延长外侧链. 接下来先使右侧CONH 关环, 再形成左侧内酰胺键, 构成双 loop 产物[86].
11 小结
统计表明, 尽管直链肽的数量远远多于环肽, 但目前已有的肽类先导化合物、用于临床试验的肽类候选药及已经上市的肽类药物中, 环肽却占一半以上. 由此表明, 在新药研发中, 环肽的成功率远远高于直链肽. 因此, 设计、合成结构多样的环肽不但进一步丰富肽化学的内容, 而且将会促成更多肽类新药的出现.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。

































































