
摘要:创伤性脑损伤 (TBI) 后,因慢性炎症引起的继发性脑损伤是情绪和记忆障碍延迟发作的最主要原因。目前尚无治疗方法可以有效减轻 TBI 后的继发性脑损伤。原因之一是血脑屏障 (BBB),它阻止大多数治疗药物进入大脑。肽类药物因其低免疫原性和毒性、生物利用度高且易于修改而成为中枢神经系统治疗的主要候选药物之一。在本研究中,我们证明,在弥漫性中度 TBI 小鼠模型中,非侵入性鼻内 (IN) 给药 KAFAK(一种细胞穿透性抗炎肽)可以穿过 BBB。值得注意的是,KAFAK 治疗减少了导致继发性损伤的促炎细胞因子的产生。此外,行为测试表明,接受 KAFAK 治疗的小鼠在 TBI 后神经系统、记忆力和运动能力得到改善或恢复。这项研究证明了KAFAK能够穿过血脑屏障、降低体内促炎细胞因子,并在中度TBI后恢复功能。
过去几十年来,创伤性脑损伤 (TBI) 和中枢神经系统疾病(如阿尔茨海默病、脑肿瘤和帕金森病)的发病率一直在上升 [ 1 ]。尽管发病率不断上升,但目前可用的中枢神经系统治疗方法相对较少 [ 2 ]。其中一个原因是,许多治疗分子向大脑的输送受到血脑屏障 (BBB) 的阻碍。脑毛细血管内皮细胞及其之间的紧密连接限制了蛋白质和核酸等大分子的运输 [ 3 ]。此外,由于血脑屏障的复杂性,大多数新开发的有效候选药物在临床试验中失败 [ 4]因此,迫切需要探索治疗脑部疾病的其他方法,例如使用可以穿透血脑屏障的肽。然而,当采用口服给药时,肽可能会被消化道中的酶快速降解;当采用全身给药时,肽可能会在血浆中快速降解 [ 4 , 5 ]。
非侵入性鼻腔内 (IN) 给药是一种越来越常用的替代方法,用于克服 BBB 的局限性,从而增加脑部的治疗负荷剂量。这最大限度地减少了药物剂量,从而可以减少相关的副作用 [ 6 ]。此外,它还可以避免血清蛋白酶和消化酶,这些酶会显著降低生物利用度 [ 4、5、7 ]。鼻腔内给药利用三叉神经和嗅觉通路以及微血管,从而能够将药物输送到脑实质 [ 4 ]。
由于具有毒性低、特异性高、生物利用度高和生产可扩展等优点,肽类药物在治疗领域已显示出巨大的潜力 [ 8 ]。目前,约有 70 种治疗性肽可供使用,还有更多肽类药物正在临床试验中。其中一些肽类药物已证明其在治疗中枢神经系统疾病方面具有潜力 [ 9,10 ]。然而,大多数肽类药物尚未评估其穿过血脑屏障的能力。
除了直接治疗疾病的肽外,一些肽还用于递送药物。其中包括细胞穿透肽 (CPP) 和受体介导肽 (RMP)。这些肽在促进大分子穿过血脑屏障方面表现出特别有希望的结果 [ 11 , 12 ]。CPP 是内源性或合成的小阳离子或两亲性肽 [ 13]。内源性肽载体效率高,细胞毒性小。某些内源性肽能够穿过血脑屏障,这激发了研究人员基于这些天然肽开发神经药物。CPP 转运的确切机制仍有争议,但人们大多认为它们是通过吸附介导的胞吞转运进行的,转运取决于细胞类型和货物 [ 14 ]。与单独的治疗性肽相比,TAT 蛋白、SynB、穿透素和朊病毒肽等 CPP 已显示出更好的治疗性货物转运到大脑的能力 [ 15]。相反,L57 RMP 通过低密度脂蛋白受体相关蛋白 1 (LRP1) 受体转胞吞 BBB。我们最近在体外 BBB 模型中证明了其与另一种 RMP Angiopep-7 相比具有更好的通透性 [ 11 ]。
创伤性脑损伤 (TBI) 是一种复杂的疾病,具有细胞介导的继发性损伤 [ 16 ],即使是轻度损伤,也可能在数月后导致慢性神经系统疾病 [ 17 ]。缺乏有效的诊断工具来检测轻度至中度 TBI,缺乏有效的预防性治疗来尽量减少继发性损伤,导致 TBI 管理困难。继发性损伤可由多种因素引起,包括炎症分子、活性氧和兴奋性毒性。促炎细胞因子,如 TNF、IL-1β 和 IL-6,会促进继发性损伤的进展 [ 18 , 19丝裂原活化蛋白激酶活化蛋白激酶 II (MK2) 通路在神经元炎症中起重要作用。MK2 通路活化增加与 TNF、IL-1β 和 IL-6 水平升高有关,而这会导致继发性损伤。KAFAK 是一种抑制 MK2 的抗炎 CPP [ 7 ]。值得注意的是,局部植入含有这种具有治疗活性的 CPP 和脑源性神经营养因子的水凝胶可显著减轻大鼠脊髓损伤模型中的炎症[ 20 ]。此外,KAFAK 治疗降低了骨关节炎离体模型中促炎细胞因子 TNF、IL-1β 和 IL-6 的表达[ 21 ]。
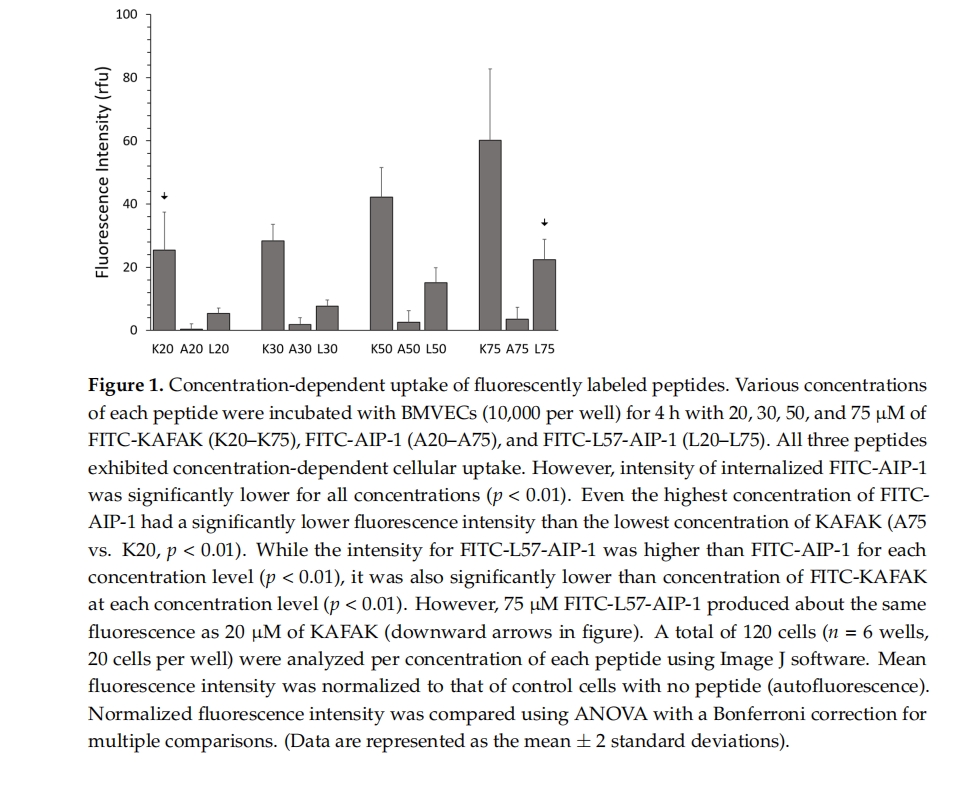
本研究使用了三种荧光标记的治疗性肽 FITC-KAFAK、FITC-L57-AIP-1 和 FITC-AIP-1,以比较它们在原代大鼠脑微血管内皮细胞 (BMVEC) 中的细胞摄取情况。AIP-1 是 KAFAK 的治疗域。还评估了这三种肽的潜在细胞毒性。原代 BMVEC 代表 BBB 的初始结构成分,在调节分子向脑部的运输方面发挥着重要作用 [ 22]。使用原代 BMVEC 可确保实验与体内 BBB 的情况非常相似。即使在低浓度下,KAFAK 也表现出比单独的 L57-AIP-1 和 AIP-1 更好的吸收。此外,在小鼠中使用临床相关的 IN 输注进行 KAFAK 疗法,对小鼠 TBI 中线流体冲击模型中的行为产生了保护作用。它还降低了大脑中的炎症细胞因子水平。由于其能够通过 IN 输注穿过 BBB 并减少炎症,KAFAK 有望成为一种药物输送剂和一种治疗 MK2 通路上调的中枢神经系统疾病的方法。
2 材料和方法
荧光标记肽 KAFAK-RITC (罗丹明-B-KAFAKLAARLYRAKLARQLGVAA)、KAFAK-FITC (FITC-Ahx-KAFAKLAARLYRKALARQLGVAA) 和 L57-AIP-FITC (FITC-AhxTWPKHFDKHTFYSILKLGKH-(Beta-ala)-LARQLGVAA-CONH2) 是定制的,从加拿大安大略省基奇纳的 Biomatik 购买。肽 AIP-FITC (FITC-Ahx-KAFAKLAARLYRKALARQLGVAA) 是定制的,从美国肯塔基州路易斯维尔的 Aapptec 购买。F12 培养基混合物的成分(10% 马血清、10% 胎牛血清、谷氨酰胺、NaHCO 3、和肝素)购自 ATCC USA,嘌呤霉素购自 Millipore Sigma, St. Louis, MO, USA。琼脂糖和 Tris HCl 购自 Avantor/VWR。IL-1β(EK0394)和 IL-6(EK0411)的 ELISA 试剂盒购自 Boster Bio。TNF(BMS607-3)和 Pierce Rapid Gold BCA 蛋白质测定试剂盒购自 Thermo Fisher Scientific。使用的其他试剂包括 0.9% 盐水(Teknova,加利福尼亚州半月湾,美国)、盐酸氯胺酮(Vedco,密苏里州圣约瑟夫,美国)、赛拉嗪(Vet One,菲律宾圣费尔南多)、甲醛(Ward's Science,纽约州罗切斯特,美国)、聚甲基丙烯酸甲酯(Lang Dental,伊利诺伊州惠灵,美国)、低熔点琼脂糖(IBI Scientific,爱荷华州杜比克,美国)、磷酸二氢钠和没食子酸正丙酯(MP Biomedicals,俄亥俄州索伦,美国)、磷酸氢二钠和蔗糖(Sigma Aldrich,密苏里州圣路易斯,美国),
成年 Sprague Dawley 大鼠购自杰克逊实验室并进行繁殖。根据路易斯安那理工大学动物护理和使用委员会批准的 2022-05 方案,通过颈椎离断术处死 1-3 天大的幼崽。该方案包括根据或超过美国卫生和公众服务部《实验室动物护理和使用指南》的要求尽量减少疼痛和不适的方法。从幼崽中提取皮质细胞并在 F12 营养培养基中培养。神经胶质细胞具有通过在培养基中掺入特定生长因子分化为内皮细胞、星形胶质细胞和/或小胶质细胞的能力 [ 11 , 23 , 24]。首先分离神经胶质细胞,然后用5.51 µM嘌呤霉素纯化。为了将它们分化为BMVEC,将纯化的细胞培养在含有内皮生长因子的培养基中。为了确保保留BMVECS的特征,研究中仅使用早期细胞传代。
这些细胞被接种到涂有聚赖氨酸的96孔黑壁板中,密度为每孔10,000个细胞。然后在37°C、5% CO 2的条件下培养直到 50–80% 汇合。随后,用不同浓度的荧光标记肽 FITC-KAFAK、FITC-L57-AIP-1 和 FITC-AIP-1 处理它们,所有这些肽均可溶于 PBS。在 500 µL PBS 中制备肽原液(2 mg/mL),并通过用培养基新鲜稀释原液来制备肽的工作浓度(10 µL、20 µL、30 µL、50 µL、75 µL)。使用两个不同的细胞传代对每种肽进行三次测试,而未处理的细胞则用作对照。达到所需的汇合度后,用含有适当肽浓度的培养基替换孔中的培养基,并在 37 °C 下在 5% CO 2 中孵育 4小时。孵育后,用温热的 PBS 轻轻洗涤细胞三次,去除多余的肽以减少背景荧光。然后用多聚甲醛固定细胞 10 分钟,再用 PBS 洗涤,用 DAPI 染色以显示细胞核。从每个孔的三个不同随机选择区域获取落射荧光图像,同时使用一致的图像采集设置在 10 倍和 20 倍放大率下使用相差来显示细胞,并使用 FITC(激发:470 nm,发射:530 nm)和 DAPI(激发:358 nm,发射:461 nm)滤光片分别显示荧光标记的肽和细胞核。使用配备有数码彩色相机的 Leica DMI 6000B(Leica Microsystems, Inc.,美国伊利诺伊州迪尔菲尔德)倒置显微镜捕捉图像。
使用 ImageJ 软件 ( https://imagej.net/ij/于 2022 年 1 月 15 日访问)量化荧光强度。从每个孔中随机选择 20 个细胞来测量以相对荧光单位 (rfu) 表示的平均荧光强度。然后,减去每个孔的背景荧光强度平均值,再用对照孔的平均荧光强度对数据进行归一化。未溶解的肽聚集体和圆形细胞不包括在分析中。
还使用三种肽 FITC-KAFAK、FITC-L57-AIP-1、FITC-AIP-1 的不同浓度(每种 10 µM、30 µM、50 µM、100 µM、250 µM 和 500 µM)在 BMVEC 中评估细胞毒性,重复三次。首先,将细胞接种到 96 孔板中,密度为每孔 10,000 个细胞,并用三种肽浓度中的一种处理细胞,而对照孔则接受不含肽的相同培养基。处理后,将细胞在 37 °C 和 5% CO 2下孵育按照 CellTiter-Glo 1.0 ATP 检测试剂盒(美国威斯康星州麦迪逊市 Promega 公司)的说明,将板在室温下孵育 30 分钟,使其平衡。接下来,将 CellTiter-Glo 底物、缓冲液混合物和 100 µL 试剂添加到每个孔中的 100 µL 培养基中。然后将板放在轨道振荡器上 2 到 3 分钟,使细胞裂解。使用 Biotek Cytation(美国加利福尼亚州圣克拉拉市安捷伦科技公司)记录发光。
所有实验程序、动物护理和处理均按照路易斯安那理工大学机构动物护理和使用委员会批准的 2202-3 号方案进行。野生型 C57BL/6NHsd 小鼠从杰克逊实验室采购,随后根据需要进行繁殖。在湿度和温度受控的动物饲养箱中,为小鼠提供无限量的食物和水,同时保持 12 小时的黑暗/光照循环。该方案还描述了根据或超过美国卫生和公众服务部《实验室动物护理和使用指南》的要求来尽量减少疼痛和不适的方法。
12 只小鼠用于初步实验,通过腹膜内 (IP) 和 IN 给药确定 KAFAK 的 BBB 通透性。它们没有受到伤害。该过程的详细信息请参阅题为“BBB 通透性的评估”的部分。
总共 24 只 8-16 周龄小鼠,随机分配到以下治疗组,每组 4 只雄性小鼠和 4 只雌性小鼠:(1) 假性 TBI 加载体治疗 (Sham),(2) 中度 TBI 加载体治疗 (TBI),以及 (3) TBI 后给予 KAFAK 治疗 (KAFAK)。治疗在受伤后一小时内通过鼻腔给药 (24 µL 500 µM KAFAK 溶液)。
为了使用 ELISA 研究 KAFAK 的抗炎作用,将 20 只小鼠随机分配到以下四组中:假手术组(IN 载体治疗)、TBI(IN 载体治疗)、TBI 和 IN 输送 KAFAK(24 µL 500 µM KAFAK)以及 TBI 和 IP 注射 KAFAK(14.6 mg/kg)。在实验早期进行了功效分析以确定组大小。
根据我们之前发表的研究,在麻醉下进行了中线液压冲击伤 (mFPI) [ 16]。简而言之,在前囟门和人字门之间的中线处开颅,并将鲁尔锁连接器连接到头骨上。连接器中充满了无菌盐水,并用Parafilm密封。所有程序均在麻醉下进行。当天晚些时候,使用流体冲击装置注入短暂的水脉冲,压低硬脑膜,导致中度弥漫性脑损伤。将小鼠置于仰卧位并记录其翻正时间。这是用于确认中度TBI的指标之一。之后,密封开颅口并将小鼠放回其笼子中,并在将其放回动物饲养箱之前监测其在笼子内的正常运动。
称量小鼠并将其分入单独的笼子,让其适应这种状况,然后再用于研究。使用 SomnoSuite 数字汽化器系统(美国康涅狄格州托灵顿市肯特科学公司)以 500 mL/min 的速度对小鼠进行镇静。在用 1% 异氟烷治疗期间,小鼠保持轻度镇静,仰卧 70 度。通过鼻腔输注给予 6 µL 治疗剂(KAFAK 或载体),然后以一分钟为间隔交替进行三次治疗。输注五分钟后,停止给予异氟烷,将小鼠移回原来的笼子并监测五分钟,然后再将其放回动物饲养箱。
腹腔注射小鼠的处理方式与腹腔注射类似。将 KAFAK (14.6 mg/kg) 或载体注射到腹腔内,同时对小鼠进行镇静并使其保持仰卧姿势,如腹腔注射所述。将每只小鼠放入笼子中,并至少监测五分钟,然后再将其放回饲养箱。
小鼠通过鼻腔或腹膜内接受单次 FITC-KAFAK 或 RITC-KAFAK 治疗,以评估 KAFAK 的 BBB 通透性。FITC 和 RITC 标记的 KAFAK 用于确定在脑中可视化 KAFAK 的最有效标记。治疗四小时后,每只小鼠用 2% 异氟烷镇静,流速为 500 mL/min。然后分别以 100 mg/kg 和 10 mg/kg 的剂量腹腔注射氯胺酮/赛拉嗪混合物。之后,为了减轻压力,将小鼠放回笼子里。深度麻醉后,将每只小鼠以仰卧姿势固定在穿孔尸检台上。切开胸腔,并在右主动脉上开一个缝隙以方便血液引流。然后通过左心室泵入 25 mL 1×冰冷 PBS 来置换血液。
使用 EMS-500 振荡组织切片机(美国宾夕法尼亚州哈特菲尔德电子显微镜科学公司)将冷冻脑切成 60 µm 厚的冠状切片,然后在 4 °C 的黑暗环境中保存直至制备载玻片。脑切片用 DAPI 复染以显示细胞核。用梯度浓度的酒精制备组织切片,然后使用防褪色封固剂将其封固在载玻片上。脑切片(包括嗅球)按从前端到后端的顺序排列在载玻片上。将载玻片密封并保存在黑暗环境中,然后用 Olympus IX51 落射荧光显微镜进行成像。为防止荧光染料光漂白,通过最小化光强度、采集时间并首先执行 FITC 或 RITC 图像捕获来优化图像采集。
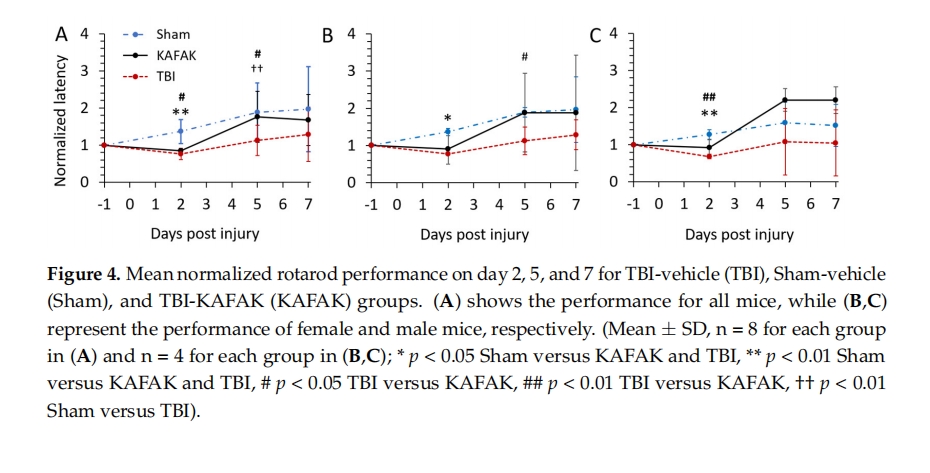
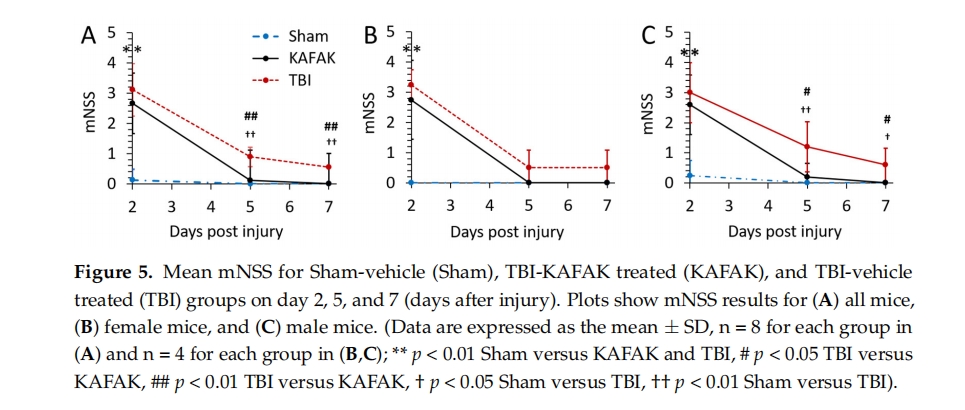
使用型号为 76-0770 的转棒系统(Panlab,巴塞罗那,西班牙)进行转棒测试以评估前庭运动功能。为了尽量减少压力,让小鼠适应环境至少 10 分钟,每次测试后清洁转棒室。记录平均跌倒时间(延迟时间)以评估每只小鼠的表现。每个测试日包含三次独立试验,第二次试验后休息 10 分钟。测试在每天的同一时间段进行。记录每天两次最佳分数的平均值。小鼠在 TBI 前 -3、-2、-1 天接受训练。每只小鼠从 -1 天开始的平均分数被用作其基线分数,以标准化受伤后第二天、第五天和第七天(分别为第 2 天、第 5 天和第 7 天)的测试延迟时间。这些测试在一天中的同一时间进行。第 2、5 和 7 天的分数根据每只动物的基线(-1 天)分数进行标准化,以尽量减少差异 [16 ]。
这一系列测试旨在评估反射、平衡、视觉和触觉障碍。为了评估这些障碍,进行了八项测试:惊吓反应(突然拍手)、寻求行为、后肢屈曲、在 30 厘米长、1 厘米、2 厘米和 3 厘米宽的高架杆上行走、在 0.5 厘米宽的方梁上保持平衡至少 30 秒,以及在直径为 0.5 厘米的杆上保持平衡。未能完成任务会在 mNSS 结果中加一分。零分表示功能未受损,分数越高,脑损伤和神经功能障碍的严重程度就越高 [ 16 ]。
进行行为测试以比较 KAFAK 对治疗组之间记忆功能的影响。NOR 测试基于啮齿动物探索不熟悉物体的自然倾向。该测试在低压力条件下进行,在适应开放盒子 5 分钟后进行。此外,每只老鼠测试后都会清洁盒子。开始测试时,将一只老鼠放在一个方形开放式盒子(30 × 30 厘米,墙壁高 25 厘米)的中心,盒子的对角放置大小相似的物体。在老鼠探索物体的同时,记录老鼠 5 分钟的行为。将其中一个物体移除并替换为另一个具有不同形状的物体(新物体),并记录老鼠的行为另外 5 分钟。MATSAP 软件(https://www.mathworks.com/matlabcentral/fileexchange/58412-matsap,访问于 2022 年 4 月 20 日)用于量化与物体相处的时间。辨别指数 (DI) 计算为 (与新物体相处的时间 × 100)/(与剩余原始物体相处的时间 + 与新物体相处的时间) [ 25 ]。
NOR 测试的视频以每秒 10 帧的速率转换为音频视频交错 (AVI) 文件。然后对文件进行解压缩,删除音频,然后转换为灰度。之后,将视频缩短至 5 分钟 (300 秒),并从最后一帧中移除鼠标,以使用该帧作为背景 [ 25 ]。如果需要,可以将帧稍微裁剪为精确的正方形。然后将视频文件转换为多 TIFF 文件,使用 MATLAB 软件 (版本 R2012a) 中的插件进行分析。
为了评估 KAFAK 减少促炎细胞因子产生的能力,小鼠在 mFPI 后的第一个小时内通过 IN 递送或 IP 注射(16.4 mg/kg)接受 KAFAK(24 µL 500 µM KAFAK)。小鼠在治疗后 12 小时被麻醉并灌注,但不固定,如题为“BBB 通透性评估”的部分所述。使用含有裂解缓冲液(每个半球 500 µL)的手持式组织匀浆器提取、称重和匀浆大脑。所有脑组织的处理和加工均在寒冷条件下进行,以避免细胞因子降解。匀浆后,对样品进行超声处理并放置在 4 °C 的轨道振荡器上 15 分钟,然后以 19,000× g离心. 样品上清液储存在 −80 °C 下直至进行 ELISA 检测。对于 ELISA,样品在冰上解冻,并通过 BCA 检测定量蛋白质浓度。用裂解缓冲液稀释样品以确保测量值在试剂盒的工作范围内,然后根据制造商的说明进行 ELISA。
使用 SPPS 软件版本 28.0.1.0 对行为测试进行统计分析,使用 Gpower 版本 3.1.9.7 计算统计功效以确定实验小鼠数量。分析由对治疗条件不知情的人员进行。在统计假设检验期间,使用 Bonferroni 校正对所有多重比较进行调整。
3.结果

4 讨论
据报道,KAFAK 在骨关节炎模型中具有抗炎作用 [ 7,21 ]。值得注意的是,与其他 CPP 相比,该肽表现出优异的细胞穿透能力和更低的毒性。此外,将含 KAFAK 的水凝胶侵入性直接注射到大鼠脊髓损伤部位也能够减轻炎症 [ 20 ]。然而,其渗透血脑屏障的能力以及使用非侵入性、临床相关的给药途径治疗 TBI 和其他神经炎症疾病的适用性尚未得到研究。KAFAK 能够穿过血脑屏障、减少炎症并改善脑损伤后的行为结果是本研究的动机。
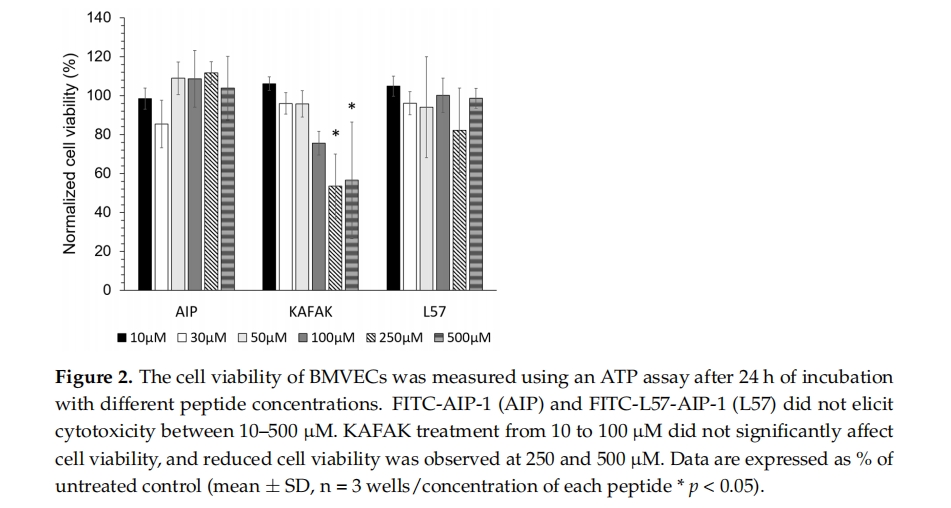
在我们之前的研究中,与另一种受体介导的肽血管肽素-7 (Angiopep-7) 相比,使用原代 BMVEC 的体外 BBB 模型中,RMP L57 表现出更高的细胞摄取量 [ 11 ]。L57 肽通过 LRP-1 受体内化,该受体在多种疾病条件下高度表达 [ 26 , 27]。在本研究中,我们在与之前研究相同的 BMVEC 模型中比较了 KAFAK 的摄取、L57 与抗炎肽 AIP-1 (L57-AIP-1) 结合的摄取以及单独的 AIP-1 肽的摄取。我们的结果显示,与 L57-AIP-1 结合物相比,KAFAK 的摄取提高了 3 至 5 倍,与单独的 AIP-1 肽相比,摄取提高了 14 至 25 倍。我们的阴性对照 AIP-1 的细胞摄取水平较低是意料之中的,因为这种肽既不是 CPP 也不是 RMP。这些结果与我们之前的研究一致,其中使用肝细胞炎症的 LPS 模型,与 AIP-1 相比,KAFAK 在较低浓度下具有治疗效果 [ 28]。此外,与低至中等浓度的相同浓度的 KAFAK 相比,L57-AIP-1 和 AIP-1 肽在 BMVEC 中引起的毒性水平相同。在非常高的浓度下观察到的 KAFAK 毒性可能是由于 KAFAK 的细胞摄取量高得多。KAFAK 的细胞摄取量较高表明相对较低的剂量可以有效减少炎症。此外,根据先前的报告,IN 递送所需的量仅为全身递送所用量的一小部分,因此可以进一步降低剂量水平[ 29,30 ]。
在脑损伤(如 TBI 或缺血性中风)后,迅速减少炎症至关重要,以尽量减少导致慢性神经炎症和潜在长期神经系统损伤的急性炎症级联反应 [ 31,32,33,34 ]。由于 KAFAK 在骨关节炎模型 [ 21 ] 和脊髓损伤模型 [ 20 ]中的抗炎作用,我们推断 KAFAK 会减少引发继发性损伤级联反应的炎症,从而减少或预防慢性炎症。然而,KAFAK 的先前应用依赖于工程纳米颗粒 (NP) 中肽的相对缓慢释放,以实现全身递送 [ 21] 以及直接涂抹在脊髓伤口上的水凝胶 [ 20 ]。为了最大限度地增加可用于紧急治疗的剂量,我们选择使用未受保护的 (游离) KAFAK。然而,静脉注射时游离肽容易被血清蛋白酶降解 [ 21 , 35 ],口服时容易被消化酶降解 [ 4 , 36 ]。为了弥补生物利用度的损失,剂量可以增加很多倍。然而,高剂量可能会导致不良的副作用 [ 30 ]。
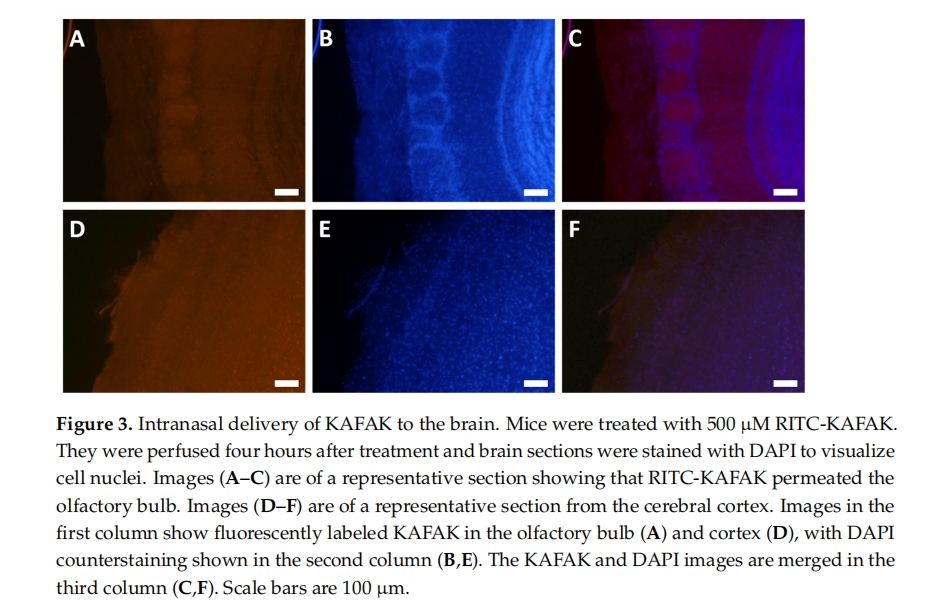
与全身给药的高剂量相比,IN 给药通常使用明显较低的剂量。IN 方法还具有快速吸收和分布到大脑 [ 30 ]、化合物代谢减少导致生物利用度更高 [ 37 ] 以及从神经上皮到体循环的流出量低 [ 38]等优点。]。这些优点结合起来,可以最大限度地提高相对低剂量游离肽(如 KAFAK)的生物利用度,从而快速输送到大脑,同时将全身副作用降到最低。然而,鼻腔输送的缺点可能会削弱游离 KAFAK 的益处。这些缺点包括由于鼻腔内运输面积相对较小而导致的剂量/体积限制、pH 范围的限制以及粘膜肽酶是否会降解 KAFAK 的不确定性 [ 4]。这些缺点对于 KAFAK 输注来说可能微不足道,因为本研究的结果导致小鼠行为指标显著改善,促炎细胞因子浓度降低。此外,我们的研究结果表明,通过荧光成像观察到,以最小剂量无创性地注射荧光标记的 KAFAK 会导致肽在脑实质中弥散分布。相反,腹腔注射导致荧光强度较低,这意味着这种给药途径不如 KAFAK 的腹腔注射有效。
在本研究中,在脑微血管内皮细胞模型中明显观察到了 KAFAK 的细胞摄取,并且在体内模型中观察到了穿过血脑屏障。然而,没有采用更定量的方法来研究其穿过 BBB 的通透性。未来的工作将包括体外测定,以确定 KAFAK 穿过内皮细胞屏障的速率,使用带有 BMVEC 的 transwell 模型。虽然本研究提供了 KAFAK 经鼻给药产生显著有益效果的证据,但给药方案将在未来的研究中进行优化。这些未来的研究还将确定经鼻给药途径的缺点是否会显著降低肽在脑中的生物利用度。如果是这样,纳米颗粒将被设计成能够让肽高效地通过鼻腔,并在脑微血管中快速释放。21、35、39 ] 。尽管我们观察到行为上不存在显著的性别差异,但仍有必要进行进一步研究,包括确定药代动力学、毒性和对剂量水平的反应的潜在差异。
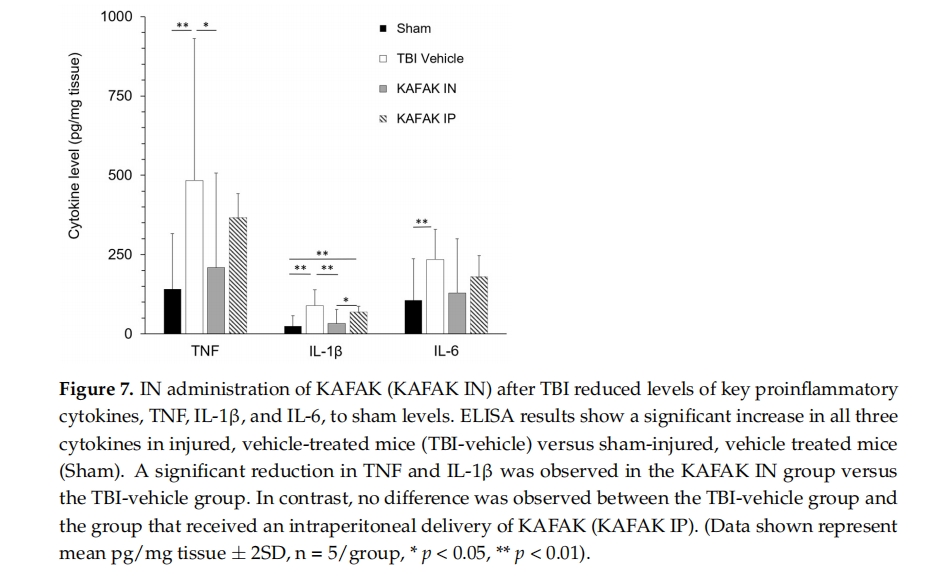
细胞因子 TNF、IL-1β 和 IL-6 是与 TBI 后继发性损伤有关的生物标志物。在本研究中,我们评估了在弥漫性 TBI 诱发后不久施用 KAFAK 肽是否会降低这些促炎细胞因子的水平。与接受载体治疗的假手术小鼠相比,IN 施用 KAFAK 导致 TNF 和 IL-1β 水平显著降低。值得注意的是,MK2 通路与这些细胞因子的产生密切相关 [ 40 ],而 KAFAK 通过抑制该过程发挥作用 [ 7 ]。这些促炎细胞因子的减少可能是由于大脑中的 MK2 通路受到抑制。
与经腹腔注射给药相比,腹腔注射 KAFAK 不会导致炎症细胞因子水平显著降低(与受伤且接受载体治疗的小鼠相比)。此外,腹腔注射给药组的 IL-1β 水平显著高于经腹腔注射给药组。这些结果表明,经腹腔注射给药比腹腔注射给药更有效。腹腔注射给药的化合物可通过门脉系统进入全身循环,而酶促降解会降低其生物利用度 [ 41 ]。因此,腹腔注射给药效果的降低可能是由于全身稀释和酶促降解的共同作用。