
摘 要: 在过去的几十年中, 抗生素药物的过量使用导致耐药性(antimicrobial resistance, AMR)的产生, 这促使人们开始寻找传统抗生素的潜在替代品, 从而降低 AMR 的发生率。目前, 研究人员开始持续关注具有广谱抗菌活性的抗菌肽(antimicrobial peptides , AMPs)。AMPs 是一种能够抑制细菌、真菌、病毒、寄生虫、肿瘤细胞等的小分子多肽, 是不同生物体先天免疫系统的重要组成部分, 是宿主抵御病原体的第一道防线, 具有快速杀伤活性、低毒性和细胞选择性等优点, 在医药、食品、畜牧业、农业等领域均具有良好的应用前景。本文概述了 AMR 的发展、来源、结构、生物活性和作用机制, 并讨论了 AMPs 转化为临床应用所面临的挑战, 旨在总结 AMPs 结构和作用机制的最新研究进展, 并提供其微生物活性的详细证据, 为人们进一步深入研究 AMPs 的抗微生物作用机制提供借鉴与参考。
英国细菌学家亚历山大ꞏ弗莱明在 1928 意外发现了 青霉素, 这一发现标志着现代医学进入抗生素疗法的新 纪元[1] 。青霉素的发现不仅激发了各种新抗生素的开发, 而且改变了整个药物的发现过程。最常用的抗菌药物包括 氨基糖苷类、四环素类、大环内酯类(均来自放线菌)、碳 青霉烯类、青霉素类、头孢菌素类(均来源于真菌)、磺胺 类和氟喹诺酮类(均为合成药物)[2]。抗生素对抗细菌的作用 机制主要包括抑制细胞壁合成(如 阝-内酰胺类)、蛋白质合 成(如大环内酯类和四环素类)、核酸合成(如喹诺酮类)及细 胞膜损伤(如多粘菌素)等[3]。然而, 人们过度依赖抗生素是 有代价的。青霉素的不当使用及在治疗剂量不足的情况下 容易获得耐药性。世界卫生组织(World Health Organization, WHO) 的报告显示 , 全世 界的抗微生 物药物耐药 性 (antimicrobial resistance, AMR)正在不断上升。导致抗生素 耐药性细菌全球传播的最主要原因包括抗生素的滥用和市 场上缺乏有效的抗生素产品[4‒5] 。AMR 显著影响抗菌药物 的疗效, 它可降低治疗效果并延长患者的感染时间进而引 发较高的死亡率。如果不制定适当的计划来克服危机, 抗 微生物药物耐药性和相关感染将构成更严重的健康和经济 负担。因此, 需要人们开展更多相关研究, 寻找并设计更 有效的替代抗生素的治疗方法, 以解决耐药性问题[6] 。这 迫使人们认识到需要寻找到新的抗微生物药物。而具有较 强抗菌活性的抗菌肽(antimicrobial peptides, AMPs)将非常 有希望成为对抗耐药病原体的治疗选择。广泛存在于生物 体内的 AMPs 也被称为宿主防御肽或先天防御调节肽, 是 微生物促进免疫应答的非特异性靶标成分, 是抵御入侵病 原体的一线防御机制[7‒12] 。研究显示, 从蜱虫中分离出的 一种被称作 persulcatusin 的抗菌肽对耐甲氧西林金黄色葡 萄球菌(methicillinresistant Staphylococcus aureus,MRSA) 和耐万古霉素金黄色葡萄杆菌 (vancomycinresistant S. aureus)均具有较好的抗菌作用[13] 。此外, 还有研究人员 证明 protegrin 1 和 hBD-3 这两种 AMPs 和细胞内活性抗 生素( 如庆大霉素、利福霉素) 对 MRSA 、黄体微球菌 (Micrococcus luteus)、鲍曼不动杆菌(Acinetobacter baumannii)、 肺炎克雷伯杆菌(Klebsiella pneumonia)、铜绿假单胞菌 (Pseudomonas aeruginosa)和大肠杆菌(Escherichia coli)均 显示出协同抗菌作用, 值得注意的是, 它们很少会对正常 真核细胞表现出协同细胞毒性作用[14]。目前, 关于 AMPs 的研究正在不断发展和完善。2023 年 1 月更新的抗菌肽数 据库(Antimicrobial Peptide Database, APD3)中共记录了 3569 种 AMPs。然而, 对于 AMPs 的作用机制尚不完全清楚, 仍需要进一步深入研究以确定 AMPs 的理化性质、生 物活性与空间结构之间的关系, 从而获得具有显著抗菌效 果、低成本和安全性较高的 AMPs。本文系统地总结了 AMR 的发展和 AMPs 结构、抗菌活性的和作用机制的最 新研究进展, 以及 AMPs 转化为临床应用所存在的一些挑 战, 拟为人们探寻新的AMPs, 以及更深入探究AMPs 的与 各种病原体微生物的相互作用机制提供一定的参考。
1 抗菌肽的来源和结构
AMPs 是生物体内广泛存在的小分子蛋白质, 是大多 数生物(包括动物、人类、昆虫、鱼类和植物)发生宿主免 疫防御的关键物质[15]。AMPs 是短链氨基酸, 通常由 10~60 个氨基酸组成, 具有两亲性、带正电的特征[16] 。这一特性 使得 AMPs 很容易被整合到细胞膜中或通过细胞膜进入细 胞质, 进而表现出良好的抵抗外来病原体活性[17]。
1.1 抗菌肽的来源
抗菌肽的来源如图1所示, 主要是通过一系列提取和 纯化过程从自然生物(如植物、青蛙、昆虫、真菌、细菌和其他生物等)中获得。在自然生物来源的AMPs中, 两栖动 物、昆虫、哺乳动物和鱼类在内的物种来源AMPs 占总 AMPs 的75.65%, 而其余的主要来源于植物和细菌, 分别 占总AMPs的13.5%和8.53%[18]。除自然生物之外, 研究 者还可以借助计算机生物信息预测等相关软件辅助技术, 设计和优化抗菌蛋白编码序列, 获得一系列改良的AMPs。近年来, 基于来自宿主生物中天然来源的AMP 基因的表 达的AMP 的重组生产已成为一种更有吸引力的方法。此 外, 在重组生产中, 可以通过对肽序列进行修饰或生产用 于特定目的完全合成的类似肽[19‒20]。
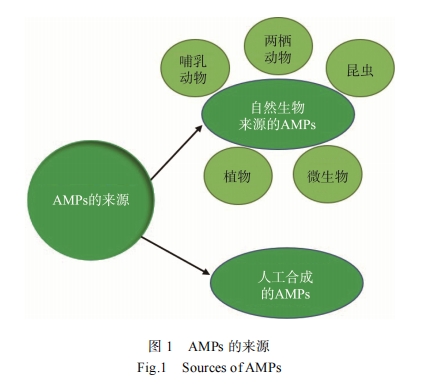
1.1.1 哺乳动物
哺乳动物来源的AMPs种类丰富, 主要来源于皮肤、 肠道、血液、唾液和牛奶。目前, 一些哺乳动物的AMPs已经被充分的研究和表征, 其中大多数具有抗多种病原体 的活性。哺乳动物 AMPs 可分为组织蛋白酶(cathelicidins) 和防御素(defensins)两大类[21] 。来源于哺乳动物AMPs大多数包括吲哚菌素 (indolicidin) 、牛银屑素 (bovine psoriasin)、牛防御素1(bovine defensin1) 、防御 肽 (protegrin) 、天蚕素 (cecropin P1) 、绵羊 防御素 (ovine defensins)和乳铁蛋白(lactoferrecin)[22]。
1.1.2 两栖动物
两栖动物的 AMPs 在保护其免受导致全球两栖动物 种群减少的病原体的侵害方面发挥着至关重要的作用[23]。青蛙被认为是两栖动物中 AMPs 的最主要来源[24]。研究人 员已从 Phyllomedusa sauvagei 青蛙和非洲爪蟾的皮肤分泌 物中获得 magainins 和 dermaseptins 两种 AMPs, magainins 和 dermaseptins 是两类阳离子、两亲性的 α 螺旋肽[25] 。magainins 是一个由 23 个氨基酸组成的长肽, 而 dermaseptins 是由 28~34 个氨基酸组成的线性聚阳离子肽[26]。
1.1.3 昆 虫
昆虫AMPs 在其体内的脂肪中合成并储存在血淋巴 中[27]。目前, 已从昆虫中鉴定出200 多种AMPs。这些AMPs主要分为5大类: 天蚕素(cecropins)、昆虫防御素(insect defensins)、富含甘氨酸的肽(glycine-rich peptides)、富含脯 氨酸的肽(proline-rich peptides)和溶菌酶(lysozymes)[20]。天蚕 素对革兰氏阴性菌和革兰氏阳性菌的抗菌作用均有效, 而昆虫防御素只能选择性地杀死革兰氏阳性菌, 抗菌肽 cecropin A 对不同炎症疾病和癌症均显示良好的活性[28]。令 人意外的是, AMPs 的数量在不同昆虫之间具有很大的差异, 如瓢虫(Harmonia axyridis)和黑水虻(Hermetia illucens)含有 多达 50 种 AMPs, 而豌豆蚜虫(Acyrthosiphon pisum)则不含 AMPs[29]。大多数昆虫 AMPs 具有很强的抗菌活性和低毒性, 因此它们是开发替代抗菌剂的绝佳候选药物[22]。
1.1.4 微生物
从微生物如真菌和细菌中可以多种 AMPs。其中, 来 源于乳酸菌的细菌素是常见 的 AMPs, 如乳酸乳球菌 (Lactococcus lactis)、短芽孢杆菌(Bacillus brevis)和枯草芽 孢杆菌(Bacillus subtilis)。最常见的细菌素包括乳酸链球菌 肽(nisin)、杆菌肽(mersacidin)、乳酸菌素 481 (lacticin 481) 和乳酸菌素 3147 (lacticin 3147)。其中, Nisin 已被批准用于 治疗牛乳腺炎[30], 而 mersacidin 和 lacticin 对于治疗细菌引 起的感染,特别是耐抗生素菌株具有很好 的效果,如MRSA 和耐万古霉素肠球菌(vancomycin-resistant Enterococci, VRE)[31]。
1.1.5 植 物
植物中存在多种AMPs, 已被纯化、鉴定和表征的植物源AMPs 包括防御素(defensins)、蜕皮素(snakins)、puroindoline 蛋白、富含甘氨酸的蛋白质(glycine-rich proteins)、天然环肽(cyclotides)、hevein型蛋白质(heveintype proteins)、硫素(thionins)、knottins 蛋白和脂质转移蛋白(lipid transferproteins)[32‒33]。大多数植物源AMPs是天然碱性的, 分子量为2~10 kDa, 含有4~12个半胱氨酸残基,胱氨酸残基可提高其结构和热力学的稳定性[34]。大部分植物源AMPs与来自哺乳动物、昆虫和微生物的AMPs具有相似的特征。例如,defensins、thionins和cyclotides等植物AMPs, 它们与动物源AMPs的两亲性、分子形式、阳性电荷和富含Cys 的特征是一样的。而另一方面, 一些植物AMPs 又与动物AMPs 不同, 如结合几丁质的类橡胶素(hevein-like peptides)[35‒36]。目前, 已鉴定出数千种植物源AMPs, 但还尚未获得批准用于临床。
1.2 抗菌肽结构的人工优化
然而, 从上述自然生物中提取 AMPs 存在诸多问题, 主要包括稳定性低、耐盐性和毒性高等, 这些问题阻碍了 其广泛应用。对 AMPs 构效关系的研究揭示了天然 AMPs 和新设计合成肽的理化性质、生物活性与空间结构之间的 关系。这使得设计出具有广谱活性和良好稳定性的 AMPs 成为可能[37]。
设计合成新AMPs 的方法主要是通过修改各种生物的天然抗菌肽的序列。研究表明, 氨基酸组成的微小变化可导致肽的构象和理化性质发生显著的变化。对模板肽的修饰主要通过截短、氨基酸取代、杂交或环化等方法。通过截断AMPs序列获得短肽在大规模生产合成AMPs中提供了低成本的优势。此外, 通过去除一些天然肽区域也可以获得毒性或免疫原性降低的合成类似物。ZASLOFF等[38]首先证明, 将含有23个氨基酸的magainin 2的前3个N- 末端氨基酸Gly-Ile-Gly 截短并不会影响其抗微生物活性, 但第4个或更多残基的去除就会导致活性逐渐丧失, 这表明α-螺旋肽跨越膜脂双层只需要至少19个氨基酸。虽然LL-37被发现具有直接膜溶解产生的广谱抗菌和内毒素中和特性, 以及免疫调节和趋化活性, 但由于其显著的溶血性和细胞毒性, 其临床应用受到严重限制。在多个研究中发现, 将LL-37的N端和C端的序列截断或氨基酸进行替换后, 变短的类似物保留了其抗菌和脂多糖中和特性, 并表现出较低的毒性, 同时降低了总体疏水性[39‒41]。与线性肽相比,AMPs的环化使其具有更高的膜渗透性, 以及对蛋白酶的稳定性[42]。ROZEK 等[43]研究表明, 二硫键介导的吲哚美辛类似物CP-11的环化作用使位于肽末端的阳离子Arg和Lys残基紧密接近, 导致主链具有更刚性结构, 从而在空间上阻碍胰蛋白酶的接近。
另一种有效方法是通过杂交技术合成设计 AMPs。例 如, 具有低毒性和活性的 AMPs 与表现出高活性但相对更 高毒性的 AMPs 的组合能够开发具有高抗菌活性和低毒性的新型嵌合型 AMPs[44] 。有研究人员将抗菌肽 cecropin A 和 melittin 的 N-末端 α-螺旋结构域(具有相反的极性)结合 在一起, 获得了一系列具有更强和更广泛抗菌和抗疟活性 的杂交肽, 同时比亲本肽诱导更少的溶血[45‒46]。
尽管拥有各种 AMPs 的优化策略可供选择, 但并没有 能够满足所用需求的完美 AMPs 的万能之策。因此, 应根 据最终的应用性质(如局部或全身)、安全性、所需抗菌能 力的程度和成本仔细考虑选择的优化方法。
1.3 抗菌肽的结构
AMPs根据其二级结构主要分为4种类型, 包括α-螺旋肽(α-helical)、阝-折叠肽(阝-sheet)、线性延伸肽(extended)和环状肽(cyclic)。AMPs的4种三维结构如图2所示。一些抗菌肽完全由单个螺旋或片状折叠组成。延伸肽的特征在于它们缺乏可识别的结构基序。然而, 它们含有大量特定氨基酸, 如精氨酸、色氨酸、甘氨酸和组氨酸[21]。此外,还存在一些具有更复杂的拓扑结构(包括套索肽和硫醚桥接结构)的渐进式环状肽[51]。AMPs的结构会随着环境条件改变而变化, 这主要是与细胞膜的疏水性和净电荷的变化有关[52]。在自然界中,α-螺旋结构是含量最丰富的一类天然肽。这些α-螺旋肽与靶细胞膜相互作用后将折叠成具有两亲性的结构特征。“两亲性”是指在空间中疏水性和亲水性区域分离的性质, 螺旋的一面占主导地位其含有疏水性氨基酸, 其相对面含有带电氨基酸[51]。阝-折叠肽由反向平行阝-片层结构组成, 该类肽通常由一个或多个二硫键来维系其结构的稳定性, 如脊椎动物、昆虫和植物的防御素(defensins)就是典型的阝-折叠结构[53‒55]。延伸结构的肽主要包括吲哚菌素(indolicidin), 含有较高比例的色氨酸、组氨酸和脯氨酸等氨基酸[49]。环状肽的特征在于其环结构是由单键(即二硫化物和酰胺)的存在所形成的[54]。目前, 对AMPs 的结构进行鉴定的实验方法主要有核磁共振(magneticresonance,NMR)、X-射线晶体学(X-ray crystallography)、原子力显微镜(atomic force microscopy, AFM)和冷冻电子显微镜(cryo-electronmicroscopy, cryo-EM)等, 同时也可与分子建模、对接和动力学等计算模拟方法相结合, 更深入地研究AMPs的结构和生物学功能[56]。

2 抗菌肽的生物活性
最近更新的APD3根据AMPs的生物活性可将其分为20 多个种类, 这些生物活性主要包括抗细菌、抗病毒、抗真菌、抗寄生虫、抗人类免疫缺陷病毒(humanimmunodeficiencyvirus,HIV)和抗肿瘤等。此外, 抗菌肽还具有促胰岛素分泌的活性及抗氧化活性[57‒58]。其中, 具有抗细菌活性的AMPs的数量最多, 有超过3000种, 其次是具有抗真菌活性的AMPs, 达1000多种, 而抗肿瘤活性与抗病毒活性分别有200多种, 其他类活性的抗菌肽数量分别约为十几种到数十种。这里主要介绍数量较多的具有抗细菌活性、抗真菌活性、抗肿瘤活性和抗病毒活性的抗菌肽。
2.1 抗细菌活性
ZHAO 等[59]通过使用 Dregea sinensis Hemsl 蛋白酶水 解水牛 αS1 酪蛋白, 分离出一种被命名为BCp12 的抗菌肽。一级结构为YLGYLEQLLRLK, 分子质量为 1508.82 Da,属于疏水性阳离子抗菌肽, 该 BCp12 显示出较高的耐盐性, 将BCp12 加热到 121℃后仍表现出很强的抗细菌活性。此 外, BCp12浓度低于 4 和 1.6 mg/mL 分别导致轻微的溶血 活性和细胞毒性。结果表明 BCp12是一种有效的细菌抑制 剂。ZHU 等[60]发现被命名为 L1G 、L7A 和 L1GA5K 的3种 AMPs 与抗生素利福平、多粘菌素 B 和庆大霉素联合使 用能够对革兰氏阴性菌的有着良好的抑制作用。这 3 种 AMPs 具有良好的生物活性、轻微的细胞毒性、低抗性和对生理盐及蛋白酶的良好稳定性, 可通过膜破裂和释放细 胞内物质快速杀死细菌。综上可知, 抗菌肽不仅自身具有 良好的抗菌活性, 且抗菌肽与传统抗生素之间具有良好的协同作用, 两者联用可提高抗菌肽和传统抗生素的药物疗 效, 拓宽传统抗生素的抗菌谱。
2.2 抗真菌活性
脊椎动物的防御素(defensins)属于阳离子和两亲性肽, 可分为两个亚家族, 分别是 α-defensins 和 阝-defensins[61] 。人 α-defensin-6 (HD6)可防止白色念珠菌(Candida albicans) 黏附到人肠道上皮细胞, 从而防止细菌生物膜的形成[62] 。阝-defensins-1 对烟曲霉的萌发分生孢子显示出抑制活性[63] 。人源抗菌肽 LL-37 被证实可以抑制聚苯乙烯和硅表面上的 白色念珠菌的黏附, 一种牛源抗菌肽 BMAP-28 能够减少 硅表面上白色念珠菌黏附细胞的数量, 并抑制其成熟的生物膜[64‒65] 。目前, 大部分实验还只是在细胞水平上进行 AMPs 的抗真菌活性测试, 缺乏在复杂生理条件下的作用 效果和机制探究。因此, 还需要在该基础上, 进一步增加 动物实验的验证和探究。
2.3 抗肿瘤活性
AMPs 显示出抗癌活性的机制主要包括4 个方面通过: (1)招募免疫细胞(如树突状细胞)杀死肿瘤细胞; (2)诱导癌症细胞坏死或凋亡; (3)抑制血管生成以消除肿瘤营养并防 止转移; (4)激活某些调节功能蛋白以干扰肿瘤细胞的基因 转录和翻译[66] 。研究发现抗菌肽 Trirptitin 及其类似物对 Jurkat 细胞(人外周血白血病 T 细胞)能够产生相当大的毒 性效应。研究人员在体外实验中, 发现抗菌肽吲哚美辛和 嘌呤 A 也表现出了良好的抗肿瘤活性[67]。
2.4 抗病毒活性
具有抗病毒活性的 AMPs 被称为抗病毒肽(antiviral peptides, AVPs)[68]。一些 AVPs 可以通过将病毒整合到病毒 包膜和细胞膜中来中和病毒, 从而破坏病毒膜的稳定进而 防止被感染。类似地, 它们可以与病毒糖蛋白结合, 从而 使病毒不能再与宿主细胞表面结合。而另一些 AVPs 与宿 主细胞受体结合, 进而阻止病毒与其目标受体结合, 最后 使其失活(如抑制单纯疱疹病毒的肝素)[69]。AVPs 对流感病 毒作用的一个基本机制是通过增加抗原复合物上细胞因子 和趋化因子的表达、活化免疫系统细胞和灭活病毒病原体 来调节人体免疫系统[70] 。最近, 关于 AVPs 对冠状病毒[如 严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus, SARS-CoV)]的抗病毒作用的研究越 来越多。有研究表明脂肽 EK1C4 是对抗新冠肺炎 S 蛋白 介导的膜融合最有效的融合抑制剂[71]。另有研究通过计算 机模拟技术验证 50 多种 AVPs 对 SARS-CoV-2 的 S 蛋白的 受体结合域(receptor-binding domain, RBD)的结合能力, 发 现其中 15 种肽对人血管紧张素转化酶 2 (angiotensin converting enzyme 2, ACE-2)受体表现出较高的亲和力, 其 中两个最有希望的候选肽(S2P25 和 S2P26) 能够阻止 SARS-CoV-2 进入细胞。这些发现可能有助于合理设计具 有能够选择性抑制 SARS-CoV-2S 蛋白作用的 AVPs[72]。
3 抗菌肽的作用机制
AMPs 的净电荷和疏水性是其最初能与细菌膜结合的 两个重要特征。如带净正电荷的 AMPs 可与带负电荷的细 胞壁发生静电相互作用[73], 阳离子电荷使肽和质膜发生相 互作用, 促使 AMPs 在膜表面积聚。阴离子 AMPs 也可以 通过利用金属离子辅因子靶向膜, 形成与微生物带负电的 质膜相连的阳离子盐桥[74] 。AMPs 抗菌作用的机制主要分 为膜靶向和非膜靶向两种类型。膜靶向机制可以通过模型 来描述, 如图3 所示[16,75], 包括极点和地毯模型(carpet model),极点模型可 以进一步分为环形空隙模型(toroidal pore model) 和桶壁模型(barrel-stave model)。在桶壁模型中, AMPs 聚集并与质膜管腔中的亲水域形成孔, 而疏水域与 脂质双层接触。在环形孔模型中, AMPs 垂直进入膜, 在脂 质形成环孔时拖曳和弯曲脂质。在地毯模型中, AMPs 可以 通过定位在质膜的水平面上而起到清洁剂的作用, 引起改 变, 然后遭到破坏。AMPs 非膜靶向抗菌活性由抑制细胞 壁、核酸和蛋白质合成及酶活性实现[21]。在非膜作用机制 中, AMPs 以直接渗透或内吞的方式进入细胞。一旦进入细 胞, AMPs 可能具有不同的靶点。AMPs 可以通过干扰相关 效应酶或分子来影响转录、翻译和蛋白质折叠。分子伴侣 是正确折叠和组装新合成的蛋白质并使其具有立体异构性 的关键蛋白质, 这使 AMPs 具有细胞选择性并可防止细胞 毒性[75]。已有研究表明, 阴离子 AMPs 可以直接靶向核糖 体。例如, pyrrhocoricin 靶向核糖体以抑制蛋白质翻译, 而 PR-39 通过抑制从初始阶段到延伸阶段的转变来抑制大肠 杆菌中的蛋白质合成[76]。除此之外, AMPs 还可以抑制蛋白 酶的活性, 如丝氨酸蛋白酶、弹性蛋白酶和糜蛋白酶或靶 向和降解 DNA 或 RNA, 抑制核酸生物合成的关键酶活性 也会干扰 DNA 复制和核酸损伤反应。最后, AMPs(如 histatin 5)还可以靶向真菌线粒体, 导致活性氧生成, 最终 诱导细胞死亡[77‒81]。CRUZ 等[82]报道了一种 MciZ 抗菌肽, 具有抑制细菌分裂的能力, 同时还能够抑制细菌 Z 环形成 和定位。此外, SOMMA 等[83]研究抗菌肽 temporrin L 与大 肠杆菌的相互作用时观察到 temporin L 通过与 FtsZ 和分裂 体复合物相互作用进而损害大肠杆菌细胞分裂。AMPs 与 大肠杆菌细胞的结合将导致形成长链状的细胞丝, 最终使 得细胞无法进行分裂。
4 结束语
由于对细菌、真菌、病毒和寄生虫等具有独特抑制活 性, AMPs 在医药、食品、农业等不同行业均有广泛的应用潜力。特别是近几十年来, 全球范围内的微生物感染的激 增, 人们过度或滥用抗生素, 导致微生物对现有抗生素等 药物产生越来越严重的耐药性。AMPs 与病原体的非特异 性相互作用使其与传统药物不同。因此, AMPs 将是抗微生 物感染极有潜力的药物, 尤其是在消除耐药和多耐药的致 病微生物方面。然而, AMPs 研究仍存在 AMPs 筛选过程艰 难、生物利用度较低、存在潜在细胞毒性、生产成本较高 等问题, 这无疑限制了 AMPs 从实验室转化到临床应用。为了应对这种情况, 越来越多的研究者通过优化合成新 AMPs, 消除其毒性或不稳定性的因素, 增强其抗微生物 活性, 使 AMPs 作为一种新型的替代抗菌剂成为可能。同 时, 还需要进一步开发 AMPs 特异性和高协同能力[84]。
未来关于抗菌肽的研究将主要集中在对AMPs 与复杂的生物体环境之间的相互作用, 这将有助于评估这些抗菌肽类药物的真正潜力。AMPs 的临床试验应重点关注临床需求未得到满足的地方, 以获得动力。通过化学修饰抗菌肽的结构增强化合物通过临床试验的能力, 进而提高它们的可药用性。此外, 计算机建模软件的开发将进一步优化抗菌肽类药物的开发。目前关于AMPs的研究与开发仍处于早期阶段, 需要进一步体外和体内试验, 更充分的阐明AMPs 的作用机制, 并充分表征其结构,以便最终能够应用到人类的临床治疗中。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。