
缺乏有效的神经退行性疾病 (ND) 治疗方法是当前的一个重要问题。脂质纳米颗粒可以递送创新的活性分子组合,以靶向神经退行性疾病的各种机制。将药物递送到大脑进行 ND 治疗的一个重大挑战与血脑屏障有关,这限制了传统药物给药的有效性。当前利用脂质纳米颗粒和细胞穿透肽的策略具有各种吸收机制的特点,有可能延长封装药物的停留时间和生物利用度。此外,可以递送具有神经营养或神经保护特性的生物活性分子,以潜在地介导 ND 靶向途径,例如神经营养因子缺乏、脂质代谢受损、线粒体功能障碍、内质网应激、错误折叠蛋白质或肽片段的积累、有毒蛋白质聚集体、氧化应激损伤和神经炎症。本综述讨论了脂质纳米颗粒和 CPP 的最新进展,以期将这两种方法整合到纳米医学开发和用于神经退行性疾病脑部输送的双靶向纳米颗粒系统中。
1. 简介
中枢神经系统 (CNS) 相关疾病被称为神经退行性疾病 (ND),主要包括阿尔茨海默病 (AD)、帕金森病 (PD) 和亨廷顿病 (HD) [ 1 , 2 ]。尽管全球约有 15 亿人患有 CNS 相关疾病,但现有的 ND 治疗方法主要只是缓解症状,而不能治愈潜在的疾病过程 [ 2 ]。治疗 ND 的挑战不仅仅归因于所涉及的多种致病因素。血脑屏障 (BBB) 的低通透性是另一个重大障碍,它限制了治疗药物进入 CNS [ 3 , 4 , 5 , 6 ,7 ]。
一些最新的中枢神经系统药物输送创新包括:(i) 使用纳米技术设计纳米颗粒或纳米载体,(ii) 创建受体介导的运输系统,(iii) 研究特洛伊木马模拟物以穿过血脑屏障,(iv) 使用鼻腔内的纳米颗粒进行鼻内输送,(v) 利用鞘内或脑室内途径将药物直接输送到脑脊液中,以及 (vi) 使用聚焦超声暂时破坏血脑屏障。这些有针对性的方法旨在提供传统药物输送的替代方案,可能实现更有效的治疗,同时最大限度地减少对中枢神经系统保护屏障的侵入性破坏。
本文旨在简要回顾基于 CPP 和纳米技术的策略,这些策略促进药物在 BBB 中的运输,CPP 介导的细胞吸收药物和其他生物分子的可能机制,以及它们在纳米医学中的潜在治疗用途。此外,还指出了将脂质纳米颗粒和 CPP 结合起来以提高纳米药物制剂的功效的优势。我们重点介绍了中枢神经系统靶向递送系统的一些最新进展,特别是液晶脂质纳米颗粒和 CPP 在脑递送中的应用以及生物分子(生物活性肽、蛋白质和脂质)在预防和治疗神经系统疾病中的治疗用途。在 CPP 中,我们特别感兴趣的是 PACAP(垂体腺苷酸环化酶活化多肽),因其神经营养和神经保护作用而闻名。
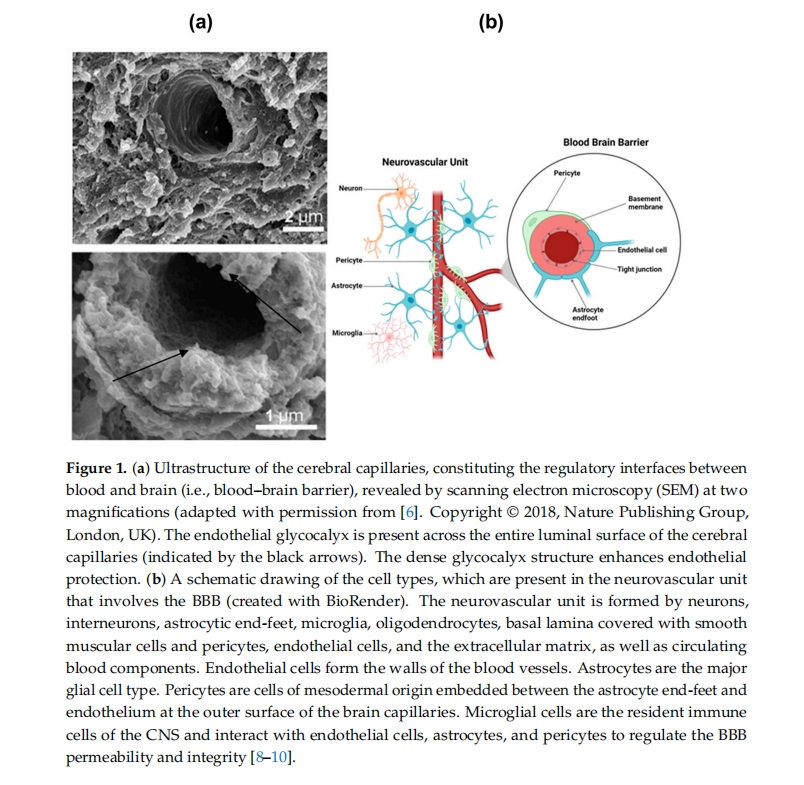
图 1显示了中枢神经系统血管横截面的电子显微照片,图中显示了由不同细胞类型构成的 BBB 超微结构:神经细胞、支持细胞(如星形胶质细胞、周细胞和小胶质细胞)和脑毛细血管内皮细胞 (BCEC) [ 6 , 8 ]。星形胶质细胞是中枢神经系统内一种重要的神经胶质细胞,其细胞突起延伸至包裹血管、神经元突触和郎飞氏结 [ 11 ]。除星形胶质细胞外,小胶质细胞也在介导这一屏障部位的免疫和神经炎症方面发挥着至关重要的作用 [ 3]。过度炎症、氧化应激、血脑屏障破坏、神经元损伤和血管功能障碍都可能由小胶质细胞活化失调引起[ 4、5、6、7 ] 。神经元、神经胶质细胞(如星形胶质细胞)和血管细胞(包括内皮细胞和周细胞)共同组成神经血管单元(图1 b)。神经血管单元的一个重要作用是协调神经元和星形胶质细胞释放的信号,精细调节脑血流,确保大脑获得充足的氧气和营养[ 14]。神经血管单元内的功能障碍与一系列神经系统疾病密切相关,包括 AD、中风和创伤性脑损伤 [ 15 ]。血管细胞在 BBB 中起着关键作用,因为它们直接与血流交界。BCEC 是神经血管单元中的重要血管细胞,它们在相邻的内皮细胞之间具有紧密连接,并显著限制溶质的旁细胞通量 [ 3 ]。血管被两层基底膜 (BM) 包裹,即内层血管 BM 和外层实质 BM,也称为血管周围胶质限制层 [ 5]。血管 BM 是由内皮细胞 (EC) 和周细胞 (PC) 分泌的细胞外基质,而实质 BM 主要由延伸至血管系统的星形胶质细胞突起产生 [ 8 ]。这些特殊的内皮细胞形成中枢神经系统血管壁,并创建具有不同管腔和管腔外膜区室的极化界面。这使得能够精确控制血液和大脑之间物质的运输 [ 4 ]。一方面,这些内皮细胞主动调节某些物质进出大脑,另一方面,它们创建选择性渗透屏障来保护大脑。这种二元性为向中枢神经系统输送药物提供了机会。
1.2. 使用细胞穿透肽和脂质基纳米载体克服血脑屏障挑战的策略
在保持血脑屏障完整性的范围内,人们积极研究如何有效地将治疗药物输送到血脑屏障[ 16、17、18、19、20、21 ]。20世纪90 年代初,人们发现转铁蛋白受体 (TfR) 在脑毛细血管内皮细胞界面高表达[ 13随后,在脑毛细血管内皮细胞界面发现了几种受体和转运蛋白,包括胰岛素受体 (IR)、低密度脂蛋白受体相关蛋白 1 (LRP1) 和各种氨基酸转运蛋白。这些蛋白质也被用于受体介导的药物转运策略,以实现中枢神经系统靶向 [ 7,12 ] 。例如,Johnsen 等人研究了免疫脂质体与血脑屏障脑毛细血管内皮细胞的相互作用,并表明靶向转铁蛋白受体可增强药物向大鼠脑内的转运 [ 22 ]。根据这一发现,促进细胞摄取各种分子的肽被称为细胞穿透肽 (CPP) [23,24,25,26,27,28,29,30 ] 。
在 CPP 中,垂体腺苷酸环化酶活化多肽 (PACAP) 是一种能够通过位于内皮细胞的蛋白质转运系统-6 (PTS-6) 穿越血脑屏障的神经肽 [ 31 ]。越来越多的证据凸显了 PACAP 的重要性,因为它能够进入中枢神经系统,并且具有强大的神经保护和神经营养特性 [ 32 ]。PACAP 已显示出显著的神经保护作用和对抗病理状态的各种有益作用 [ 33 , 34 ]。对 PACAP 等生物活性肽的探索,对于穿越血脑屏障具有很大的希望,并代表了治疗神经退行性疾病的潜在策略 [ 35 , 36 , 37 ,38,39,40,41,42 ] 。
据我们所知,尽管基于 CPP 的递送系统的临床试验数量不断增加[ 43、44、45 ] ,但尚未有任何 CPP 或 CPP/货物组合获得美国食品药品监督管理局 (FDA) 的批准。关于 CPP 的免疫原性、稳定性、特异性和毒性的了解仍然有限。亲水分子和难溶性药物的传统口服给药途径的一个主要问题是其生物利用度低。生物活性肽和蛋白质对于口服给药来说非常具有挑战性。一种预期的策略是使用替代给药途径或纳米颗粒载体来保护此类治疗剂免于酶降解[ 46、47、48 ]。在此背景下,应用基于纳米技术的方法已成为一种有前途的策略,既可以增强药物对大脑的靶向性,也可以增强载多种药物的纳米载体(亲水性或疏水性)的递送[ 17,49,50 ]。
脂质基纳米载体已用于制造高效且成功的抗 COVID-19 疫苗,引起了广泛关注 [ 51、52、53、54、55、56、57、58 ] 。此类纳米颗粒可促进药物穿过血脑屏障,并能够有效输送治疗神经系统疾病的药物[ 59、60、61、62、63 ]功能化纳米粒子具有延长治疗药物在血脑屏障停留时间、增强药物渗透性等优势 [ 9、20、21、22、23 ] 。此外,利用脂质纳米载体进行主动靶向治疗,可实现脑内给药 [ 64、65、66、67、68、69、70 ] 。主动靶向治疗包括将配体附着到纳米系统或CPP表面[ 10、12 ]。] 以促进与 BBB 中组成性表达的蛋白质相互作用,例如低密度脂蛋白受体 [ 71 , 72 ]、转铁蛋白 (Tfr) [ 73 ] 和胰岛素受体 [ 49 , 50 , 74 ]。除了受体介导的转运、肽介导的递送 (CPPs) [ 75 , 76 , 77 , 78 , 79 ] 和基于纳米技术的策略 [ 46 , 47 , 48 ],已经研究了许多用于增强药物跨 BBB 渗透性的策略。这些包括药物的化学修饰 [80 ]、渗透压阻断[ 81 ]、脑内植入[ 82 ]和鼻内给药[ 83 ]。
2. 细胞穿透肽和血脑屏障穿梭肽在中枢神经系统治疗中的应用
2.1. CPP 类型
CPP 是长度可变的氨基酸序列(在 4-50 个氨基酸范围内),具有出色的穿过细胞膜和生物屏障的能力 [ 84、85、86 ]。在细胞模型中,Green 等人展示了合成的转录激活因子 ( TAT ) 肽(其氨基酸序列源自 HIV-1 蛋白(Tat 47-57:YGRKKRRQRRR))穿透细胞膜的能力 [ 87 ] 。TAT是第一个被鉴定的 CPP。CPP 的重要优势在于其跨脂质膜的高转运能力以及低细胞毒性和免疫原性[ 24、25 ]]。这些肽可以促进细胞吸收和递送货物,如肽、siRNA、DNA质粒、荧光化合物和纳米颗粒进入细胞。人们已经探索了使用CPP的各种药物递送策略来治疗一系列疾病,特别是神经退行性疾病[ 26 ]。与治疗ND的替代方法(例如渗透破坏或脑内植入)相比,CPP提供了一种非破坏性的细胞内递送方法,不会破坏质膜结构[ 27,28 ]。
根据 CPP 的物理化学性质、来源或序列类型对其进行分类。根据物理化学性质,CPP 可分为三个亚类:阳离子肽、两亲肽和疏水性肽。阳离子 CPP 是最常见的 CPP 类型。它们在生理 pH 下带高正电荷。一般而言,阳离子 CPP 含有许多阳离子氨基酸,例如精氨酸 (R) 和赖氨酸 (K)。例如,TAT 肽是一种典型的阳离子 CPP [ 29 ]。尽管能够穿过细胞屏障的 TAT 氨基酸序列仍不清楚,但研究表明,带电残基(如精氨酸)在跨膜转运的效率中起着重要作用 [ 30]]。CPPs的另一个特点是带正电荷的CPPs可以与带负电荷的分子(如生物膜的磷脂)发生静电相互作用[ 88 ] 。因此,CPPs的正电荷可提高细胞的摄取效率。然而,CPP序列正电荷的过度增加可能导致细胞毒性增加,体外和体内研究均证实了这一点[ 89,90 ]。Qian等强调富含精氨酸的CPPs具有严重的毒性。作者通过小鼠静脉注射测试了TAT及其结合物的毒性[ 91 ]。TAT的LD50值为27.244mg·kg −1,属于剧毒化学物质。值得注意的是,毒性随着TAT结合复合物中TAT的质量比增加而增大。相比之下,不含任何精氨酸残基的十一肽衍生物的毒性比TAT或寡精氨酸CPP低得多。这一结果表明阳离子CPP的毒性与精氨酸残基的数量之间存在潜在联系。然而,确切的毒性机制仍然难以捉摸。
两亲性 CPP 具有亲水区和疏水区,可折叠成 α 螺旋和 β 片层状结构。根据两亲性 CPP是否具有两亲性一级序列或在折叠时获得两亲性,可进一步将其分为一级两亲性 CPP(例如,甘露糖-6-磷酸 (MPG))[ 92 ] 和二级两亲性 CPP(例如,穿透素)[ 93 ] [ 94 ]。一级两亲性 CPP 仅在细胞膜存在的情况下才采用折叠构象,而二级两亲性 CPP 则倾向于在与脂质膜相互作用之前在溶液中形成二级结构 [ 95 ]。
与阳离子肽和两亲性肽相比,疏水性 CPP 的数量很少。这些肽通常由非极性成分组成,或包含对穿透细胞膜至关重要的特定疏水性基序。它们来自包含非极性元素的信号肽序列,如异戊烯基化肽 [ 96 ]、pepducins [ 97 ] 或 Staples [ 98 , 99 ]。疏水性 CPP 表现出低净电荷和低毒性,其疏水片段在与脂质膜相互作用中起关键作用 [ 100 ]。正在进行的研究旨在了解疏水性对 CPP 生物治疗效果的重要性和功能性 [ 101目前的研究表明,可以利用CPPs的疏水性来预测蛋白质货物的活性[ 102 ]。
2.2. CPPs 增强细胞摄取
CPPs 可增强细胞对各种货物的摄取,包括纳米颗粒、蛋白质、药物和核酸 [ 50,79,80 ] 。将CPPs 与货物结合起来可以通过各种方法实现,包括共孵育、封装、化学结合(共价键合,如化学键)、非共价络合和自组装 [ 103 ]。自发现以来,TAT 已被广泛用作 CPP(表 1 )。TAT 不仅可以穿过质膜,还可以穿过各种细胞膜,包括神经元膜,这使得 TAT 修饰的 NPs 成为用途广泛且有前途的细胞内递送工具 [ 98]] Lee 等人研究了半导体纳米线 (NW) 器件和 TAT 共轭复合物 (TAT-NW) 是否可以内化到原代神经元细胞中。首先,将 NW 与 Alexa Fluor 555 标记的链霉亲和素 (STV) 共价连接。然后,将它们在生物素-TAT 溶液中孵育。最后,将 TAT-NW (5 μg) 与小鼠海马神经元在 37 °C 下孵育 20 小时。通过荧光显微镜检查内化效果(图2)。荧光显微镜成像结果显示 TAT-NW 进入神经元细胞,而对照组中裸露的 NW 仍留在细胞外[ 104 ]。
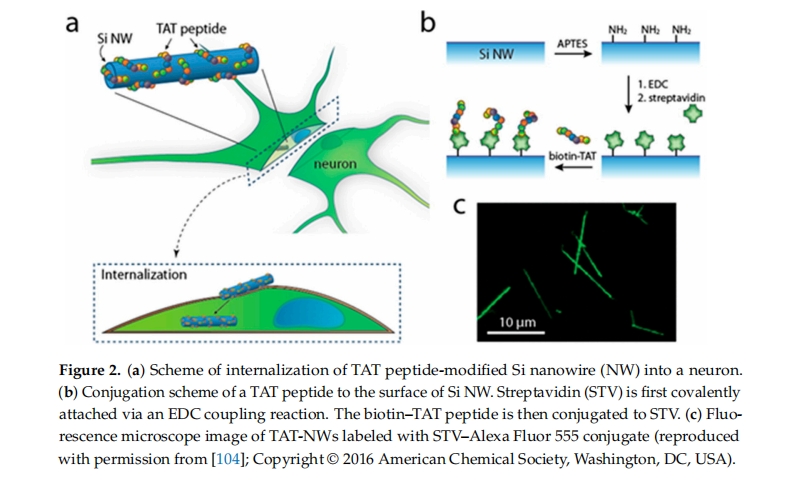
Wen 等人的研究表明,TAT 与磁性 PLGA/脂质纳米粒子的结合可通过穿透细胞膜大大增强脑源性内皮细胞 3 (BEnd.3 细胞) 模型中的治疗分子递送[ 105 ]。大量研究证实,TAT 结合纳米粒子可有效克服 BBB,因此可有效用于实现脑内药物的治疗剂量[ 106]]。此外,Tat-NR2B9c 是一种 TAT 偶联化合物,专门针对 N-甲基-D-天冬氨酸 (NMDA) 受体的 N-甲基-D-天冬氨酸受体亚基 2B 亚基进行设计,作为一种潜在的神经保护剂,表现出良好的效果。它于 2012 年成功完成了一项名为 ENACT(评估动脉瘤栓塞治疗中的神经保护作用)的 2 期临床试验(ClinicalTrials.gov 标识符 NCT00728182)。这些临床发现刺激了 CPP 偶联药物输送系统的进一步应用[ 107,108 ]。

Neves-Coelho 等人研究了一种名为 PepNeg 的阴离子肽(表 1),它可以有效地将绿色荧光蛋白等货物转运穿过血脑屏障而不会破坏血脑屏障 [ 25 ]。作者表明,PepNeg 可以通过能量依赖性和能量不依赖性的吸附介导转胞吞机制来转移血脑屏障,挑战了带负电荷的膜表面是这种肽转移的严格要求这一观点 [ 25 ]。
Alizadeh 等人发现,组蛋白置换 9(一种富含组氨酸的九聚精氨酸肽,表 1)可大大增强 DNA 向细胞中的递送 [ 62 ]。与对照组相比,组蛋白置换 9 复合物可显著增加细胞内的蛋白质表达 [ 62 ]。这种肽介导的 DNA 递送系统可被视为一种有前途的非共价基因转移方法。
Ying 等人提出利用脑靶向性血管肽-2 肽(表 1)通过电响应水凝胶纳米粒子精确递送苯妥英钠进行抗癫痫治疗。在体内成像研究观察到,改良的水凝胶纳米粒子系统显示,与对照组相比,海马和脑干区域的血管肽-2 荧光强度更高。此外,作者在杏仁核点燃癫痫模型中评估了血管肽-2 偶联 NP 复合物的抗癫痫功效。结果证实了这种偶联复合物具有快速、长期和准确的体内脑靶向性,最终增强了苯妥英钠的抗癫痫效果 [ 109 ]。
穿透素是一种众所周知的 CPP,来源于触角足同源结构域蛋白的第三螺旋(表 1)。Alves 等人将穿透素与促凋亡肽 Kappalactone A (KLA) 结合,后者难以穿透真核生物的质膜,因此在哺乳动物细胞中的细胞毒性极小 [ 110 ]。进入细胞后,KLA 肽会破坏线粒体膜完整性,并通过细胞凋亡启动程序性细胞死亡。为了增强 KLA 肽的内化,作者最初证实 KLA-Pen 结合物对来自不同组织的多种人类癌细胞系表现出细胞毒性,包括对某些传统化疗药物有耐药性的细胞 [ 110 ]。
R8 基肽含有一系列带正电荷的精氨酸 (R) 残基序列,由于与带负电荷的细胞表面相互作用,这些残基具有细胞穿透特性。Ringhieri 等人证明,当用 CCK8 和 R8 肽序列双重功能化时,脂质体阿霉素既可以靶向递送至特定细胞,也可以有效内化脂质体药物 [ 111 ]。Chen 等人通过体外研究表明,c(RGDfK) 和肽-22 的联合作用显著增强了 U87 细胞对脂质体的摄取。随后的体内成像证实,与用单一配体修饰的脂质体相比,c(RGDfK)/Pep-22-LP 脂质体在脑肿瘤内的分布更广泛 [ 112 ]。
CPP 还可用于 DNA 疫苗的递送。Saleh 等人使用了一种基于 MPG 的基因递送系统,该系统与核酸形成稳定的非共价 NP 复合物,适用于体外和体内递送 HPV16 E7 DNA。后者编码人乳头瘤病毒 (HPV) 16 型的模型抗原。结果令人信服地证明,MPG 有效地将质粒 DNA 浓缩成稳定的纳米颗粒,平均尺寸范围为 180 至 210 nm,表面带正电。此外,发现基于 MPG 的纳米颗粒的转染效率与聚乙烯亚胺 (PEI) 的转染效率相似。通过蛋白质印迹和流式细胞术检测到的稳定蛋白质表达凸显了基于 MPG 的纳米颗粒作为 DNA 疫苗制剂中有效递送系统的巨大潜力 [113 ]。据报道,从α1-抗胰蛋白酶359–374衍生的合成CPP肽C105Y(表1)在活细胞中表现出很高的快速内化倾向(通过不依赖网格蛋白和洞穴蛋白的途径),并增强基因向细胞核的转移以及随后的基因表达[ 114 ]。膜转运和核定位被认为是能量独立的,而C105Y肽向核仁的运输则以能量依赖的方式进行。
2.3. 血脑屏障穿梭肽
血脑屏障穿梭肽是 CPP 的一个子类,可使各种货物穿过血脑屏障,例如结合小分子、蛋白质、纳米颗粒或遗传物质。1986 年,Pardridge 发现了能够穿过血脑屏障的小肽,包括脑啡肽、转铁蛋白片段和胰岛素样生长因子。这一发现促使人们建议将这些肽用作脑靶向的递送系统 [ 12 ]。随后,体外和体内研究证明了一些肽的脑靶向特性。例如,PepH3 已在体内生物分布和体外实验中证明了其穿过血脑屏障的能力 [ 118目前,人们正在研究小肽作为将物质从血液运输到大脑的潜在策略。其中,Angiopep-2 因其能有效运输治疗有效载荷(如 siRNA [ 119 ]、酶 [ 120 ] 和药物 [ 121 ])穿过血脑屏障而备受关注。Demeule 等人在体外血脑屏障模型和原位脑灌注中研究了一类名为 Angiopeps 的肽家族。结果表明,Angiopep-2 穿过血脑屏障的能力是由其与 LRP1 受体的相互作用介导的 [ 118]。此外,Drappatz 等人报道了一项由 Angiopep-2 和紫杉醇组成的制剂 (GRN1005) 用于治疗神经胶质瘤的 I 期研究。他们指出,GRN1005 在患者中表现出与紫杉醇类似的毒性特征,但显著增加了紫杉醇在肿瘤内的积累。这说明了 Angiopep-2 有可能作为治疗药物在 BBB 中的转运体,且毒性最小 [ 45 ]。
然而,使用血脑屏障穿梭肽仍存在一些困难。确保这些肽靶向大脑的正确部位而不影响其他区域(这可能会产生意想不到的影响)是一个主要问题。此外,这些肽可以穿过血脑屏障运输的物质的大小和种类也受到限制。人们还担心这些肽在体内的停留时间以及产生不良影响的可能性。这些问题表明,在这些肽广泛应用于纳米医学之前,还需要进行大量研究。
虽然血脑屏障穿梭肽的应用仍然存在局限性,但结构修饰可以改善其应用。使用 PepH3 作为模板设计的非典型阴离子肽 PepNeg 可以有效地通过血脑屏障模型运输货物(高达 27 kDa),而不会破坏屏障,而 PepH3 则相反 [ 25]。Li等合成了一种名为转录激活因子-神经降压素的CPP,它能抑制膜联蛋白A1(ANXA1)的核转位,降低caspase-3凋亡途径的激活,增强体外缺氧缺糖的海马神经元的存活率。采用单侧脑室内注射,在脑缺血动物模型中,已经证实转录激活因子-神经降压素肽能有效递送至缺血的海马和皮质[ 122]。透明质酸修饰的肽对脑毛细血管中的人转铁蛋白受体 (TfR) 具有亲和力,能够提供转运蛋白介导的跨 BBB 递送。Arranz-Gibert 等人表明,透明质酸修饰的肽能够将 AuNP 递送到大鼠脑中 [ 117 ]。Prades 等人证明,通过逆对映体方法修饰的肽毒性低、对蛋白酶的稳定性更高,并提高了将药物转运到脑中的能力 [ 43 ]。此外,Oba 等人的研究表明,将环状 dAA 和钉合肽添加到 R9 肽序列 (RRRRRRRRRR) 中可提高细胞穿透能力,因为 dAA 的存在可以稳定 CPP 的螺旋二级结构 [ 123]。
2.4. 与肽介导的血脑屏障通过有关的肽内化机制
CPPs 的精确内化机制仍是一个问题,因为它取决于各种参数,例如肽序列、肽浓度、被结合的治疗分子以及细胞膜的脂质成分。因此,彻底检查 CPPs 进入细胞的模式对于全面评估其安全性和有效性至关重要 [ 124 ]。迄今为止,两种主要的跨膜途径已被广泛接受:(i)直接转运和(ii)内吞作用(图 3胞吞作用是一种需要能量的主动分子运输过程。CPPs 直接跨生物屏障转运是一种能量独立的机制,可以在低温、能量耗竭和使用胞吞抑制剂等特定实验条件下进行评估[ 125 ]。该机制主要包括三种不同的模型,即瞬时环形孔形成模型(如 MPG [ 126 ])、反胶束模型(如 TAT [ 127 ])和“地毯”模型(magainin 2 [ 128,129 ]])。孔隙形成有两种模型:桶板模型和环形模型。在桶板模型中,CPP 形成一个桶状结构,疏水表面靠近脂质,亲水界面位于内部。在环形模型中,脂质弯曲,使 CPP 靠近表面,CPP 和脂质都会形成孔隙 [ 125 ]。反胶束模型是较早引入的一种潜在机制,用于直接渗透渗透素,主要依赖于疏水成分(如色氨酸)与膜内疏水区之间的相互作用 [ 130]]。“地毯”模型也可以称为“膜变薄效应”,因为它反映了带正电荷的 CPP 与带负电荷的膜之间的相互作用。当 CPP 在膜表面聚集时,它们会引起局部表面张力的降低,从而使其能够插入膜中 [ 131 ]。
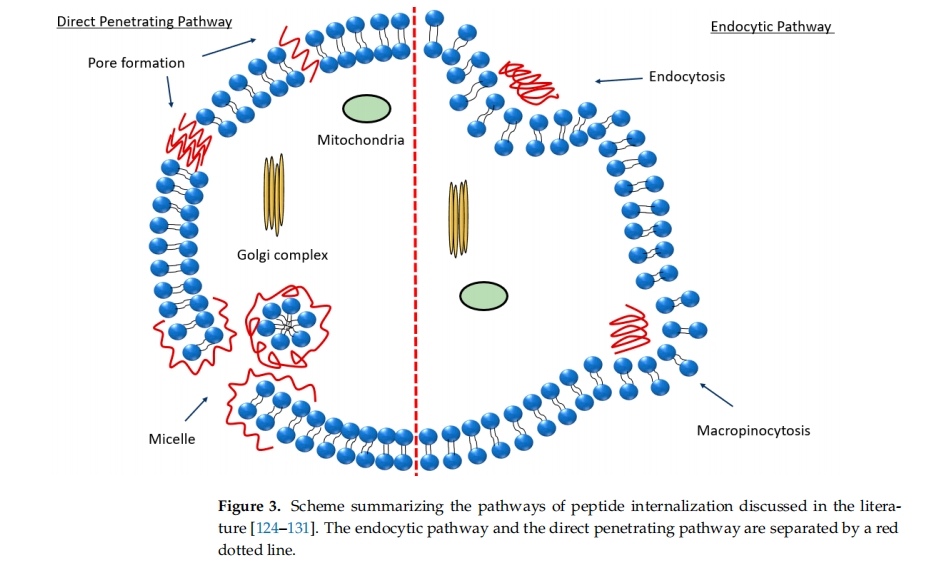
穿过血脑屏障涉及多种转运机制,为药物输送到大脑提供了可能性 [ 131 , 132 ]。(i)被动穿过,包括被动扩散和吸附介导的胞吞转运。被动穿过存在非特异性转运机制。(ii)主动穿过,涉及小分子(如葡萄糖和氨基酸)的特异性转运蛋白。某些蛋白质,如转铁蛋白或胰岛素,可与特定受体结合。
有研究表明,细胞对富含精氨酸的肽的摄取是通过内吞作用和巨胞饮作用机制进行的(图 3)[ 124 ]。PACAP 的细胞摄取涉及直接转位和内吞作用,即,该 CPP 可能通过受体非依赖性机制穿过脂质膜。作为一种生物活性肽,PACAP 在多种生理过程和信号通路中起着关键作用,尤其是在神经功能中。其分布在中枢神经系统和外周器官中均有特征 [ 133 ]。PACAP 还通过三种主要受体采用受体依赖性内化机制:PAC1 受体以及血管活性肠肽受体 1 和 VPAC2 受体 [ 134]。十多年来,受体介导的内吞作用被认为是 PACAP 转位到细胞内区室的潜在机制。然而,Doan 等人提出了一种不依赖受体的细胞摄取 PACAP [ 135 ]。了解 PACAP 的内化机制对于阐明从细胞外围到细胞核的信号转导过程至关重要。
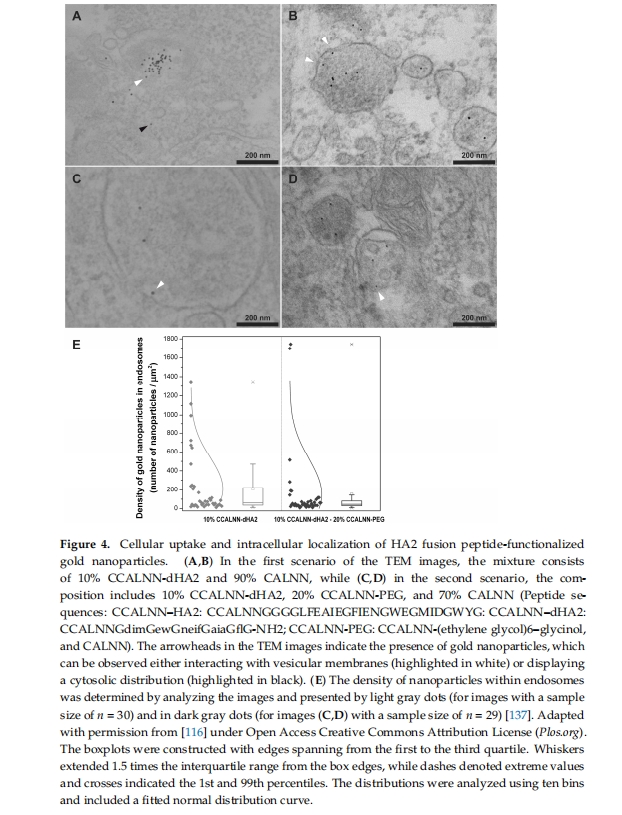
其他 CPP,例如 PepNeg,也可以通过两种途径穿透 BBB。虽然直接转位发生在一些低分子量成分中,但内化机制取决于 CPP 浓度 [ 136 ]。Cesbron 等人通过透射电子显微镜 (TEM) 揭示了 HA2 融合肽功能化的金纳米粒子在 HeLa 细胞中的内化(图 4)。所得结果表明,共轭纳米粒子 (NP) 能够进入细胞。此外,接枝的 PEG 链略微增加了内体中的 NP 密度 [ 137 ]。
3. 纳米粒子介导的药物输送
3.1. 脂质纳米颗粒类型
基于纳米技术的递送系统是用于高效运输治疗剂的最常见递送系统 [ 138 ]。纳米颗粒在各种疾病治疗和诊断中得到广泛探索,为药物递送提供了广泛的可能性 [ 139,140,141 ]。脂质纳米颗粒由胶体分散体组成,已被广泛报道为安全有效的纳米载体 [ 142,143,144,145,146根据其物理化学性质,脂质纳米粒子可分为几类,例如脂质体,固体脂质纳米粒子,纳米结构脂质载体,纳米乳液,囊泡和立方型液晶纳米粒子(图5)。不同类型的脂质纳米粒子具有特殊的特性,可能会影响大脑药物输送,特别是在药物释放和稳定性方面。选择合适的脂质纳米粒子对于有效向大脑输送药物至关重要。了解各种脂质纳米粒子的类型及其独特的特性将有助于优化药物输送过程,以适应复杂的大脑环境,从而治疗神经系统疾病。
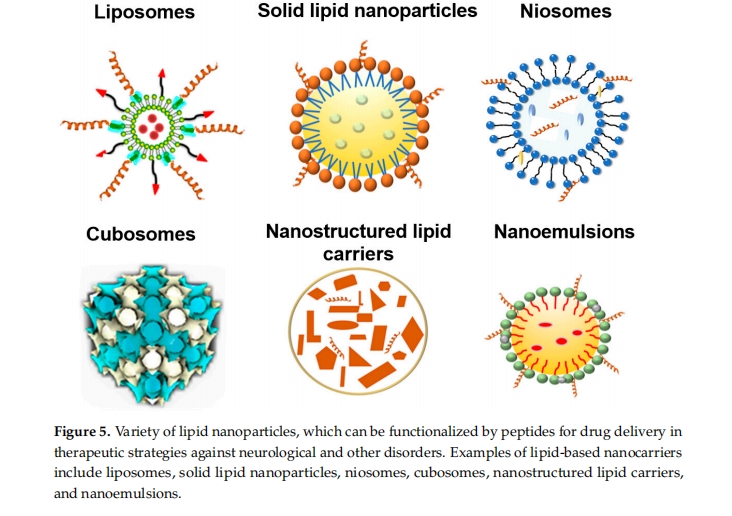
脂质体已被广泛用于脑靶向递送系统 [ 50 ]。脂质体由球形水性核心组成,周围包裹着双层磷脂。一般来说,脂质体如果不靶向配体就无法克服血脑屏障。然而,它们可以通过延长循环时间来增加脑中的药物浓度。脂质体的另一个优点是它们可以封装亲水性和疏水性化合物 [ 147]。与靶向肽结合的脂质体可以从根本上提高药物疗效。dos Santos Rodrigues 等人的研究报道了一种与 CPP 和转铁蛋白 (Tf) 结合的脂质体制剂,它表现出更高的穿过 BBB 的能力。体内研究的结果证实,TAT-Tf 脂质体可将治疗性 DNA 运送到小鼠脑内[ 142 ]。因此,CPP 功能化的脂质体系统在将治疗药物递送到脑方面具有巨大的前景。
固体脂质纳米粒 (SLN) 在室温和体温下含有固体脂质核心。SLN 可以封装多种治疗分子,保护它们免受网状内皮系统清除,并降低其毒性 [ 148 ]。然而,由于脂质相的固化和随后的结晶,SLN 可能存在严重的稳定性问题。纳米结构脂质载体 (NLC) 是由脂质二元混合物形成的胶体系统。NLC 可以避免封装的活性分子发生重结晶和相分离。NLC 具有增强的稳定性并提供控制释放,这对于长时间维持大脑中的药物水平至关重要。因此,NLC 被认为比SLN更稳定[ 144、145、146]。
纳米乳剂是两种不混溶液体的油包水 (O/W) 或水包油 (W/O) 分散体,由适当的表面活性剂稳定。它们由大小为 20 至 400 纳米的小液滴组成。与传统乳剂相比,纳米乳剂的优势在于其稳定性更高、表面积大、吸收快。纳米乳剂的给药途径包括肠外、口服、局部和鼻内给药系统[ 149,150 ]。
立方体是脂质纳米颗粒,具有双连续立方体或胶束立方体类型的内部立方体结构。它们可以通过涉及非层状脂质的脂质混合物的自组装形成 [ 57 , 66 ]。双连续脂质立方体相包含具有周期性最小表面的脂质双层,该双层与三维水纳米通道网络交织在一起。立方体的优点是生物相容性、亲水和疏水化合物共同封装的可能性、在生物环境中的稳定性以及易于被细胞内化 [ 151 , 152立方体型液晶纳米粒子由于其独特的内部自组装立方体膜结构,具有更高的药物包封率和可控的药物释放曲线。纳米载体的持续药物释放似乎对大脑药物输送至关重要。Rakotoarisoa 等人展示了立方体纳米制剂将姜黄素和过氧化氢酶共同输送到人类神经母细胞瘤细胞 (SH-SY5Y) 的能力,该细胞是神经退行性疾病的细胞模型。结果表明,含姜黄素的立方体可以维持或增加酶促过氧化氢酶的活性。这种纳米制剂表现出神经保护特性 [ 153]。立方纳米粒子的表面结构和涂层会影响其吸收机制。Deshpande 等人建立了聚ε-赖氨酸 (PεL) 包被的立方纳米粒子和未包被的空白立方纳米粒子的不同吸收机制 [ 75 ]。
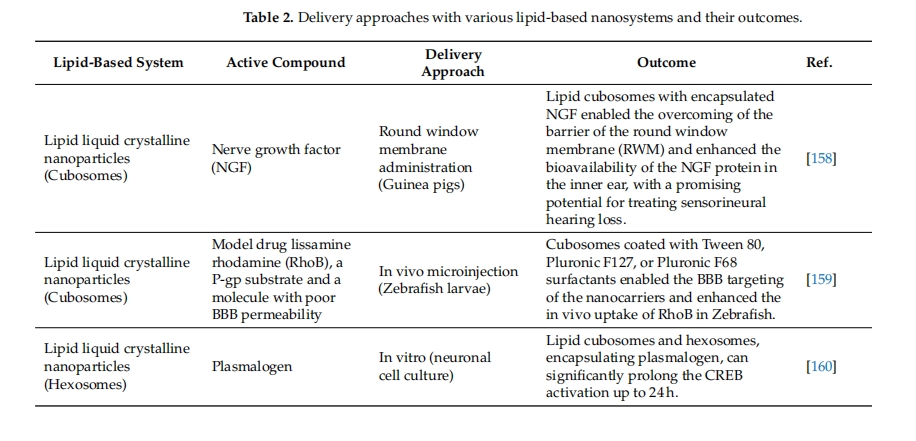
纳米载体类型会影响药物向中枢神经系统的输送[ 154、155、156、157 ] 。表2列举了一些例子,证明了所讨论的 LNP 类型对于药物向大脑或脊髓输送的重要性。
3.2 纳米载体的靶向和内化能力
为了开发基于纳米颗粒 (NP) 的载体,以便有效地跨 BBB 输送药物,必须解决几个问题。我们需要确定 NP 是否能够成功穿过 BBB,如果可以,阐明 NP 实现这种渗透的机制。纳米颗粒可以通过几种机制穿过 BBB [ 163 ]。小的亲脂性分子 (<400 Da) 被动扩散穿过内皮细胞层 [ 164对于相对较大的生物分子配体,该过程涉及受体介导的转胞吞作用。特定的表面暴露配体与内皮细胞受体结合,促使纳米粒子内化并穿过屏障。此外,当纳米粒子由于其特定电荷或表面特性与细胞膜成分相互作用时,可能会发生吸附介导的转胞吞作用。此外,某些纳米粒子或药物递送系统可以诱导暂时的血脑屏障破坏以促进其通过。NPs 穿越血脑屏障的能力取决于各种参数,包括大小、形状、配体密度和结合亲和力以及表面电荷。通过改变这些参数,可以改变 NPs 的血脑屏障穿越能力和内化机制 [ 165]。刘等人发现 TiO 2粒子的大小和形状会影响其通透 BBB 的能力。具体而言,与较大的棒状粒子相比,小球形 TiO 2 NPs 通透 BBB 的效率更高 [ 166 ]。NPs 穿过 BBB 的主要机制是通过内皮细胞层的胞吞作用,这为增强 BBB 通透性以将药物递送至靶细胞提供了选择 [ 167 ]。
为了提高靶向能力,磁性纳米粒子的表面用聚(D,L-丙交酯-共-乙醇酸)(PLGA)和CPP等部分进行改性。经过修饰的纳米粒子被称为第三代“靶向纳米粒子”[ 168 ]。如上所述,靶向通常包括转铁蛋白受体和其他肽,它们在BBB内皮细胞上高度表达[ 142 ]。静脉注射载有阿霉素的纳米粒子可显著延长单发脑瘤大鼠的生存时间。荷瘤小鼠脑切片的荧光图像显示,纳米粒子和阿霉素在大型肿瘤周围大量积聚[ 169Householder 等人提供了直接的生物分布证据,证明 100 纳米纳米粒子在健康小鼠鞘内给药后迅速分布在大脑和脊柱的蛛网膜下腔内[ 170]。c 等人证明,载有神经保护肽碱性成纤维细胞生长因子 (bFGF) 并与抗转铁蛋白受体 1 单克隆抗体 (TfRMAb) 结合的壳聚糖纳米颗粒 (NP) 在通过转铁蛋白受体介导的胞吞转运作用全身给药后迅速渗透到 BBB。这种配方可增强对局灶性脑缺血的神经保护作用。靶向递送不仅具有神经保护作用,而且还通过将施用的 bFGF 剂量减少约 300 倍而大大降低了全身副作用的风险 [ 171 ]。
脂质是用于脑部药物输送的聚合物纳米载体系统的替代选择(图 6),因为迄今为止,只有有限数量的聚合物获得了监管部门的临床使用批准 [ 54 , 56 , 128 ],脂质纳米颗粒 (LNP) 特别适合配制亲脂性药物,并已广泛研究用作大量针对 ND 的治疗剂的载体(例如姜黄素 [ 172 ]、罗匹尼罗 (RP) [ 173 ] 和槲皮素 [ 174 ])。此外,脂质纳米颗粒具有生物相容性和生物降解性等优势,有助于提高其整体安全性 [ 175]。它们可以同时包含亲水性和疏水性药物(作为单一化合物或组合)。此外,LNP 易于扩大生产规模,具有封装和保护生物治疗药物的能力,具有良好的长期稳定性,具有延长药物释放效果,尺寸小,便于细胞内化,允许进行表面改性以促进药物靶向,并便于药物跨BBB运输[ 103、104、105、106、107 ]。
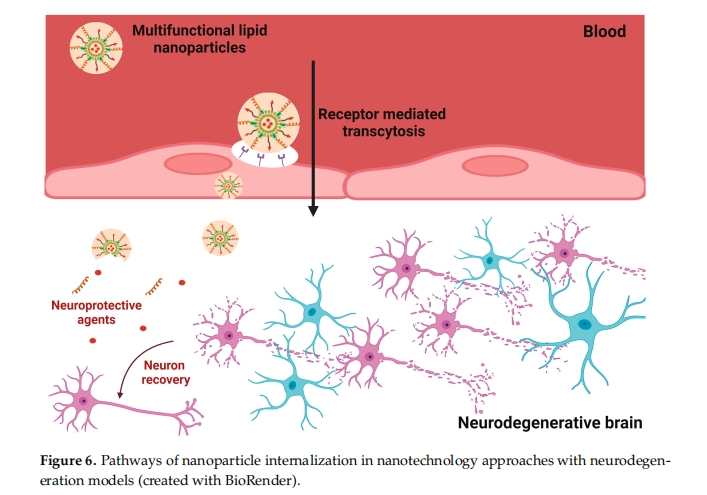
虽然脂质纳米粒子因具有穿过血脑屏障的能力而有望将药物输送到大脑,但它们的疗效受到一些限制。其中一个限制因素是诱导免疫反应,导致被身体清除或引起不良反应 [ 176,177 ]。针对特定的大脑区域仍然是一个障碍,因为大脑复杂的生物环境可能会阻碍纳米粒子中治疗有效载荷的有效运输和释放 [ 178 ]。因此,尽管脂质纳米粒子为大脑药物输送提供了途径,但需要解决现有的缺点,才能成功应用脂质纳米粒子治疗神经系统疾病。
4. 神经退行性疾病纳米药物开发的例子
4.1. 用于神经保护和神经修复的生物活性肽
生物活性肽是通过化学合成或酶水解蛋白质(例如来自食物资源的蛋白质水解物)获得的氨基酸序列。此类肽可用于治疗各种人类疾病[ 75 ]。许多出版物表明,一些具有神经保护作用的生物活性肽(例如 PACAP)可以在预防和治疗神经退行性疾病方面发挥潜在的治疗作用。PACAP(表 1)最初是从绵羊下丘脑提取物中分离出来的,因为它能够刺激大鼠垂体前叶细胞中环磷酸腺苷的形成[ 115]。在过去的三十年中,PACAP 已被证明在各种神经病理学的体外和体内模型中都发挥神经营养和神经保护作用 [ 116 ]。虽然 PACAP 具有细胞穿透能力,但其神经保护潜力引起了更多的关注,使其成为一种有前途的治疗剂,而不是传统的 CPP。PACAP 已被证明可以激活 CREB(cAMP 反应元件结合蛋白),这是一种参与各种细胞过程的重要转录因子。PACAP 与其受体的结合会触发信号级联(ERK、AKT 或 PLC 通路),从而导致 CREB 的激活(图 7)[ 179在AD病理学中,在人类患者的脑脊液(CSF)样本和脑组织中观察到较低的PACAP水平,这与轻度认知障碍和痴呆阶段的认知能力下降有关[ 180 ]。这些数据证实了这种生物活性肽在维持神经元功能方面的重要作用。
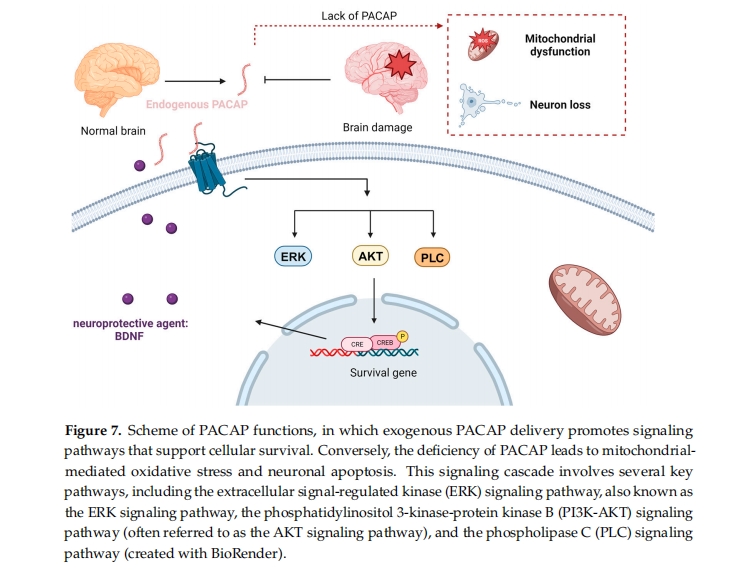
PACAP 治疗已显示出通过保护神经元免受 Aβ-淀粉样蛋白-42 寡聚体的毒性而减缓 AD 进展的效果 [ 181 ]。这种保护可能是通过增强线粒体功能实现的 [ 181 ]。Chen 等人在野生型和 PACAP 缺陷型小鼠中发现了几个在大脑中动脉闭塞 (MCAO) 后上调的基因,随后在 MCAO 后通过 PACAP 治疗抑制了这些基因。这种转录模式符合这些基因在损伤反应中发挥作用的概念,因为外源性 PACAP 治疗与中风后神经系统结果的改善有关 [ 182]]。此外,在黑质和腹侧被盖区也观察到了 PACAP 结合,这两个区域都与帕金森病的发病机制密切相关 [ 183 ]。PACAP 的神经保护特性也在 PD 大鼠模型中得到证实,在该模型中,肽给药可防止黑质多巴胺能神经元的退化,减缓认知能力下降,并通过调节多巴胺水平和 PD 蛋白 7 (PARK7) 改善行为缺陷 [ 184]。虽然有大量证据强调了 PACAP 的关键作用及其对 ND 的治疗潜力,但在将其转化为药物产品之前必须克服某些挑战。将 PACAP 等神经治疗分子输送到 CNS 会带来一些挑战。BBB 的存在和大脑中的一些外排机制使肽或蛋白质类型的神经治疗剂的输送变得困难。
Zhang 等人证明,含有两种抗氧化肽 HDHPVC 和 HEKVC 的圆尾鱼水解物 (RSH) 具有强大的神经保护特性,包括抗氧化、抗凝和降血压等一系列活性。他们还提供了进一步的证据,证实了 RSH 在减轻大鼠睡眠剥夺引起的记忆缺陷方面的保护作用 [ 185 ]。
Leo 等人最近测试了S. hispanica的几种肽级分对 HMC3 细胞的神经保护作用。S. hispanica中的 F-1–3 kDa显著提高了 HMC3 细胞在叔丁基过氧化氢 (TBHP) 损伤后的存活率。这一结果证明了 F-1–3 kDa 肽的神经保护作用。为了了解 F-1–3 kDa 肽的神经保护机制,我们检查了细胞内的 ROS、NO 生成、H 2 O 2生成和 TNF-α。ROS、NO、H 2 O 2的生成和TNF-α在F-1–3 kDa肽孵育后均降低。因此,F-1–3 kDa肽的神经保护作用可能有助于抗炎和抗氧化机制[ 154 ]。
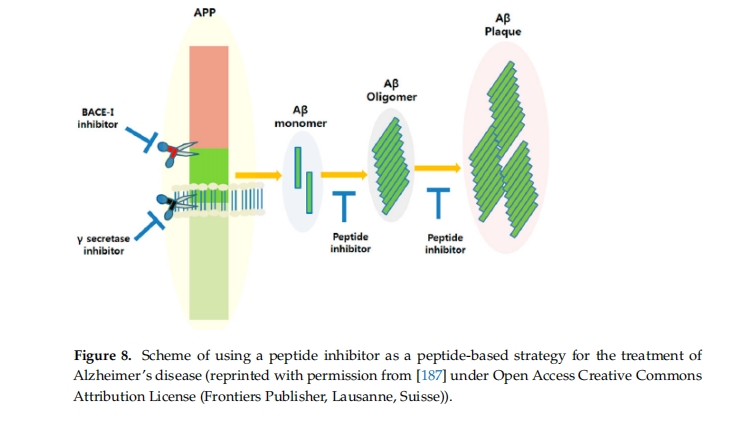
对于阿尔茨海默病,使用针对淀粉样蛋白β的肽抑制剂可以减轻这种蛋白质的积累,这是阿尔茨海默病病理学的一个标志[ 85 ]。淀粉样蛋白β(Aβ)肽是来自一种称为淀粉样蛋白前体(APP)的较大蛋白质的片段,它们倾向于聚集形成有毒的低聚物和原纤维。Aβ肽抑制剂旨在干扰或调节Aβ肽的聚集过程,目的是预防或减缓淀粉样斑块的形成[ 186]因此,过去二十年来,淀粉样β肽抑制剂一直是AD治疗研究的重点。这些抑制剂可以针对Aβ聚集的各个阶段进行定制,包括单体、低聚物和原纤维,其开发对阿尔茨海默病治疗的发展具有巨大的前景(如图8所示)[ 187 ]。
4.2. 用于神经保护和神经修复的脂质纳米粒子
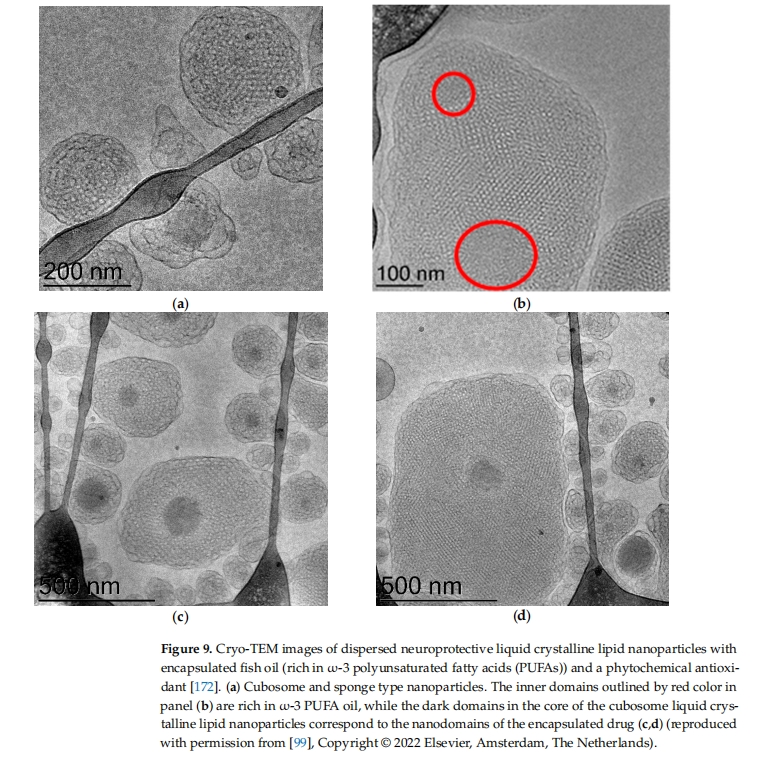
脂质纳米粒子 (LNP) 具有生物相容性和生物可降解性,有助于减轻与传统药物给药相关的副作用 [ 52、143、165、188、189、190 ]。除了安全性之外,LNP 还有助于防止封装的生物活性分子降解 [ 144、145、146、147、149、150、151 ] 。通过自组装制备的双载药立方体型纳米载体可以显示涉及纳米域的多室液晶组织(图 9通过双负载液晶LNPs来调节内质网(ER)应激已被提议作为预防神经退行性疾病的一种治疗选择[ 172 ]。
为了克服肽和蛋白质递送的问题,脂质基纳米载体已被广泛研究用于纳米药物开发,因为它能够保护封装的治疗成分,延长循环时间,并通过修改LNP表面增强靶向效果。Fukuta等人证明了脂质体药物递送系统对缺血性中风治疗的有效性。将制备的PEG脂质体静脉注射到大鼠模型中。使用成像系统在缺血区域切片中检测到DiL荧光。结果表明,PEG脂质体可以在缺血区域中聚集。此外,与非缺血区域相比,缺血区域中的积累增强,说明PEG脂质体能够通过EPR效应(增强渗透性和滞留效应)进入病变区域[191 ]。Gajbhiye 等人报道了使用聚乙二醇化纳米载体作为脑部靶向药物的有效递送。PEG 链延长了药物进入大脑的循环时间[ 49 ]。Rodrigues 等人的研究介绍了使用双重修饰脂质体的其他例子,结果表明,与 CPP 和 Tf 结合的脂质体在单次静脉给药后可以穿过血脑屏障。此外,体内研究结果证实,TAT-Tf 脂质体可促进治疗性 DNA 的运输和进入小鼠大脑。因此,该系统对于脑靶向基因递送似乎非常有前景[ 67 ]。
尽管许多肽和蛋白质已在细胞和动物模型中显示出其神经保护特性,但将这些发现转化为临床应用仍是一项重大挑战。人体是一个错综复杂的互连系统,因此将治疗剂精确输送到大脑是一项重要任务。LNP 适用于神经保护和神经修复,因为它们具有封装疏水性药物和提高药物输送到目标组织后的生物利用度等优势。例如,穿心莲内酯 (AG) 具有神经保护作用,但溶解性差,生物利用度低。Graverini 等人表明固体脂质纳米颗粒 (SLN) 可以将 AG 输送到大脑。SLN 改善了药物的释放特性和向 BBB 部位的运输。这些结果已通过使用体外细胞模型、BBB 模型和大鼠体内实验的评估得到证实。143 ]。Zhu 等人证明了包裹神经生长因子 (NGF) 的明胶纳米结构脂质载体 (GNL) 可减少脊髓损伤 (SCI) 模型中的神经元缺陷。作者研究了神经元存活率、行为恢复情况,并通过苏木精-伊红染色测量了 SCI 恢复的效果。结果表明,施用 NGF-GNL 可通过调节内质网 ER 应激产生神经保护作用 [ 162 ]。Ho 等人的研究展示了 PACAP 对中枢神经系统 (CNS) 的神经保护作用的一个例子,他们研究了纳米颗粒-水凝胶复合材料中 PACAP 控制释放的体内功效 [ 192]]。为了达到治疗效果,采用所创建的控释系统在10天的治疗期内将PACAP局部输送到中风小鼠的大脑中。
4.3. 神经治疗药物输送治疗阿尔茨海默病
对 AD 治疗药物的探索仍在进行中。AD 是最常见的进行性神经退行性疾病,多年来一直是医疗保健面临的最重大挑战之一。其症状包括记忆丧失和认知能力下降,这两者都对患者的日常生活产生深远影响。AD 病例数每年都在增加,尤其是在发达国家。根据世界卫生组织 (WHO) 的预测,到 2050 年,全球患者数量可能高达 1.52 亿 [ 193 ]。AD 是一种复杂的多因素疾病 [ 194]] 淀粉样蛋白 β (Aβ) 聚集体的过度表达和积累被广泛认为是该疾病发病机制中的一个重要因素。因此,绝大多数临床试验和研究工作都集中在开发针对 Aβ 的药物和干预措施上,以减缓 AD 的进展。目前有多个药物开发项目处于第 2 和第 3 阶段。由于许多试验在早期就停止了,因此尚不清楚长期治疗是否会产生有益效果 [ 194 , 195 ]。
4.3.1. 基于肽的策略
基于肽的 AD 治疗策略主要集中在减少淀粉样 β 斑块的积累。基于肽的制剂 CH-3 是由三种酶产生的牛酪蛋白水解物。Akio 等人评估了其 ACE 抑制活性和抗高血压作用,与其他水解物相比,显示出显著的抗高血压作用 [ 196 ]。Min 等人证明,口服 CH-3 肽可以改善 AD 小鼠模型的认知功能。在该研究中,AD 动物模型是通过脑室内注射 Aβ 1-42创建的在小鼠中,导致认知障碍,这通过 Morris 水迷宫测试得到证实。口服 CH-3 后,认知功能恢复到与对照组相当的水平。此外,在 AD 小鼠模型中还检测了一种不同于 CH-3 的三肽 MKP。MKP 表现出穿透 BBB 的能力,并有效缓解了 Aβ 1-42引起的认知障碍 [ 197 ]。
除了这些神经保护肽之外,另一种针对 AD 的肽基策略涉及 Aβ 或 Tau 肽疫苗,由 Aβ 或 Tau 肽的各种片段组成。这些疫苗通过训练人体免疫系统识别和消除阿尔茨海默病患者大脑中存在的有害 Aβ 沉积物(或 Tau 蛋白缠结)发挥作用。ACI-35 就是这样一种候选疫苗,它被设计为一种基于脂质体的疫苗,含有 16 个合成 Tau 片段(Tau393–408)的拷贝,在残基 S396 和 S404 处被磷酸化。这些 Tau 磷酸肽经过修饰,两端各包含两条棕榈酸链,使其能够组装成脂质体。目前,这些有前景的疫苗正在进行临床前和临床研究,以评估其安全性和有效性 [ 198 ]。
4.3.2. 基于蛋白质的策略
蛋白质在维持中枢神经系统正常功能方面起着核心作用。神经营养因子 (NT) 是一类具有神经保护作用和潜在治疗 AD、PD 和亨廷顿氏病作用的蛋白质。神经营养因子可通过对特定神经元群的神经营养作用来预防或减少神经元退化。哺乳动物神经营养因子家族包括神经生长因子 (NGF)、脑源性神经营养因子 (BDNF)、神经营养因子-3 (NT-3) 和神经营养因子-4/5 (NT-4/5) [ 155 , 156 ]。神经胶质细胞源性神经营养因子 (GDNF) 是一种重要的蛋白质,可维持中脑多巴胺能神经元的存活 [ 155]。GDNF 功能障碍与许多神经退行性疾病有关。一项研究报告称,AD 患者血浆中的 GDNF 水平下降[ 157 ]。因此,施用 GDNF 可能是某些中枢神经系统相关疾病的潜在治疗方法。然而,GDNF 不会穿过血脑屏障。Dietz 等人在 PD 小鼠模型中证明了 TAT 可穿过血脑屏障递送 GDNF 的有效性。进行的免疫组织化学分析证实,全身给药后,Tat-GDNF 可以到达大脑区域[ 156 ]。这些基于蛋白质的策略在临床前研究中表现出低毒性,但在最终进行临床试验之前还需要进一步进行配方和安全性研究。
4.4. 细胞穿透肽与纳米粒子的结合用于治疗神经退行性疾病
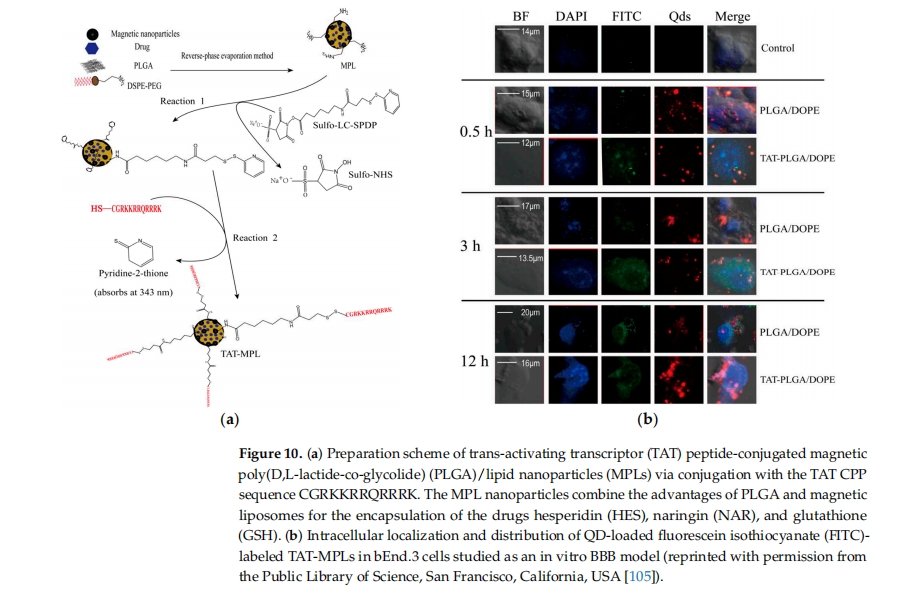
神经退行性疾病,如 AD 和 PD,对将治疗药物靶向输送到大脑提出了重大挑战 [ 52 , 57 ]。CPPs 和纳米颗粒的结合具有多种优势,例如增加细胞摄取和靶向输送特定细胞或疾病部位,从而最大限度地减少副作用并改善治疗效果。多项研究强调了 CPP-NPs 结合物对治疗各种疾病(例如癌症)、中枢神经系统疾病、局部损伤以及成像探针的有益作用 [ 199]。Ahlschwede 等人的研究表明,阳离子 CPP(K16ApoE)与 NPs 的结合不仅可以显著改善治疗分子向脑内的运输,还可以靶向与AD 病理有关的特定肽(Aβ 40 )。这一结果表明,CPP-NPs 结合物可以成为一种有前途的 AD 治疗递送系统 [ 200 ]。Zhang 等人报道了一种双靶向药物递送系统,该系统可递送用于 AD 治疗的 siRNA 治疗剂。该配方可以抑制 β-淀粉样蛋白转换酶 1(BACE1)以减少 Aβ 的形成。此外,双修饰的 NPs 在细胞模型中表现出低毒性 [ 201]。Wen等人展示了一种多功能靶向药物递送系统TAT偶联磁性聚(D,L-丙交酯-共-乙交酯)(PLGA)/脂质纳米粒(MPL)的靶向功效(图10 )。制备过程如图10a所示,使用激光共聚焦扫描显微镜观察到TAT-MPL发出的强荧光(图10b)。这一发现表明TAT-MPL能够有效地将荧光结合物(FITC和QDs)递送到bEnd.3细胞中[ 105 ]。
虽然 CPP 功能化纳米粒子仍在研究中,但它们在 ND 治疗中的广泛应用仍存在障碍。尽管 CPP-纳米粒子组合促进了细胞内药物输送,但它们在不同的生物环境中面临着稳定性、可能的细胞毒性、脱靶效应和选择性差的困难。由于 CPP 和 NP 之间的相互作用而引起的对免疫原性和身体清除的担忧可能会损害货物输送的效率,最终会降低治疗效果。与传统的输送途径相比,“鼻脑”输送等策略能够更快地将药物输送到大脑,并为改善神经退行性疾病和相关中枢神经系统疾病的治疗提供了替代方案。
5. 鼻-脑CPP介导的生物活性分子递送在纳米医学中的应用前景
由于血脑屏障限制了大多数生物分子以治疗剂量输送到中枢神经系统,神经元疾病的治疗面临巨大挑战。除了血脑屏障带来的挑战之外,许多神经保护剂(如 PACAP)的半衰期很短 [ 115 ]。具体来说,当 PACAP 静脉注射 (IV) 时,由于二肽基肽酶 IV (DPP IV)(一种负责从多肽的 N 端裂解 X-脯氨酸或 X-丙氨酸二肽的外肽酶)的快速降解,其半衰期非常短,不足 5 分钟 [ 115除静脉给药外,直接向脑注射由于其高度侵入性且不切实际的临床应用,不被认为是一种现成的转化选择。一种替代且有效的向脑部输送药物的策略是使用非侵入性鼻-脑给药系统。鼻内途径因其能够将药物直接输送到脑部而不经过体循环而受到广泛关注[ 202 ]。虽然从鼻子到大脑的具体路径仍不清楚,但 Pardeshi 等人提出药物通过嗅觉神经通路和三叉神经通路进入大脑[ 203 ]。
过去十年,小分子量药物、肽和蛋白质的鼻腔给药系统研究取得了长足发展[ 161,204 ]。例如,Boche 等人评估了纳米乳剂制剂将富马酸喹硫平 (QTP) 输送到大脑的有效性。与静脉注射制剂 (0.25 ± 0.44 μg/mL) 相比,鼻腔内给药的 QTP 纳米乳剂在大脑中产生的峰浓度更高 (0.48±0.16 μg/mL)。这表明鼻腔内纳米乳剂给药是将治疗分子输送到大脑的有效方法[ 205]。Brown等研究了TAT结合的D1–D2干扰肽经鼻腔给药后的抗抑郁作用。利用加压嗅觉递送(POD)装置将TAT-D1–D2干扰肽施用于抑郁大鼠模型。通过强迫游泳试验、免疫荧光和共聚焦显微镜成像评估研究结果。强迫游泳试验结果显示,与盐水组和TAT组相比,TAT-D1–D2干扰肽和丙咪嗪的不动计数显著减少,表明TAT-D1–D2干扰肽具有抗抑郁作用。此外,对接受治疗的大鼠前额叶皮质切片进行免疫荧光染色证实了TAT-D1–D2干扰肽能够进入中枢神经系统。然而,TAT-D1–D2 干扰肽进入中枢神经系统的机制仍是一个问题[206 ]。为了增强鼻到脑的药物输送,人们探索了各种方法,如壳聚糖表面改性、PEG 表面改性、脂质表面改性和肽表面改性的纳米系统[ 207 ]。目前有几项临床试验正在进行中,旨在探索针对神经退行性疾病的鼻内疗法[ 208 ]。
6 结论
近年来,人们对使用脂质纳米颗粒和 CPP 实现更有效的靶向递送以治疗中枢神经系统疾病产生了浓厚的兴趣。在这篇综述中,我们总结了该领域的最新进展和创新,涵盖的主题包括将脂质纳米颗粒制剂递送至大脑、CPP 的选择性靶向能力,以及 CPP 与纳米颗粒结合的协同效应。在治疗神经退行性疾病方面,脂质纳米颗粒药物在增强治疗分子的溶解度、稳定性和生物利用度方面表现出优势。另一方面,CPP 结合药物在改善细胞摄取和促进选择性靶向方面表现出前景。开发兼具纳米颗粒和 CPP 优势的双重输送系统,对靶向输送系统的未来具有巨大的潜力。人们特别关注 PACAP 肽作为神经保护药物输送方法中的治疗剂的潜力。尽管穿越 BBB 存在固有的挑战,但靶向药物输送系统(包括纳米颗粒载体、双重载药脂质纳米颗粒和 CPP)已证明其在增强 BBB 渗透方面的实用性。此外,鼻脑药物输送的概念已成为一种有前途的向大脑输送药物的方法。为了充分理解潜在机制、减轻潜在的毒性问题并推进新型靶向输送系统的开发,在将该策略转化为人体临床试验之前,还需要进一步研究。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。