
摘要:两亲性多肽分子具有类似天然磷脂分子的两亲特性、 丰富的分子结构、 独特新颖的组装体结构以及特殊的生物学功能, 是多肽自组装研究的热点领域. 本文总结了近年来关于两亲性多肽自组装研究及应用的进展, 介绍了几种常见的两亲性多肽, 并进一步阐述其分子结构特征、 组装行为和机理、 组装体结构和功能以及在纳米技术和生物医学领域中的应用.
多肽自组装广泛存在于生命体中, 是众多生命活动和生物学功能得以实现的基础. 自组装是多肽分子与生俱来的能力, 具有特定氨基酸序列的多肽可以组装形成具有特定空间结构和生物学功能的蛋白质分子. 而多肽及蛋白的错误组装不仅会造成生物学功能的丧失或改变, 而且会产生一系列的病理反应. 因此, 对多肽分子的自组装研究不仅有利于深入了解生命现象, 而且对于许多重大疾病的病理及治疗方法的研究也具有十分重要的意义. 更为重要的是, 多肽作为天然的优良组装分子, 具有特殊的生物活性和良好的生物相容性, 能够赋予材料独特的生物学功能. 易于合成和化学修饰也是多肽分子的突出优势, 通过20种天然氨基酸的排列组合以及外源性功能基团的引入, 可以提供数以亿计的多肽组装分子, 从而形成浩如烟海的结构及功能各异的多肽组装体. 也是实现“自下而上”制备纳米/亚微米结构的新型生物功能材料的一条重要途径. 相比于其它自组装体系, 多肽自组装在先进功能材料制备、 基因治疗、 生物矿化、 生物传感以及组织工程等生物医学领域具有广阔的应用前景, 受到研究人员的广泛重视[1].
在多肽自组装研究中, 作为堆砌模块的多肽分子结构及设计至关重要, 是决定多肽自组装行为及组装体形貌和功能的重要因素. 两亲性多肽分子结构具有类似于表面活性剂的疏水链段和亲水端基, 在疏水性链段间的疏水性作用力和亲水性多肽链段间的氢键协同驱动下, 多肽分子能够自组装形成规整有序的纳米/微米结构. 在组装过程中, 疏水性链段由于憎水而相互聚集, 形成组装体的疏水性内核, 所产生的疏水性作用力是驱动两亲性分子自组装和维持组装体结构稳定的主要驱动力; 而肽链间的氢键则使得相互靠近的亲水性多肽链段以某种特定的二级结构紧密堆砌排列在组装体表面, 与水接触, 进一步驱动组装的完成. 两亲性多肽分子种类繁多, 按疏水链段的构成可以分为疏水链段全部由氨基酸残基构成的表面活性肽(Surfactant-like peptide)和疏水链为长烷基碳链的两亲性多肽(Peptide amphiphiles, PAs), 而后者又可以按照分子结构的不同分为传统的两亲性多肽和结构特殊的两亲性多肽, 如Bola型两亲性多肽和Gemini型两亲性多肽等.
1 由氨基酸残基构成疏水链段的表面活性肽自组装
表面活性肽的疏水链段一般由多个连续的疏水性氨基酸残基组成, 亲水链段含有1个或2个带有1或2个正电荷或负电荷的氨基酸残基, 结构和尺寸与天然磷脂非常相似[2]. Zhang等[3~6]设计合成了一系列小分子表面活性肽, 如带有负电荷的DA6, DV6, D2V6, D2L6[3]和 D[4]2G4~10以及电正性的KA6, H2V6, K2V6和K2L6[5]. 这些小分子表面活性肽在水中可以组装形成由纳米管构成的网状结构, 纳米管周围存在有纳米囊泡; 而亲水链段电荷的正负变化会影响纳米管的直径. 组装机理研究表明, 组装体中多肽分子并没有按照明确的二级结构排列, 说明此类多肽的组装主要依靠疏水间作用力的驱动. 疏水链段聚集于组装体内部形成双分子层, 而亲水链段发生电离与水分子形成水化层, 近似于天然磷脂的组装方式(图1). 在此基础上, 对多肽结构进行了优化, 发现以磷酸化的Ser残基为亲水链段, A6或V6为疏水链段时, 多肽的组装行为更接近天然磷脂[6]. 而将带有相反电荷的A6D和A6K共混时, 随着A6D/A6K混合摩尔比从1∶1增加到2∶1时, 组装体从纳米线转变为膜结构[7].
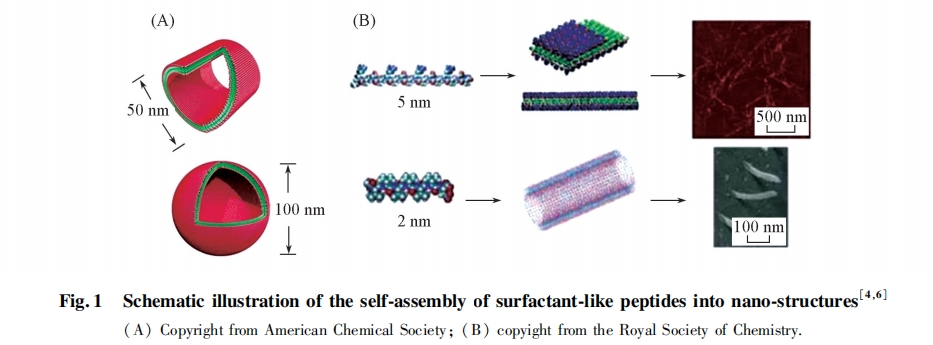
通过改变氨基酸残基种类和数目, 可以调节多肽分子的几何构型, 从而影响多肽分子的组装行为和最终组装体形貌. 如一个非常短的I3K肽组装的双分子层倾向形成卷曲的螺旋带状结构, 并进一步形成直径只有~10 nm的管状结构[8]. Xu和Lu等[9]通过改变AmK多肽中Ala残基的数目(m=3,6,9)来改变多肽分子的几何构型.
由于此类表面活性肽的结构与天然磷脂分子非常相似, 因此其组装形成的双分子层膜可以模拟天然细胞膜的功能, 极具应用潜力. 如表面活性肽V6D, A6D, A6D和V6K可以极大地提高膜蛋白的活性和稳定性[7], 优于传统的表面活性剂N-十二烷基-D-麦芽糖苷和N-辛基-D-葡糖苷[10~12]. 带有正电荷的表面活性肽还可以作为抗菌药物使用, 它可以通过与细菌细胞膜磷脂相互作用破坏细菌的细胞膜结构, 从而杀死细菌. 如表面活性肽AmK(m=3, 6, 9)通过渗入和破坏细菌细胞膜表现出极高的抗菌活性, 且抗菌活性随着疏水链段的氨基酸残基Ala数目增多而增强. 其中, A9K对革兰氏阴性菌和革兰氏阳性菌都有杀灭作用[13].
2 疏水链段为长烷基链的两亲性多肽自组装
疏水链段为脂肪族长烷基链、 亲水链段为亲水性氨基酸残基构成的两亲性多肽分子(PAs)是一类最为重要的组装多肽[14], 最早由Kunitake等[15]提出, 包含由1条或多条长烷基链构成的疏水尾部以及由氨基酸残基构成的连接区、 分隔区和亲水头部[图2(A)]. 长烷基链之间的疏水作用力以及多肽链段间的氢键作用是驱动此类多肽分子组装和维持组装体结构稳定的重要因素. Stupp等[16~23]设计了一系列重要的PAs分子, 采用一段β-折叠序列作为连接区, 而亲水头部则由带电的亲水性氨基酸残基和具有生物活性功能的多肽序列构成[19]. PAs分子在水溶液中组装时, 疏水的长烷基链倾向于在组装体内部聚集形成疏水性内核, 而氨基酸链段则以β-折叠的二级结构堆砌排列在组装体表面形成亲水性外壳, 进而形成具有纳米纤维结构的组装体. 由于组装形成的纤维具有类似于传统胶束的结构, 因此也称之为纤维状胶束[图2(B)][20]. 由于疏水作用力在PAs组装过程中发挥着重要作用, 因此烷基链长度对其组装影响较大. 当烷基链含碳数超过10时, 含有C4G3SPRGD多肽序列的PAs分子在酸性溶液中可自组装形成由纳米纤维缠绕而成的水凝胶; 而当烷基链含碳数小于10时, 由于烷基链间的疏水作用力减弱, PAs分子不能进行组装[17]. 此外, 通过改变亲水多肽链段间的氢键作用可以调控组装体结构和组装行为. 由于极性氨基酸残基的带电状态能够促进或破坏多肽链段间氢键的形成, 因此, 亲水多肽链段中含有带电极性氨基酸残基的PAs分子的组装多具有pH敏感性[16,17,19]和金属离子敏感性[20,21], 且不同带电性的PAs分子对不同金属离子的敏感性不同. 仅有负电性较弱的PA7和正电性的PA8对高浓度的K+敏感, 能够形成凝胶; 而绝大多数的PAs凝胶对Mn2+, Ca2+, Cu2+, Gd3+等二价或三价金属离子敏感. 在此基础上, 他们进一步利用计算模拟以及实验观察的方法绘制了PAs分子组装变化的“相图”, 讨论了PAs分子在水中自组装行为及组装体结构变化与其分子结构、 分子间作用力、 盐离子浓度及溶液pH值之间的关系[18,22]. 近年来, Stupp等[23]将2种带有相反电荷的PAs分子在水溶液中混合, 利用两者间的静电吸引作用组装形成纳米纤维结构, 因此这种组装方法有望实现PAs在生理条件下的自组装.
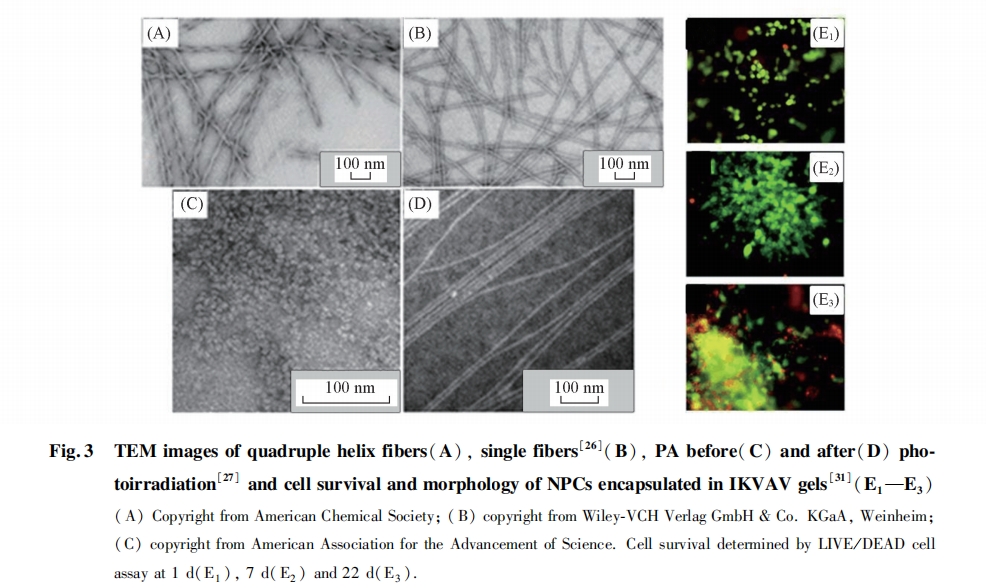
利用上述PAs多肽分子独特的自组装性质, 通过在分子结构中引入特殊的功能基团和具有特定生物活性的功能多肽序列, 从而使PAs的自组装行为、 组装体结构和物理化学性质发生改变, 赋予PAs组装材料更多的应用价值. Stupp等[24] 将4个连续的Cys残基引入到C16-C4G3SPRGD多肽分子结构中, 在酸性条件下组装形成纤维后, Cys残基含有的巯基在I2的作用下发生氧化交联. 这种在组装体内部引入化学交联的方法有效提高了纤维的强度, 交联后的纤维在碱性溶液中仍能稳定存在, 而未化学交联的纤维在碱性溶液中迅速分解. 由化学交联的纤维形成的网络结构能够模拟细胞外基质结构, 通过磷酸化的Ser残基对Ca2+的吸附产生生物矿化功能, 形成的矿化物非常接近天然羟基磷灰石结构成分. 富含组氨酸残基序列的多肽分子C16-A4G3H3组装形成的纳米纤维上具有能够与Fe2+和Fe3+离子结合的活性位点, 以此为模板可以矿化形成磁性纳米材料[25]. 将光敏性的邻硝基苯化合物引入C16-GV3A3E3多肽分子的侧链上, 由于邻硝基苯侧链基团的空间位阻使得PAs分子能够组装形成螺旋状纤维结构, 并相互缠绕形成更高级的二重、 三重和四重螺旋结构. 在紫外光照射后, 侧链邻硝基苯基团发生光解, 螺旋状纤维结构随之转变为普通的单股纳米纤维[图3(A, B)][26]. 将邻硝基苯基化学连接到C16-GV2E2RGDS分子上进一步制备出光控触发的水凝胶材料. 带有邻硝基苯的PAs分子在水中可以组装成球形纳米结构, 当紫外光照射后, 光解脱落邻硝基苯基团的PAs分子组装成具有β-折叠结构的纳米纤维, 进而相互缠绕形成水凝胶. 由于PAs分子含有细胞黏附功能肽段RGDS, 光照后形成的水凝胶能够有效促进NIH3T3细胞膜骨架蛋白的mRNA表达[图3(C, D)][27]. 其它含有RGD功能序列的PAs分子组装形成的水凝胶也同样可以作为优良的细胞培养支架材料[20,28,29], 并可用于制备体内注射成型水凝胶材料, 与纤维细胞生长因子混合后用于组织修复[30]. 含有促神经突生长的Leu-Lys-Val-Ala-Val功能序列的PAs分子可以在细胞培养液中在Ca2+触发下组装形成具有纳米纤维结构的水凝胶, 利用该水凝胶培养和诱导神经元干细胞进行选择性分化[图3(E1~E3)][31]. 此外, Hartgerink等[32]将对细胞基质金属蛋白酶敏感的多肽序列GTAGLIGQ引入到PAs结构中, 组装形成的水凝胶具有酶敏感性, 能够在细胞分泌的Ⅳ型胶原酶的作用下发生降解, 对于人体内的应用具有较大潜力. 组装方法的改变同样可以对PAs的组装进行调控, 并极大地拓展了其生物学应用. 将多肽C16-V3A3E3黏溶液拉成长丝状铺在表面涂有热CaCl2溶液的平板上, 并在80 ℃下保温30 min后发现, 形成的条状凝胶内部纳米纤维呈高度有序的定向排列状态, 不同于C16-V3A3E3在水溶液中形成无规缠绕的纤维. 推测在高温下薄层中的Ca2+对表面带有负电荷的纤维产生了静电作用, 诱导纤维呈定向有序排列. 进一步研究还发现, 细胞可以在定向排列的纤维束上很好地黏附生长, 这可能是因为定向排列的纤维束形成的环境与体内的细胞外基质环境相似, 更适于细胞生长[33].
除了上述包含不同功能链段的PAs分子外, 直接将长烷基链与某一多肽链段相连制备的结构更为简单的PAs分子也具有组装能力, 并能够形成更丰富的组装体形貌. Stupp等[34]将C16烷基链与短肽VEVE相连接制备了一种新型的PAs分子(C16H31OVEVE), 由于疏水性氨基酸残基Val与亲水性氨基酸残基Glu交替排列, C16H31OVEVE极易形成疏水性Val残基和亲水性Glu残基分别排列在折叠面两侧β-折叠的二级结构中. 在水溶液中, 由Val 残基形成的疏水面为了避免与水接触而相互聚集, 使C16H31OVEVE分子形成了独特的二聚体结构, 从而组装形成宽度达150 nm的巨型纳米带状结构(Giant nanobelts). 当增大溶液pH值时, 电离的E残基间的电荷排斥作用使组装体产生规则的缝隙, 从而形成带有沟槽的纳米带(Grooved nanobelt). 巨型纳米带状结构的形成同时依赖于多肽分子溶液的浓度, 在低浓度(0.01%, 质量分数)下首先组装形成狭窄、 扭曲的纳米带(Narrower and twisted nanoribbons); 随着溶液浓度的升高(0.05%), 多条扭曲的纳米带聚集形成更大的带状结构, 并能观测到二者共存的类似扫帚状的中间态结构(Broom morphology); 当溶液浓度达到0.1%时, 巨型纳米带状结构形成. 而将C16H31OVEVE的分子结构更改为C16H31OVVEE时, 无法形成Val残基疏水面相互作用的二聚结构, 纳米带状结构随之消失, 又重新组装形成纳米纤维结构. Rosi等[35]将一段具有高度金和银表面亲和性的多肽功能链段AYSSGAPPMPPE与C12直接键联在一起形成C12-PEPAU两亲肽, 在有HAuCl4存在的羟乙基哌嗪乙硫磺酸(HEPES)缓冲液中, 能够组装矿化形成高度规整的左手双螺旋多肽-金纳米颗粒杂化结构(图4).

Wang等[36]将C12烷基链与β-淀粉样纤维肽的一段功能序列EVHHQKL[Aβ(11~17)]相连制备出C12-Aβ(11~17)两亲肽. 在低pH值溶液中, C12-Aβ(11~17)能够组装成长度不等、 直径约为5 nm的棒状纤维; 随着pH值的升高, 这些短棒状纤维又能进一步相互排列形成长的纤维结构. 而溶液pH=10时, 组装体则转变为扭曲的带状结构, 推测不同pH值溶液中分子间作用力的变化是导致组装体形貌发生改变的主要原因. Core等[37]系统地研究了烷基链的长度、 数目以及温度对含有胶原蛋白片段肽GVKGDKGNP GWPGAP(IVH1)的PAs分子组装行为的影响. 发现含有单条烷基链或2条C12~14烷基链的PAs分子能够组装形成球形胶束; 而含有2条C16~18烷基链的PAs分子则能组装形成盘状胶束, 并且这些盘状胶束在室温下能进一步相互堆积形成更大的棒状结构. 但通过升温-冷却处理后, 棒状结构则全部转变为球形胶束. 此外, 将烷基链与某些功能肽直接相连, 利用其独特的组装性能能够有效地提高原功能肽的作用效果. 如将具有杀菌作用的功能肽KLFKRHLKWKII(SC4)与C12或C18相连制备的新型抗菌PAs分子, 对革兰氏阳性菌的杀灭效果比原SC4肽提高了30倍, 甚至对传统抗菌药物无效的金黄色葡萄球菌也有很好的杀灭作用[38].
除了上述化学键联外, 通过静电作用及主客体相互作用等非共价键作用力也能制备复合型PAs分子组装模块. Kros等[39]利用环糊精与金刚烷的主客体相互作用, 将含有金刚烷端基的多肽分子修饰在环糊精囊泡表面. 当溶液pH=5.0时, 囊泡表面的多肽链可以通过氢键作用形成β-折叠的二级结构; 而当溶液pH=7.4时, 组装体结构可以从球形囊泡结构转变为线性纤维, 并且囊泡中包裹的药物分子也随之释放. Scherman等[40]利用主客体相互作用将芘肽、 紫脂以及葫芦脲相连接, 制备了新型三元复合分子(芘肽/葫芦脲/紫脂), 此三元复合分子能够自组装形成囊泡结构. 当体系中存在新的客体分子2,6-二羟基萘时, 它与紫脂间更强的作用会使芘肽游离出来, 并形成新的三元复合分子(2,6-二羟基萘/葫芦脲/紫脂), 组装体结构也随之由囊泡转变为纳米粒子. 当客体分子变为金刚烷时, 则会与葫芦脲分子相互作用, 三元复合分子解体, 组装体也随着消失. 更为特殊的是, 由于芘肽分子所处微观环境的不断变化, 此过程同时伴有荧光的猝灭和恢复. 这种具有荧光开关功能的新型纳米材料在生物成像和药物传递等领域显示出良好的应用潜力.
近年来, 一些新的关于PAs自组装研究被相继报道, Das等[41]设计合成了一种含有赖氨酸残基的新型PAs分子, 其在水溶液以及水和有机溶剂的混合溶液中能够组装形成具有螺旋纳米纤维结构的凝胶体系; 所形成的螺旋纳米纤维能够作为模板原位合成结构均一的介孔硅单壁碳纳米管. 而将具有原卟啉[(PPIX)Zn]络合能力的组氨酸残基引入到C16-AHL3K3多肽分子中, 通过C16-AHL3K3组装形成的纤维阵列结构可以调控金属卟啉的有序排列, 从而制备出具有特殊光物理性能的新型纳米材料[42]. Danino等[43]设计合成了另一种结构类似于2个PAs分子首尾相连而成C12-β12多肽分子, 此类分子在组装时能够发生链段的分子内折叠从而形成不同的组装体结构.
研究发现, 在低温条件下, C12-β12首先组装形成纤细的纤维, 随着培育时间的延长, 纤维进而转变为扭曲的带状结构, 并进一步卷曲成纳米管状结构. 升温至45 ℃后, C12-β12分子内折叠方式发生变化, 组装体随之转变为球状胶束.
Stupp等[44]则发展了一种操控PAs多肽组装的方法, 他们将多肽溶液与带有相反电荷的聚合物溶液相混合, 利用电荷的相互作用使多肽在2种液体界面进行组装, 通过调节外加电场的强度和方向来改变HA分子在多肽溶液中的渗透速度和方向, 从而改变膜结构中的纤维束排列方向, 并使膜厚度及硬度等物理特性发生改变. Spoerke等[45]系统地研究了电荷作用对PAs分子自组装的影响, 发现分枝端基带有的不同电荷可以使PAs呈伸展或坍陷的分子构型, 从而形成胶束、 纤维和双层膜等不同的组装结构.
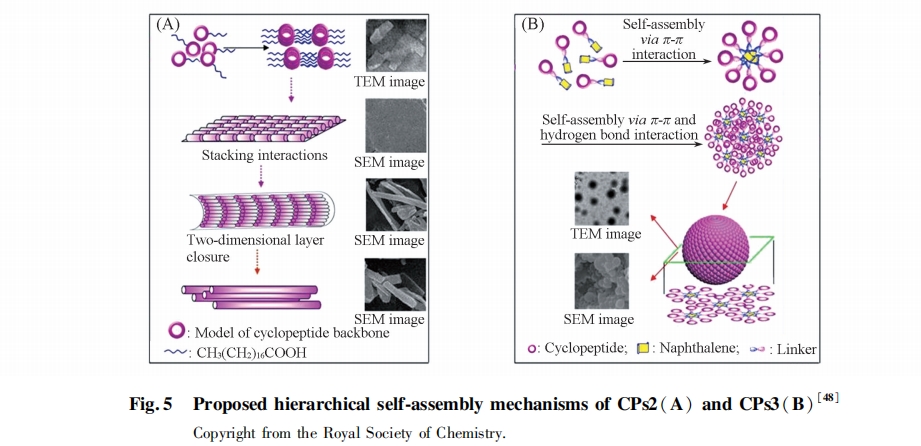
近年来我们在PAs多肽自组装研究方面也进行了一系列相关的工作. 研究了疏水链结构的变化对PAs多肽组装的影响, 发现无论是烷基链还是芳香族基团与RGD亲水短肽构成的PAs分子都能够组装形成纳米纤维和胶束, 且由于疏水链段结构的不同导致其组装体形貌在不同pH值溶液中的变化也不同[46]. 而烷基链的长度变化同样也可以显著地影响到PAs分子的组装特性和组装体形貌, 随着溶液pH值变化, 较长的烷基链(C16~C18)相互作用形成更强的疏水作用可以保护组装体结构免受静电排斥作用的影响, 从而使得所形成的纳米纤维无论在酸性、 中性还是碱性环境中都能稳定存在; 而较短的烷基链(C12~C14)由于其疏水作用较弱, 相应的PAs在酸性溶液中组装形成的纳米纤维随着环境pH值的升高则全部转变为纳米胶束结构[47]. 进一步将亲水性的环肽与醋酸、 硬脂酸和萘环相连接获得两亲性多肽CPs1~3, 研究发现CP1通过分子间盐桥和氢键作用能够组装形成纺锤状纳米结构; CP2可以通过烷基链间的疏水作用和肽链间的氢键能够组装形成纳米管; 而CP3则通过芳香环间的π-π相互作用和肽链间的氢键能够组装形成纳米球结构(图5)[48].
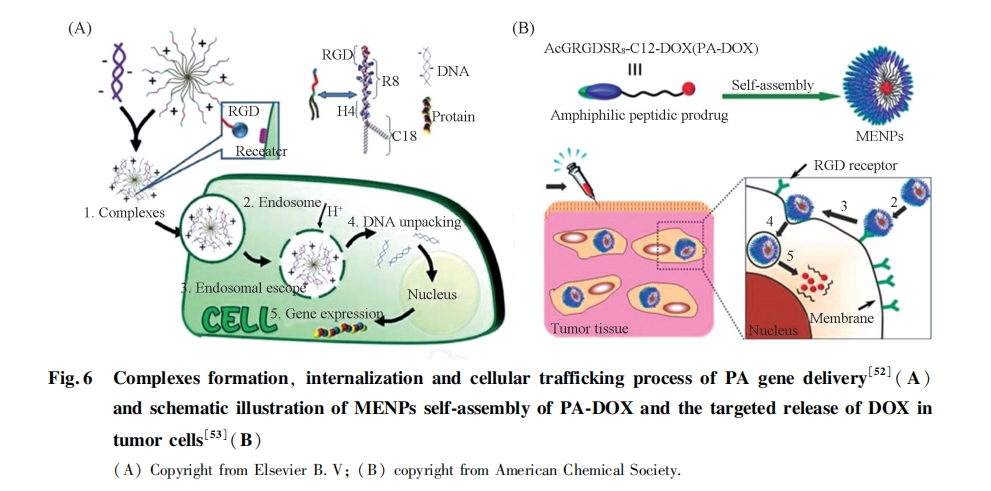
另外, 含有2条疏水链的U型PAs能够在不同pH值溶液中发生Z型和线型构象的转变, 从而引起组装体结构的变化[49]. 我们[50~52]将跨膜肽R8和核定位信号肽PKKKRKV与C18烷基链相连制备的PAs分子, 其可以与药物分子或治疗基因共组装形成稳定的纳米球状结构, 能够有效提高药物传递和基因转染效率[图6(A)]. 而将疏水性药物分子阿霉素(DOX)共价连接到Ac-GRGDSR8多肽链段上, 形成前药类PAs分子. 此类PAs分子能够组装形成将DOX包裹其中的纳米颗粒, 依赖功能肽R8的穿膜作用和RGD的靶向作用, 实现了抗癌药物的高效和选择性传递[图6(B)][53].
3 具有特殊分子结构的两亲性多肽自组装
近年来, 一些具有特殊结构的两亲性多肽分子由于其独特的组装性能日益受到研究者的关注, 其中有代表性的是Bola型两亲性多肽和Gemini型两亲性多肽.
3.1 Bola型两亲性多肽自组装
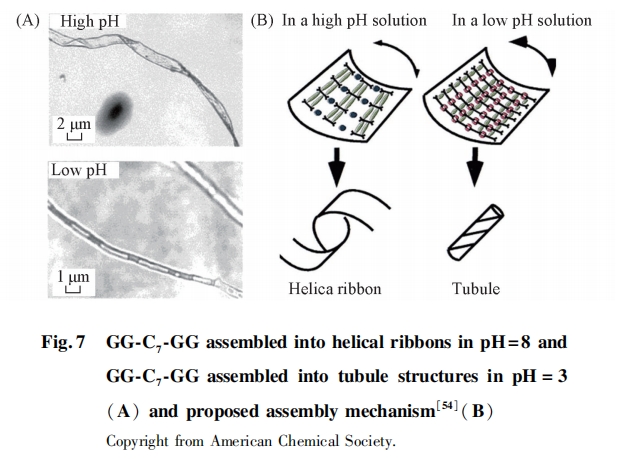
Bola型两亲性多肽分子结构呈哑铃形, 是将2个亲水性多肽链段用一条或多条疏水链段连接起来的两端亲水、 中间疏水的特殊结构, 由于酷似南美土著人的一种武器Bola(2小球分别系于一根细绳两端)而得名. Bola型两亲肽由于其本身结构的特点有着较为独特的组装行为, 其中管状结构是Bola型两亲肽中的常见组装结构. Matsui等[54]设计合成了一种Bola型两亲肽GG-C7-GG, 其在碱性溶液(pH=8)中能够组装形成宽约2 μm、 长约10~40 μm的螺旋带状结构; 而降低溶液pH值到5时, 则能够组装形成平均直径为500 nm的中空纳米管[图7(A)]. 组装机理研究表明, 在不同pH值下, GG-C7-GG分子间氢键强度的变化是决定组装体形貌的主要因素[图7(B)].
当向组装体系加入一定浓度的Ni2+离子后, 能够在Bola肽纳米管间形成金属离子桥(Ni ion bridge)和管间氢键作用, 从而使分散无序的Bola肽纳米管重新定向排列形成规整的纳米管束. 其中纳米管束的形成受金属离子种类、 浓度、 加入时间以及是否存在乙二胺四乙酸(EDTA)络合剂的影响[55]. 随后他们又对Bola肽纳米管的管径进行了调控, 利用多孔碳酸酯为模板制备管径均一的多肽纳米管[56]. 此外, 我们[57]也合成了一种Bola型两亲性多肽分子, 烷基链两端分别连接了D/L构型相间的环肽, 该肽能够在水溶液中自组装形成单壁的纳米管. Bola肽纳米管具有易修饰及结构稳定等优点, 具有广泛的应用前景. 通过向Bola肽纳米管上引入富含His残基的功能性短肽分子, 利用His残基对金属离子的络合作用诱导金属离子(Au, Cu, Ag, Ni等)在纳米管壁上结晶生长[58~60]. 将光敏性的偶氮苯基团引入到Bola肽纳米管上, 利用偶氮苯与α-环糊精的主客体相互作用, 实现了肽纳米管在修饰有α-环糊精的硅表面的光控吸附和解离[61]. 利用生物抗原-抗体相互识别和作用, 修饰有抗体的Bola肽纳米管能够在具有抗原阵列的金表面进行有序的吸附和排列[62]. 利用原卟啉Ⅸ Zn(Ⅱ)与Bola肽纳米管间的氢键作用, 可将原卟啉Ⅸ Zn(Ⅱ)包裹于肽纳米管上形成金属卟啉纳米管, 有望用于纳米化学传感器和光电材料的制备[63]. 此外, Bola肽纳米管还可应用于免疫传感器中, 用于检测单纯疱疹病毒等病原体[64].
除管状结构外, Stupp等[65]报道了另一种不对称的Bola两亲肽分子, 其疏水链两端分别连接了多肽链段和低聚乙二醇. 在水溶液中组装时, 疏水链段深埋于单分子层内部, 形成同时具有亲水性内核和亲水性表面的双亲性的特殊纤维结构. Kogiso等[66]设计合成了一系列Bola两亲肽VV-(CH2)n-VV, 并系统研究了中间疏水链长度对其组装行为的影响. 发现当n=4或6时, 可以在水溶液中组装形成类似结晶固体物的沉淀; 而n=7~12时, 可以在水溶液中以β-折叠形式组装形成纳米纤维结构. 此类Bola肽纤维具有与Ni2+, Zn2+, Cu2+, Co2+等二价金属离子络合的能力, 能够进一步组装形成结晶固体沉淀物, 具有纳米纤维结构胶体分散物以及水凝胶等[67].
3.2 Gemini型两亲性多肽自组装
Gemini型两亲性多肽分子的设计灵感源于Gemini型表面活性剂. Gemini型表面活性剂是一种新型的表面活性剂, 是由2个单链表面活性剂分子通过靠近头部的联结基团化学键合而成的. 从结构上看, 类似于2个单链分子的二聚体, 所以称作双子(Gemini)表面活性剂. 一般表面活性剂在水中组装形成聚集体时, 受2种相反作用力的影响: 一种是疏水链段之间的疏水相互作用, 驱动表面活性剂分子紧密排列; 另一种是亲水头部同种电荷的静电斥力, 使得表面活性剂分子间距增大, 破坏组装. 而Gemini型表面活性剂的化学键联结构有效地消除了亲水头基间静电排斥作用, 使得疏水链段更加紧密地排列, 增强了分子间的疏水相互作用, 这是Gemini型表面活性剂比传统单链表面活性剂具有更高表面活性的根本原因. 更为重要的是, Gemini的独特结构为自组装过程提供了更加丰富的结构调控因素, 从而产生了复杂而新颖的组装特性[68~71]. Luis等[72,73]报道了一系列Gemini型两亲肽, 发现在分子结构、 溶剂极性以及溶液pH等因素的调控下, 其能够组装形成极为丰富的组装体形貌. Wang等[74]将2条烷基链C12与β-淀粉样多肽(Amyloid-β peptide Aβ)功能片段的不同部位相连制备了2种不同的Gemini型两亲肽2C12-Lys-Aβ(12~17)和C12-Aβ(11~17)-C12. 研究发现2C12-Lys-Aβ(12~17)在不同pH范围内都能组装形成稳定的纳米纤维结构; 而C12-Aβ(11~17)-C12在较低pH值溶液中可以组装形成短的扭曲带状结构, 随着pH值的升高, 转变为薄片状结构[图8(A)], 为通过分子结构的简单变化实现组装体形貌的调控提供了一种新的途径. 此外, 带有正电性氨基酸残基的阳离子Gemini型两亲肽由于具有临界胶束浓度(cmc)低、 对电解质不敏感等优点, 能够与DNA复合组装形成粒径更小、 结构更加稳定的纳米球状结构, 有望成为一种新型的体内注射基因载体材料[图8(B, C)][75,76].

近年来, 我们[77]设计合成了一系列具有不同长度烷基链的GAPs分子, 利用其进行自组装制备出分枝状纤维结构. 在具有良好平衡的分子间疏水作用和氢键协同驱动下, (C10-C-O3)2和(C12-C-O3)2分子能够组装形成长的分枝状纤维; 而疏水作用和氢键协同作用平衡的破坏, 导致(C14-C-O3)2和(C16-C-O3)2分子组装形成不具有任何分枝结构的短纤维.
通过仿生设计了另一类尾部烷基链含有不同数目双键的GAPs分子, 利用这些简单的多肽分子, 制备出形貌和尺寸不同的囊泡结构, 其中包括由纳米囊泡逐级融合形成的微米级细胞状的巨型囊泡. 机理研究发现, 囊泡形貌和尺寸的变化可能是与顺式双键引起的GAPs分子在囊泡双分子层膜中的排列紧密程度的变化有关[78]. GAPs分子对相应的同源性单链PAs分子的自组装具有很好的调控作用, 能够使组装体有纤细的长纤维转变为均一的、 结构更加稳定的短棒状纤维. 短棒状纤维在由GAPs特殊双链结构产生的纤维间疏水作用的驱动下, 进一步自发地重新定向排列, 并逐渐延长长度, 最终由延伸方向不同的平行排列的纤维相互交织进而形成了复杂的、 高度有序的“编织型”纤维阵列. 同时, 此类多肽还具有出色的界面组装能力, 在不同亲疏水性界面上可以方便迅速地形成具有空间立体结构的多肽纳米阵列[79].
4 展 望
近些年多肽自组装研究及其在纳米科技、 生物医用领域的应用受到了极大关注并取得了显著的进展, 通过在诸多领域的交叉渗透, 在新材料制备方面显示出巨大的应用潜力. 其中, 新型的两亲性多肽组装分子的设计和制备、 操控多肽组装新方法的建立、 具有特殊性质和结构的组装体的构建、 多肽组装机理的深入揭示以及以组装体为构筑基元的高层次组装等研究必将成为两亲性多肽自组装研究领域新的热点和发展方向, 可以预期, 随着多肽自组装技术和基础理论研究的不断发展, 多肽自组装必将极大地推动生命科学、 生物医学以及材料学的长足进步.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。