
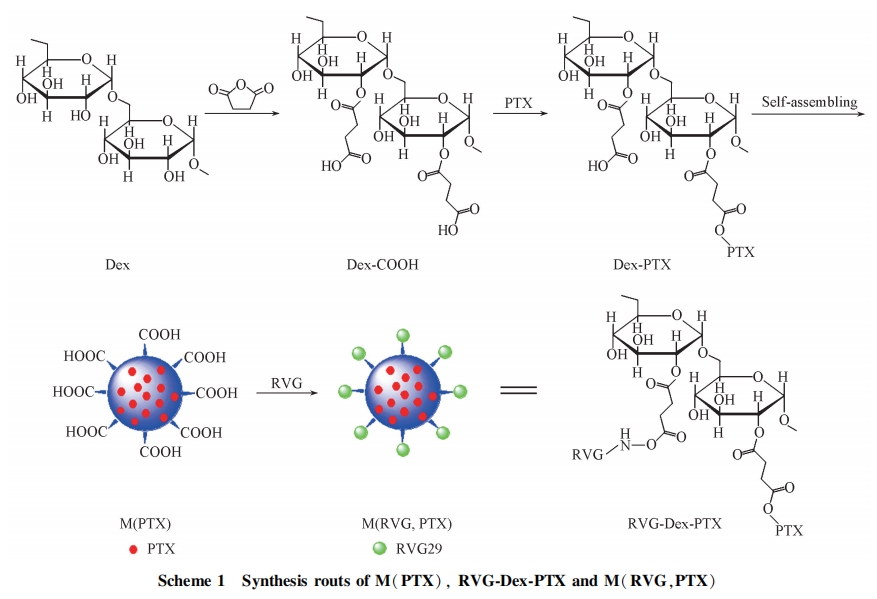
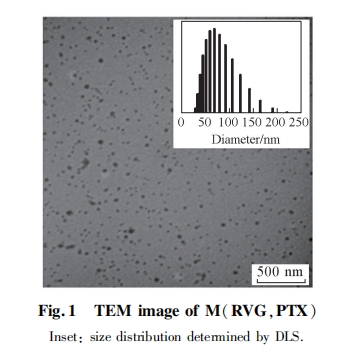
摘要 将羧基化的水溶性葡聚糖(Dex) 与紫杉醇( PTX) 化学偶联, 制得载药纳米胶束 M( PTX), 再将M(PTX)与嗜神经性病毒衍生肽(RVG29)化学偶联, 得到 RVG29 靶向的载药纳米胶束 M(RVG,PTX). 采用核磁共振氢谱(1H NMR)测定了 Dex-PTX 及 RVG-Dex-PTX 键合物的分子量, 并对 2 种胶束进行了表征, 考察了 2 种胶束对肿瘤细胞的抑制效果及细胞凋亡情况, 观察了 C6细胞对荧光标记 M(RVG,PTX)和M(PTX)的摄取情况. 结果表明, 羧基化葡聚糖鄄紫杉醇键合物的分子量约为 16500, 紫杉醇的质量约为葡聚糖的20% , RVG29 的质量约为葡聚糖的 10% . 2 种胶束的粒径在 45 ~ 60 nm 之间; M(RVG,PTX)胶束对 C6细胞的抑制作用具有浓度和时间依赖性, 细胞抑制率随着作用时间和药物浓度增加而增加, 且 M(RVG,PTX)胶束对 C6细胞的抑制作用强于 M(PTX)胶束. 细胞摄取实验结果表明, 与 M(PTX)相比, C6细胞摄取了更多的M(RVG,PTX)胶束. 如果先用游离的 RVG29 处理 C6细胞, 再进行细胞实验, 则 M(RVG,PTX)胶束对 C6细胞生长的抑制作用及被 C6细胞摄取的比率显著降低, 与 M(PTX)相当. 表明靶向载药胶束 M(RVG,PTX)中的 RVG29 保留了游离 RVG29 的活性, 对 C6细胞依然具有靶向效应, 从而介导了 M(RVG,PTX)被 C6细胞的摄取, 增强了对 C6细胞的生长抑制作用. 由于 M(RVG,PTX)胶束只使用水溶性葡聚糖作载体, 不涉及疏水高分子链段, 不需要分别制备载药高分子和靶向高分子然后再共组装, 因而制备过程比较简单, 同时具有载药和靶向功能.
脑胶质瘤是颅内常见恶性肿瘤, 发病率约占颅内肿瘤的 40% . 高复发率和高恶性度导致患者 5 年存活率极低. 目前治疗方法有手术、 放射和化学治疗, 对芋鄄郁级胶质瘤主要采用化学治疗[1 ~ 3]. 但由于血脑屏障和肿瘤的耐药性, 现有脑胶质瘤化疗药物品种有限, 疗效欠佳, 对延长患者存活期几乎无贡献[4]. 随着纳米技术的发展, 纳米药物在癌症治疗中显示出巨大的潜力和优越性. 其中, 肿瘤靶向给药体系将药物选择性地送到病变部位或病变细胞, 可以提高药物的生物利用度, 降低毒副作用, 因而备受关注[5]. 紫杉醇(PTX)是多种肿瘤的一线化疗药物, 但其水溶性差, 临床剂型难以通过血脑屏障, 对脑胶质瘤几乎无效[6]. Jing 等[7 ~ 11]设计了多种纳米给药系统, 将 PTX 键合在两亲性嵌段共聚物分子链上再自组装成纳米胶束. 与传统的物理包裹不同, 这种键合型纳米胶束可有效地增溶难溶性药物, 避免初期暴释, 延长药物在体内的循环时间, 提高生物利用度. 通过载药高分子和靶向高分子的共组装, 可以制得具有靶向功能的载药纳米胶束, 将药物选择性地送到病变部位或病变细胞, 进一步提高药物的生物利用度, 降低毒副作用. 但此类制剂使用两亲性嵌段共聚物作为基本载体, 合成难度较高, 新药审批的难度也比较大[12,13].
狂犬病病毒是自然界存在的嗜神经病毒, 其衣壳中包含有嗜神经性蛋白质(RVG), 能被神经细胞表面的尼古丁乙酰胆碱受体(nAchR)特异性地识别. 在 RVG 作用下, 狂犬病病毒很容易越过血脑屏障, 侵袭脑组织和神经中枢, 引发狂犬病. 研究发现, RVG 中的 29 个氨基酸序列嗜神经性病毒衍生肽(RVG29)[13 ~ 15](YTIWMPENPRPGTPCDIFTNSRGKRASNG)同样可被 nAchR 特异性地别. Liu 等[16]和Gong 等[17]将 RVG29 键合到聚酰胺鄄胺树状聚合物(PAMAM)和聚亚乙胺(PEI)上, 用以担载和输送核酸类药物, 具有一定的脑靶向效果. 经 RVG29 修饰的 PAMAM 和 PEI 能够通过血脑屏障(BBB)模型,但对细胞毒类抗癌药物的脑靶向输送鲜有报道.
葡聚糖可以在肝、 脾、 肾和消化道被葡聚糖酶降解, 毒性极低, 用葡聚糖修饰的高分子胶束在体内具有类似聚乙二醇(PEG)的“隐形冶效果. 载药葡聚糖纳米颗粒可减少肝脏对药物的清除, 提高在高度血管化的癌变组织中的药物浓度[18,19]. 本文首先将葡聚糖羧基化, 然后将羧基化的葡聚糖与紫杉醇( PTX)化学偶联, 制得载药纳米胶束 M(PTX), 将 M(PTX)与 RVG29 化学偶联, 得到 RVG29 靶向的载药纳米胶束 M(RVG,PTX), 考察脑胶质瘤 C6 细胞对 M(PTX)和 M(RVG,PTX)的摄取能力和 2 种胶束对 C6 细胞生长的抑制能力, 通过比较 M(PTX)和 M(RVG,PTX)被细胞摄取和抑制细胞生长的能力研究 RVG29 的引入对细胞摄取及细胞凋亡的贡献, 判断 M(RVG,PTX)胶束越过 BBB, 实现脑靶向的可能性。
1 实验部分
N,N-二环己基碳二亚胺(DCC)、 4-二甲氨基吡啶(DMAP)、 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、 N-羟基硫代琥珀酰亚胺( sulfo-NHS)和狂犬病病毒衍生肽(RVG29), 葡聚糖(Dex, 分子量 10000)负责; 紫杉醇(PTX); 二氯甲烷(DCM)和三乙胺(TEA), 分析纯, 北京化工厂, 使用前用氢化钙干燥后蒸馏; 乙腈, 色谱纯, 上海复旦化学试剂有限公司; 二次蒸馏水, 用 SZ-93 型自动双重纯水蒸馏器(上海亚荣生化仪器厂)制备; 磷酸盐缓冲溶液(PBS), 浓度为 0.01 mol / L (pH = 7.4); 醋酸纤维素材质的透析袋, 截留分子量 3500; 鼠 C6胶质瘤细胞系(C6细胞), 吉林大学基础医学院生化教研室; 培养基: DMEM(美国 Sigma 公司)+10% (体积比)热灭活小牛血清+青霉素 100 U/ mL+链霉素 100 ug / mL,pH = 7.2 ~ 7.3, 过滤消毒; 小牛血清, 杭州四季青生物材料有限公司; 青霉素和链霉素, 华北制药厂;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT), 上海阿拉丁试剂公司.
德国 Varian 公司 Unity-400 型或 300 型核磁共振仪(1 H NMR), 溶剂为 DMSO-d6 , 以四甲基硅烷(TMS)为内标; 美国 Perkin Elmer 公司 LS-55 型荧光光谱仪; 德国 Leica 公司 TCS SP2 型共聚焦激光扫描显微镜(CLSM); 英国 Malvern 公司 Nano ZS90 型激光粒度仪; 日本 JEOL 公司 JEM-1011 型透射电子显微镜(TEM); 美国 Wyatt Technology 公司 DAWN EOS 型动态光散射仪(DLS); 美国 BD Bioscience 公司 FACS Calibur 型流式细胞仪(FCM).
在 50 mg M(PTX)纳米胶束溶液(10 mL)中加入 23 mg EDC 和 26 mg sulfo-NHS, 室温搅拌 4 h 后,加入 5 mg RVG29, 继续搅拌 24 h, 透析除去未反应的 RVG29, 获得 RVG29 靶向胶束 M(RVG,PTX),冻干备用. 构成该胶束的聚合物即为 RVG-Dex-PTX.
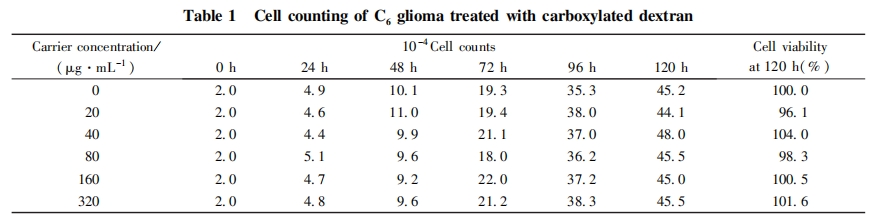
将消化对数生长期的 C6细胞制成 2*105 Cell / mL 的悬液, 接种于 96 孔培养板, 每孔 100 滋L 细胞悬液(2 *104 Cell), 并加入 200 uL 羧基化葡聚糖的 DMEM 溶液, 浓度分别为 20, 40, 80, 160, 320ug / mL, 培养 1 ~ 5 d, 以 DMEM 培养液作为对照, 采用台盼蓝染色法检测各组的细胞数, 考察载体材料的生物相容性.
1. 4. 1 MTT 实验 将消化对数生长期的 C6细胞制成 2*10^5 Cell / mL 的细胞悬浮液, 接种于 96 孔培养板上, 每孔 100 滋L 悬浮液(2*10^4 Cell), 贴壁生长 24 h 后, 加入 200 uL M(RVG,PTX)胶束或M(PTX)胶束溶液(其紫杉醇含量分别为 40, 20, 10, 5.0 ug / mL), 分别培养 24, 48 和 72 h, 以 DMEM 培养液为对照, 采用 MTT 法检测. 细胞抑制率(CI) 由公式 CI(% ) = ( AControl -AExp. ) / AControl *100% [ AControl 和AExp. 分别为对照组和实验组 MTT 反应产物甲瓒(Formazan)溶液在 570 nm 的吸光度]计算.
1. 4. 2 FCM 检测细胞凋亡率 将消化 C6细胞接种于 25 cm2培养瓶中, 细胞密度 5*10^5 Cell / mL, 于37 益培养 24 h 后更换培养液, 分别加入 PTX 浓度为 0, 20 和 40 ug / mL 的 M(PTX)或 M(RVG,PTX)胶束溶液, 计时. 在 24 和 48 h 分别收集各组细胞, 加入 0.5 mL 冰冷的 70% 乙醇溶液中, 于-20度冰箱保存. 将单细胞悬液以 1000 r/ min 离心 10 min, 弃去固定液, 用冷 PBS 缓冲液漂洗 2 次(1000r/ min, 5 min), 调整细胞为 1*10^9 Cell / L, 加入 5 滋L Annexin V, 195 uL PBS 缓冲液及 20 uL PI, 室温避光孵育 20 min, 用 FCM 检测细胞凋亡率. 每个剂量组检测 3 个平行样, 取平均值.
用 1% PBS 缓冲液冲洗预先培养在 NEST 玻底培养皿(上海耐思科学有限公司)上的 C6细胞 3 次,加入等体积相同荧光强度的 M(Cy5,PTX)和 M(Cy5, RVG,PTX)胶束溶液, 于 37度避光孵育 1 ~ 2 h,用 PBS 缓冲液洗涤细胞, 加入 3.7% 多聚甲醛固定细胞 12 min, 用 PBS 缓冲液冲洗, 滴加 50 uL PBS /甘油混合溶液(体积比 1:1), 盖上专用盖玻片, 进行 CLSM 观察.
1. 5. 2 FCM 检测 将 1 mL 密度为 1*10^6 Cell / mL 的细胞悬液种植在 6 孔板中, 以 DMEM 为培养基, 于 37度无菌培养, 观察到细胞均匀贴壁生长后, 加入等体积等荧光强度的 M(Cy5,PTX) 和M(Cy5, RVG, PTX)胶束溶液, 反应 1 ~ 2 h 后倒掉培养基, 加入 1 mL 胰蛋白酶, 孵育 1 min 左右, 在显微镜下观察细胞由贴壁状态变为悬浮状态. 收集细胞悬液, 以 1000 r/ min 的速度离心 5 min, 弃去上清液, 离心管底部细胞重新用新鲜的 0度 PBS 缓冲液吹打悬浮. 重复 3 次后, 取 3 mL 细胞悬液, 用200 目尼龙布过滤后, 用流式细胞仪(BD Biosciences)进行测试, 记录 10000 个细胞的荧光信号, 计算平均值.
在以上细胞摄取和生长抑制实验中, 为了证明 RVG 纳米胶束是通过 RVG 受体介导的途径进入细胞, 专门设立一个细胞实验组, 在孵育介质中加入游离 RVG29, 使其浓度为 40 ug / mL, 孵育 30 min 后再加入 M(RVG,PTX) 或 M(Cy5, RVG,PTX) 胶束溶液, 其它条件与正常 M(RVG,PTX) 或 M(Cy5,RVG,PTX) 组 相 同. 这 一 过 程 称 为 “ RVG 封 闭 ( RVG-shielding), 相 应 样 品 称 为 “ RVG-shieldedM(RVG,PTX)冶或“RVG-shielded M(Cy5,RVG,PTX)
细胞实验数据表述为“平均值(X)依标准偏差(SD)冶. 采用 t-检验方法分析各实验组与对照组之间的统计偏差, p < 0.05 视为实验偏差有统计学意义.
2 结果与讨论
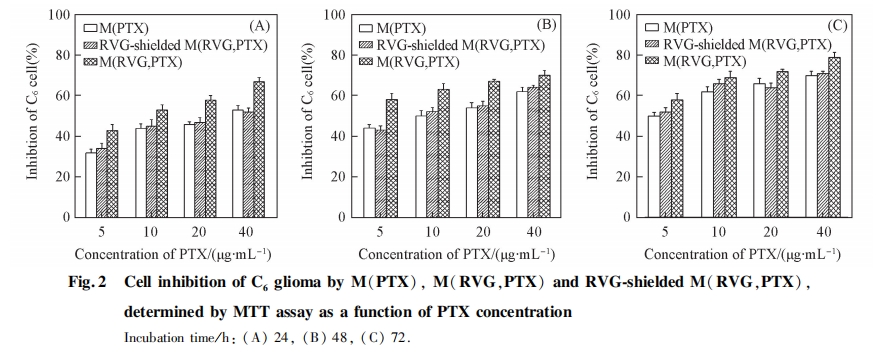
靶向载药胶束 M(RVG,PTX)的肿瘤细胞抑制率明显高于非靶向载药胶束 M(PTX), 在每个 PTX浓度值和每个时间点都可观察到这种差别. 当 PTX 浓度为 5 ug / mL 时, 在 24, 48 和 72 h 时, M(PTX)组的 C6细胞抑制率分别为(32+-1.8)% , (44+-1.8)% 和(50+-1.8)% , 而 M(RVG,PTX)组的 C6细胞抑制率分别为(43+-2.8)% , (58+-3.1)% 和(62+-3.1)% , 差别显著(p<0.05).
为进一步证实肿瘤细胞抑制率的增加是通过 RVG29 的靶向作用实现的, 采用游离 RVG29 多肽预先封闭相关受体, 再给予靶向载药胶束 M(RVG,PTX), 结果如图 2 中“RVG-shielded冶组所示. 可见封闭后 M(RVG,PTX)的细胞抑制率与 M(PTX)胶束组的抑制率无明显差别. 当 PTX 浓度为 5 ug / mL 时,24, 48 和 72 h 时 M(RVG,PTX)组的 C6细胞抑制率分别为(43+-2.8)% , (58+-3.1)% 和(62+-3.1)% ,而 RVG-shielded 组的 C6细胞抑制率分别为(34+-2.6)% , (43+-2.2)% , (52+-2.2)% , 均明显低于靶向载药胶束组, 与未经封闭的 M(PTX)组相当[(32 +-1.8)% , (44+-1.8)% 和(50+-1.8)% ]. 说明游离RVG29 与 C6细胞上受体的结合能力强于键合后的 RVG29, 而且在不封闭条件下 M(RVG,PTX)的抑制效果是与 RVG29 的存在分不开的, RVG29 与细胞表面受体作用所介导的细胞内吞增强了细胞对纳米胶束的摄取, 提高了细胞内的药物浓度, 增强了抑制效果.



3 结 论
将羧基化后的葡聚糖与紫杉醇化学偶联, 制备了载药纳米胶束 M( PTX), 进而将 M( PTX) 与RVG29 化学偶联, 制备了 RVG29 靶向的载药纳米胶束 M(RVG,PTX), 实现了在同一个载体高分子链上既键合药物分子, 又键合靶向分子. 与通常的基于双亲高分子的靶向载药胶束相比, 本文方法充分利用了葡聚糖的生物相容性、 水溶性和可反应性以及紫杉醇的疏水性, 避免了分别合成载药高分子和靶向高分子然后进行共组装的麻烦, 不需要使用专门的疏水聚合物链段, 就能使紫杉醇的含量达到20% , 且胶束的水溶性和冻干后的复溶性都很好, 因而具有实际应用的潜力. 体外 MTT, CLSM 和 FCM实验结果表明, 靶向载药胶束 M(RVG,PTX)对 C6细胞增殖的抑制能力强于载药胶束 M(PTX). 这种抑制作用主要表现为肿瘤细胞的凋亡, 这种增强的细胞生长抑制和细胞凋亡与 M(RVG,PTX)胶束表面的 RVG29 相关. RVG29 经过与葡聚糖键合和胶束化后依然保持对 C6细胞的靶向性, 即与 C6细胞表面 RVG 受体的特异性识别和结合能力. M(RVG,PTX)正是通过 RVG29 的靶向作用提高了药物的摄入效率, 增强了对脑胶质瘤 C6 细胞的抑制作用, 具有良好的应用前景.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。