
摘要:基于多肽和蛋白质的水凝胶体系作为生物材料的一个重要种类,受到了广泛关注,近年来更得到了 长足的进步。其凝胶化的机制既可以是侧基之间的物理组装和聚集,也可以是反应性残基之间的可控化学反 应。两者协同作用可进一步促进其功能改性。多肽和蛋白质独有的生物活性及其结构和功能上的多样性和可 调性为生物材料的发展提供了诸多可能,展现出广泛的应用前景。本文对基于多肽和蛋白质的水凝胶的设计、制备和应用等研究进展进行了简要的介绍与总结,并对该领域的进一步发展进行了展望。
引言:材料科学与生命科学的交叉,推动了生物材料的迅猛发展。水凝胶是一类非常重要的生物材料。它 是由亲水性三维网状结构与大量水构成的独特分散体系,能够在水中溶胀而不溶解。多数软组织就是由 蛋白质和聚糖等生物高分子组成的水凝胶。因此,水凝胶在生物医学领域,特别是药物释放、组织工程、再生医学、生物传感器、柔性促动器以及人工细胞外基质等方面具有广泛的应用前景[1~3] 。近年来,基于 多肽和蛋白质的水凝胶,因其结构上的精确性和功能上的多样性得到特别的关注,本文将就该体系做简 要的介绍和总结。
1 背景
1.1 水凝胶
构建水凝胶可以通过物理交联和化学交联的方法 。前者基于非共价键相互作用 , 如静电作用 、疏水 作用 、氢键等作用;后者则是基于共价键作用 。评价水凝胶作为生物材料的应用前景的两个方面是生理 活性和机械性能[4, 5] 。生理活性主要取决于高分子的组成 、分布及其与细胞之间的相互作用;而机械性能 主要取决于交联点的强度和密度 。两者直接影响细胞的生长和分化行为[3, 6] 。近年来 , 围绕水凝胶的功 能化和机械性能改性涌现了很多出色的工作 。一方面 , 人们通过加入纳米复合物或大分子聚集体参与交 联[7] , 改变交联点的性质 , 结合两个甚至多个性质互补的网络[8, 9] 或者利用不同交联机理协同作用[10, 11] 等方法来改进水凝胶的力学性能;另一方面 , 通过引入具有生理活性的基元并控制它们在时间空间上的 表现来改进水凝胶的生理活性 。综合调控这两方面的性质是水凝胶研究的重要方向 。
1.2 多肽和蛋白质
多肽和蛋白质均为一类由α-氨基酸以肽键相连而成的化合物。一般把含有100个(有时是50个)以 上氨基酸的多肽称为蛋白质。它们在体内起到了极为重要的生理功能,可以说是构成生命的物质基础。
虽然其组成仅包含20种天然氨基酸,它却能在生命过程中起到复杂多样的关键功能。这主要归因于其精确的序列结构和多级的空间结构。氨基酸上不同性质的官能团(疏水、亲水、电中性、电负性、极性基团)的微妙平衡和巧妙结合正是蛋白质能进行有序折叠和实现多种功能的关键。
多肽可以通过固相合成,也可以通过蛋白质降解得到。多肽的固相合成虽然只适用有限长度分子的合成(通常小于50个氨基酸),但是可以方便地引入各种非天然氨基酸[12] 。蛋白质的生物合成则是由DNA的转录与翻译实现的一个高度精确可靠的模板聚合反应。现代基因工程和重组蛋白质生物合成的迅猛发展为蛋白质生物材料研究提供了很好的基础,而蛋白质工程更进一步拓展了其可修饰性和功能性。例如,schultz组[13,14]与Tirrell组[15,16]成功将非天然氨基酸引入蛋白质,为设计与操纵特殊蛋白质提供了极大的便利。定点突变和定向进化等技术的成熟更容许人们对于同一种蛋白质的性质进行改进和微调,其结构和功能控制的精确水平是合成高分子体系里所不能比拟的。
2 基于多肽/蛋白质-合成高分子的水凝胶体系
合成高分子虽然不具有生物大分子的结构精确度 , 生理功能也相对有限 , 但是其单体结构复杂多样 , 也比较容易修饰并实现量产。现代可控聚合技术的发展更提供了控制合成高分子分子量 、分散度等重要 结构参数的多种有效方法。因而 , 合成高分子与多肽和蛋白质在作为材料方面具有很多互补的优点 , 其 复合水凝胶体系也备受关注。Michael加成 、点击化学[17] 等一系列快速高效的化学修饰手段为创造复合 水凝胶提供了合适的手段 , 架起了合成体系和生物体系之间的桥梁 , 促进了这个方向的蓬勃发展。
2.1 多肽P高分子水凝胶
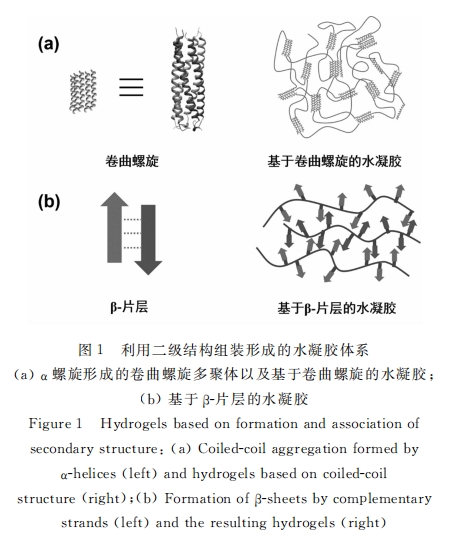
多肽因其合成和修饰的简便性被广泛地应用于制备复合水凝胶。多肽之间的有序聚集可以形成物理交联。例如,卷曲螺旋如亮氨酸拉链是由α-螺旋因疏水作用形成的多聚体(如图1a所示)。赵元弟和刘波等将其接到聚乙二醇链(PEG)的一端,另一端连上丙烯酸酯。在光和引发剂作用下,该大分子单体聚合形成接枝高分子刷,侧链的亮氨酸拉链聚集就形成了物理凝胶[18] 。β-片层结构是一种基于氢键的聚集作用 (如图1b所示)。Kopecek组设计了一类水解聚马来酸酐(HPMA)-多肽的接枝共聚物[19] 。其中两种多肽可以互补形成β-片层结构,从而使整个体系凝胶化,并能作为调控骨细胞分化以及羟基磷灰石矿化的生物材料。同时,多肽上的官能团也可以被用于实现共价交联,例如含有反应性官能团的多肽能和含有相应反应性官能团的合成高分子进行交联制备水凝胶。
PEG是一类 具 有 很 好 生 物 相 容 性 的 水溶性合成高分子 , 被广泛应用于生物高分子的改性和制备水凝胶。基于 PEG 的水凝胶因而被认为是水 凝胶体系的“金标准”。已有很多工作将 PEG 和多肽或蛋白质结合在一起制备水凝胶。最常用的反应是 基于半胱氨酸的巯基或者赖氨酸的氨基的反应。例如 , Hubbell组通过 PEG 的乙烯砜端基与含有精氨 酸-甘氨酸-天冬氨酸序列(RGD)多肽片段上的巯基之间的 Michael加成实现凝胶化 , 发展支持细胞黏附 与酶降解的细胞外基质[20~22] 。该体系中还引入了能够被基质金属蛋白酶(MMP)或血浆酶特异性降解 的多肽序列 。不同多肽序列的降解速率不同 , 以此就可以调节体系的降解速率。该体系被成功应用在细胞培养过程 。结果表明 , 细胞在更容易被降解的水凝胶中舒展和迁移的速度更快 。
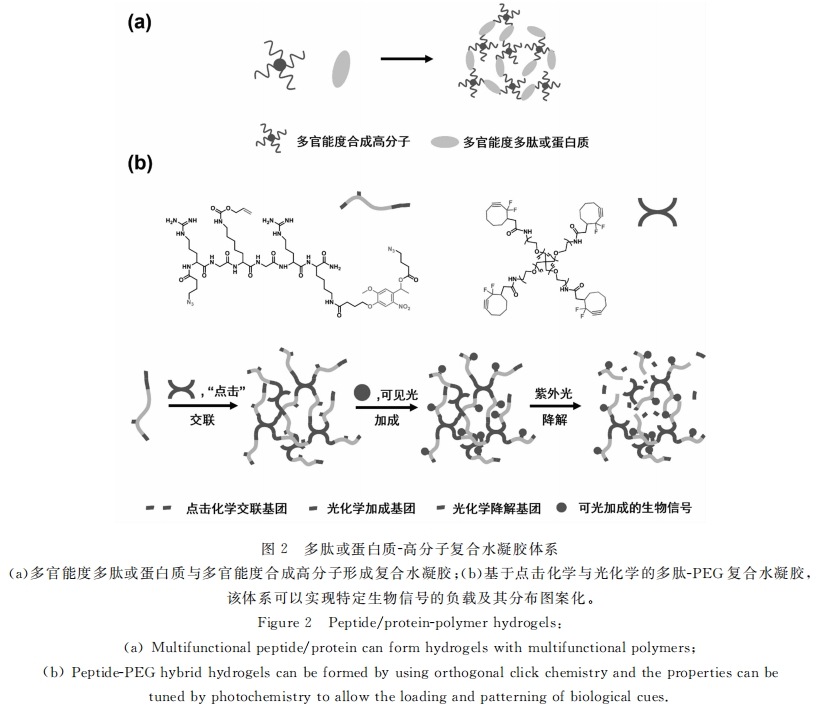
为了尽量减少凝胶化过程对于生物分子以及细胞的影响并更好地控制凝胶化过程,生物正交的点击 化学被广泛地应用到水凝胶的制备中来。kopeek组对PEG进行化学修饰得到端基为叠氮的四臂 PEG,并合成了端基为炔并含有酶降解片段的多肽GFLG1,利用炔基和叠氮之间的点击反应,实现了 PEG与多肽的复合水凝胶[23] 。类似地,Anseth组利用点击生物正交反应制备了一系列PEG凝胶,并把 重要的生物信号固定到网络中去,以增强胰腺β-细胞在水凝胶中的封装成活率[24] 。他们更进一步开创 性地进行了将PEG水凝胶性能在三维空间中图案化的研究[25,26] 。比如硝基苯甲醚衍生物是一类广为人 知的光降解基团(如图2所示)。在多肽交联分子中引入硝基苯甲醚衍生物后,就可由光刻技术调控其官 能化状态。当在该结构末端加入含RGD片段时,光照会导致的多肽信号释放,这就可以方便地控制被封 装细胞的迁移和分化[26] 。利用加成反应的官能化与利用硝基苯甲醚的可控降解可以通过不同波长的光 激发来分别实现。他们成功地将该方式应用于水凝胶性能的三维图案化,使成纤维细胞能够沿着RGD官能化的空间进行生长[27,28] 。这为调控细胞在三维空间中的生长提供了强有力的手段。
相比于点击化学 , 酶催化的可控偶联也许和细胞过程更为兼容 。比如谷氨酰胺转胺酶可以有效地催 化谷氨酰胺和赖氨酸之间的异肽键形成 。Ehrbar与 Lutolf、weber等制备了两种八臂 PEG, 其末端分别 携带两类多肽:一类含有谷酰胺受体底物(Gln),一类是含有供基质金属蛋白酶降解的多肽序列的赖氨酸 底物(Lys)。两种大分子在谷氨酰胺转胺酶的作用下共价相连 , 就可以形成网络结构 。因为这个方法也 适用于和生物大分子的共价偶联 , 所以该复合水凝胶也可被用于固定含有特定标签的融合蛋白 , 比如捕获人胚肾细胞(HEK-293T)分泌出的标签生长因子 。加载了生长因子的水凝胶体系可以作为指导细胞 行为的智能人工细胞外基质[29] 。
2.2 蛋白质P高分子水凝胶
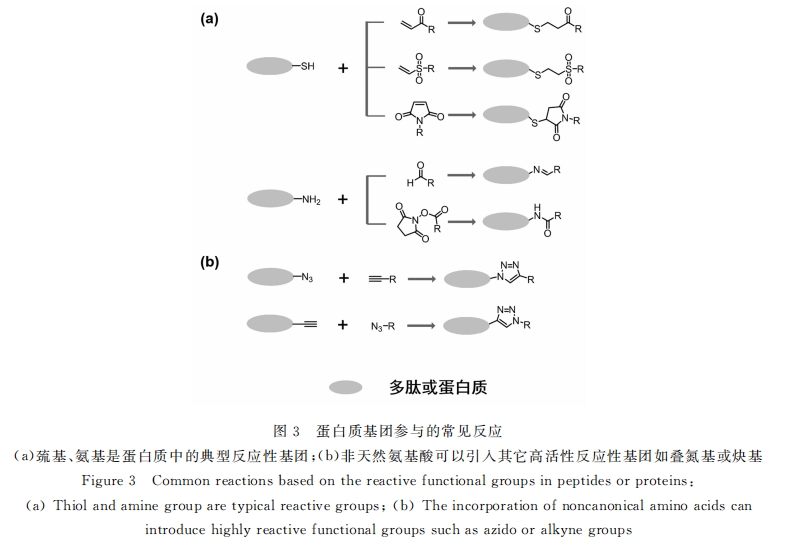
基于蛋白质和合成高分子的水凝胶和多肽-高分子水凝胶有很多的相似性 , 其形成同样既可以依靠 蛋白质基元之间的物理聚集 , 也可以利用蛋白质的典型反应性基团 , 比如赖氨酸的氨基 、半胱氨酸的巯基 等 , 甚至是非天然氨基酸中的高反应性基团 , 如叠氮基和炔基等 。巯基来源于天然氨基酸 , 它和双键之间 的 Michael加成反应在生理条件下具有较高的选择性和反应性 , 对蛋白质生理活性的影响较少 , 所以也 最为常用(见图 3)。Hubbell组设计了末端具有乙烯基砜结构的 PEG, 与含有多个半胱氨酸的重组纤维 蛋白原蛋白质作为交联分子 , 利用 Michael加成反应原位形成水凝胶封装水凝胶 , 从而揭示了材料宏观 的力学性能是比 RGD序列密度更为重要的影响细胞迁移速率的因素[30, 31] 。yang 组设计并表达了具有 类泛素结构域(ULD)的蛋白质[32] 。该蛋白质能够形成四聚体 , 每部分提供一个可供反应的巯基 , 可作为 四官能度的重组蛋白质与端基为马来酰亚胺的四臂 PEG进行 Michael加成反应交联 。巯基与不同类型 的双键反应活性不一 , 速率也不尽相同 , 容许人们对反应的动力学和凝胶时间有较好的控制 。同时 , 由于 交联的位点确定 , 在网络中的分布和距离均匀 , 对于机械性能也有很好的促进作用 。
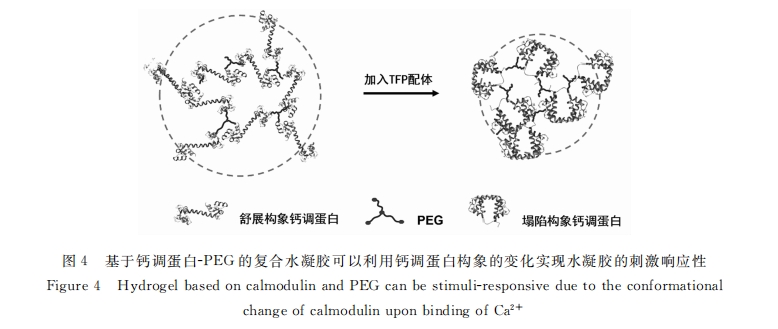
这种可控的凝胶化过程和蛋白质的构象变化和功能转换结合在一起 , 就有可能实现刺激响应性水凝 胶 。例如 , 钙调蛋白(calmodulin, caM)是一种较为舒展的 , 具有哑铃形状的蛋白质 , 在 ca2十 离子存在的 情况下 , 它的构象发生坍塌 , 以便于与一些小分子(如三氟拉嗪 TFP)进行结合[33] 。Murphy 组利用巯基 与丙烯酸酯在紫外光下的 Michael加成反应构建出了一种钙离子浓度响应的钙调蛋白-高分子复合水凝 胶[34] (见图 4)。在钙离子和 TFP 的环境下 , 凝胶迅速收缩;如果将其置于 EDTA 环境下 , 则会溶胀并释 放出 TFP。这种由蛋白质构象变化所带来的宏观性质转变过程可以循环反复 , 多次进行 , 充分展示了蛋 白质在实现刺激响应性和智能化水凝胶体系方面的巨大应用前景 。
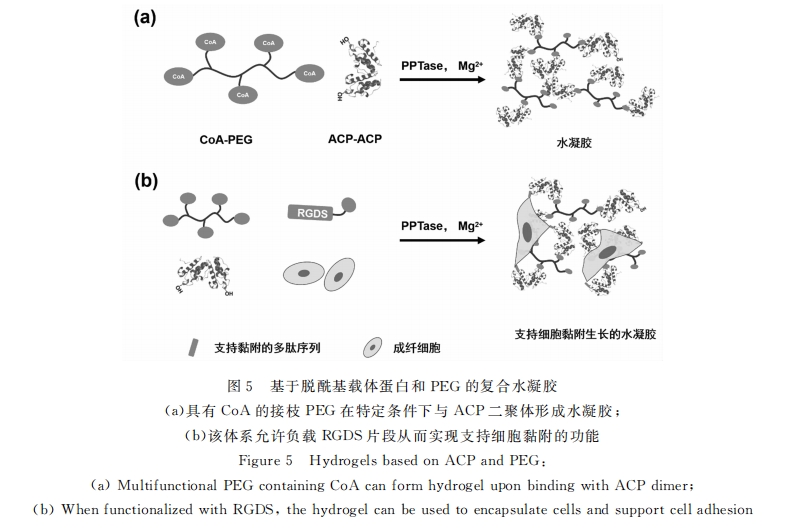
和多肽相比 , 蛋白质的生理活性对其构象更为敏感 , 在利用反应性残基进行官能化过程中容易失活 。酶催化的高效偶联可以规避这个缺点 。利用内含肽和转氨酶都可能实现这种交联 。Lutolf组则选用了一个稍微不同的策略[35] (见图 5)。已知乙酰辅酶 A(CoA)的磷酸泛酰巯基乙胺部分在磷酸泛酰巯基乙 胺基转移酶(PPTase)的催化作用下 , 能与丝氨酸的羟基共价相连 。所以 , 他们就设计了脱酰基载体蛋白 二聚体(ACP-ACP)以及末端为乙酰辅酶 A 的接枝多臂 PEG链(CoA-PEG),两者在 PPTase催化下交联 形成水凝胶 。这是一个高度生物相容性的反应 , 同时容许共价加载含有精氨酸-甘氨酸-天冬氨酸-丝氨酸 黏附序列(RGDS)的多肽片段 , 有效支持被封装细胞在三维空间内的生长 。
蛋白质相互作用也是构建复合水凝胶的有效驱动力 。组报道了利用卷曲螺旋聚集交联的 蛋白质-高分子复合水凝胶[36] 。该体系组成为 N-(2-羟丙基)-甲基丙烯酰胺和 N-(N’, N’-二羧甲基氨丙 基)-甲基丙烯酰胺两种单体的共聚物(HPMA-co-DAMA),以及具有卷曲螺旋(coiled-coil)结构的两种蛋 白质 CC1 与 CC2。其中 CC1 来源于驱动蛋白的茎部区域(~150个氨基酸), CC2则是基于从头设计的 多肽链(~50个氨基酸),具有极高的热稳定性 。蛋白质与合成高分子之间首先通过组氨酸标签和高分 子侧链羧基之间的 Ni2十 离子配位络合接枝相连 , 而卷曲螺旋的进一步聚集则有效导致了物理凝胶的形 成 。这种方法具有一定的普适性 , 也适用于比如 zn2十 、Ca2十 、Mg2十 等离子 , 将有可能允许体系作为生物环境下对金属离子响应的微型传感器 。
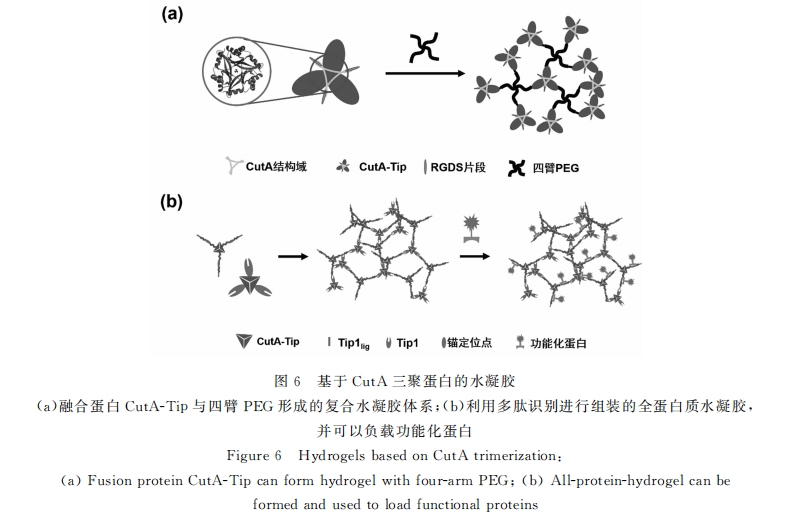
除了卷曲螺旋之外 , 二价离子耐受蛋白质(cutA)也是最近研究中比较热门的能够进行有序聚集的 蛋白质(见图 6a)。它来源于超嗜热古菌 pyrococcus horikoshii , 能形成极其稳定的三聚体[37] 。Ito 组设 计了一种由三官能度 cutA 和四官能度 PEG 交联而成的水凝胶体系 , 并在 cutA 三聚体的 c 端融合了 TAX相互作用蛋白质 I(Tip-1)。Tip-1具有一段盘状同源结构域(PDZ),能够与相应的多肽段识别并结 合 。他们同时合成了具有识别 PDZ结构域多肽端基的四臂 PEG 分子 。两者自组装就形成具有规整网 络的水凝胶 。流变测试发现 , 该体系出现典型的剪切变稀现象 , 撤去形变之后其机械强度即刻回复 。这 可以由 PDZ结构域与相应多肽在高剪切力下可逆的分离和结合来解释[38] 。
实际上 , 利用蛋白质相互作用实现物理交联制备的复合水凝胶的力学 性能仍具有相当大的提 升 空 间 。结合不同的物理交联或化学交联机理协调作用就是一种非常好的策略[39] 。olsen组将蛋白质-蛋白 质相互作用和高分子的相转变结合在一起 , 构建了具有两种交联网络的水凝胶[40] (见图 7)。该嵌段复合 物两端具有聚(N-异丙基丙烯酰胺)(PNIPAM),升温后能够聚集形成物理交联 , 而中间的蛋白质则通过 卷曲螺旋形成第二种物理交联 。这种双网络结构使得整个体系的力学性能与抗腐蚀性能都有了极大的改善 。
总的来说 , 制备蛋白质-高分子复合水凝胶 , 主要是为了利用蛋白质的生物活性和合成体系的易制备 和易修饰性 , 这类体系具有一定的促进细胞生长与分化的能力 。目前的挑战主要在于进一步开发和利用 与生物过程相容的化学反应 , 在最大程度保证蛋白质生理活性的基础上实现凝胶化 , 并进一步改进机械 性能 , 实现水凝胶功能多样化 、图案化和智能化 , 更好地模拟天然细胞外基质的特性 , 开拓其在组织工程 中的运用 。
3 完全基于多肽和蛋白质的水凝胶体系
多肽或蛋白质与合成高分子的复合水凝胶体系结合了两者的优点 , 但是在不影响生理活性的前提下 实现可控偶联的方法相当有限 。同时 , 对于大多数体内应用来讲 , 合成高分子的生物相容性及可降解性质等也需要慎重考虑 。因此 , 完全基于多肽或蛋白质的水凝胶体系成为一个非常吸引人的方向 。它取法自然 , 能够更好地对生物体系进行模拟 。
3.1 多肽水凝胶
多肽的自组装是丰富多彩的。多肽的组成并不限于传统的20种天然氨基酸,还包括各种非天然氨基酸。同时,即使仅含有数个残基,多肽仍然可以展现强烈的组装现象,形成有序结构。徐兵和杨志谋等[41]构建了D构型的四肽,这种四肽具有萘基端基ADA苯丙氨酸ADA苯丙氨酸ADA赖氨酸ADA酪氨酸的结构,能够结合紫杉醇等生物活性分子。磷酸化的多肽前体一经去磷酸化,就能组装形成具有纤维骨架的凝胶。由于D型氨基酸有一定的抗降解能力,该体系能够长时间保持稳定,并缓慢释放药物。ulijn等[42]仅利用一种末端是芴甲氧羰基(Fmoc)的二肽,就实现了多肽凝胶化过程,其中π-π相互作用被认为是凝胶化的关键。随后Gough与ulijn等将芴甲氧羰基-二苯丙氨酸多肽(FmocFF)与芴甲氧羰基-精氨酸-甘氨酸-天冬氨酸多肽(Fmoc-RGD)的水溶液混合,也得到了具有纳米纤维结构的水凝胶,并可用于增强封装在其中的人类真皮成纤维细胞的增殖与生长[43,44] 。
多肽也可以通过更为复杂的二级结构的相互作用实现凝胶化。多肽β折叠的有序组装率先激发了研究者对多肽凝胶的研究。例如,具有16个谷氨酸(E)-甘氨酸(A)-赖氨酸(K)重复单元的多肽(EAK16),可以通过多肽链间氢键作用形成β折叠的平面,这些平面再通过残基间的静电作用进行堆叠,从而形成特定的三维结构[45~46] 。另一种IsK蛋白中的转膜结构域具有富含赖氨酸的多肽片段,也能够基于上述方式形成凝胶[47] 。在该工作中,Aggeli等把能够发生凝胶化的多肽体系的理性设计总结为三个原则:(1)不同链的侧基间要具有吸引力(如疏水相互作用、静电相互作用、氢键作用、π-π堆叠等);(2)肽链段侧基在某方向上(通常为垂直于β折叠平面的方向)具有一定的识别作用,可以限制一个方向上的自组装;(3)结构表面要对溶剂分子有较强的吸附性[47] 。
这些规律指导了自组装多肽的进一步理性设计。Messersmith等选择了具有交替疏水亲水残基的 多肽片段,其序列为H2N-(FEFEFKFK)2-COOH,简称为FEK16。在热或光引发下,由脂质体负载的氯 化钙被释放,就激发了多肽的自组装形成凝胶,这种方式成功实现了凝胶化过程的光控或热控[48] 。Schneider等设计了具有(VK)4VDPPTK(VK)3V-NH2 序列的多肽链[49] ,它在酸性下是无规线团,在碱 性条件下则形成β-发夹,自组装成为稳固的凝胶网络。这种构象的转变随着pH的升高而发生,其速率 由多肽浓度和混合速率决定。基于α-螺旋以及卷曲螺旋结构的凝胶体系也同样地表现出pH敏感性。Hartgerink等[50]设计了能形成α-螺旋结构的多肽片段EIKQLESEISKLEQEIQSLEK,该螺旋的e和g 位置为谷氨酸(E)。在pH升高时,谷氨酸去质子化,在静电斥力的作用下螺旋解聚,多肽凝胶就会溶解。
多肽水凝胶的进一步功能化也是研究者青睐的热点 。张曙光等[51] 发现具有纳米纤维结构的多肽水 凝胶体系可以包藏并缓释溶菌酶 、免疫球蛋白 G 等不同结构不同电性的蛋白质 , 其缓释速度取决于蛋白 质大小而非蛋白质电性 , 并且释放的蛋白质仍可以保持原来的高级结构[52] 。这说明方法具有一定的普 适性 , 换言之 , 通过合理设计调整水凝胶的骨架尺寸 , 就可以精确调控其缓释过程[53] 。这为研究细胞生 理和组织工程提供了有利的平台 。但是另一方面 , 相比蛋白质而言 , 多肽在其生理功能多样性和生物过 程的角色上都比较有限 。因此 , 全蛋白质水凝胶的研究也正方兴未艾 。
3.2 全蛋白质水凝胶
基因重组和生物合成手段的成熟使得重组蛋白质的制备和性质调控变得常规。在生物体内,蛋白质基元之间的交联是形成细胞外基质和其它蛋白质材料的重要过程。因此,完全基于蛋白质的水凝胶可以最大程度地模拟人工细胞外基质和利用天然蛋白质的生物活性。目前,多数全蛋白质水凝胶都是基于可控确定的蛋白质-蛋白质相互作用或较不规整的蛋白质聚集所形成的物理交联。前者如亮氨酸拉链(Leucinezipper)的聚集作用[54,55]、二价离子耐受蛋白(cutA)的三聚[56,57] 以及钙-钙调蛋白(calmodulin)的结合等[58] ,后者如弹性蛋白的热聚集[59] 和富含脯氨酸的肽段的聚集等[60] 。
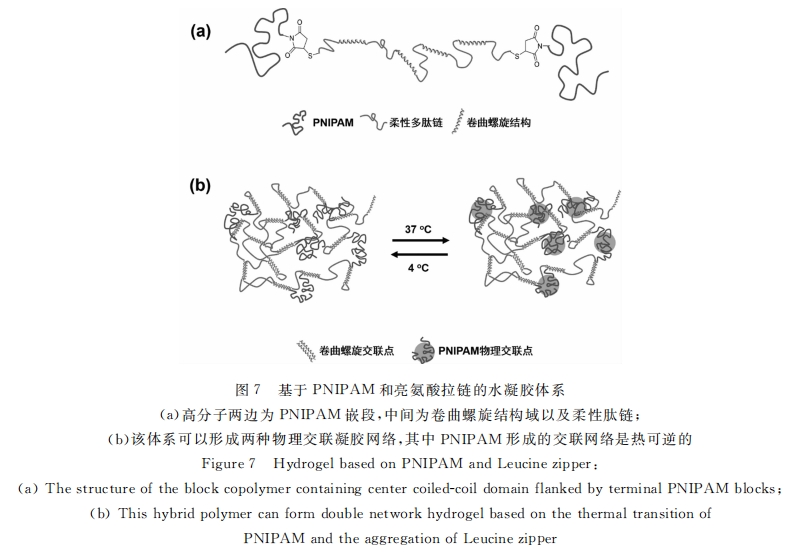
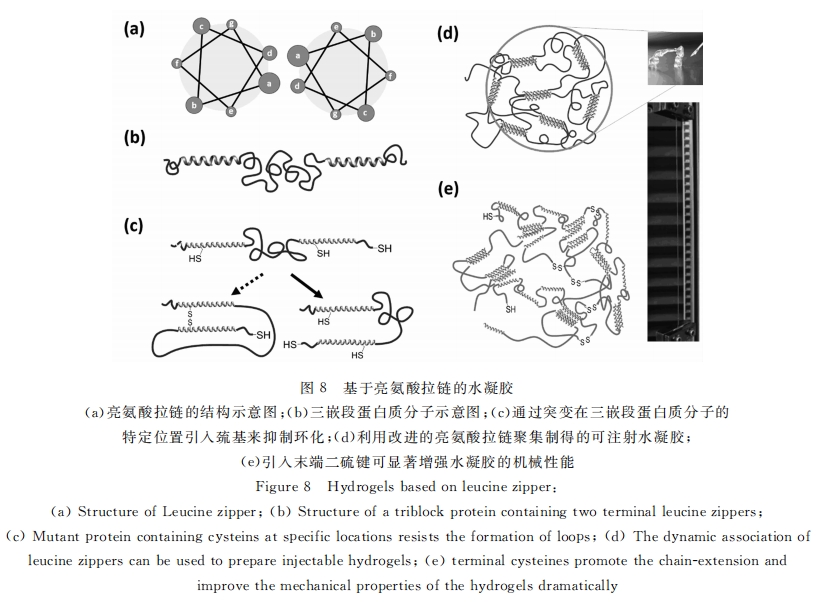
亮氨酸拉链(Leucine zipper)是一种能形成卷曲螺旋结构的蛋白质,由多个71 螺旋聚集形成,其七 元重复单元可以表示成abcdefg,其中两组螺旋的a与d为疏水基团,通常为亮氨酸,e与g为带电残基 (见图10a)。它们通过亮氨酸的疏水作用形成卷曲螺旋。Tirrell组利用亮氨酸拉链的疏水相互作用作 为交联手段,设计了三嵌段组蛋白质基元Ac10A[61] (见图10b),A代表亮氨酸拉链,c10代表亲水柔性链。它可以形成水凝胶,并具有pH响应性。当pH升高时,亮氨酸拉链A上谷氨酸的离子化使亮氨酸拉链 解聚。核磁表征进一步发现,体系中水溶性的柔性链段是动态变化的,而亮氨酸拉链则表现为比较刚性 的结构,这与设想的结构是相吻合的[62] 。
Kennedy等发现亮氨酸拉链存在二聚体-四聚体的平衡 , 这些聚集体共同构成了水凝胶的物理交联 点 , 中间柔性肽链的水溶性可以防止多聚体的无规聚集析出[63] 。然而 , 在开放溶液环境中 , 蛋白质会逐 渐以环状中间体的形式溶解到溶液中去 。为了稳定此类水凝胶 , 他们将亮氨酸拉链 A 重复单元上的 d 位氨基酸突变为半胱氨酸(见图 10c)。因为 A倾向于反平行聚集 , 这种设计使之更倾向形成分子间二硫 键而非分子内二硫键 , 减少了成环的可能性 , 提高了水凝胶的稳定性[64] 。
解决亮氨酸拉链水凝胶不稳定性的另一个方法是采用具有不同聚集特性的亮氨酸拉链。Tirrell组设计了另一种基于大鼠软骨寡聚基质蛋白(cOMP)的P型亮氨酸拉链。上述体系中的亮氨酸拉链成分A倾向于形成四聚体,而P倾向于形成五聚体,并且P与A难以形成异聚体。因此,末端成分不同的三嵌段结构Pc10A就不容易形成环状分子而溶解,其腐蚀速率要低于Ac10A体系2~3个数量级[54,55, 65,66] 。具有刺激响应性的相似体系在ek组的系统工作中得到很好的体现。他们设计了四种三嵌段蛋白质[67] ,其中卷曲螺旋结构域的特定位点被替换成具有正电荷的赖氨酸,使其稳定性各不相同。圆二色谱表明,此类水凝胶中的二级结构在加热或化学变性剂作用下的变性过程是可逆的。这在宏观上表现为溶液和凝胶之间的转变。基于亮氨酸拉链的动态性质,Olsen等还发展了可注射的水凝胶[54] 以及断裂伸长率高达3000%的高弹性水凝胶[10] (见图8d-e)。
chen等以cutA三聚体作为三官能度交联分子,内含肽(Intein)的剪接作用作为偶联手段,制备了一种新型的两组分全蛋白质水凝胶[68] 。由于内含肽的剪接速度快、效率高[69] ,并且完全和细胞相容,因此不啻为一种构建可基因编码的水凝胶体系的好方法。类似Ito组的cutA-Tip-PEG体系,chen等构建了三官能度的cutA-Tip1lig和cutA-Tip1,其中Tiplig和Tip1能够互相结合导致凝胶形成。值得一提的是,该蛋白质中还包含着一段具有锚定作用的多肽序列SH3lig ,允许加载任意具有SH3结构域的融合蛋白,模式化地引入特定功能[70] (见图6b)。此外,弹性蛋白具有独特的低临界溶解温度(LCST),在温度升高的时候溶解度降低。根据氨基酸序列的不同,它们的亲水性和热转变温度均有不同。所以,对于一个三嵌段弹性蛋白来说,如果两端具有较低的热转变温度,中间段是高度亲水的,那么在溶液中升温的时候,憎水的两端就会发生聚集,形成凝胶[59] 。devries等利用酵母发酵获得大量高度亲水的明胶蛋白质[71] ,结合类丝蛋白,设计构建了一种三嵌段蛋白质,并进一步通过将类丝蛋白序列中的特定位点替换成能够离子化的组氨酸,赋予了凝胶化过程pH响应性[72] 。
利用天然蛋白质的反应性残基也可以实现交联的全蛋白质网络。同时,对蛋白质的简单修饰可以允 许以多种多样的方法来实现凝胶化。虽然这并不完全是全蛋白质基水凝胶,但它大大拓展了蛋白质基水 凝胶的范畴和功能,提供了其改性的新思路。例如,自然界中的贝类能够牢牢固定在岩石上,主要归功于 其贝类黏附蛋白(MAP)中关键成分3,4-二羟基苯丙氨酸(DOPA)的存在,其原理被Messersmith等在基 于PEG体系的合成高分子水凝胶中已有体现[73,74] 。Cha组进一步在蛋白质体系里也做了详细的工作。他们首先利用蘑菇酪氨酸酶对重组fp-1型MAP进行后修饰,获得含有DOPA的MAP蛋白质[75] 。它 既能与Fe3+ 形成多齿配合物[76,77] ,又能在氧化条件(如IO4- )下形成共价交联。这为全面提升全蛋白质 水凝胶的粘附性和机械性能提供新的一种思路。
利用可控化学偶联实现全蛋白质水凝胶的报道相对较少。天然蛋白质(比如明胶)的交联通常可以利用转氨酶来完成,但其交联位点并不可控。最近,谍反应的出现为这个目标提供了可能。谍反应是发生在谍捕手(蛋白质片段)和谍标签(多肽片段)之间的反应[78] 。两个片段之间首先发生分子识别和结合,继而发生自催化反应,在谍捕手的赖氨酸和谍标签的天门冬氨酸之间,高效形成异肽键[79] 。该反应具有高度的特异性,和细胞过程兼容,已被成功地应用于拓展蛋白质的拓扑结构(见图9)[79] 。利用该反应制备的网络结构(或称谍网络)是一个完全生物相容的凝胶化过程,并可以通过基因编码的方式引入生物活性基元(比如白血病抑制因子),预计在活细胞的封装和行为控制方面将有广泛的应用前景。
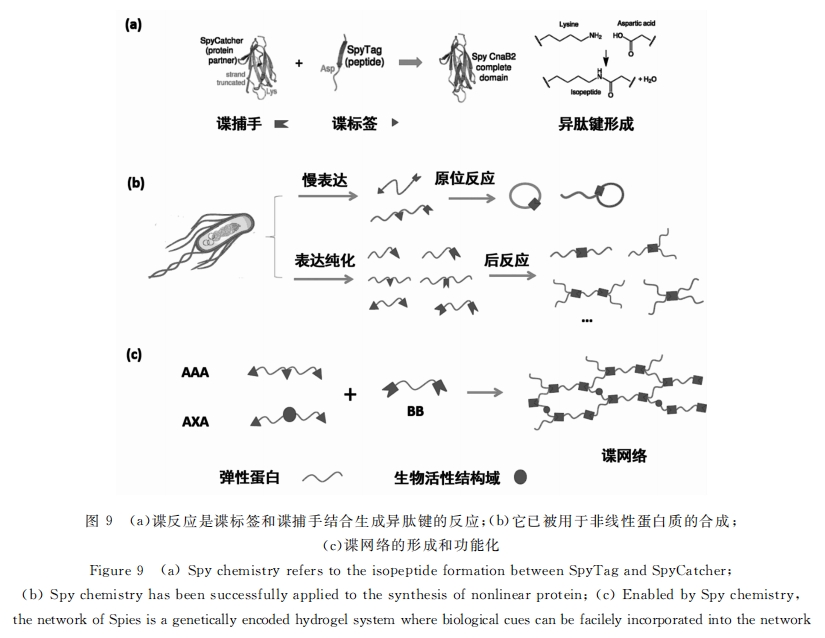
由此可见,具有高度特异性和强亲和力的蛋白质-蛋白质相互作用在全蛋白质水凝胶中可以发挥其强大的功能。通过基因工程的方法可以编辑凝胶前体的结构和功能,而生物合成则保证我们能够简便地获得具有相应结构和功能的凝胶前体蛋白质。两种方式结合,能够更加快速简便地获得不同功能的凝胶前体蛋白质,从而实现模块化构建全蛋白质水凝胶。例如,在前体蛋白质中嵌入一段结构域,同时在另一前体蛋白质中引入与之结合的互补结构域,就可以结合不同的功能蛋白设计重组融合蛋白质,以制备功能性水凝胶。结构域之间结合的不同动力学和不同稳定性可以被用来微调水凝胶的宏观性质。
4 总结与展望
在近几十年的科学道路上,蛋白质工程经历了飞速的发展,而材料研究也日新月异。可以说,对合成高分子水凝胶的研究已经相当成熟。目前,生物大分子-合成高分子的复合水凝胶方向取得了相当大的进展,完全基于多肽和蛋白质的水凝胶体系也正日新月异。有理由相信,利用蛋白质的优势构建水凝胶材料,在未来仍具有极其广阔的前景以及应用潜力。然而该领域仍然存在一系列重大的挑战。首先,如何找到一种合适、简便可行而又生物相容的凝胶化方法,以适应广泛的生物用途? 其次,如何利用其特殊的功能性,为体系增添丰富的刺激响应性和智能性,进一步提升蛋白质水凝胶的生物价值? 如何真正将材料从惰性变成活性,从被动变成主动? 自然界具有各式各样、功能丰富的蛋白质,要在浩如烟海的蛋白质库中寻找合适的蛋白质,并运用到水凝胶的构建和功能化中,需要结构生物学和生物信息学的合作发展。全蛋白质水凝胶是一个可以以基因编码的方式去调控材料宏观性能的独特体系,为我们研究材料结构功能关系提供了强有力的手段。相信在未来几年内,全蛋白质水凝胶将会脱颖而出,成为生物材料中极具生命力和实际应用潜力的一个领域。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。