
摘要:基于铜离子对罗丹明B标记的多肽的荧光猝灭作用, 构建了一种用于铜离子检测的荧光传感器. 利用共振光散射分析、 紫外-可见吸收光谱、 荧光寿命测试和圆二色光谱研究了铜离子检测的传感机理, 发现铜离子的加入诱导多肽结构发生变化而使罗丹明B荧光团彼此靠近, 从而导致铜离子与多肽之间发生聚集诱导荧光猝灭. 实验结果表明, 该传感器检测铜离子的线性范围为5×10‒4~1×10‒2 μmol/L和0.1~7 μmol/L, 检出限为0.29 nmol/L, 且拥有良好的选择性, 能用于湖水样品中铜离子的检测.
铜是水中一种微量的金属元素, 在生物体的新陈代谢过程中发挥重要作用, 但过量的铜对生物体危害极大. 铜离子污染的环境水常被用作生活用水或灌溉用水, 直接影响生物体的生长和发育, 因此探索快速、 灵敏、 选择检测水样中铜离子的方法对于环境监测具有重要意义[1,2]. 目前, 环境水中铜离子的检测方法有原子吸收光谱法[3]、 电感耦合等离子体-原子发射光谱法[4]和电感耦合等离子体-质谱法等[5], 然而这些方法操作复杂, 样品处理较为烦琐且成本较高. 相比较而言, 荧光光谱法由于灵敏度高、 操作简单和响应快等优点近年来受到广泛关注[6]. 然而, 铜离子本身不具有荧光, 因此不能使用直接荧光分析方法进行定量检测, 这就需要采用借助于荧光探针的间接荧光法来对铜离子进行检测. 这种间接荧光法检测铜离子通常选择性不佳, 因此迫切地需要开发出分子识别受体结合荧光探针实现铜离子的选择灵敏检测.
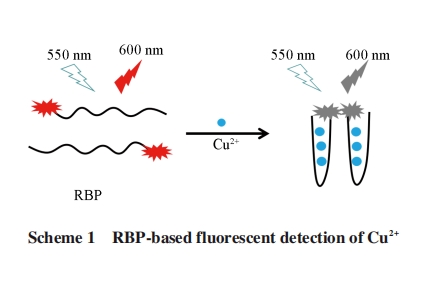
多肽因易于制备、 成本相对较低、 生物相容性优良、 水溶性好及对分析物具有高亲和力等优点而成为优良的分子识别受体[7]. 据文献[8~12]报道, 精氨酸、 组氨酸和赖氨酸对铜离子有高亲和力, 基于此, 本文设计了罗丹明B标记的多肽序列(RBP)作为识别铜离子的选择性生物受体, 发现低浓度的铜离子能够猝灭该多肽的荧光, 据此构建了检测铜离子的传感器, 检测原理如Scheme 1所示.
1 实验部分
1.1 试剂与仪器
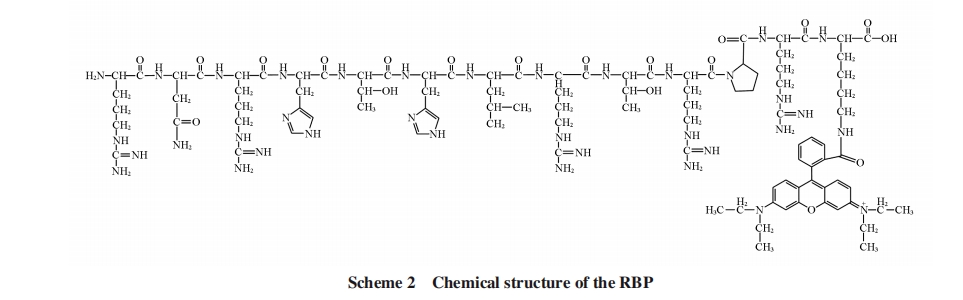
罗丹明B标记的多肽(RNRHTHLRTRPRK-Rhodamin B, RBP, 结构见Scheme 2), 每条多肽标记1个罗丹明B荧光团, 标记过程中罗丹明B荧光团通过羧基与多肽末端赖氨酸侧链的氨基进行键合;三羟甲基氨基甲烷购自中国医药集团有限公司;罗丹明B、 醋酸和醋酸钠购自上海试剂厂;盐酸、 六水合硝酸铜购自西陇化工股份有限公司(汕头);所用化学试剂均为分析纯. 用醋酸钠和醋酸配制100 mmol/L pH=3~6的缓冲溶液;用三羟甲基氨基甲烷和盐酸配制100 mmol/L pH=7~8的缓冲溶液. 实验用水为二次蒸馏水.
F-4600型荧光分光光度计(日本日立公司);UV-2550型分光光度计(日本岛津公司);C11367-11型荧光寿命测试仪(日本滨松光子学公司);MOS-450型多功能圆二色光谱仪(法国Bio-Logic公司).
1.2 实验过程
1.2.1 荧光测定铜离子
在含1.0 μmol/L RBP的醋酸钠/醋酸缓冲液(10 mmol/L, pH=5)中加入不同浓度的铜离子, 混合均匀后于室温下反应3 min, 用荧光分光光度计检测.
1.2.2 湖水中铜离子的预处理及测定
水样取自南昌市润溪湖, 先将水样在10000 r/min转速下离心15 min, 取上层液用0.22 μm滤膜过滤, 按照1.2.1节方法对铜离子进行测定.
2 结果与讨论
2.1 不同pH下RBP多肽对铜离子的荧光行为
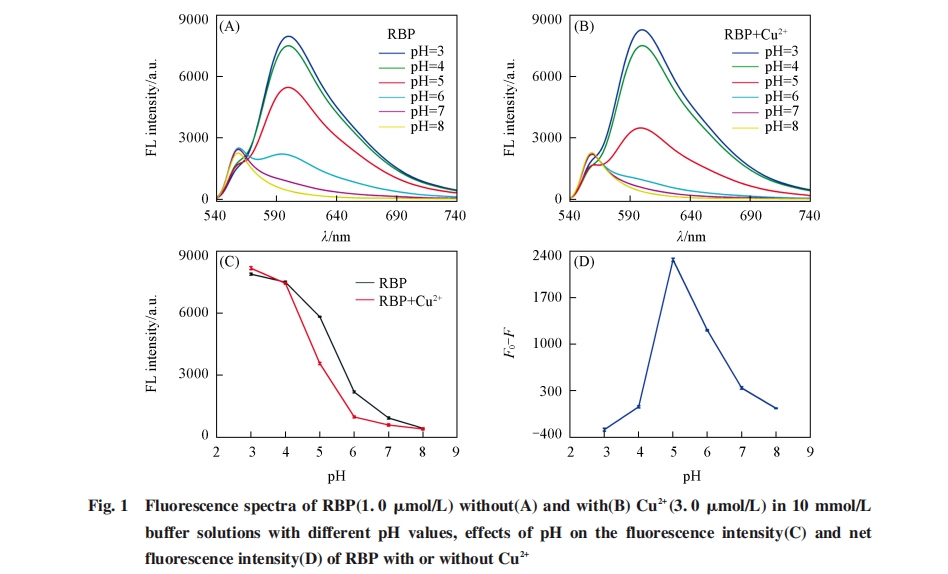
图1(A)和(B)分别为在不同pH的10 mmol/L醋酸钠/醋酸缓冲液中有、 无铜离子存在时的RBP多肽的荧光光谱. 可见, 无论有无铜离子存在, 在激发波长为550 nm处, RBP多肽的荧光发射强度均随着缓冲液pH值的增大而降低, 其原因可能是增加pH加大了RBP多肽分子的聚集程度. 基于RBP多肽分子的等电点值(pI=12.71), RBP多肽分子在整个研究的pH范围内(pH=3.0~ 8.0)均带正电, 而增加溶液pH值将导致RBP多肽分子中的氨基去质子化, 从而有利于RBP分子的聚集, 这将有利于罗丹明B的非荧光二聚体或聚集体的形成, 从而增强其荧光猝灭[13,14]. 由图1(C)和(D)可见, 当缓冲溶液pH=5.0时, 在600 nm处无铜离子存在下的RBP 多肽荧光发射强度(F0)与有铜离子存在下的RBP 多肽荧光强度(F)之差最大, 因此选择pH=5.0作为荧光检测铜离子的最优条件.
2.2 反应时间的选择
考察了反应时间对Cu2+检测的影响, 结果表明, 将3.0 μmol/L的Cu2+加入到RBP溶液中时, RBP的荧光发生猝灭, 反应3 min即可达到稳定. 因此, 选择反应时间为3 min.
2.3 铜离子的荧光检测
图2(A)为向pH=5.0的10 mmol/L醋酸钠/醋酸缓冲液中加入不同浓度铜离子后RBP多肽的荧光光谱. 可见, 随着铜离子浓度的增加, RBP多肽的荧光强度逐渐减小. 有、 无铜离子存在下的RBP多肽荧光强度比(F/F0)与铜离子浓度(c, μmol/L)之间存在2个良好的线性关系[图2(B)], 这2个线性范围分别为0.0005~0.01 μmol/L和0.1~7 μmol/L, 相应的线性回归方程分别为F/F0=0.96‒22.56c, 相关系数为0.999;F/F0=0.74‒0.04c, 相关系数为0.996. 根据3倍信噪比估算出铜离子的检出限为0.29 nmol/L, 此检出限远低于世界卫生组织和美国环境保护署对水中铜离子最大污染水平的规定[15].

2.4 荧光传感机理研究
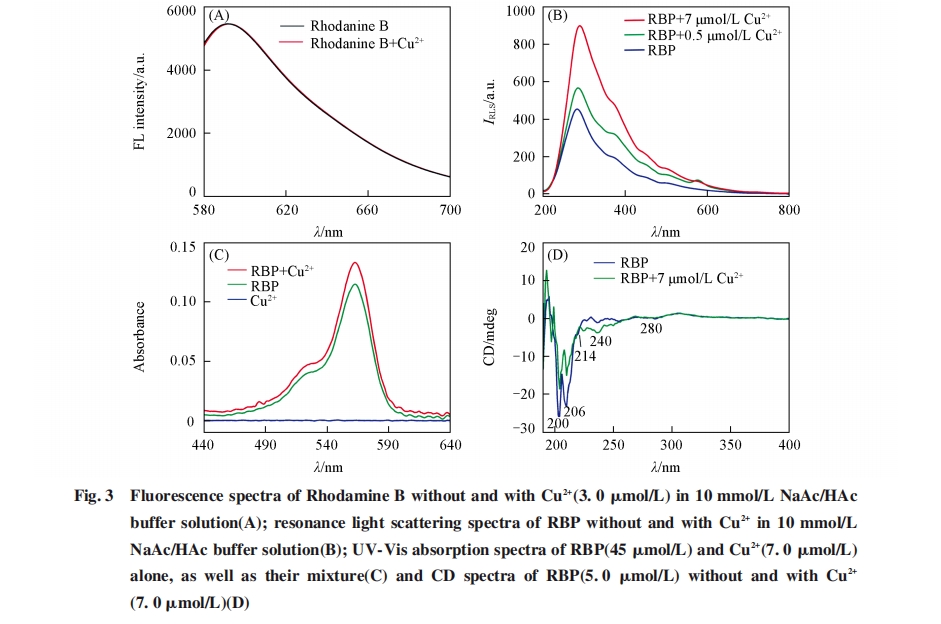
图3(A)为在pH=5.0的10 mmol/L醋酸钠/醋酸缓冲液中有、 无铜离子存在时罗丹明B的荧光光谱. 可见, 加入铜离子后罗丹明B的荧光光谱几乎无变化, 说明铜离子诱导RBP多肽的荧光猝灭不是由RBP多肽中的罗丹明B单元与铜离子的相互作用导致, 而可能是因为RBP多肽中的多肽单元和铜离子的结合导致. 因此, 进一步利用共振光散射和紫外-可见吸收光谱探究了RBP多肽与铜离子的相互作用. 由图3(B)可见, 加入铜离子后, RBP多肽的共振光散射增强, 说明铜离子的加入促进了RBP多肽的聚集. 此外, 由图3(C)可见RBP多肽在562 nm处有强吸收谱带, 低浓度铜离子在此波长范围无吸收, 当铜离子加入到RBP多肽溶液中后吸收谱带蓝移557 nm, 这说明铜离子促进了RBP多肽的聚集, RBP多肽的聚集很可能增强罗丹明B的非荧光二聚体或聚集体的形成[16,17]. 同时, 紫外-可见吸收光谱也表明, 荧光猝灭机理与RBP多肽和铜离子之间的荧光共振能量转移或它们之间的内滤效应无关. 另外, 实验还测定了有、 无铜离子存在时RBP多肽的荧光寿命, 发现RBP多肽的荧光寿命约为2.11 ns, 而加入铜离子后RBP多肽的荧光寿命几乎无变化, 约为2.04 ns, 进一步说明荧光猝灭机理可能是因为铜离子与RBP多肽结合, 从而诱导罗丹明B的非荧光二聚体或聚集体的形成. 将圆二色光谱进一步用于有、 无铜离子存在时RBP多肽的结构表征. 由图3(D)可见, RBP多肽在200, 206和214 nm 处的紫外区间有强的负谱带, 而在196 nm处显示强的正谱带, 这些谱带归属于多肽的β折叠和无规卷曲结构[18];当加入铜离子后, 200和206 nm处的谱带强度减弱而224和240 nm处的谱带强度增强, 说明铜离子的加入增加了RBP多肽的α螺旋和β转角的含量, 而减少了β折叠和无规卷曲结构的含量[18], 此外, 还表明铜离子的加入可能导致RBP多肽结构变化, 进而使罗丹明B荧光团彼此接近形成非荧光二聚体或聚集体.
2.5 传感器的选择性
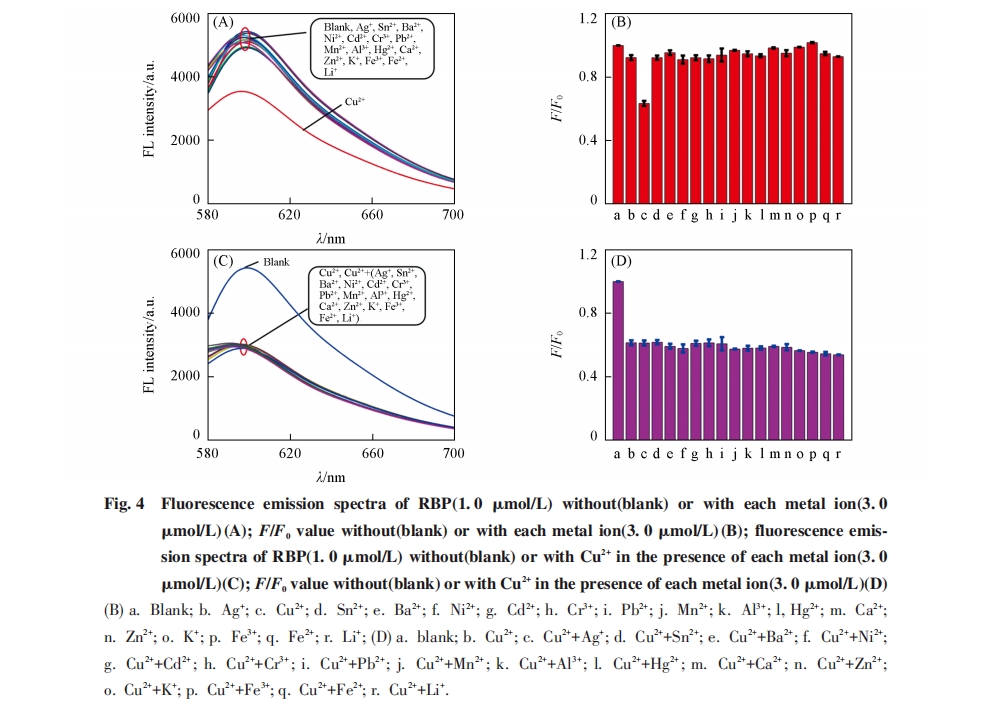
为了评价此RBP多肽荧光传感器对铜离子的选择性, 测试了加入不同金属离子(Ag+, Sn2+, Ba2+, Ni2+, Cd2+, Cr3+, Pb2+, Mn2+, Al3+, Hg2+, Ca2+, Zn2+, K+, Fe3+, Fe2+, Li+)后RBP多肽的荧光响应[图4(A)]. 由图4(B)可见, 加入铜离子后F/F0显著减小, 而加入其它金属离子所导致的F/F0的变化很小, 表明基于RBP的荧光传感器对铜离子有高选择性. 此外, 考察了RBP多肽与铜离子作用的共存离子效应, 测试了在RBP多肽中加入Cu2+和上述其它金属离子后RBP多肽的荧光响应[图4(C)]. 由图4(D)可见, 在RBP多肽中同时加入Cu2+和其它不同金属离子后的F/F0值与仅加入Cu2+的接近, 进一步说明此荧光传感器对铜离子有高选择性.
2.6 实际水样分析
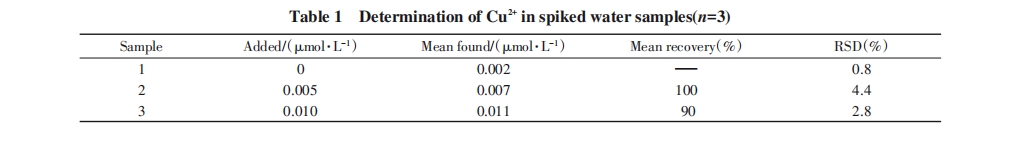
为了评价该荧光传感器检测实际样品中的实用性, 对南昌市润溪湖的水样进行了测定, 发现水 样中含有0.002 μmol/L的铜离子, 随后将不同浓度的铜离子加入到湖水样中评价了该方法的可靠性. 由表1可见, 添加值和测量值接近, 相对标准偏差RSD<4.4%, 说明该方法可用于水样中铜离子的检测.
3 结 论
基于铜离子对罗丹明B标记的多肽的荧光猝灭作用, 构建了一种用于检测铜离子的高选择、 高灵敏荧光传感器. 该传感器检测铜离子的线性范围为5×10‒4~1×10‒2 μmol/L和0.1~7 μmol/L, 检出限为0.29 nmol/L, 可用于实际水样中铜离子的检测. 预期此荧光传感原理结合选择性多肽可用于构建检测食品或环境中其它有毒有害物质的传感器.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。







