
摘要:系统总结了弹性肽(ELPs)的自组装及其组装体的生物应用研究现状, 讨论了ELPs的温控相变在构建超分子组装体方面的独特优势, 探讨了ELPs纳米结构的序列敏感性, 展望了ELPs在超分子组装中的实际应用.
弹性肽(ELPs)是一类具有多个五肽重复单元的多肽. ELPs的一级结构为(Val-Pro-Gly-Xaa-Gly)n, Xaa是除脯氨酸外的其它氨基酸. ELPs由于具有温度响应自组装性质, 引起了科研人员的广泛兴趣; 并且由于具有易修饰、 组装效率高和生物相容性好等特点, ELPs得到了广泛应用[1,2,3]. ELPs来源于弹性蛋白, 是胞外基质的主要组成部分. 当温度低于相变温度时, ELPs以可溶形式存在, 当温度高于其相变温度时, ELPs从随机卷曲结构变为β转角或β螺旋结构, 通过增加疏水作用形成组装体. 许多ELPs诱导策略直接利用多聚Val-Pro-Gly-Val-Gly[poly(VPGVG)]作为诱导基元连接亲水分子, 温度达到相变温度时形成两亲性分子, 在水溶液中组装成纳米结构[4,5,6]. 从组装结构可以看出, Val和Pro分别参与疏水组装和β转角形成, 在形成组装体方面起到重要作用, 因而在设计和应用ELPs时常保留这2种氨基酸. ELPs结构对序列敏感, 如果用其它氨基酸替换重复序列中的氨基酸, 会使组装结构发生改变. ELPs可以被修饰, 从而显现出与ELPs不同的性质. 在ELPs主链上引入带电氨基酸, 离子化的ELPs在电荷被中和时会发生相变, 利用这一特点可以构建pH响应纳米结构[7]; 用精氨酸-谷氨酸-天冬氨酸(RGD)等分子修饰后, ELPs可以靶向细胞; 用半胱氨酸修饰后, ELPs具有氧化还原性质; 用客体分子修饰后, ELPs具有主客体组装能力. 因此, ELPs的组装及调控备受关注[8,9,10].
1 ELPs在调节结构中的应用
ELPs作为一种大分子量的多肽, 既可以采用基因工程方法合成, 也可以用肽合成法或化学法合成. 利用点击化学手段, Guan等[11]以ELPs基序为结构单元进行聚合反应, 合成了ELPs模拟物, 研究了其疏水水合作用对ELPs力学性质的影响. 基因工程常用的方法主要有滚动循环扩增(Rolling cycle amplification)、 同尾酶法、 单酶法和递归定向连接法(Recursive directional ligation). 滚动循环扩增是近年来发展的用于扩增多聚DNA的有效方法, 该方法以长度为26~74 nt的单链环状DNA为模板, 不需要常规聚合酶链式反应的升温和降温过程[12]. Li等[13]用同尾酶法构建了一系列弹性蛋白, 成功用于蛋白质折叠-解折叠研究. 如果基因两端含有同种内切酶序列, 可用单酶法进行体外多聚基因的快速筛选. 递归定向连接法则利用Ⅱs型限制性内切酶, 可以进行无缝连接[14]. 这些方法在ELPs合成方面的成功应用促进了ELPs在超分子组装领域的发展.
1.1 1D结构
在自然界中, ELPs首先形成线形纤维, 纤维通过团聚作用逐渐长成弹性蛋白网络结构. 设计并构筑一维(1D)弹性肽纤维是探索弹性肽材料的一个重要环节. Poly(VPGVG)(富含脯氨酸, 用P表示)作为弹性肽模拟物, 由于缺少形成定向氢键的能力, 难以在体外组装形成纳米纤维. 天然弹性肽含有poly(VGGVG)(富含甘氨酸, 用G表示), 当poly(VPGVG)两端连接序列poly(VGGVG)可以得到嵌段共聚物GPG[图1(A)和(B)], GPG首先形成纳米粒, 然后在7 d内形成串珠形状的线形结构[15]. 用圆二色(CD)光谱和原子力显微镜(AFM)进行组装动力学检测发现, 当在溶液中加入10%(体积分数)三氟乙醇后, 在15 min到48 h内, 嵌段共聚物GPG可以组装成纳米粒、 纳米纤维及成熟纤维, 最后形成串珠结构[图1(C1~C4)]. 当用带正电的多肽KAAK修饰C端形成GPG2, GRGDS修饰GPG2形成GPG3后, 可以靶向整合蛋白-胞外基质. 富含G的区域互相作用形成β片层结构, 促进了GPG3纳米纤维的形成. CCK-8检测或细胞数检测和细胞形态分析结果表明, GPG3是最佳的细胞黏附材料或类纤维连接蛋白组织. 因此, 基于天然弹性蛋白结构, 设计并引入β片层结构, 是一种构建ELPs纳米线的有效方法.
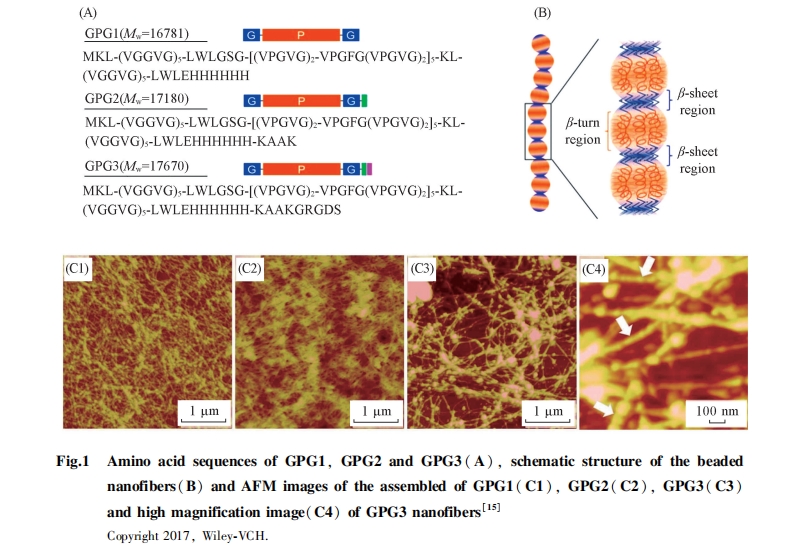
线形ELPs的成功构建激发了人们用超分子方法构建多功能蛋白质纳米线或弹性蛋白模拟物的兴趣. 本课题组[16]在C2对称的谷胱甘肽转硫酶的N末端修饰三肽Phe-Gly-Gly(FGG), 利用FGG与葫芦脲(CB[8])的主客体作用(结合常数超过1011 mol/L2, 摩尔比为2:1)构建了蛋白质纳米线, 并用硒酶模拟方法构建硒酶功能化纳米线, 该酶组装体显示出高抗氧化活性和高稳定性. 利用CB[8]与FGG的主客体作用, 我们[17]构建了钙调蛋白纳米线, 实现了金属离子响应的超分子组装. 上述研究表明, 利用蛋白质独特的对称性, 在超分子主-客体作用下可以制备多功能的弹性蛋白模拟物, 为弹性蛋白的生物和医学应用奠定了基础.
1.2 球形结构
球形纳米粒子的比表面积较高, 常用于修饰荧光分子、 细胞靶向分子或细胞膜穿透肽, 在药物传递等方面发挥着重要作用. ELPs被广泛用于构建球形胶束或囊泡, 构建这些结构的方法包括改变客体氨基酸(氨基酸或非天然氨基酸)、 改变聚合度和嵌段共聚(AB/ABA)等方法[18]. 其中, 一个有效的方法是改变氨基酸的种类, 如引入带电氨基酸, 使其具有pH响应性, 或引入疏水氨基酸改变其相变温度. Callahan等[19]设计了富含His的ELPs, 在37 ℃, pH=7.4和Zn2+存在下组装成球形胶束, 在pH值降至6.4时解离, 与pH不敏感胶束相比, 球形ELPs纳米结构具有较好的肿瘤穿透性. 研究结果表明, ELPs纳米结构对氨基酸序列具有敏感性. Vanrell等[20]设计了poly(VPAVG), 用于构建纳米粒子, 即在不影响脯氨酸与缬氨酸之间形成氢键情况下, 甘氨酸被更疏水的丙氨酸代替. DSC表征结果表明, poly(VPAVG)在升温时呈吸热反应, 而降温时呈放热反应, 降温曲线具有明显滞后效应. 这是因为降温时, 与poly(VPGVG)相比, 水结合到酰胺键的量减少, 而纳米粒子稳定性与重新溶解相关.
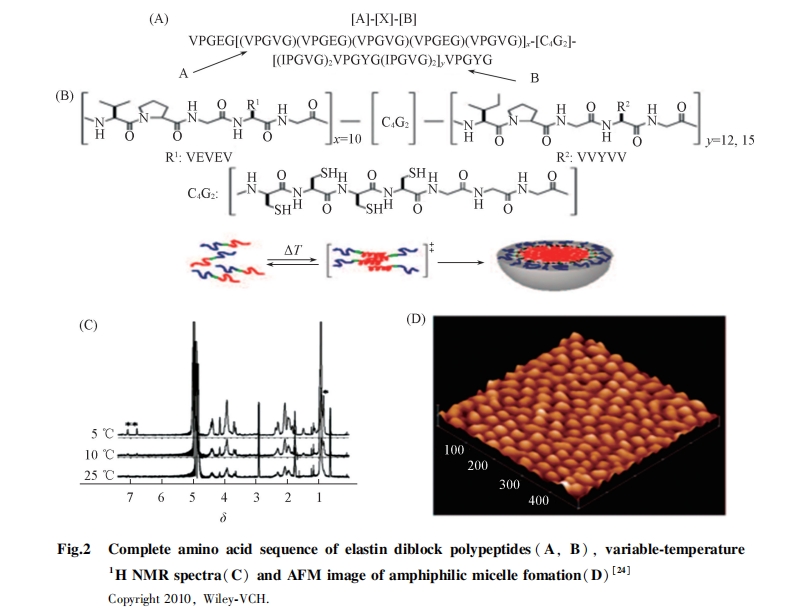
共聚是调控聚合物结构和性质的有效方法[21,22,23]. 嵌段共聚是用来设计两亲分子的常用方法. AB型多肽具有易制备、 分子量均一和结构易优化等特点, 已成功用于构建球形胶束. 研究结果表明, ELPs在第4位氨基酸负载疏水氨基酸或带电氨基酸后, 可形成具有不同相变温度的囊泡. Kim等[24]设计了C4G3作为连接基团的AB共聚物[图2(A)和(B)], 同时在A中引入Glu避免聚集, 在B中引入Ile增加疏水性. 不同层次结构检测结果显示其组装形成了球形胶束. CD光谱显示, 在210 nm处出现正峰, 表明形成β转角. 动态光散射(DLS)分析结果表明, 在10~37 ℃之间, 由于二硫键交联使结构大小稳定在25 nm. 透射电子显微镜(TEM)、 核磁共振波谱(1H NMR)和AFM分析结果表明, 共聚物组装形成了胶束[图2(C)和(D)], 与DLS分析结果一致. 该策略可用于设计制备刺激响应性胶束, 或构建药物传递系统, 在还原性硫醇分子存在时实现可控释放.
1.3 树枝状结构
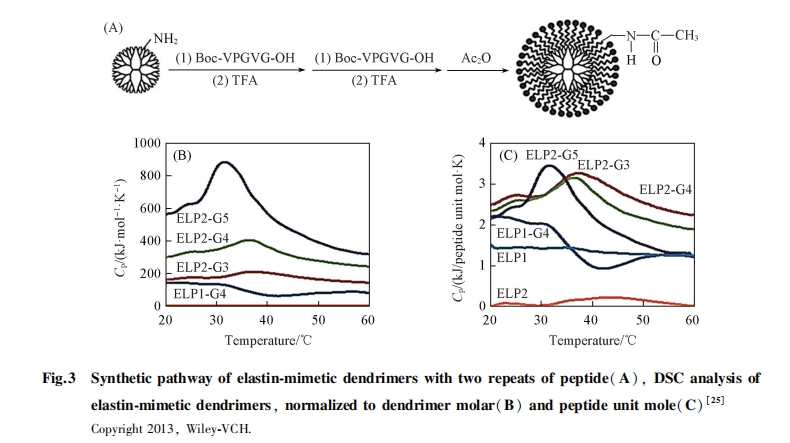
树枝状分子具有明确的大小、 结构和大量处于分子末端的功能基团. 这些基团可被VPGVG共价修饰, 使末端暴露出几十至数百个VPGVG, 从而形成树枝状的ELPs模拟物. Tanaka等[25]以HATU/HOAt为缩合试剂, 将VPGVG和(VPGVG)2交联到树枝状分子G3, G4和G5上. 圆二色光谱分析显示, 在218 nm处出现β转角峰. 在浊度实验中, 大量VPGVG共价结合在树枝状分子或者纳米粒子多个末端时, 具有poly(VPGVG)的相变性质[图3(A~C)], 因此该聚合物是一种弹性肽模拟物.
1.4 柱状结构
ELPs纳米结构具有序列敏感性, 即ELPs纳米结构不仅受一级结构影响, 而且受氨基酸相互作用的影响. 球形结构的构建激发了学者构建更加复杂纳米结构的兴趣. McDaniel等[26]将(XGG)8(X为疏水氨基酸)引入到ELPs的C末端. A160-(YGG)8不能组装成任何结构, 但通过移除甘氨酸部分增强其疏水性后, A160-(YG)8能够组装成水动力学半径为71 nm的纳米粒子, 甚至在pH=12时也保持很好的组装能力, 而此时离子化的Tyr比中性的Tyr亲水性提高了10倍. 尽管A160-(YG)8和A160-(Y)8均可组装成柱状胶束, 但A160-(YG)8具有更高的长宽比(图4), 因此它们的组装结构不同.

1.5 网状结构
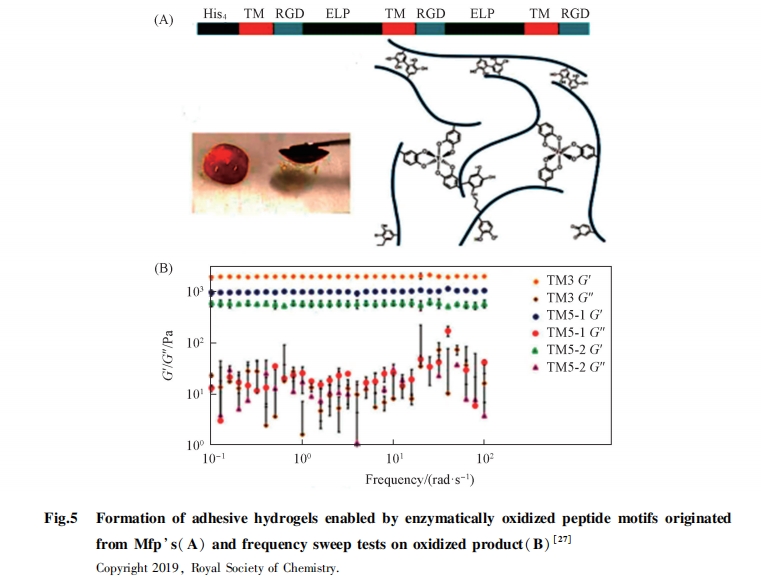
Sun等[27]用ELPs作为可溶性连接分子, 连接RGD和贻贝足蛋白的酪氨酸富含区(黏附蛋白, 重复单元为5~7个氨基酸). 在酪氨酸酶调节氧化反应中, 酪氨酸转化为DOPA和多巴醌, 从而促进交联形成网状结构和凝胶(图5). 这些凝胶表现出序列依赖性的力学性质. 细胞包覆和细胞增殖实验结果表明, 它们可以作为生物相容性材料用作细胞生长模板.
2 ELPs在生物功能方面的应用
ELPs及其组装体在医学和生物学方面应用广泛. 在医学方面, 由于弹性蛋白是细胞外基质的主要组成部分, Lee等[28,29,30]将温度响应的ELPs与整合素靶向的RGD连接, 进而利用温度刺激包覆胰岛, 发现可以重构损伤基质并提供胰岛周质环境, 保护其免于免疫排斥. 此外, ELPs本身也具有一定的生物学活性, 利用ELPs与细胞表面弹性蛋白受体复合物的作用, 可诱导细胞增殖; 或利用其与细胞表面硫酸乙酰肝素蛋白多糖的作用, 诱导金属蛋白酶在成纤维细胞中表达[31].
2.1 ELPs诱导蛋白质组装
蛋白质组装体是同源或异源蛋白质形成的有序结构, 其有序性是发挥生物功能的基础. 病毒、 微管和铁蛋白等高级有序蛋白质组装体在侵染、 维持结构和体内铁平衡方面具有重要作用. 目前, 构建蛋白质组装体是一个重要的研究方向. 利用主-客体作用、 金属配位作用和亲疏水作用, 已成功构建出具有光俘获、 催化和辅助蛋白质折叠功能的蛋白质组装体. ELPs作为疏水域可用于诱导肽、 聚合物和树枝状分子等组装, 证明ELPs是一个有效的诱导基元. 因此, 近年来ELPs被用于诱导蛋白质组装, 这些组装体不仅可以保持蛋白质的活性, 而且可以利用ELPs的刺激响应性实现药物传递. Champion等[32]设计了球-拉链-弹性肽(globule-zipper-ELPs)系统, 并提出了理论模型予以解释(图6). 通过相反电荷的拉链的二聚作用, 连接mCherry到ELPs上, 该球-拉链-弹性肽与弹性肽共组装获得了囊泡. Jang等[33]进一步研究了mCherry-ZE/ZR-ELPs组装成囊泡的详细参数. 动力学研究表明, mCherry-ZE/ZR-ELPs形成了团聚体、 单层囊泡和双层囊泡3种类型结构. 当温度达到相变温度时, 首先形成单层囊泡, 进一步加热促进ELPs分子间作用, 形成双层囊泡结构, 表明温度差ΔT(T0-Tt)决定囊泡结构.
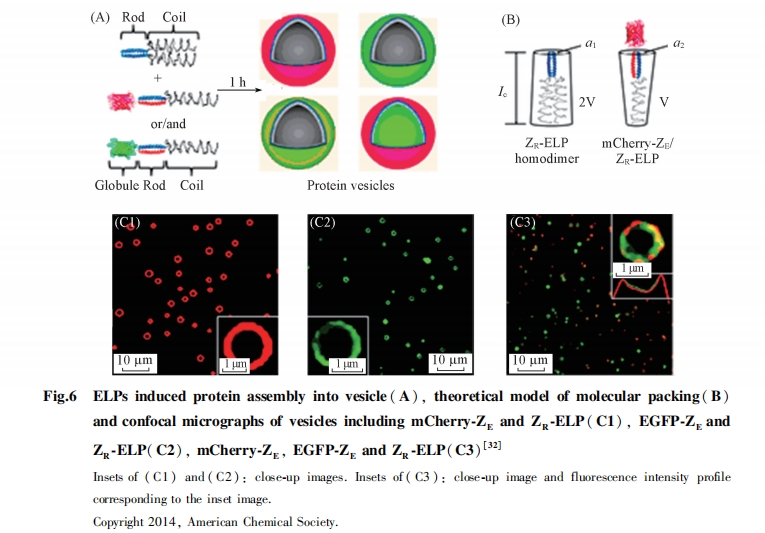
盐浓度的作用可以用堆积参数(P)表示, 可用公式P=V/(a0lc)进行计算(V为疏水基元ELP的体积, a0为亲水头部的平均面积, lc为临界长度[32]). a0可表示为a0=(1-χ)a1/2+χa2, χ为mCherry-ZE(或EGFP-ZE)与ZR-ELP的比值, a1和a2分别为ZR/ZR和mCherry(EGFP)-ZE/ZR的头部面积[图6(B)]. 由于球形的蛋白质与卷曲螺旋形成稳定的二级结构, a0的大小不受盐离子浓度影响. 增加盐离子浓度可促进ELP发生相变, 导致堆积参数V和P均降低. 因此, 高于临界盐浓度时形成囊泡, 此时参数P的范围为1/2<P<1[32]. 由于球形蛋白比卷曲螺旋头部面积大, 即mCherry-ZE/ZR的面积要比ZE/ZR的面积大, 而EGFP倾向于二聚, 使a2降低, V也相应降低, 因此EGFP组装体系(1/2<P<1)需要的盐浓度要高于mCherry. 另一方面, 当固定盐浓度而增大χ时, mCherry-ZE囊泡直径减小, 而EGFP-ZE囊泡直径则增大. 由于mCherry-ZE/ZR-ELP比卷曲螺旋ZE/ZR对囊泡表面的曲率贡献大, 所以在χ增大后, 对于mCherry-ZE囊泡, a2>a1, 而对于EGFP-ZE囊泡, a2<a1. 以上研究结果表明, 根据理论模型利用堆积参数可以有效调控ELP囊泡纳米结构, 因此扩大了ELP纳米结构的应用范围.
Hassouneh等[34]将ELPs嵌段共聚物(ELPBC)与硫氧还蛋白或纤维连接蛋白Ⅲ型结构域连接, 发现其不仅保留了ELPBC的球形组装能力, 还保留了Ⅲ型纤维连接蛋白靶向过表达αvβ3整合素细胞的能力. Mills等[35]发现, 当ELPs引入部分负电氨基酸时, SAXS表征结果显示ELPs-mCherry的组装能力显著降低.
2.2 光响应性弹性肽
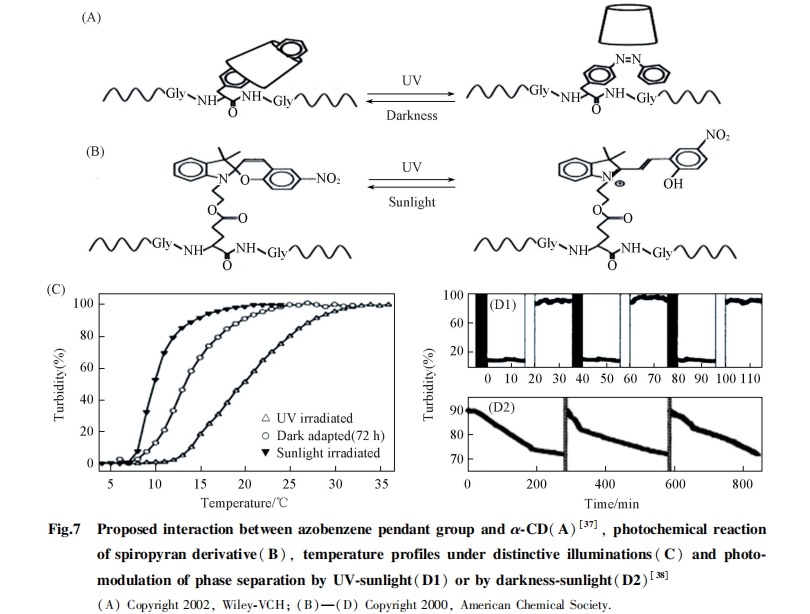
光响应分子在光照下可发生构象变化或化学反应. 由于光照是一种非破坏非添加的刺激方式, 因此, 光控被视为一种绿色的超分子诱导方法. 偶氮苯是超分子领域常用的光响应分子, Wu等[36]将其引入交替的两亲共聚物(EG4-a-NAzoOME)中, 形成了光响应性胶束结构, 实验结果表明偶氮苯在聚合物中表现出良好的光响应能力. 由于偶氮苯与α-环糊精有较好的复合能力, 在超分子研究中备受关注. Cabello等[37,38]将偶氮苯引入ELPs中, 在加入α-环糊精后, 偶氮苯的非极性侧链进入α-环糊精空腔, 使α-环糊精的极性表面暴漏, 因而导致ELPs相变温度增加, 而α-环糊精的存在不阻碍偶氮苯的顺反异构变化(图7).
2.3 ELPs应用于脂类的组装
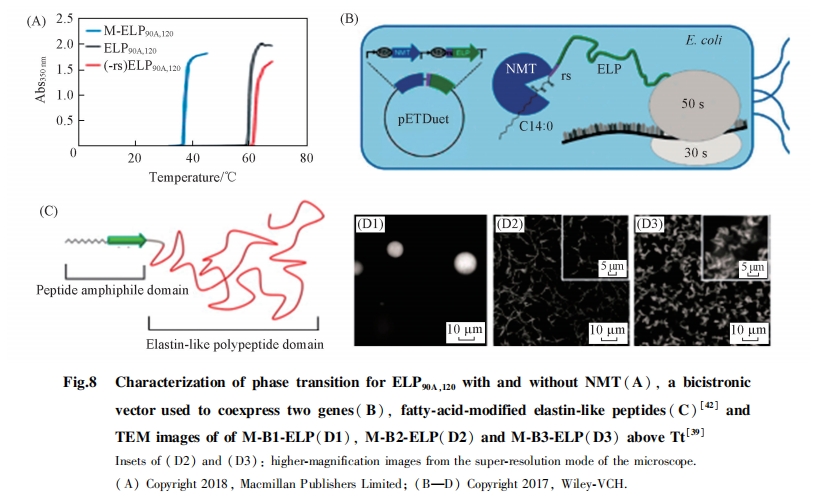
磷脂是细胞膜的主要成分, 脂类分子的组装备受关注. 为了促进脂类分子组装, Luginbuhl等[39]、 Meins等[40]和Liu等[41]利用翻译后修饰方法将脂链连接到ELPs上[图8(B)和(C)]. 在pETDuet共表达系统中, 当肉豆蔻酰转移酶(NMT)、 外源肉豆蔻酸和ELPs存在时, 通过催化甘氨酸的氨基与肉豆蔻酰-辅酶A的活化硫酯反应, 产生脂-弹性肽(lipid-ELPs)组装基元. 由于脂肪链的引入增加了ELPs的疏水性, 使M-ELPs的相变温度比ELPs降低了20 ℃. 疏水头部诱导lipid-ELPs组装形成不同结构. 研究结果表明, lipid-ELPs具有较高的DOX负载率, 在4T1肿瘤细胞中的生命周期与积累均高于游离的DOX. 该研究提供了一种构建脂类组装体系的有效方法, 并在细胞成像和药物传递等方面显示出良好的应用前景.
Mozhdehi等[42]利用同样的技术, 在脂肪链与ELPs之间引入β-片层肽基序(M-B-ELPs), 形成刺激响应材料[图8(C)和(D)]. 研究结果表明, 与单独的ELPs相比, 相变温度降低了15 ℃, 这是由于通过肉豆蔻酰化引入脂肪链使得ELPs疏水性增加, 同时N末端氨基的移除也有一定贡献. 荧光检测结果显示, 在β-片层加入硫磺素探针后, 当低于相变温度时, M-B3-ELPs比M-B1-ELPs显示出更强的荧光, 这是由于B3形成β-片层的能力更强. 由TEM照片可以看出, M-B3-ELPs在相变温度下组装成线形串珠结构, 超过相变温度后, 由于ELPs去溶剂化产生聚集, 进一步组装成分形结构.
如果ELPs与疏水药物分子共价连接, Lipid-ELPs有望应用于癌症靶向治疗. McDaniel等[43]根据组成和序列, 提出了预测ELPs的Tt的有效模型, 使含阿霉素的ELPs相变温度处在39~42 ℃之间, 研究发现, 适当升温可以显著提升DOX-ELPs纳米粒子靶向肿瘤的能力并增加在肿瘤内的积累. 与共价连接相比, 包覆等方式更有利于药物释放. Choi等[44]合成了Lipid-ELPs, 用于包覆作为药物模型的荧光素, 证明该体系增加了控制释放能力. 以上研究表明, 通过控制相变温度, 负载药物的ELPs有望成为生物相容且高效的药物传递系统.
2.4 ELPs应用于小肽组装
由于具有形成纳米管(FF苯丙二肽)、 β-片层(FKFEFKFE)和三螺旋束(CLP)的能力, 小肽或寡肽组装引起了研究人员的广泛兴趣.
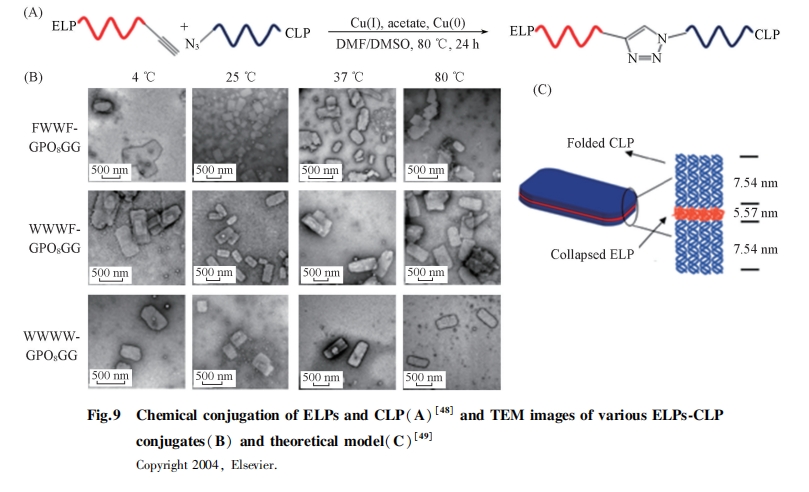
在许多ELPs组装系统中, 当重复数n或聚合度达到几十或几百时, 才能获得足够的两亲性而组装[45,46,47]. 如何降低重复数n并促进ELPs组装是近年来的研究热点之一. 研究表明, 短肽自组装能够形成多聚体, 从而在局部促进ELPs组装. Qin等[49]构建了智能的组装基元, 通过点击反应将(VPGFG)5交联到胶原蛋白CLP上(图9), 得到了具有低相变温度的ELPs-CLP. TEM表征结果表明, 在室温下ELPs-CLP可组装成80~100 nm纳米粒子. 这是由于CLP可以形成三螺旋结构, 在低温时能使3个ELPs聚集在一起. 在高温时, 解折叠的ELPs-CLP具有高相变温度, 这是因为解折叠CLP作为亲水域加入到ELPs可以提高ELPs的相变温度. 因此, 小肽组装是调节ELPs组装的一种有效方法, 通过改变ELPs序列可以得到更丰富的结构. 当将(GPO)8引入到含有GFOGER序列的ELPs中时[49], ELPs-CLP(FWWF, FWWW和WWWW)可以组装成不同类型的纳米片层[50,51]. 进一步研究表明, 纳米片由2层ELP-CLP分子组装而成, 其中ELPs呈现塌陷结构, 而CLP呈现三螺旋结构, 且这些具有不同转角的组装结构具有序列依赖性.
2.5 ELPs应用于水凝胶构筑
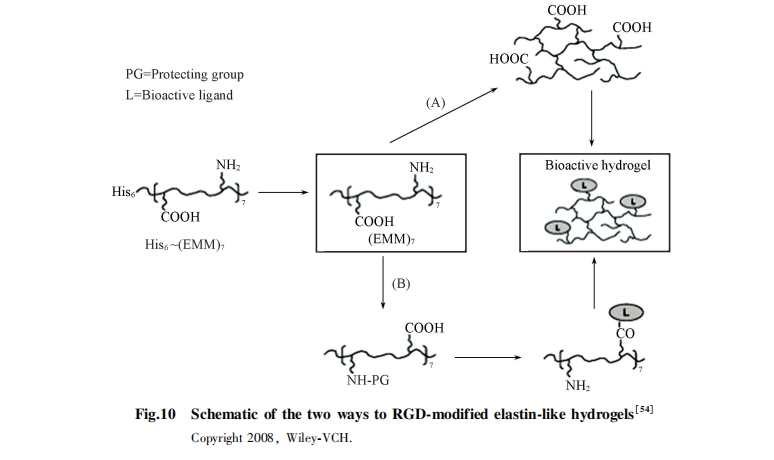
水凝胶被普遍应用于药物传递、 组织工程和诊断治疗方面. 与合成水凝胶相比, 生物水凝胶具有良好的生物相容性和生物可降解性等优势. 通过合理设计, 可利用基因重组法或化学方法合成ELPs, 使其具有合适的细胞靶向能力, 有望应用于癌症治疗方面[52,53]. Kaufmann等[54]设计了基于(EMM)7-(VPGXG)42(X代表K, E, V或I)的水凝胶, 并利用赖氨酸侧链交联RGD配体用于细胞黏附(图10). 如果交联后修饰RGD, FGRGDS修饰的凝胶不显示任何细胞黏附[54,55,56,57]. 这是由于配基的空间位阻和非均相反应导致了RGD交联效率较低. 如果ELPs交联前修饰RGD, 则显示出较好的细胞黏附行为. 重要的是, 具有环状RGD配基和己酸作为连接基团的ELPs水凝胶{(EMM)7-Ahx-c-[RGDFK]}显示出100%的细胞黏附能力, 明显高于线状RGD的ELPs水凝胶.
3 结论与展望
由于在诱导超分子组装方面具有的显著优势, ELPs诱导法已成为构建结构复杂、 功能灵活多变超分子结构的一种有效手段. 通过改变客体氨基酸、 引入疏水链或化学修饰等方法, ELPs不仅可用于组装线形、 片层、 球形和网状结构, 而且可用于制备光响应系统、 蛋白质组装体和水凝胶体系. 研究结果表明, ELPs纳米结构具有序列敏感性, 即氨基酸序列和聚合度对相变温度有很大影响, 同时, 蛋白质浓度、 盐离子种类和浓度等也起一定作用. 因此, 通过合理设计, 有望进一步丰富基于ELPs的超分子组装体的结构和种类.
尽管如此, ELPs应用于在超分子组装领域仍面临许多问题. 首先, 低聚合度的ELPs难以进行超分子组装, 主要原因是其相变温度较高; 其次, 线形组装体仍难以构建, 目前体外线形组装体组装时间较长, 而线形组装体是天然弹性蛋白网络形成的中间体; 第三, 光响应组装体动力学研究较少, 人们对光照循环过程中ELPs纳米结构变化的认识有限. 此外, 尽管已经有研究报道称, 根据ELPs的组成和分子量可以定量预测ELPs的相变温度, 但仍然缺乏pH值响应ELPs的相变温度的预测研究. 将来, ELPs的超分子组装体纳米结构和组装动力学有望更加可控, 这些ELPs组装体有望保持高效组装和高稳定性, 并进一步应用在细胞成像、 药物传递、 生物技术和组织工程等领域.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。










