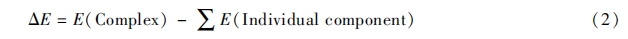摘要:设计合成了多个具有 2 个活性序列的线性和环状多肽及具有单个活性序列的短链多肽, 研究了它们的杀菌活性, 发现其杀菌活性顺序为长链肽>环状肽>短链肽, 特别是线性的 Linear-KT 和 Linear-KS 对多种革兰氏阴性菌和阳性菌均具有较高的杀菌活性. 采用 MTT 法考察了 Linear-KT 和 Linear-KS 对正常细胞的毒性, 其中 Linear-KS 表现出较低的细胞毒性, 优于阳性对照多粘菌素 B. 利用计算模拟的方法计算了多肽与细菌细胞膜中磷脂酰甘油(DMPG)的相互作用. 结果表明, 多肽和 DMPG 的结合能也表现出长链肽>环状肽>短链肽的规律, 特别是 Linear-KT 和 Linear-KS 具有较高的结合能. 长链肽含有 2 个活性序列, 可提供多个荷正电的氨基酸与荷负电的磷脂结合, 结合能较大, 杀菌活性较强. 同时, 柔性的结构及 Linear-KT 和Linear-KS 中丝氨酸和苏氨酸的B碳上的羟基可与磷脂上的羰基形成多个氢键, 进一步增大了结合能. 计算模拟的方法为抗菌肽的杀菌活性从理论上提供了一定的依据.
抗菌肽(Antimicrobial peptides, AMPs)是宿主防御体系中天然免疫系统所产生的具有一定杀菌效果的短肽类物质, 广泛分布于自然界中, 具有广谱抗菌性. 很多抗菌肽不仅对革兰氏阴性菌及革兰氏阳性菌具有杀菌作用, 而且对某些真菌、 原生生物、 甚至肿瘤细胞和病毒也具有一定的抑制作用[1 ~ 4].研究表明, 抗菌肽的主要作用机理是针对生物膜, 通过破坏生物膜的完整性, 使其产生孔洞或者生物膜瓦解而使内部物质外流, 或者穿透生物膜进入细胞内部, 干预一些重要的细胞过程, 从而起到杀菌的作用[5]. 由于抗菌肽作用主要针对于细胞膜结构, 其普遍具有比较低的抗药性, 因此也被认为是抗生素的替代品和增效剂, 用以解决日益严重的细菌抗药性问题[6].
根据天然抗菌肽的特性进行全新的抗菌肽设计是发现新抗菌肽的重要途径[7], 其中很多含有多个活性片段的多肽具有较高的生物活性. 如含有 2 个碱性溶解单位的 24 个氨基酸残基的多肽 WLBU2 比具有单个碱性溶解单位的多肽 LBU 及色氨酸取代的 WLBU 表现出更高的杀菌活性及选择性[8]. Frecer等[9]从头设计出新型的具有双活性序列 HBHPHBH 或 HBHBHBH(B: 带正电的氨基酸; H: 疏水性氨基酸; P: 极性氨基酸)的环状抗菌肽. 其中 1 个环状抗菌肽(V4, CVKVQVKVGSGVKVQVKVC)具有较高的抗菌性, 其双活性序列使两亲性加强, 有助于抗菌肽生物活性的表现. 但该肽由于含有大量疏水性缬氨酸, 水溶性差, 限制了其应用[10,11]. 除 WLBU2 和 V4 外, 不少抗菌肽也存在类似的现象. 根据抗菌肽 Tritrpticin 设计的对称模拟肽具有比 Tritrpticin 高 2 ~ 8 倍的抗菌肽活性[12]. Sushi 3 抗菌肽的二聚体比单体具有更高的破坏脂多糖胶团的能力[13]. Pexiganan(MSI-78) 和 PG-1 在溶液中是单体, 当其与生物膜相结合时, 形成两亲的二聚体, 表明二聚体是活性构象[14]. 二聚体也可看成是分子中含有 2个活性序列. 此外, 某些天然抗菌肽序列中也包含有 2 个相同的多肽片段, 如 Gramicidin S( CycloVOLdFPVOLdFP)由 2 个相同的片段环化而成[15]. 因此, 具有双活性序列的多肽可能具有潜在的生物活性. 本文设计了含有双活性序列的抗菌肽并考察了其活性, 研究了双活性序列是否有助于提高抗菌肽的活性. 鉴于多肽的化学合成成本, 具备抗菌活性的短肽具有大批量生产的潜力, 因此选取具有较短序列的多肽作为活性序列, 设计了包含 2 个相同活性序列的多肽, 测试了其抗菌活性及毒性, 并运用计算模拟的方法计算了所设计的多肽与细菌的细胞膜中一种重要的磷脂———磷脂酰甘油(DMPG)的结合能, 并对二者进行了比较. 由于二硫键的环化有助于稳定多肽的结构, 因此还设计了同时具有单个二硫键和环状结构的多肽, 研究了其抗菌活性和环状结构的关系, 为具有环状结构的抗菌肽的结构和活性关系研究以及抗菌肽的设计提供依据.
1 实验部分
1. 1 试剂与仪器
革兰氏阴性菌包括大肠杆菌(Escherichia coli)、 铜绿假单孢菌(Pseudomonas aeruginosa)和鲍曼不动杆菌(Acinetobacter baumannii); 革兰氏阳性菌包括金黄色葡萄球菌( Staphyloccocus aureus)和藤黄微球菌(Micrococcus luteus). 其中, 大肠杆菌、 金黄色葡萄球菌及藤黄微球菌由河南省药品检验所提供, 其余菌株由临床分离得到. 人支气管上皮细胞株(BEAS-2B 细胞)由郑州大学吴卫东教授馈赠; 多粘菌素B(Polymyxin B, PB)和四甲基偶氮(MTT)购自 Sigma 公司; 其它化学试剂均为国产分析纯; 实验用水为二次蒸馏水.
Spectra MR 酶标仪(美国 DYNEX 公司); IS10-OMNIL8 型红外吸收光谱仪(美国 Thermo Fisher 公司); J-815 型圆二色光谱仪(日本 JASCO 公司)
1. 2 实验过程
1. 2. 1 杀菌实验 挑取适量菌种在固体 Luria-Bertani(LB)培养基中划线, 置于 37 度培养箱中过夜培养. 挑取适量处于对数生长期的细菌于生理盐水中, 配制 0.5 ~ 1 麦氏浊度的菌悬液, 此时细菌菌落数约为 1X10^8cfu / mL, 使用时稀释至 1X10^6cfu / mL. 配制浓度为 2 mg / mL 的多肽溶液. 采用微量肉汤二倍稀释法测定合成多肽对各细菌的最小抑菌浓度(Minimum inhibitory concentration, MIC)[16], 同时进行溶剂、 只加菌液不加多肽的阴性对照和加入多粘菌素 B 的阳性对照, 每个多肽平行进行 3 次. 于 37度恒温箱中培养 12 h, 观察孔内溶液的混浊情况, 96 孔板同排中肉眼所见澄清孔所对应的最小浓度即为该多肽的 MIC 值. 采用半数有效剂量(ED50 )评价多肽的杀菌效率. 采用酶标仪测定上述 96 孔板600 nm 处的光密度值(OD600 ). 按下式计算杀菌百分数, 作图得出多肽杀伤细菌的半数有效剂量.

1. 2. 2 细胞毒性实验 采用 MTT 法测定细胞毒性[17]. 用含 10% (体积分数)胎牛血清的 RPMI1640(含 100 U/ mL 青霉素和 100 U/ mL 链霉素)培养基常规培养 BEAS-2B 细胞. 采用对数生长期的 BEAS-2B 细胞, 用含 10% 胎牛血清的 RPMI 1640 培养液调节细胞浓度为 5X10^4Cell / mL, 接种到 96 孔板上,每孔 200 uL. 培养 12 h 后, 加入不同浓度的多肽(终浓度分别为 2.5, 5, 10, 20, 40, 80, 160 和 320ug / mL), 每种多肽浓度设 4 个复孔, 并设不加细胞液的调零孔和只加细胞液、 不加肽液的空白对照孔. 培养 4 h 后, 每孔加入 180 uL 不含血清的 RPMI 1640 培养液和 20 uL 5 g / L 的 MTT 试剂, 继续孵育 4 h, 弃去上清液, 加入 180 uL DMSO, 轻轻振荡 10 min, 于 490 nm 波长下测定光密度值.
1. 2. 3 红外光谱测定 取多肽试样约 1 mg 与 KBr 混匀, 压片, 测定多肽的红外光谱.
1. 2. 4 圆二色光谱测定 在室温下, 采用 0.1 mm 石英比色皿测定多肽在水溶液中的远紫外圆二色光谱. 扫描范围 175 ~ 260 nm, 每条多肽扫描 3 次, 扫描速度 1000 nm / min, 多肽浓度为 1 mg / mL.
1. 2. 5 计算方法 磷脂酰甘油(DMPG)是细菌的细胞膜中的一种重要组成成分, 带有负电荷, 在抗菌肽和细菌细胞膜结合过程中具有重要作用. 采用 DMPG 模拟细菌细胞膜, 对多肽和 DMPG 的结合能进行了计算. 多肽与 DMPG 分子的初始构型由 Gaussian View 和 Amber 软件中的 leap 模块共同构建, 计算使用 Gaussian 09 软件[18], 采用 PM3 半经验算法对 DMPG 及各个多肽分子进行构型优化. 然后对多肽与 DMPG 分子的复合物进行优化来模拟多肽与 DMPG 分子的相互作用, 由于多肽与 DMPG 分子的复合物分子量较大, 模拟时仍然采用 PM3 半经验算法进行优化. 多肽与 DMPG 分子主要通过静电作用结合在一起, 同时还会形成氢键, 计算时需要同时考虑 2 种作用. 通过结合能来衡量多肽与 DMPG 分子间的相互作用程度, 结合能计算方法如下:
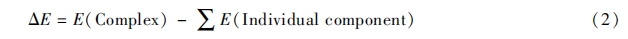
式中, E 为优化后各组分的单点能. 计算时尽量考虑不同的结合模式, 以使多肽与 DMPG 达到最好的结合.
2 结果与讨论
2. 1 多肽的设计
内毒素又称脂多糖, 是革兰氏阴性菌外层细胞膜的重要成分之一, 主要位于膜的外侧, 是与各种外源性物质最先接触的部分. Lipid A 是内毒素中具有生物活性的保守部分. 研究表明[9], 与内毒素结合的宿主防御蛋白由富含带正电的氨基酸组成两亲性结构, 具有杀菌功能, 因此基于宿主防御蛋白的结合基元设计合成的多肽可能保留其杀菌活性, 具有潜在的应用价值. Frecer 等[19]基于此计算了多个多肽片断和 Lipid A 的结合能, 发现 KFNFK, KFTFK 及 KFSFK 序列多肽与 Lipid A 结合释放了较高的结合能, 构象较稳定, 从理论上预测了这 3 个多肽片断可能具有抗菌活性. KFNFK, KFTFK 和 KFSFK的极性和非极性氨基酸交叉排列, 分别形成疏水面和亲水面, 氨基酸序列符合 BHPHB 分布规律. 具有与 Lipid A 较高的结合能表明这 3 个多肽可能更容易和细菌的细胞膜结合. 因此本文将这 3 个多肽视为一个活性序列, 参照 V4 抗菌肽的设计, 采用 GSG 将 2 个活性序列连接形成含有双活性序列的线性多肽 Linear-KT, Linear-KS 和 Linear-KN. 为进一步固定多肽的构象, 使疏水面更疏水, 亲水面更亲水,采用二硫键环化线性多肽, 形成环状的含有双活性序列的多肽 Cyclic-KS, Cyclic-KN 和 Cyclic-KT(具体序列见表 1).
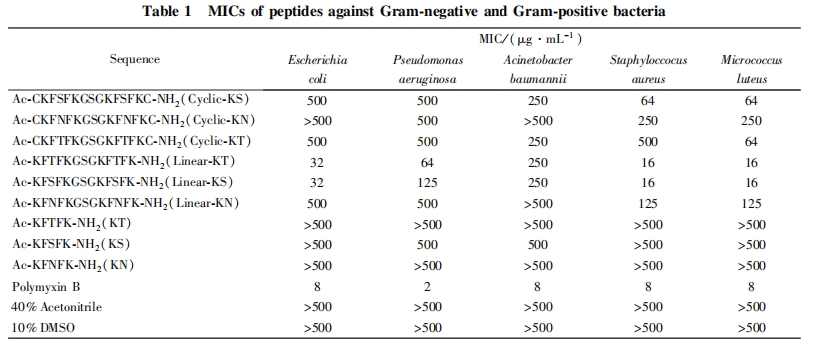
2. 2 多肽的最小抑菌浓度的确定
采用目视法, 观察肉眼所见的澄清孔所对应的最小浓度, 考察了多肽对多种革兰氏阴性菌和阳性菌的抗菌活性, 结果列于表 1. 由表 1 数据可以看出, 具有单个活性序列的多肽 KT, KS 及 KN 对 5 种细菌的杀菌活性均不理想, 最小抑菌浓度均不低于 500 mg / mL, 说明具有单个结合序列的多肽活性不高. 具有双活性序列的线性多肽对细菌的杀菌活性较具有单个活性序列的多肽有所提高, 特别是 Line-ar-KT 和 Linear-KS, 对金黄色葡萄球菌及藤黄微球菌的最小抑菌浓度低至 16 mg / mL. 而环状的多肽对细菌的杀菌活性普遍较低, 介于具有单个活性序列和双活性序列的线性多肽之间. 在对 5 种细菌的杀菌活性检验中, 含有双活性序列的多肽 Linear-KT 和 Linear-KS 均比 Linear-KN 表现出较高的杀菌活性,而 Linear-KT 和 Linear-KS 的活性则相近. 具有一定活性的多肽对革兰氏阳性菌的杀菌活性均略强于革兰氏阴性菌
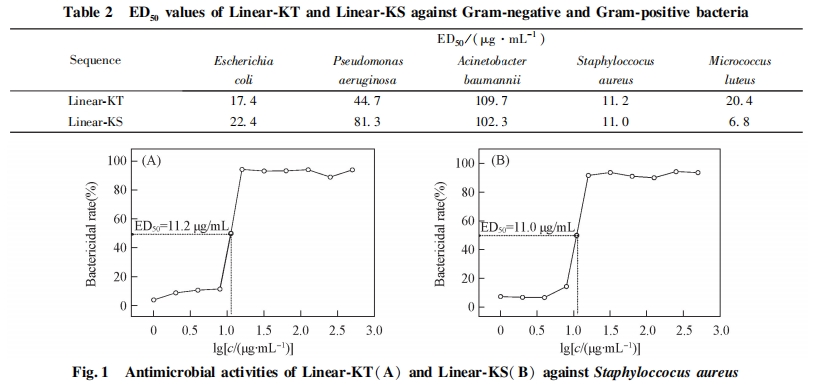
2. 3 多肽对细菌的半数有效剂量的确定
由公式(1)计算得出多肽在各浓度下的杀菌百分数, 绘制其杀菌率曲线并获得半数有效剂量ED50 , 结果列于表 2. 图 1 为 Linear-KT 和 Linear-KS 对金黄色葡萄球菌的杀菌率曲线.
2. 4 细胞毒性实验
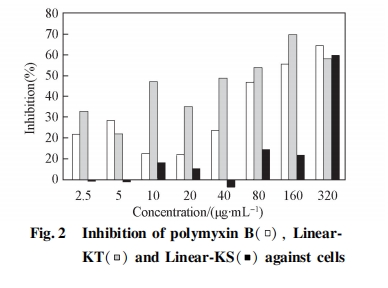
选取所设计多肽中杀菌效果较好的 Linear-KT 和 Linear-KS 进行细胞毒性实验, 结果见图 2. 阳性对照多肽类抗菌素多粘菌素 B 虽具有较强的杀菌活性(表 1), 但也引起部分正常细胞的死亡, 特别是其浓度高于 80 mg / mL 时, 多粘菌素 B 可导致较高的细胞死亡率. Linear-KT 的细胞毒性较大, 在大部分的研究浓度下均对细胞有毒性. 相比之下,Linear-KS 对细胞的毒性较小, 在浓度不高于 160ug / mL 时, 其对细胞的抑制率均不超过 15% , 低浓度时毒性更低. Linear-KS 具有较高的杀菌活性且细胞毒性较低, 因此 Linear-KS 具有进一步研究的价值和潜在的应用价值.
2. 5 红外光谱解析
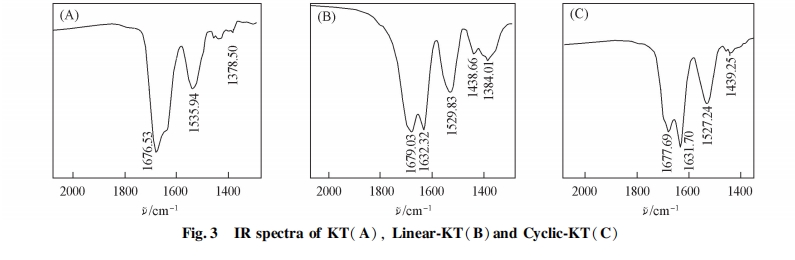
红外光谱是解析多肽以及蛋白质二级结构的有力手段. 多肽和蛋白质在红外光谱区有若干特征吸收带, 主要有酰胺I带(1600 ~ 1700 cm-1)和酰胺II带(1600 ~ 1500 cm-1). 酰胺I带主要由多肽骨架肽链 C O 的伸缩振动引起, 对研究二级结构最有价值[20]. 图3 为 KT, Linear-KT 和 Cyclic-KT 的红外光谱图. 可见, KT 在 1600 ~ 1700 cm-1处有 1 个明显的强峰, 峰形较宽; Linear-KT 在 1679 及 1632 cm-1处有 2 个很强的吸收峰; 而 Cyclic-KT 在 1677 及 1631 cm-1处也有 2 个很强的吸收峰. 因此, Linear-KT和 Cyclic-KT 均可能形成折叠结构. 采用红外光谱虽然可从一定程度上提供多肽的二级结构信息, 但由于 1600 ~ 1700 cm-1波段受干扰因素较多, 且红外光谱测试中多肽处于固体状态, 不能反映出多肽在水溶液中的状态, 因此进一步采用圆二色光谱考察了多肽在水中的二级结构.
2. 6 圆二色光谱测定
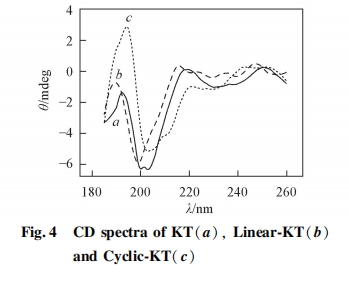
图 4 为短链多肽 KT、 线性多肽 Linear-KT 及环状多肽 Cyclic-KT 的圆二色光谱. 短链多肽 KT 在200 nm 处有 1 个负峰, 为无规卷曲结构的特征峰[21,22]. KT 只包含 5 个氨基酸残基, 肽链长度较短, 不足以形成二级结构, 因此以无规结构存在于溶液中. 多肽 Linear-KT 在 200 nm 处也有 1 个负峰, 表明 Linear-KT在水溶液中也呈无规结构. 环状多肽 Cyclic-KT 在 202及 213 nm 处有 2 个负峰, 且在 195 nm 处有 1 个正峰.典型的 B-sheet 结构在 216 nm 处有 1 个负峰, 195 nm 处有 1 个正峰, 因此 Cyclic-KT 在溶液中可能以无规及部分 B-sheet 结构存在. Cyclic-KT 以二硫键将多肽链环化,使得多肽的构象相对固定, 因此表现出部分 B-sheet 二级结构. 本研究中所用多肽长度较短, 因此不足以形成明显的二级结构, 圆二色光谱信号总体较低.
2. 7 模拟计算
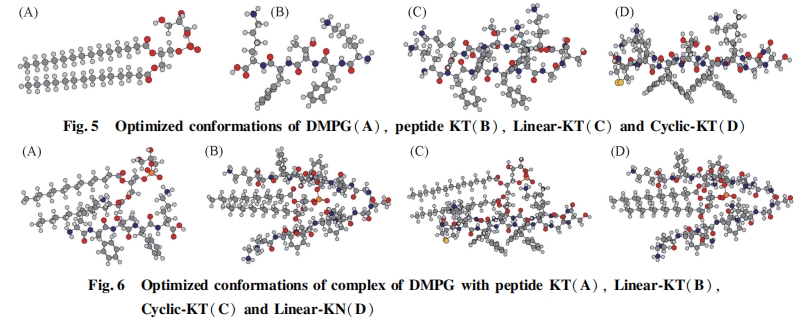
Linear-KT 和 Linear-KS 对革兰氏阴性菌和阳性菌均表现出较好的杀菌活性, 特别是对革兰氏阳性菌. 这 2 条多肽均含有双活性序列, 是由 2 条具有单活性序列的多肽通过简单的氨基酸残基相连而形成, 但比相应的具有单活性序列的多肽表现出显著提高的杀菌活性. 因此本文采用计算模拟的方法计算了所设计的多肽与磷脂相互作用时的结合能, 以评价多肽和细胞膜的结合程度. 磷脂是细胞膜的主要组成成分, 细菌的细胞膜含有较高含量的 DMPG, 而哺乳动物的细胞膜中 DMPG 的含量则很少, 因此本文采用 DMPG 为研究对象考察其与多肽的结合能力. 采用 Gaussian 09 中的 PM3 半经验算法优化DMPG 及各多肽的分子构型. 红外光谱图提示线性和环状的多肽形成折叠结构, 圆二色光谱也表明环状多肽可能具有部分 B-sheet 二级结构, 因此以折叠结构优化线性及环状多肽, 在优化过程中将多肽与DMPG 分子的骨架部分进行固定以缩短优化时间, 结果见图 5. 根据多肽和 DMPG 的构型优化结果构建多肽和 DMPG 形成的复合物, 并对复合物进一步优化, 复合物的构型见图 6. 计算时主要考虑多肽与 DMPG 分子的静电和氢键结合, 同时考虑尽可能多的结合模式. 以结合能最低为原则[23], 根据公式(2)计算出多肽与 DMPG 形成的复合物和各单体之间的能量差即得到结合能, 数据列于表 3. 由表 3 可见, 所有多肽与 DMPG 分子结合过程的能量差均为负值, 说明多肽与 DMPG 的相互作用过程释放能量, 能量差的绝对值越大说明二者的结合能越大. 长链肽和环状肽与 DMPG 分子结合时具有较大的结合能, 远高于短链肽. 结合能越大, 说明该类多肽更易与 DMPG 分子产生相互作用, 进而产生杀菌效果. DMPG 分子头基带负电, 可与带正电的氨基酸产生静电作用. DMPG 的负电头基在与长链肽和环肽结合的过程中, 可同时与 2 个带正电的赖氨酸产生静电作用, 而在与短链肽的结合过程中只能与 1个带正电的赖氨酸产生静电作用. 这是造成短链肽的结合能远小于长链肽与环状肽的主要原因. 此结果和实验所得的杀菌活性数据基本一致, 即具有 2 个活性序列的长链肽和环状肽比具有单个活性序列的短链肽杀菌活性更强.
在长链肽和环状肽中, 序列中含有丝氨酸和苏氨酸的多肽比相应的含有天冬酰胺的多肽结合能大, 这是因为丝氨酸和苏氨酸的 茁 碳上的羟基可与磷脂分子 2 条碳链上的羰基形成氢键, 从而增大了结合能. 杀菌实验结果也证明含有丝氨酸和苏氨酸的多肽活性高于含天冬酰胺的多肽. Frecer 等[19]计算表明, KFTFK, KFSFK 和 KFNFK 与内毒素的活性部分 Lipid A 结合的 Gibbs 自由能分别为-67, -75和-55 kJ/ mol; KFTFK 和 KFSFK 序列与 Lipid A 的结合能更大, 该结果与本文结果一致.
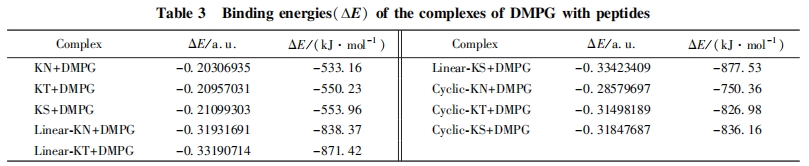
与环状肽相比, 长链肽与 DMPG 分子的结合能略高于环状肽, 这可能是由于多肽结构的影响. 长链肽在水溶液中基本以无规结构存在, 因此多肽结构柔性较大, 可根据所结合的对象采取更适合的结构与之结合. 特别是 Linear-KT 和 Linear-KS, 其柔性结构使丝氨酸和苏氨酸的 B碳上的羟基均可与DMPG 分子中 2 条碳链上的羰基形成氢键, 增大结合能. 而环状肽由于受折叠结构和二硫键的限制,肽的结构相对固定, 肽环的大小受限, 使磷脂分子不能完全插入肽环中, 只能在肽环平面的侧面与其结合, 只与 DMPG 分子中 1 条碳链上的羰基形成氢键, 氢键数目减少, 结合能降低, 因此环状肽的活性不及长链肽.
3 结 论
设计合成了多个具有 2 个活性序列的线性和环状多肽及具有单个活性序列的短链多肽, 研究了其杀菌活性, 并采用计算模拟的方法计算了多肽与细菌细胞膜中重要成分磷脂酰甘油的结合能, 从理论上解释了其活性. 结果表明, 静电作用和氢键在多肽与磷脂的结合过程中起重要作用. 线性的 Linear-KT 和 Linear-KS 具有双活性序列, 可同时提供 2 个荷正电氨基酸与磷脂结合, 杀菌活性远远大于单活性序列. 将双活性序列引入同一分子, 可起到提高杀菌活性的作用. 同时 Linear-KT 和 Linear-KS 的柔性结构能够使多肽与磷脂上的羰基形成多个氢键, 因此结合能较大, 具有较强的杀菌活性. 计算模拟的方法为抗菌肽的杀菌活性预测从理论上提供了一定的依据. 利用该方法可在一定程度上预测抗菌肽的杀菌活性, 提高抗菌肽的研发效率, 为抗菌肽的设计与开发提供了新途径.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。