
摘要 设计合成了具有 2 个活性序列的线性和环状多肽及具有单个活性序列的短链多肽, 研究了它们的杀菌活性、 细胞毒性及溶血性. 结果表明, 线性肽和环状肽的杀菌活性高于短链肽. 利用计算模拟的方法计算了多肽与细菌细胞膜中一种重要的成分磷脂酰甘油(DMPG)的结合能. 结果表明, 多肽-DMPG 的结合能与多肽的杀菌活性具有较高的相关性, 线性和环状多肽与 DMPG 的结合能大于短链肽. 线性和环状多肽均含有 2 个活性序列, 可提供多个荷正电氨基酸与荷负电的磷脂结合, 结合能较大, 杀菌活性较强. 采用模拟生物膜对其中几条多肽的作用机理进行了初步研究. 结果表明, 该类多肽有可能使正常哺乳动物细胞的细胞膜产生孔洞; 而对于细菌细胞膜, 多肽并未在膜上产生明显孔洞, 而是引起了细菌细胞膜的聚集.
随着传统抗生素在医药、 食品、 畜牧业和水产业等领域的滥用以及细菌突变速度的加快, 很多细菌对传统抗生素的抗药性问题日渐突出, 然而在过去的 30 年中却没有一种真正意义上的新种类的抗菌药物出现在市场上[1]. 因此, 寻找抗生素的替代品迫在眉睫. 抗菌肽(AMPs)的出现有可能使这局面得到改观[2], 它是宿主防御体系中天然免疫的一个重要组成部分. 天然免疫在微生物侵袭宿主细胞后几分钟内启动, 抑制病原体扩散, 为宿主细胞提供第一时间的保护. 抗菌肽广泛分布于自然界中,具有广谱抗菌性, 某些抗菌肽还具有抗癌性及抗病毒性[3,4]. 研究表明, 细菌的细胞膜是抗菌肽的主要作用靶位, 抗菌肽通过破坏细胞膜的完整性, 使其产生孔洞或者瓦解而使内部物质外流, 或者穿透细胞膜进入细胞内部, 干预一些重要的细胞过程, 从而达到杀菌作用[5]. 而对于微生物来说, 改变其细胞膜的组成和成分代价巨大, 因此抗菌肽普遍具有比较低的抗药性, 具有潜在的应用价值[6].
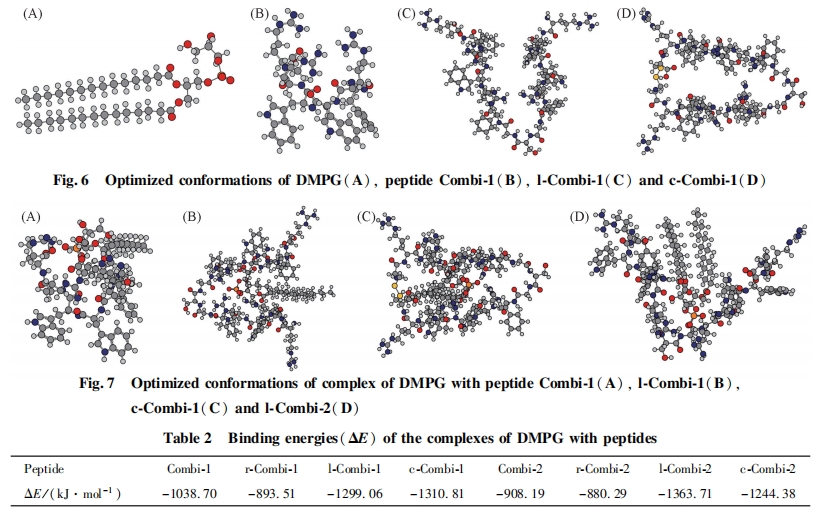
根据天然抗菌肽的特性进行设计是发现新抗菌肽的重要途径[7]. 研究表明, 很多含有多个活性片段的多肽具有较高的生物活性, 如 WLBU2[8], V4[9], Tritrpticin 的对称模拟肽[10]和 Gramicidin S[11]等.此外, 很多抗菌肽在溶液中是单体, 与生物膜相结合时形成两亲的二聚体, 如 Pexiganan(MSI-78)[12],PG-1[12]和 Sushi 3[13]等. 对于这些抗菌肽而言, 二聚体是其活性构象, 而二聚体也可视为分子中含有2 个活性序列. 大部分抗菌肽具有两亲性结构, 双活性序列使其两亲性加强, 有助于生物活性的表现.因此, 具有双活性序列的多肽可能具有更强的生物活性. 本文设计了含有双活性序列的抗菌肽, 研究双活性序列是否有助于提高抗菌肽的活性. 鉴于多肽的化学合成成本, 具备抗菌活性的短肽具有大批量生产的潜力, 因此本文选取抗菌肽数据库(http: / / aps. unmc. edu / AP / main. php)中具有较短序列的多肽 Ac-RRWWRF-NH2(Combi-1) 和 Ac-FRWWHR-NH2(Combi-2)作为活性序列. 这 2 条多肽均为不对称序列, 为加强多肽的两亲性, 需将 Combi-1 和 Combi-2 的序列颠倒, 逆序的抗菌肽是否仍有活性尚不清楚, 因此本文考察了逆序的 Combi-1 和 Combi-2 的活性. 将 Combi-1 和 Combi-2 及逆序的 Combi-1 和Combi-2 作为活性序列, 参照 V4 的结构[9] 设计出具有双活性序列的多肽, 测试了其杀菌活性、 毒性、溶血性及与模拟生物膜的相互作用, 并运用计算模拟的方法计算了所设计的多肽与细菌的细胞膜中一种重要的磷脂———磷脂酰甘油的结合能. 二硫键环化有助于稳定多肽的结构, 因此本文还设计了具有单个二硫键的环状多肽并考察其杀菌活性, 为抗菌肽的设计提供了依据.
1 实验部分
1. 2. 1 杀菌实验 挑取适量菌种在固体 Luria-Bertani(LB) 培养基中划线, 在培养箱中于 37 益过夜培养. 挑取适量处于对数生长期的细菌于生理盐水中, 配制浊度为 0郾 5 ~ 1 麦氏浊度的菌悬液, 此时细菌菌落数约为 1X10^8 CFU/ mL, 使用时稀释至 1X10^6 CFU/ mL. 配制浓度为 2 mg / mL 的多肽溶液. 采用微量肉汤二倍稀释法测定合成多肽对各细菌的最小抑菌浓度(MIC). 同时进行溶剂、 只加菌液不加多肽的阴性对照和加入多粘菌素 B 的阳性对照, 每个多肽平行进行 3 次. 置于 37 益恒温箱中培养 12 h, 观察孔内溶液的混浊情况, 96 孔板同排中肉眼所见澄清孔所对应的最小浓度即为该多肽的 MIC 值.
1. 2. 2 毒性实验 用含 10% (体积分数)胎牛血清的 RPMI 1640(含 100 U/ mL 青霉素和 100 U/ mL 链霉素)培养基常规培养 BEAS-2B 细胞. 采用对数生长期的 BEAS-2B 细胞, 用含 10% 胎牛血清的 RPMI1640 培养液调节细胞浓度为 5X10^4 Cells/ mL, 接种到 96 孔板. 培养 12 h 后, 加入不同浓度的多肽(终浓度分别为 2.5, 5, 10, 20, 40, 80, 160 和 320 ug / mL), 每种多肽浓度设 4 个复孔, 并设不加细胞液的调零孔和只加细胞液、 不加肽液的空白对照孔. 采用 MTT 法测定细胞毒性, 于 490 nm 波长下测定光密度值.
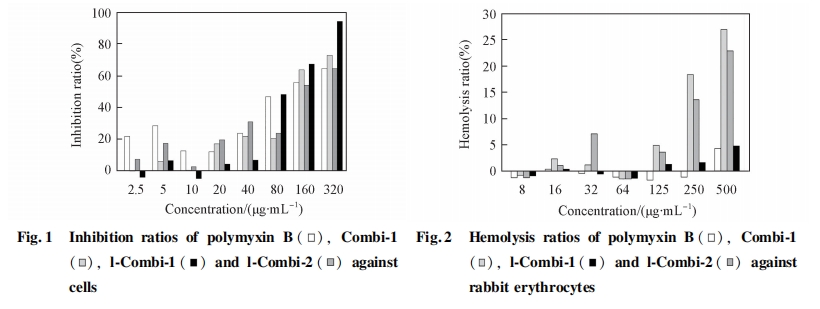
1. 2. 3 溶血性实验 分别称取各多肽, 用0.9% (质量分数)生理盐水溶解, 浓度为1000 ug / mL, 依次二倍稀释加入到 96 孔板中, 每孔 50 uL, 每个样品平行 3 次(终浓度分别 500, 250, 125, 64, 32, 16 和8 ug / mL). 抽取健康兔子的新鲜血液, 加入到含有 1 g / L 肝素钠的离心管中, 以 1000 r/ min 转速离心5 min, 弃去上清液, 分离得红细胞. 再用 0.9% 生理盐水洗涤 2 次, 重复离心操作, 弃去上清液, 得到压积红细胞. 取 2 滴压积红细胞加入 4 mL 生理盐水即得 2% (体积分数)红细胞悬液. 取 2% 红细胞悬液 50 uL, 依次加入到上述 96 孔板各孔中. 用含 1% 红细胞的生理盐水和蒸馏水分别作为空白阴性对照和 100% 溶血阳性对照. 于 37 度下摇床振荡孵化 4 h. 待红细胞沉淀, 吸取 40 uL 上清液加入到另一个干净的 96 孔板中, 采用酶标仪在 540 nm 波长下测定吸光度.
1. 2. 4 多肽和磷脂的相互作用 采用三电极体系研究多肽与磷脂的相互作用: 膜修饰玻碳电极为工作电极, 饱和甘汞电极为参比电极, 铂电极为对电极. 电解液为 1 mmol / L 的 K3Fe(CN)6/ K4Fe(CN)6溶液(包含 0.1 mol / L KCl). 将玻碳电极在三氧化二铝粉末中抛光后, 依次在硝酸(体积比 1 :1)、无水乙醇和二次水中超声清洗 1 min, 用氮气吹干. 配制 4 mg / mL DMPC 成膜液(氯仿溶液) 及 4 mg / mLDMPG 成膜液[V(甲醇) : V(氯仿)= 1:3]. 将 5 uL DMPC 或 DMPG 成膜液滴涂在玻碳电极表面, 晾干后在 0.1 mol / L KCl 溶液中水化 30 min, 制得磷脂双层膜修饰电极. 将该修饰电极在电解液中进行循环伏安测定, 扫速为 50 mv / s. 然后将电极浸泡在一系列浓度的多肽溶液中 30 min, 再在电解液中进行循环伏安测定. 通过 2 次测定的氧化峰电流差来衡量多肽与磷脂双层膜的相互作用.
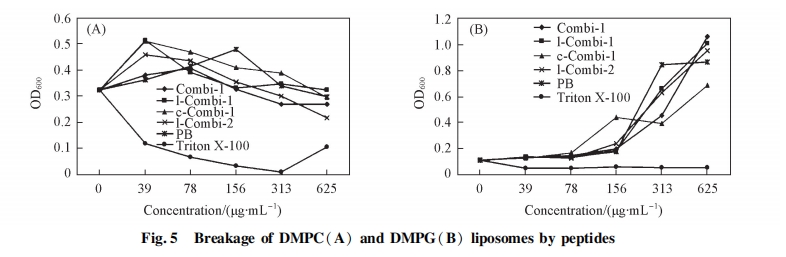
参照文献[14]方法制备脂质体. 将 100 uL 1 mg / mL 的多肽溶液加入 96 孔板中, 依次二倍稀释,每孔溶液体积 50 uL. 每孔加入 30 uL 2 mg / mL 的脂质体, 使多肽最终浓度依次为 625, 313, 156, 78和 39 ug / mL. 室温下孵育 20 min, 用酶标仪于 600 nm 波长下测定光密度值(OD600 ). 以加入 50 uL 的PBS 缓冲液为阴性对照, 加入 50 uL 10% 的 Trion X-100 为阳性对照. 每个多肽平行进行 3 次.

式中, E 为优化后各组分的单点能. 计算时尽量考虑不同的结合模式, 从而使多肽与 DMPG 达到最优结合.
2 结果与讨论
目前, 新抗菌肽的发现主要依赖于对天然抗菌肽及合成产物的大规模筛选, 组合化学对于先导化合物的发现具有重要作用. Combi-1 和 Combi-2 是采用组合化学方法经过大规模筛选得到的抗菌肽, 对多种细菌及酵母菌具有广谱杀菌活性, 而对哺乳动物细胞及红细胞无毒或具有较小毒性. Combi-1 对多种细菌的杀菌活性相当或优于天然抗菌肽(IC50 = 5 ~ 39 ug / mL)[18]. Combi-1 和 Combi-2 均含有 6 个氨基酸残基, 肽链长度较短, 但却表现出较好的杀菌活性及较低的毒性, 因此具有研究意义. 本文选取 Combi-1 和 Combi-2 作为一个活性序列, 参照 V4 抗菌肽的设计, 采用 GSG 将2 个活性序列连接形成含有双活性序列的线性多肽. Combi-1 和 Combi-2 均为不对称序列, 为使线性多肽从结构上两亲性更加显著, 采用逆序的多肽 Ac-FRWWRR-NH2(r-Combi-1) 和 Ac-RHWWRF-NH2(r-Combi-2)和相应的正序多肽相结合设计形成线性多肽 Ac-RRWWRFGSGFRWWRR-NH2(l-Combi-1) 和 Ac-FRWWHRGSGRHW-WRF-NH2(l-Combi-2). 为进一步固定多肽的构象, 使疏水面更疏水, 亲水面更亲水, 采用分子内二硫键环化线性多肽, 形成环状的含有双活性序列的多肽 Ac-CRRWWRFGSGFRWWRRC-NH2(c-Combi-1)和 Ac-CFRWWHRGSGRHWWRFC-NH2(c-Combi-2).
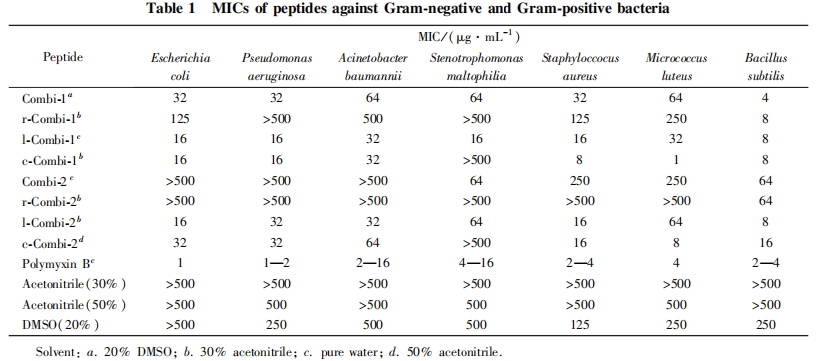
选取上述多肽中杀菌效果较好的 Combi-1, l-Combi-1 和 l-Combi-2 进行细胞毒性实验, 结果见图 1.多肽类抗菌素阳性对照多粘菌素 B 虽具有较强的杀菌活性(表 1), 但会引起部分正常细胞的死亡. 特别是浓度>80 mg / mL 时, 多粘菌素 B 可造成较高的细胞死亡率. Combi-1 的细胞毒性较小, 在浓度小于等于80mg / mL 时, 对细胞的抑制率均不超过 22% , 低浓度时毒性更低. l-Combi-1 在浓度小于等于40 mg / mL 时对细胞的抑制率很低, 但浓度>80 mg / mL 时, 细胞毒性急剧升高. l-Combi-2 在低浓度时也有一定的细胞抑制作用(浓度小于等于80 mg / mL), 高浓度时毒性较大. 以上结果说明, Combi-1 和 l-Combi-1 在较低浓度下具有较高的杀菌活性且细胞毒性较低.
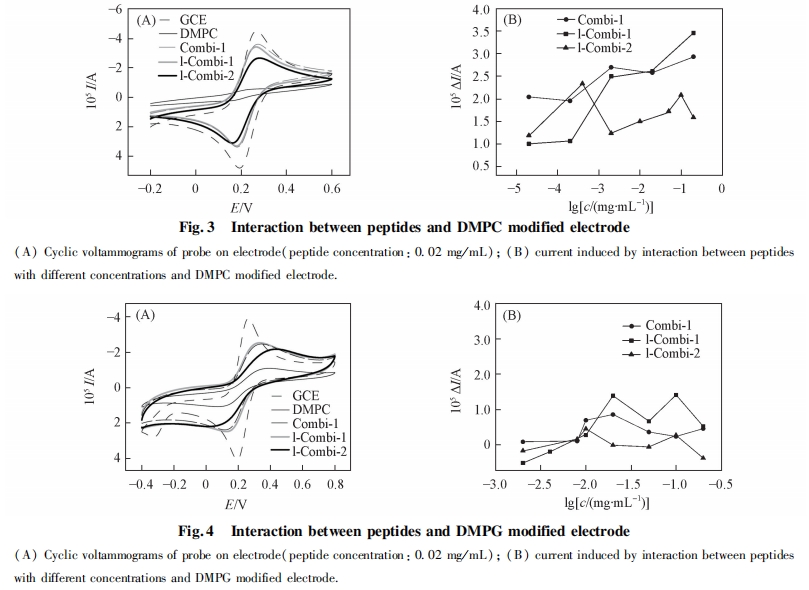
2. 4. 1 多肽与磷脂双层膜的相互作用 固体支撑的磷脂双层膜稳定性好, 作为一种生物模拟膜已被广泛地应用于抗菌肽与生物膜的相互作用研究中[19 ~ 21]. 本文采用此膜模拟生物膜研究多肽是否能增加生物膜的通透性. 将 DMPC 或 DMPG 修饰于电极上, 并置于电解液中测试. 磷脂具有电绝缘性, 因此可阻碍电解液中的探针 K3Fe(CN)6/ K4Fe(CN)6到达电极表面. 与裸玻碳电极相比, 探针的氧化还原电流较低. 当磷脂双层膜电极被置于多肽溶液中, 如果多肽与磷脂发生相互作用, 使磷脂双层膜产生孔洞或者膜发生瓦解, 磷脂双层膜通透性增加, 探针可顺利到达电极表面, 从而产生较强的循环伏安电流, 可通过电流的变化来评价多肽与磷脂的作用程度. 图 3(A)为探针 K3Fe(CN)6/ K4Fe(CN)6在裸电极及 DMPC 修饰电极上的循环伏安曲线. 探针在裸玻碳电极上的电流响应较高. 当电极表面修饰有 DMPC 双层膜时, 循环伏安电流急剧降低, 说明电极表面修饰有磷脂双层膜, 阻碍了电子的转移.将该 DMPC 修饰电极浸入到多肽溶液中 30 min 后, 置于电解液中测试, 发现探针的循环伏安电流重新升高, 说明电极表面的 DMPC 双层膜已有破损, 或者形成孔洞, 或者多肽使磷脂膜发生瓦解. Combi-1,l-Combi-1 和 lCombi-2 对 DMPC 双层膜的破坏作用见图3(B). 随着 Combi-1 和 l-Combi-1 浓度增加, 循环伏安电流增大, 说明提高多肽浓度可提高对磷脂膜的破坏作用. l-Combi-2 在实验浓度范围内对DMPC 的破坏作用随浓度变化不大. 磷脂酰胆碱是哺乳动物细胞膜的重要组分, 多肽对 DMPC 膜的破坏表明多肽可能对正常哺乳动物细胞膜具有一定的破坏作用. 多肽与细菌细胞膜的重要成分 DMPG 之间的相互作用见图 4. 与 DMPC 相比, 多肽对 DMPG 的破坏作用明显降低(图中循环伏安电流的增大主要来自于溶剂对 DMPG 的破坏作用). 在实验浓度范围内, 循环伏安电流基本上围绕零点波动(扣除溶剂的影响后), 表明多肽不能使细菌细胞膜产生孔洞或者瓦解, 多肽的杀菌作用并非源于对细菌细胞膜的破坏作用. Rezansoff 等[16]报道, Combi-1 和 Combi-2 不能造成含 PG 的脂质体产生孔洞, 但却能穿透大肠杆菌和金黄色葡萄球菌的细胞膜并聚集到细胞质中, 推测该类多肽的杀菌作用并非来自于对细菌细胞膜的破坏, 其作用靶点可能位于细胞内部, 此结果和本文所得结果一致.
3 结 论
设计合成了具有 2 个活性序列的线性和环状多肽及具有单个活性序列的短链多肽, 研究了它们的杀菌活性、 对正常哺乳动物细胞的毒性和溶血性及与磷脂之间的相互作用, 并采用计算模拟的方法计算了多肽与细菌细胞膜中重要成分磷脂酰甘油(DMPG)的结合能, 从理论上解释了其活性. 结果表明,含 2 个活性序列的线性和环状多肽比含单个活性序列的短链肽具有较高的杀菌活性, 活性提高幅度视不同的序列而异. 经过计算模拟, 多肽的杀菌活性与多肽-磷脂的结合能显示出较高的相关性. 线性肽和环状肽与 DMPG 的结合能高于短链肽. 计算模拟的方法为研究抗菌肽的杀菌活性从理论上提供了一定的依据. 线性多肽具有较高的杀菌活性, 生产成本较低, 且对正常哺乳动物细胞的毒性和溶血性均较低, 因此具有进一步的研究价值和潜在的应用价值. 采用固体支撑的磷脂双层膜及脂质体模拟生物膜, 对多肽的作用机理进行了初步研究. 结果表明, 多肽 Combi-1, l-Combi-1 和 l-Combi-2 可以使DMPC 膜产生孔洞而使细胞膜通透性增加. 而对于 DMPG 膜, 多肽并未在 DMPG 膜上产生明显孔洞,而是引起了磷脂的聚集, 因此细菌细胞膜可能不是该类多肽杀菌的主要作用靶点.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。