
摘要:芳基吡咯类小分子化合物NB-2衍生物(Noc或Npc)与衍生于C34中的靶标特异性多肽P26所形成的缀合物具有低纳摩尔水平的融合抑制活性. 本文通过不同长度或不同柔性的连接臂将Noc或Npc与衍生于C34的靶标特异性多肽P27缀合, 探讨了C34中a位残基I635和连接臂对缀合物活性的影响. 人体免疫缺陷病毒1型(HIV-1)Env介导的细胞-细胞融合实验结果表明, 多肽与小分子之间产生了强的协同作用.
人体免疫缺陷病毒1型(HIV-1)包膜糖蛋白中的跨膜亚基gp41是介导病毒与宿主细胞膜融合的功能性蛋白质. 在HIV-1感染宿主细胞的初始阶段, gp41胞外域的2个功能区, 即C末端重复序列(C-terminal heptad repeat, CHR)和N末端重复序列(N-terminal heptad repeat, NHR), 发生相互作用并形成一种热力学稳定的六股螺旋束(Six-helical bundle, 6-HB)[1,2] , 此过程是由疏水效应主导的熵与焓的动态平衡过程(ΔG=ΔH-TΔS)[3,4]; 之后病毒包膜和宿主细胞膜接近并最终融合. HIV-1融合抑制剂通过阻止上述内源性6-HB的形成来阻断膜融合的过程[5,6].
T20和C34是衍生于gp41 CHR的融合抑制多肽[7,8], 能够竞争性地与gp41 NHR所形成的螺旋三聚体(N-trimer)结合, 抑制内源性6-HB的形成. 其中, T20已于2003年由美国食品和药品管理局(FDA)批准上市[9]. C34虽然具有比T20更高的抗病毒活性, 但因其水溶性不佳, 故未能应用于临床, 仅作为先导结构用于结构修饰[10,11]. 在C34的N端含有可与gp41 N-trimer表面疏水性口袋相互作用的3个关键性氨基酸残基(Trp628, Trp631和Ile635)[12,13], 即口袋结合区(Pocket binding domain, PBD).
研究[14]结果表明, N-trimer表面的疏水性口袋在gp41介导的膜融合过程以及稳定gp41所形成的6-HB方面起到了重要作用. 同时, 这个疏水性的口袋也成为小分子类融合抑制剂的作用靶点. Jiang等[15]报道了2个芳基吡咯类小分子化合物NB-2和NB-64, 它们抑制HIV-1复制的EC50值分别为1.04和2.21 μmol/L. 通过诸如酶联免疫吸附测定法(ELISA)和圆二色谱分析(CD)等分子生物学或生物物理学方法证明, NB-2和NB-64可作用于N-trimer表面的疏水性口袋.
前文[16]研究表明, C肽类融合抑制剂的序列内可以细分为结构部分和功能部分, 每一部分的侧重点不同. 结构部分主要用于维持药物的高级结构和分子尺寸; 功能部分则含有可与靶标特异性结合的氨基酸残基[17,18]. 将作用于N-trimer表面疏水性口袋的NB-2衍生物Noc [2-氧乙酸基-4-(2,5-二甲基吡咯基)-苯甲酸]或Npc[1-(4-羧基-3-羟苯基)-2,5-二甲基吡咯-3-羧酸]与衍生于C34中结构部分的多肽P26(序列为NNYTSLIHSLIEESQNQQEKNEQELL)缀合得到的多肽-小分子缀合物具有低纳摩尔水平的细胞融合活性[19]. C34/N36形成的6-HB的晶体结构分析表明, 在N-trimer中, 3个NHR通过a和d位残基作用形成螺旋三聚体; 在其表面, e和g位残基形成疏水性沟槽. C34中的a和d位残基分别与N-trimer中的e和g位残基相互作用, 形成6-HB(见图1).
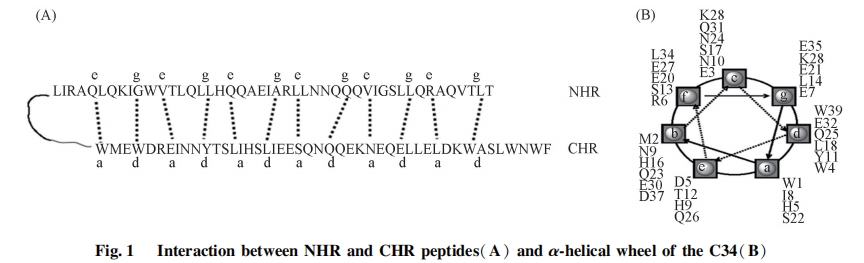
本文将衍生于C34的P27多肽(序列为INNYTSLIHSLIEESQNQQEKNEQELL)与Noc或Npc缀合. 与P26多肽相比, P27多肽保留了C34中的a位残基I635. 期望通过I635的保留使其所在螺旋得以保持, 并且I635可与疏水性口袋发生相互作用, 上述因素也许有利于提高缀合物的活性. 同时, 在P27多肽与小分子之间引入不同长度和柔性的连接臂[20], 探讨了连接臂对缀合物活性的影响.
1 实验部分
1.1 试剂与仪器
Rink-amide树脂(载量0.44 mmol/g, 天津南开和成科技有限公司); 各种保护氨基酸[Fmoc-βAla-OH(N-芴甲氧羰基-β-丙氨酸)、 Fmoc-L-Asn(Trt)-OH(N-芴甲氧羰基-N'-三苯甲基-L-天冬酰胺)、 Fmoc-L-Gln(Trt)-OH(N-芴甲氧羰基-N'-三苯甲基-L-谷氨酰胺)、 Fmoc-L-Glu(OtBu)-OH(N-芴甲氧羰基-O-叔丁基-L-谷氨酸)、 Fmoc-L-His(Trt)-OH(N-芴甲氧羰基-N'-三苯甲基-L-组氨酸)、 Fmoc-L-Ile-OH(N-芴甲氧羰基-L-异亮氨酸)、 Fmoc-L-Leu-OH(N-芴甲氧羰基-L-亮氨酸)、 Fmoc-L-Lys(Boc)-OH(N-α-芴甲氧羰基-N'-叔丁氧羰基-L-赖氨酸)、 Fmoc-L-Ser(t-Bu)-OH(N-芴甲氧羰基-O-叔丁基-L-丝氨酸)、 Fmoc-L-Thr(Trt)-OH(N-芴甲氧羰基-O-三苯甲基-L-苏氨酸)、 Fmoc-L-Tyr(t-Bu)-OH(N-芴甲氧羰基-O-叔丁基-L-酪氨酸)]及Fmoc-6-Aminocaproic Acid(N-芴甲氧羰基-6-氨基己酸); Fmoc-8-amino-3,6-dioxaoctanoic acid(N-芴甲氧羰基-8-氨基-3,6-二氧杂辛酸)购自浙江嘉兴博美生物有限公司; 5-氨基水杨酸购自英国Alfa Aesar公司; 其它试剂均为分析纯.
CEM LibertyTM微波多肽合成仪(美国CEM公司); Shimadzu 10A 型高效液相色谱仪(日本岛津株式会社); Venusil ASB C8液相色谱柱(250 mm×4.6 mm, 5 μm, 天津博纳艾杰尔公司); Prep LC4000高压制备液相色谱仪(美国Waters公司); X-Bridge C8制备色谱柱(195 μm×250 μm, 5 μm, 美国Waters 公司); Free-Zone 18 L型冷冻干燥机(美国Labconco公司); REFLEX Ⅲ型 MALDI-TOF 质谱仪(德国Bruker公司).
1.2 实验过程
1.2.1 小分子中间体的合成纯化 Noc和Npc的合成参考文献[19]方法. Noc: 红色固体, 收率36%. LC-MS(C15H15NO5的MS理论值), m/z: 290.1(M+H, 100)(289). Npc: 白色固体, 收率21%. LC-MS(C14H13NO5的MS理论值), m/z: 276.1(M+H, 100)(275).
1.2.2 多肽及缀合物的合成与分离纯化 参考文献[19]方法进行多肽及缀合物的合成与分离纯化.
1.2.3 HIV-1 Env介导的细胞-细胞融合实验 将含有荧光素酶报告基因的TZM-b1细胞(50×104 cell/mL)与HL2/3细胞(100×104 cell/mL)及稀释后的样品共同孵育24 h后, 裂解细胞, 采用Lucife-rase Assay System(美国Promega公司)进行荧光素酶活性检测, 得到待测样品在不同浓度下的细胞融合抑制百分率. 以Origin 7.5软件(美国Origin Lab)处理数据, 对剂量-融合抑制百分率曲线进行S形拟合, 得到测试样品的IC50值, 结果如表1所示.

2 结果与讨论
2.1 小分子与多肽的协同效应
如表1所示, C34的细胞融合活性为1.91 nmol/L, 而衍生于C34的靶标特异性多肽P27的融合抑制活性比C34降低了约700倍. 该结果表明C34中的PBD在抑制HIV-1 Env介导的细胞-细胞融合过程中发挥了重要作用. 小分子Noc通过连接臂共价键合P27得到的缀合物的细胞融合活性为10.38~17.09 nmol/L, 比单独的P27提高了80~130倍; Npc通过连接臂共价键合P27得到的缀合物的细胞融合活性为314.5~649.8 nmol/L, 比P27提高了2~4倍. 上述结果表明, 芳基吡咯类小分子化合物与P27多肽之间产生了协同作用, 与前文[19]报道一致. 其中, Noc-βAla-P27的细胞融合活性比Noc-βAla-P26[文献值[19]: IC50=(22.5±3.18) nmol/L]提高了2.2倍, 表明引入a位残基I635确实可以提高缀合物的细胞融合活性. 但是, Npc-βAla-P27的细胞融合活性比Npc-βAla-P26降低了2.4倍. 上述结果表明, 缀合小分子的类型会对I635的作用产生影响.
2.2 连接臂对协同效应的影响
选用不同长度及柔性的连接臂连接小分子和多肽, 探讨了连接臂的长度和柔性对于缀合物活性的影响. 其中, βAla和Aca均为脂肪烃类, 前者的长度小于后者; PEG3为脂肪醚类, 长度上和Aca相近, 但比Aca具有更好的柔性. 通过比较Noc-βAla-P27, Noc-Aca-P27与Noc-PEG3-P27之间或Npc-βAla-P27, Npc-Aca-P27与Npc-PEG3-P27之间的细胞融合活性结果发现, 连接臂的长度和柔性对缀合物的活性无显著影响.
综上所述, 小分子Noc或Npc与衍生于C34的靶标特异性多肽P27可形成缀合物, 缀合物中小分子部分和多肽部分分别作用于gp41 N-trimer的不同区域, 二者起到了协同作用, 细胞-细胞膜融合活性达到了低纳摩尔水平. 不同类型的小分子在一定程度上影响了缀合物的活性. 连接臂的长度和柔性的不同对缀合物的活性无显著影响. 本文缀合物的设计与合成进一步的继承和拓展了小分子-肽缀合物融合抑制剂.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。