
摘要:刺激响应聚多肽是一类能够在外界刺激下发生物理形态或化学组成变化的高分子材料,本文介绍了聚多肽的合成方法,并从氧化还原、温度、A5、光照这四个环境因素出发,总结了近年来新发展的具有刺激响应性的聚多肽类材料。同时也对这些材料在药物运输、生物技术方面的应用前景进行了简要归纳。
多肽是a-氨基酸以肽键为主链连接起来的寡聚物或者大分子,多肽的一个显著特性在于它们具有丰富的多层次结构,多肽侧链的R取代基序列构成了多肽的一级结构,通过主链的氢键作用,多肽还可以形成、螺旋、折叠等二级结构;进一步地,带有不同侧链官能团的多肽还可以通过二硫键等动态共价键及多种非共价相互作用,如氢键、范德华力、π-π 堆积等使多肽发生折叠形成精确的三级结 构[1] 。由于多肽类材料的结构特性和仿生性质 , 它们在生物医药 、生物技术 、组织工程 、药物运输等领域 具有广泛的应用前景 , 人们对其的研究兴趣日益提高[2] 。
多肽材料的制备主要通过多肽固相合成法和N-羧基内酸酐(NCA)的开环聚合来实现。自从1963年Merrifield第一次报道多肽固相合成法以来[3],经过数十年的发展,多肽固相合成法已经能够大规模 生产序列明确的短肽材料。其方法是将肽链端基的氨基酸负载在树脂上,再依次完成随后不同氨基酸的 缩合-脱保护-缩合步骤,重复数次完成需要的多肽序列后再将多肽从树脂上整体脱除,侧链保护基也一 并脱除,经过高效液相色谱提纯即可得到纯品多肽。然而这一方法虽被人们广泛采用,其缺点也是显而 易见的:由于固相合成法是通过逐步反应的方式实现肽链的增长,长肽的合成费时费力,代价不菲。而随 着肽链长度的增加,即使对于单步反应产率超过99%的缩合反应,其最终产率也会严重下降,目前人们 通过固相合成法得到的最长多肽仅为50肽[4] 。
N-羧基内酸酐(NCA)的开环聚合能够在短时间里得到高分子量的多肽,明显弥补了固相合成法的不足。同时,通过对侧链R基不同反应基团的引入,可以方便地得到功能化的聚多肽材料。最早的NCA开环聚合由Hermann Leuchs在1906年报道[5] 。之后在1921年,Curtius[6] 、wessely等[7]用水、醇和一级胺来引发NCA开环聚合,并第一次制备了高分子量的聚多肽材料。随后人们尝试用不同的亲核试剂和有机碱引发NCA聚合,最常见的是胺类化合物和金属醇盐[8] 。由于在这样的聚合中存在许多副反应, 聚合的控制并不好。近年来,随着NCA开环聚合的不断发展,新型可控NCA聚合方法被相继报道。第一个实现活性NCA开环聚合的是Deming,他使用零价镍和钴的共催化体系(例如(PMe3)4Co和bpyNi(COD),bpy=2,2-联吡啶,COD=1,5-环辛二烯)得到了一系列具有很好的分子量控制和窄分子量分布的聚合物[9~12] 。2007年,Cheng和Lu发展出一种有机硅调控的NCA开环聚合体系[13] (例如HMDS,HMDS=六甲基二硅氮烷)。在这个体系中,N-三甲基硅基胺对NCA环亲和进攻后,三甲基硅基转移到链末端的二氧化碳基团处形成三甲基硅基氨基甲酸酯的结构,以此来稳定聚合物链的末端,加速链增长,并最终实现活性聚合。2011年,Ling等将稀土金属复合物引入到NCA开环聚合中(例如Re(OiPr)3,iPr=异丙基),并制备了分子量可控且分子量分布窄的随机共聚物和嵌段共聚物,实现了NCA的可控聚合[14] 。
NCA的可控聚合极大地促进了聚多肽的发展,其中一类具有广阔应用前景的材料是刺激响应性聚多肽[15~19] 。刺激响应性聚多肽是外界环境的刺激下(例如光、温度、PH等),能够发生物理形态或者化学组成改变的聚多肽材料。与其它刺激响应性聚合物相比,聚多肽具有良好的生物相容性和稳定的二级结构,这就更使得它在药物运输、组织工程等领域具有得天独厚的优势。本综述将从氧化还原、温度、PH和光这四个角度对近几年发展出的新型刺激响应聚多肽材料进行概述。
1 氧化还原响应聚多肽
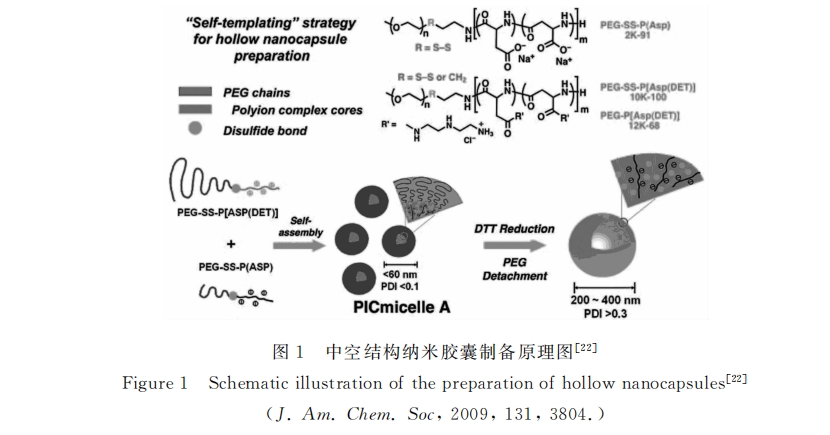

2013年 , Chen等[27] 同样利用二硫键赋予聚合物氧化还原响应性并最终实现可控的药物释放 。其工 作是利用叠氮和炔基的“Click”反应将聚谷氨酸苄酯(PBLG)和聚葡萄糖结合 , 随后进行药物的包裹 , 并 通过二硫键实现聚葡萄糖链间的交联 。最终得到的包裹药物后的胶束能够在细胞内谷胱甘肽的刺激下 完成药物的释放 , 从而实现特异性的给药治疗。
最近 , Cheng等[28] 通过 NCA开环聚合制备了侧链含有巯基的正电荷螺旋聚多肽 , 它可以通过静电 相互作用力与带负电荷的 siRNA形成纳米粒子 , 并进一步通过二硫键的交联得到尺寸更小且更为稳定 的纳米粒子 。这样的纳米粒子在癌细胞内谷胱甘肽的作用下可以实现高效的 siRNA 释放 , 并且依然保 持螺旋聚多肽的二级结构 , 从而实现 siRNA 的高效运输及可控释放 。
2014 年 , Dong等[29] 利用 mPEG-NH2 制备了侧链带有邻硝基苄基的聚半胱氨酸 , 这样的嵌段共聚物 在水中自组装成囊泡结构 。在 365nm紫外光照射下邻硝基苄基脱除 , 得到的新聚合物自组装成胶束结 构 。而在 0. 1 M 过氧化氢作用下 , 裸露出的巯基通过二硫键交联 , 胶束的尺寸变小;在 DTT 的还原作用 下 , 二硫键被切断 , 胶束又会变回原来的尺寸 。通过这样的方式 , Dong等巧妙地构建了同时具有光 、可逆 氧化还原响应性的聚多肽 。随后的载药实验也表明这种氧化还原响应性能够实现可控的药物释放 。
2 温度响应聚多肽
2011 年 , Li等报道了一种新型的寡聚乙二醇作为侧链的聚谷氨酸 , 其溶解性 、二级结构以及低临界 溶解温度都随侧链 OEG 的长度而改变[33] 。通过调节单体的手性或者将不同 OEG 侧链长度的 NCA 共 聚都能对 LCST进行调节 。基于这种温度响应性的 NCA单体 , Li等制备了其与 PEG 的共聚物 , 得到的 水凝胶同样具有温度响应性 , 在不同的温度下这种嵌段共聚物能够发生溶胶-凝胶的转换[34] 。随后该课 题组又利用同样的策略在半胱氨酸的巯基上接出 OEG侧链 , 得到的聚多肽同样具有 LCST[35] 。
这种聚多肽能够形成两亲性纳米粒子 , 当温度高于其 LCST 时 , 纳米粒子的药物释放速率会极大地增加 , 从而说明温度响应聚多肽在药物运输方面具有极大的潜在价值 。
另外有很大一部分工作围绕用具有温度响应性的聚合物引发NCA聚合展开。这样一类聚合物大引发剂中最广泛为人们使用的是聚N-异丙基丙烯酰胺(PNIPAM) 的衍生物[37~41] ,其LCST在31℃~37℃,而LCST在10℃~40℃的聚合物在生物应用方面具有更明显的优势[42] 。例如,2008年zhang等用端基含有氨基的PNIPAM引发谷氨酸苄酯NCA(BLG-NCA)和叔丁氧羰基赖氨酸NCA(BLLYs-NCA)的共聚[43] 。脱除保护基后,得到的嵌段共聚物具有良好的水溶性以及随PH变化的LCST。此外,聚多肽通过后修饰的方式接上PNIPAM制备温度响应材料也有报道[44~46] 。
3 PH响应聚多肽
人体内正常生理环境的胞外PH是7.4,而核内体和溶酶体的PH则是4.5~6.5[47] ,这样的差异使得PH响应材料实现胞内药物释放成为可能。另一方面,肿瘤组织胞外环境的PH是5.7,这就使得PH响应材料在癌症治疗中也有广阔的应用前景。近年来,PH响应聚多肽用作药物运输载体成为人们研究的热点之一[48] 。PH为中性时,这些载体保持胶束或囊泡结构,内部包裹特定的药物分子。PH为酸性时,胶束或囊泡的结构瓦解,药物分子释放,从而完成对特定部位的给药。通常来说,PH响应的功能由侧链带氨基或羧基的聚多肽实现,例如聚谷氨酸[49~51] 和聚赖氨酸[52~54] 。它们的溶解性随PH变化。将这样的片段与其它亲水或疏水片段结合,就可以通过改变PH调控材料的自组装行为。
Lecommandoux等[55]利用聚谷氨酸和聚赖氨酸的嵌段共聚物制备了PH响应的囊泡。在近中性PH时(5<PH<9),两嵌段都带电并能很好地溶解在水中。在酸性(PH<4)时,聚谷氨酸段被质子化,形成α-螺旋构型,并使得嵌段共聚物形成一种聚赖氨酸在两侧,聚谷氨酸在中间的囊泡结构;在碱性(PH>10)时情况相反,形成聚赖氨酸在中间而聚谷氨酸在两侧的囊泡结构。
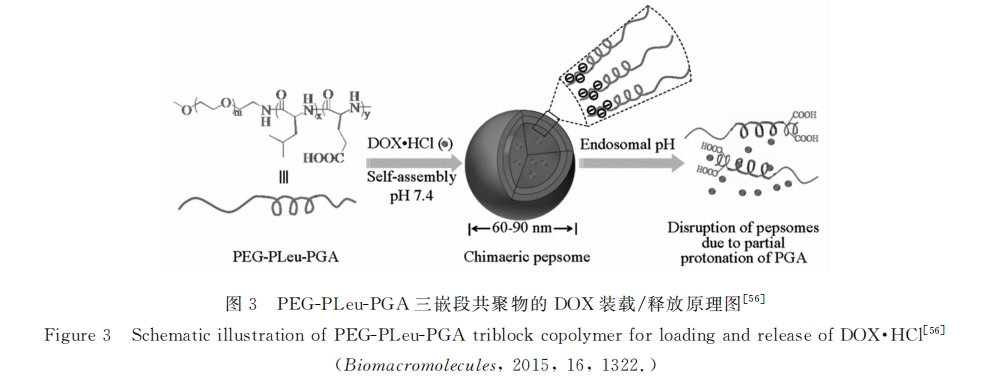
最近,Hammond等[57]利用聚合后修饰的方法制备了一系列PH响应聚多肽。他们先用甲氧基聚乙二醇胺引发炔丙基谷氨酸NCA聚合,得到两嵌段共聚物,再通过“Click”反应在后一段上修饰二异丙基胺、二乙胺等基团。这些三级胺作为侧链的聚多肽都是很强的质子缓冲体系。在包裹药物后(DOX),它们在PH7.0~7.4能以稳定的胶体形式存在,而在PH5.5~6.3则迅速瓦解完成药物的释放。更进一步的是Hammond等还在不同聚合物链中极少数(<0.1%)未反应的炔基上分别修饰了Cy5.5和Cy7两种荧光基团。当聚合物链彼此靠近时,两种荧光基团会通过荧光共振能量转移(FRET)成像,从而使 药物载体的分布变的更为直观。
Bae等[58~ 59] 报道了一系列基于组氨酸的 pH 响应聚多肽并将其应用于 DNA 和药物分子的运载中 。例如 , Bae等[60] 对比研究了侧链接枝聚组氨酸和单个组氨酸的聚赖氨酸(PLL-g-PHis和 PLL-g-mHis), 发现当聚合物侧链的组氨酸成分增加时 , 其运载的 DNA 的基因表达效率明显上升[60] 。
4 光响应聚多肽
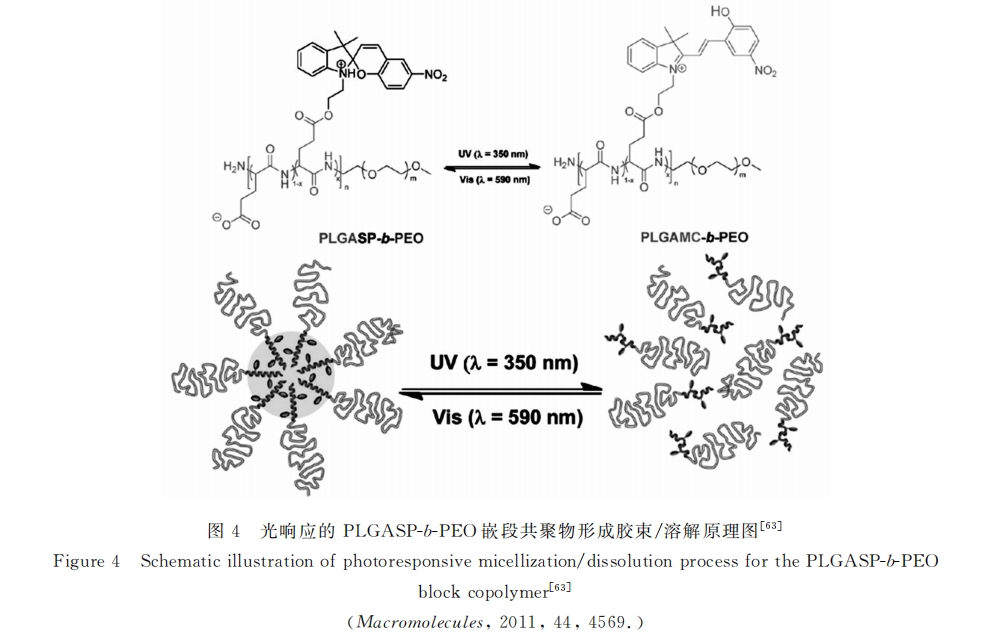
而 Chen等[64] 则通过光信号实现了聚多肽的交联 。他们先制备了 mPEG-PLGA 的嵌段共聚物 , 然 后将肉桂醇与部分聚谷氨酸中的羧基偶联 , 得到的聚合物含有大量羧基因而具有 pH 响应性 。在 254nm 紫外光照射下链间的苯乙烯片段二聚实现交联 , 原本的胶束结构形成纳米凝胶 , 稳定性进一步增加 。随 后的体外实验也表明 , 这种 pH 响应的光交联水凝胶具有可控的载药特性 。
最近 , Cheng等[65] 合成了精巧的光响应螺旋聚多肽 。他们将 3, 4-二甲氧基-2硝基苄基这一光敏基 团引入到聚多肽中 , 得到具有 α-螺旋结构的正电荷聚多肽 。它能与 DNA 紧密结合 , 并在进入细胞后通 过紫外光照射实现光敏基团的裂解 , 从而破坏聚多肽的 α-螺旋构型将 DNA 释放出来 。这种光诱导的聚多肽构型转变能够极大地增强 DNA释放效果 , 从而提高基因传递效率 。
5 总结与展望
正如活性自由基聚合极大地推动了自由基聚合的发展一样,NcA活性聚合方法的出现也将聚多肽材料的发展推上了一个新的平台。自从1997年Deming第一次报道NcA的活性聚合以来,大量的分子量可控、分子量分布窄、端基明确的聚多肽被合成出来。人们对于聚多肽的兴趣日益增厚,各种结构精巧的聚多肽相继见诸于报道。刺激响应聚多肽作为一类生物相容性良好、功能多样化的材料更是广受青睐。在这篇综述里,我们从氧化还原、温度、pH、光这几个方面总结了刺激响应聚多肽最近几年的研究进展,这些精巧的聚合物在药物运输和生物技术等方面广阔的应用前景无疑会使它们从实验室走向工业生产,而这一领域的迅速发展也必将推动整个生物医药行业的进步。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。