
心血管疾病是全球发病率和死亡率的主要原因,为世界带来巨大的健康和经济负担[1,2]. 目前,人工血管作为自体血管的替代物,已被广泛应用于心血管疾病的治疗[3~5]. 然而,植入过程中容易造成内皮损伤及微生物感染,从而导致内膜增生、伤口感染和炎症浸润等并发症的产生,严重影响了人工血管的临床应用[6~8]. 其中,促进人工血管管腔表面内皮层的快速形成能够有效降低内皮损伤带来的风险,而植入过程中的微生物感染则可以通过材料表面抗菌来进行有效预防[9~16]. 因此,研究同时具有促进表面内皮化和抵抗微生物感染的多功能生物材料,对促进人工血管的发展及心血管疾病的治疗至关重要(图1(a)).
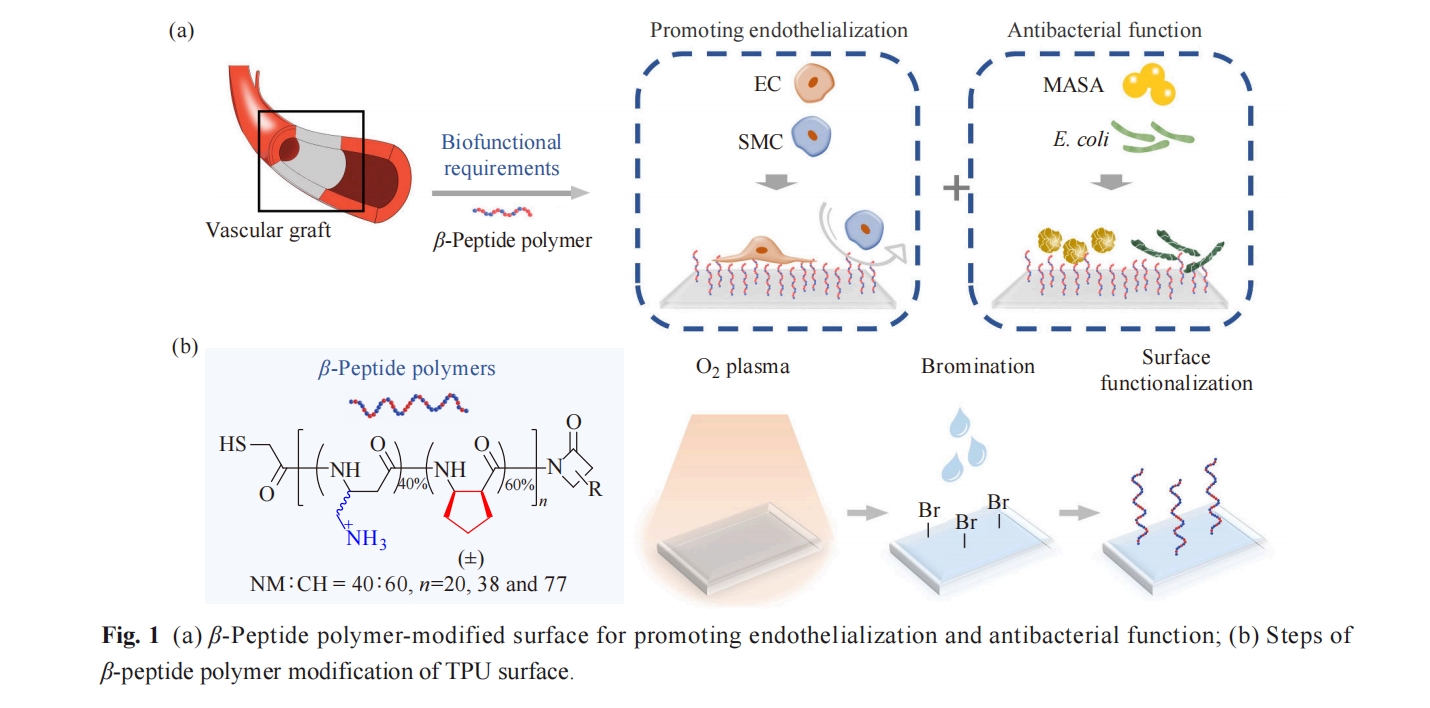
宿主防御肽(HDPs)作为先天免疫系统的重要组成部分,具有广谱的抗菌活性,被广泛应用于抵抗溶液或生物材料表面的微生物的感染[17~19]. 然而,HDPs存在结构不稳定、难以大量制备以及价格昂贵等缺陷,严重限制了其进一步应用[18,20]. 为了克服HDPs的固有缺陷,越来越多的HDPs模拟物被合成并投入到抗菌的研究与应用中[21~24]. 其中,β-多肽聚合物具有优异的抗菌活性和生物相容性,并且稳定性高、易于大量合成且价格低廉,已被广泛应用于溶液及表面抗菌[25~27]. 此外,我们的前期研究表明,β-多肽聚合物NM40CH60具有优异的选择性促进内皮细胞(EC)黏附并抑制平滑肌细胞(SMC)黏附的功能,在促进血管移植物内皮化的方向具有较好的应用前景[28]. 因此,本研究使用具有促内皮化功能的β-多肽聚合物NM40CH60进行表面修饰,并对其表面抗菌活性及抗菌机理进行研究.
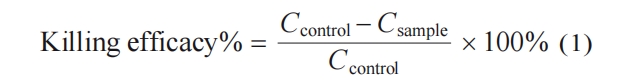
热塑型聚氨酯(TPU)材料具有较高的生物相容性及良好的机械性能,被广泛用于人工血管移植物的研究与应用[29]. 本文合成了不同聚合度的β-多肽聚合物NM40CH60,利用表面等离子体照射和溴代的方式将其接枝于TPU表面,研究其抗菌活性、抗菌机理及细胞选择性黏附功能. 研究发现,β-多肽聚合物NM40CH60修饰的TPU表面对革兰氏阳性菌(MRSA)和革兰氏阴性菌(E. coli)均表现出广谱的高效抗菌活性. 此外,聚合度为38 (DP=38,DP表示聚合度)的β-多肽聚合物NM40CH60修饰的TPU表面具有优异的血液相容性及选择性促进EC黏附的功能. 这些结果表明,β-多肽聚合物NM40CH60修饰的TPU表面能够有效降低人工血管植入过程中面临的感染及内皮损伤的风险,在心血管疾病的治疗领域具有广阔的应用前景.
1 实验部分
N,N-二甲基乙酰胺、双(三甲基硅基)氨基锂、四氢呋喃、石油醚、三氟乙酸、甲基叔丁基醚、甲醇、无水乙醇、甲苯等试剂购于上海泰坦科技股份有限公司,溴仿购于萨恩化学技术(上海)有限公司,Triton X-100购于美国Sigma-Aldrich公司,内皮细胞培养基(ECM)和平滑肌细胞培养基(SMCM)购于美国sciencell公司,细胞活死染色试剂盒购于江苏凯基生物技术股份有限公司.
不同聚合度的β-多肽聚合物NM40CH60按照之前文献报道中的合成步骤进行合成[28].
将TPU基材(1 cm × 1 cm)浸泡于无水乙醇中超声清洗1 h. 随后浸泡于2 vol%的吐温-20溶液中,超声清洗15 min. 吹干后置于等离子体照射机内,控制腔体内氧气流速为0.3~0.4 MPa,照射功率为70 W,照射时长为8 min进行单面照射,获得表面带活性氧基团修饰的TPU表面. 随后将其浸没于溴化试剂溶液(溴仿/甲苯 = 1/10,V/V)中反应6~7 h,甲醇和乙醇交替冲洗,氮气吹干,真空干燥24 h,获得溴代TPU表面(TPU-Br). 最后在TPU-Br表面均匀滴加β-多肽聚合物溶液(80 μL,1 mg/mL). 反应12 h后,将表面使用超纯水和无水乙醇交替冲洗并氮气吹干,加硫代甘油(80 μL,10 mg/mL)溶液反应3~4 h,清洗并吹干后,获得β-多肽聚合物修饰的TPU表面.
测试β-多肽聚合物修饰的TPU表面对革兰氏阳性菌Staphylococcus aureus USA 300 (MRSA)和革兰氏阴性菌Escherichia coli (E. coli JM109)的抗菌性能,使用菌浓为5×105 CFU/mL. 将β-多肽聚合物修饰的TPU片放置于24孔板中,并使用未修饰的TPU表面作为实验对照组. 将每个表面均匀滴加80 µL的菌液,置于37 ℃霉菌培养箱内培养2.5 h. 随后每孔加入1.4 mL磷酸盐缓冲液(PBS)稀释,将孔板超声2 min并混匀震荡5 min,确保细菌从表面脱离. 最后,为了获得每组样品的菌落数,从孔板中取30 µL的细菌悬浮液使用接种环进行涂布,并将培养皿置于37 ℃霉菌培养箱内培养过夜. 培养后对菌落数进行计数,其中β-多肽聚合物修饰的TPU和TPU表面菌落数记为Csample,直接加入菌液的空白对照组记为Ccontrol,表面抗细菌率通过下式计算获得:
TPU-NM40CH60和TPU表面的亲疏水性使用水接触角仪器(JC2000D2,上海中辰数码)进行表征. 使用Thermo Scientific K-Alpha光谱仪检测TPU-NM40CH60和TPU表面的光电子能谱(XPS). 该光谱仪配备有AI Kα (1486.6 eV) X射线源,工作电压为12 kV,真空度为8×10-10 Pa. TPU-NM40CH60的聚合物层厚度使用椭圆偏振仪进行表征,聚合物链的接枝密度通过σ = (hρNA)/Mn公式计算获得,其中h为聚合物链的厚度,ρ为聚合物的密度(假设为1 g/cm3),NA是阿伏伽德罗常数(6.023×1023),Mn是聚合物的数均分子量(Mn = 4460 g/mol).
将TPU-NM40CH60和TPU表面置于24孔板中并加入1.5 mL PBS浸没. 在固定时间点(0.5、1、2、4、6、9、12、15、18和24 h)取出90 µL孔内液体作为表面浸出液,再补充等量PBS于孔板内. 表面浸出液使用荧光胺溶液进行测定(10 μL,3 mg/mL 溶于二甲基亚砜中). 与荧光胺溶液共混后避光孵育15 min,使用酶标仪在Ex 400 nm和Em 470 nm波长下读数. 其中,使用1 mg/mL的聚合物溶液作为阳性对照.
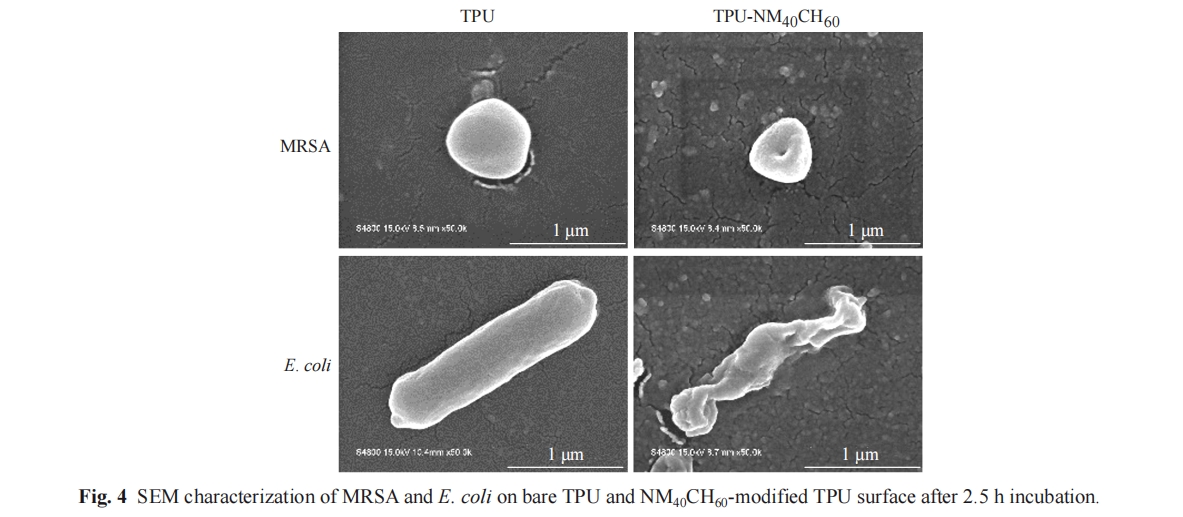
使用场发射扫描显微镜(SEM)观察TPU-NM40CH60表面的杀菌形貌. 在TPU-NM40CH60和TPU表面上滴加80 µL工作浓度为107 CFU/mL的细菌悬浮液,在37 ℃霉菌培养箱内培养2.5 h. 随后,使用4%戊二醛溶液进行固定,并4 ℃过夜. 固定后的表面用PBS轻柔冲洗3次,使用梯度乙醇(30%、50%、70%、80%、90%、95%、100%)进行表面逐步脱水,每次10 min. 最后将样品放在干燥器中干燥处理,喷金后使用SEM进行形貌表征.
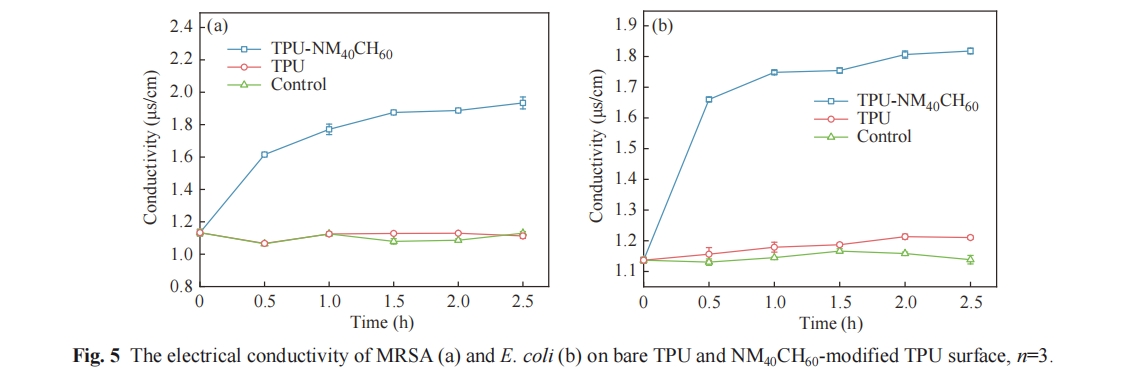
将E. coli和MRSA稀释到5×105 CFU/mL的工作浓度后,取80 µL加入TPU-NM40CH60和TPU表面,并置于37 ℃霉菌培养箱内培养. 培养0.5、1、1.5、2和2.5 h后,吸取表面菌液并加入装有2420 µL超纯水的15 mL的离心管中,并将TPU-NM40CH60和TPU表面同样置于15 mL离心管中,超声3 min后混匀2 min. 随后将TPU-NM40CH60和TPU表面取出,使用导电仪测量溶液的电导率.
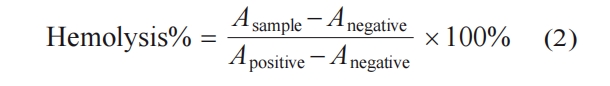
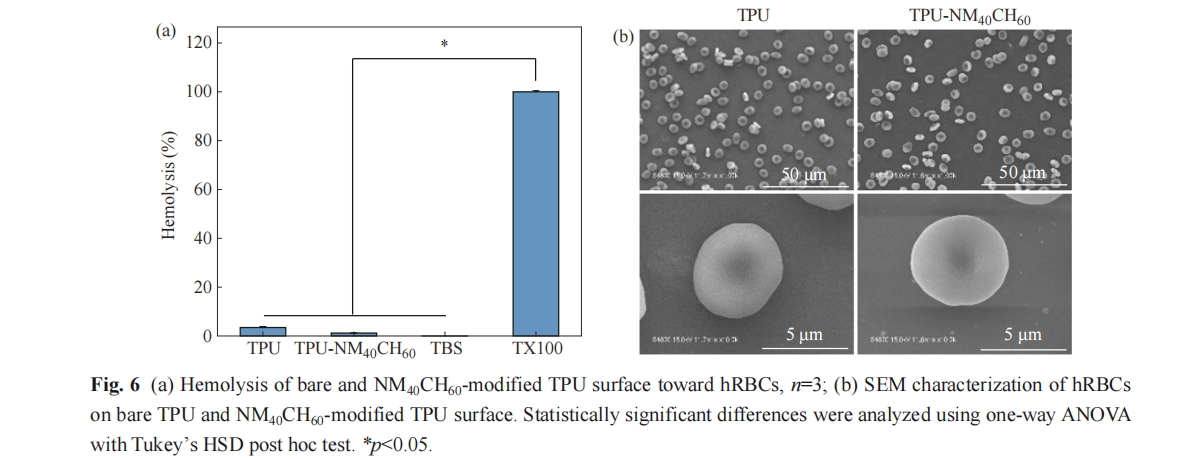
溶血实验后,使用SEM观察表面hRBCs的形貌. 将表面用PBS洗3次,使用2.5%的戊二醛溶液固定,置于4 ℃过夜. 随后,用PBS洗去固定液,并用梯度乙醇(30%、50%、70%、80%、90%、95%、100%)进行表面逐步脱水,每次10 min. 最后将样品放在干燥器中干燥处理后喷金,使用SEM进行hRBCs形貌表征.
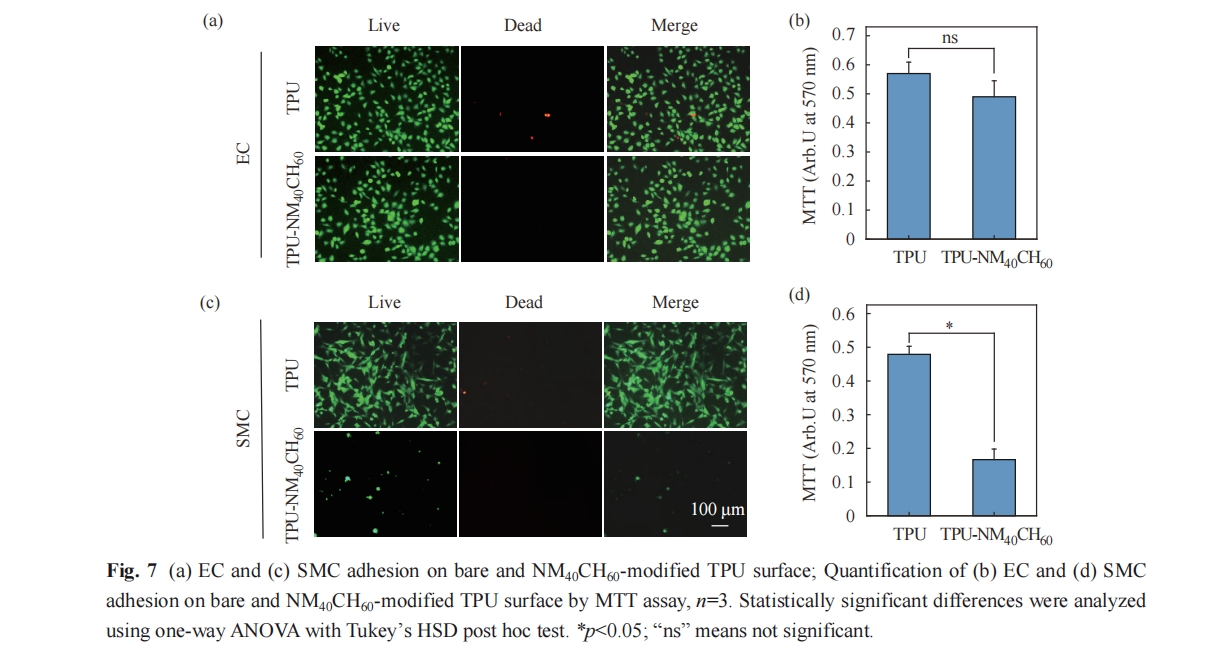
使用原代人脐静脉内皮细胞(HUVEC)和原代人脐动脉平滑肌细胞(HUASMC)进行细胞黏附实验. 其中,HUVEC使用ECM培养基(含5%胎牛血清,1%内皮细胞生长补充物和1%青霉素/链霉素溶液)进行培养,HUASMC使用SMCM培养基(含2%胎牛血清,1%平滑肌细胞生长补充物和1%青霉素/链霉素溶液)进行培养. 细胞在37 ℃含5% CO2的细胞培养箱中培养,当细胞达到80%的汇合后,收集细胞,以每毫升培养基1.2×104个细胞的浓度接种在表面,每个表面100 μL. 培养2 h后,将表面浸没于培养基中,培养24 h. 使用细胞活死染色试剂盒(AM/PI)对细胞进行染色,并置于荧光倒置显微镜下观察并拍照.
细胞在表面黏附的定量实验是将细胞在表面培养24 h后,向培养液中加入10%的MTT溶液,在37 ℃避光孵育4 h. 随后,移除表面的培养基,加入100 μL的二甲基亚砜,轻微晃动以溶解细胞与MTT形成的甲臜晶体. 将溶液后的液体等量转移至新的96孔板中,使用酶标仪读取570 nm下的OD值.
2 结果与讨论
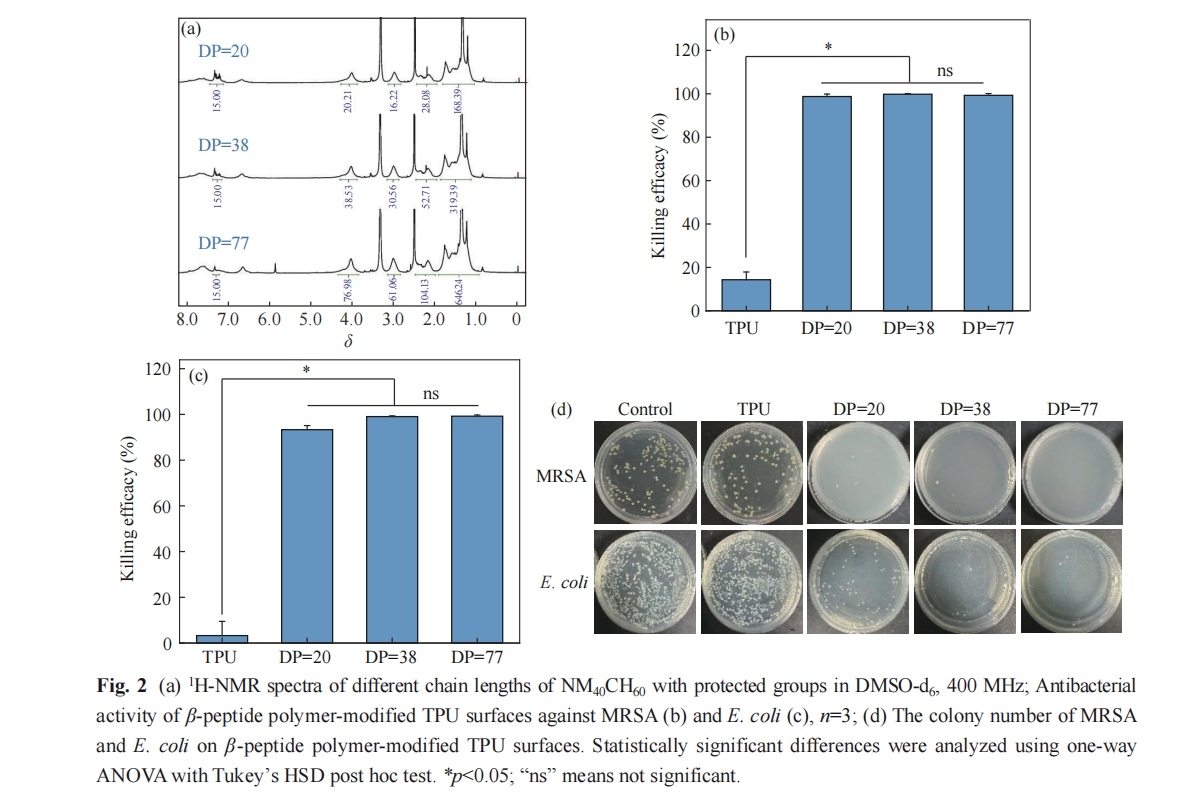
使用耐甲氧西林金黄色葡萄球菌(MRSA) 和大肠杆菌(E. coli)对不同聚合度的β-多肽聚合物NM40CH60修饰的TPU表面进行抗菌活性筛选. 图2(b)可以看出不同聚合度的β-多肽聚合物修饰的TPU表面均表现出对MRSA优异的抗菌活性,杀菌率分别为98.76%、99.82%和99.29%. 图2(c)为不同聚合度的β-多肽聚合物修饰的TPU表面对E. coli的抗菌活性,杀菌率分别为93.32%、99.07%和99.21%. 此外,MRSA和E. coli在LB-ager板上的菌落照片如图2(d)所示,聚合物修饰的TPU表面上的菌落均远少于TPU表面及对照. 这些结果证明不同聚合度的β-多肽聚合物NM40CH60修饰的TPU表面均具有较强的抗菌活性. 从中,我们优选出DP=38的NM40CH60聚合物进行后续研究.
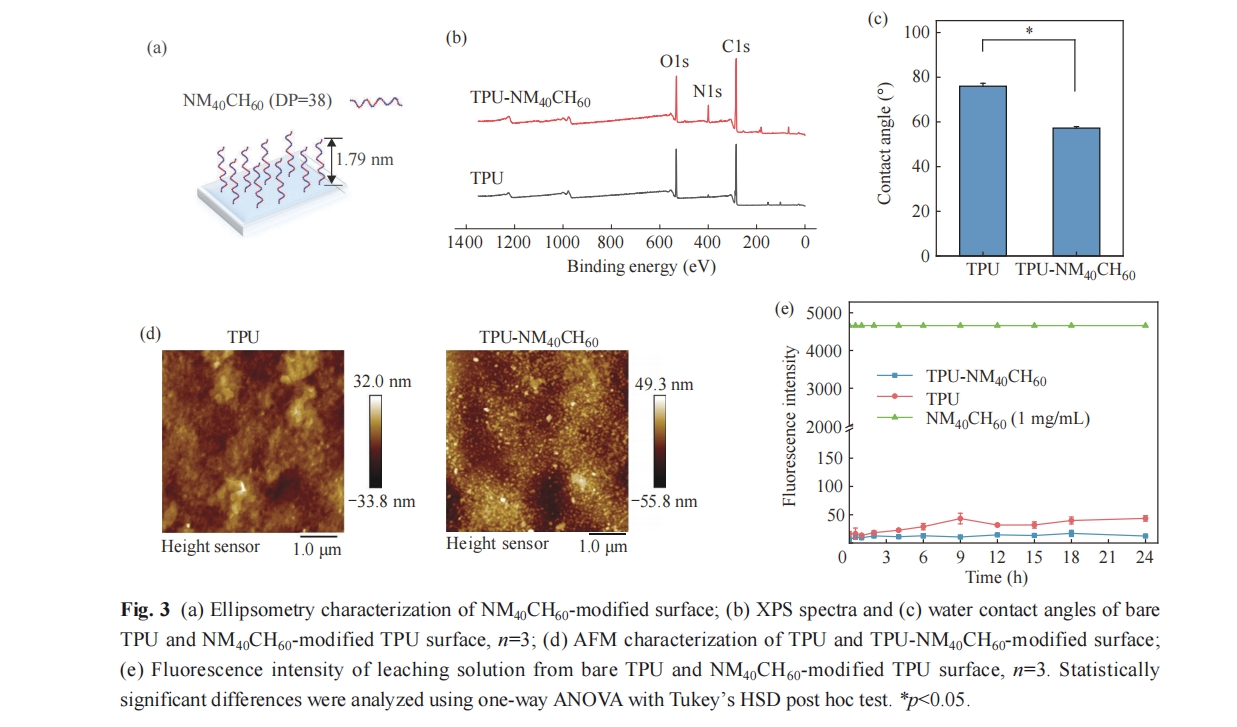
为了进一步研究聚合物是否稳定接枝于TPU表面,我们将TPU、TPU-NM40CH60浸没于PBS中在不同时间点使用荧光胺监测溶液中的聚合物浓度变化,结果如图3(e)所示. 与对照相比,TPU- NM40CH60表面的荧光强度无明显变化,表明该表面具有优异的接枝稳定性.
3 结论
本文将促内皮化功能的β-多肽聚合物NM40CH60接枝于TPU表面,并研究其抗菌活性及抗菌机理. 结果表明,TPU-NM40CH60表面对革兰氏阳性菌和革兰氏阴性菌展现出广谱的接触杀菌活性. 此外,该表面保持了优异的EC选择性黏附功能,能够有效降低人工血管植入过程中的感染及内皮损伤的风险,在心血管疾病治疗领域具有广阔的研究及应用前景.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。