
摘要: 随着多肽类化合物在治疗肿瘤疾病和生物医学应用中的重要性与日俱增,开发和构建多肽分子的新方法已成为有机合成化学家的研究热点。近年来有机电化学作为一种绿色高效的反应工具被逐步运用于有机小分子合成领域,其温和可控的特征适合解决现有生物偶联策略存在的化学和区域选择性问题,为多肽分子的选择性修饰提供了一种重要合成手段。综述了近五年利用电化学手段修饰氨基酸和多肽类化合物的反应,阐述了电化学合成技术的优势及其在开发新型生物相容性方法中的适用性。
多肽类化合物具有活性高、特异性强、毒副作用小、靶点选择性高等优点,对癌症、自身免疫性疾病、记忆力减退、精神失常、高血压和某些心血管及代谢疾病[1]有显著的疗效和广泛的应用前景。随着全球小分子药物研发难度的增加,化学修饰肽因其卓越的生物活性和药代动力学特性受到了科学家们的广泛关注[2]。目前,全球市场上大约有 80 种多肽药物,超过 150 种多肽处于临床开发阶段,另有 400-600 种多肽正在进行临床前研究[3],其中以抗肿瘤、抗生素与免疫调节剂居多,如抗肿瘤药物亮丙瑞林 Leuprorelin、抗生素药物万古霉素 Vancomycin 和激素类药物阿托西班 Atosiban(图 1)。但氨基酸和多肽类化合物的高选择性合成仍存在许多困难,如氨基酸和多肽分子的稳定性差、敏感侧链(如巯基)的存在、保持手性中心的完整性,以及溶解性和纯化等问题。
随着有机合成技术的不断提升,近年来氨基酸和多肽的化学选择性合成得到了一定的发展[4]。2018 年,Timothy课题组报道了光催化修饰氨基酸、多肽和蛋白质的研究进展[5]。在光氧化还原过程中,有机光催化剂在吸收能量后跃迁到激发态,在该状态下,很容易与作为电子供体或受体的底物发生单电子转移(SET),形成自由基中间体。与其它方法相比,光催化可在温和的条件下对氨基酸或多肽进行化学修饰,同时利用可见光作为可持续能源。但光敏剂在水介质中的溶解性差,此外,大多数已报道的用于氨基酸修饰的光氧化还原方法需要使用当量的还原剂(如有机碱)或氧化剂(如高价金属盐)。这些试剂的使用与氨基酸和多肽的生物性质不相容,从而阻碍了光催化方法的应用。C−H 官能化作为一种强大的工具已被广泛应用于氨基酸和多肽的选择性修饰,2014 年,Brimble 课题组对氨基酸和多肽合成中的 C−H 官能化方法进行了综述[6]。2018 年,Ackermann 课题组总结了通过位置选择性 C−H 活化实现多肽后期多样化的研究进展[7]。2020 年,陈弓课题组综述了金属催化 C―H 官能化(CHF)对多肽进行组装后修饰方面的研究[8]。多肽的特异性合成从局限的极性亲核残基(如半胱氨酸和赖氨酸),拓展到疏水性脂肪族和芳香族残基。金属催化的 CHF 反应通过改变反应途径、试剂和配体来控制反应活性,从而实现更有鉴别性的多肽合成。然而 C−H 官能化方法通常需要对活性位点进行保护或借助导向基团,以减少副产物的产生;同时需要金属催化剂以及化学计量的强氧化剂,无水无氧的氛围,这些反应条件相对苛刻,限制了该方法进一步的拓展和应用。
电化学合成技术作为一种温和及环境友好的合成工具,近年来受到了有机合成化学家的青睐[9]。从 1848 年 Kolbe阳极氧化反应,电化学已经发展成一项重要的技术手段,为化学转化提供绿色可持续的电子。如烯烃的双官能化[10]、立体选择性杂环合成[11]、与 CO2 进行羧化反应[12],或应用于合成结构复杂的天然产物[13]。电化学合成技术的主要优势是利用电子替代氧化还原试剂,通过电极电位的精确控制来调控反应的热力学驱动力,实现温和条件下的化学转化,具有绿色环保的特点[14]。但是,在电化学环境中修饰氨基酸和多肽依然存在一些挑战。在 Brabec 和 Mornstein教授的早期研究中[15],20 种常见的蛋白质原性氨基酸只有半胱氨酸(-0.22 V)、酪氨酸(+0.93 V)、色氨酸(+1.02V)、组氨酸(+1.17 V)和蛋氨酸(+1.48 V)侧链具有氧化还原活性[16],可在电极表面被氧化,说明多肽中存在多种活性官能团可被电极氧化或还原。而且,这些氨基酸侧链的氧化还原电势会随着不同的环境,包括 pH 值以及与之相连的肽链或蛋白质的变化而发生改变。因此,对于氨基酸和多肽的电化学修饰需注意电位范围,实现电位的精准控制,防止侧链副反应的发生。
2021 年,Malins 课题组依据电解方式对多肽和蛋白质的电化学修饰方法进行了归纳与总结[14],但是近年来通过电化学技术对敏感氨基酸和多肽进行选择性修饰的策略得到了快速发展,许多新颖独特的研究相继而出。本文结合国内外课题组近五年的报道,对这一领域的工作进行补充与完善,依据氨基酸的种类及相关化学反应类型,分别从(1)氨基酸残基与多肽侧链的电化学修饰;(2)几种常见反应类型的氨基酸和多肽电化学修饰;以及(3)电化学多肽合成三部分内容进行归纳与总结,期望为今后氨基酸和多肽类化合物的电化学修饰提供一定的参考作用。
1 氨基酸残基与多肽侧链的电化学修饰
1.1 氨基酸残基的电化学修饰
1.1.1 酪氨酸
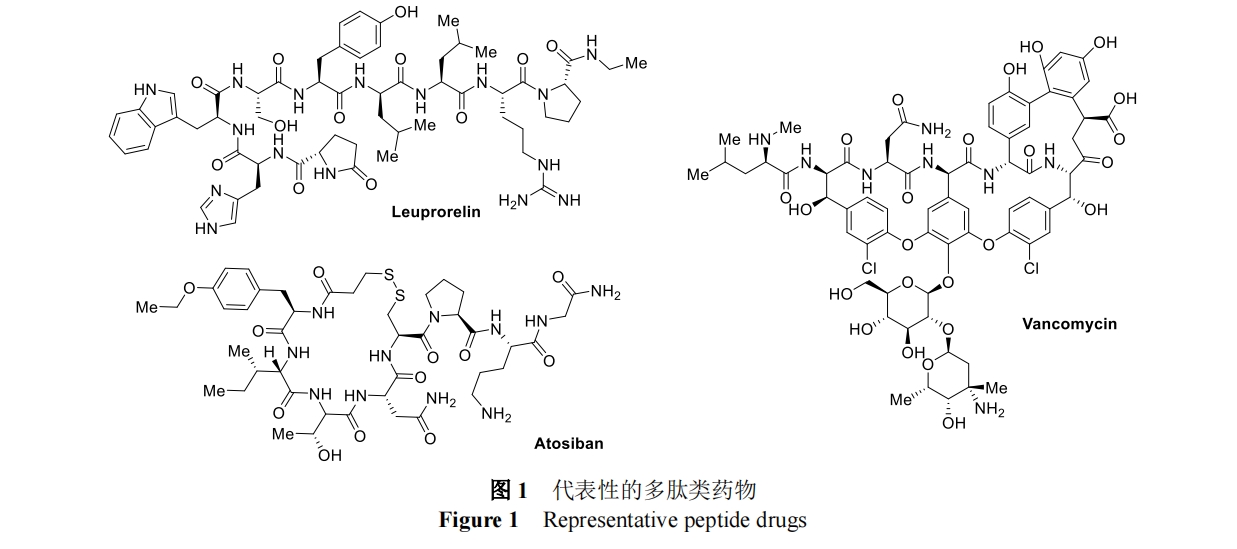
Gouin 课题组在 2018 年首次报道了 e-Y-click 反应[17](图 2A)。这种电化学方法建立在 Barbas 小组 2010 年发表的开创性工作上,其描述了酪氨酸侧链与化学氧化生成的取代苯基-3H-1,2,4-三唑-3,5(4H)-二酮(PTADs)之间的反应[18]。这种“点击式”方法被合成界广泛采用,提供了多种酪氨酸功能化分子,包括抗体-药物结合物[19]、放射性标记肽[20]、糖结合物和糖结合疫苗[21]、DNA-蛋白质结合物[22]、以及蛋白质水凝胶[23]等。如上所述,该方法依赖于脲唑前体的大量化学氧化反应以生成活性 PTADs,但这种预活化策略的缺点是在化学氧化剂存在的情况下,活化的PTADs 分解和硫醇氧化可能会对酪氨酸支链造成“过度修饰”。为了尽量减少这些副反应,需额外使用助溶剂或清除剂(如 Tris)。与之相比,e-Y-click 反应通过在纯水缓冲液中进行温和的电化学氧化(0.36 V,恒压电解)来取代“钝化”化学氧化剂,从而避免了这些问题。小分子脲唑在电极表面的连续原位电化学活化,使酪氨酸共轭反应在反应物生成后立即发生,抑制了不必要的副反应,从而显著提高了选择性。此外,极低的应用电位可最大限度地减少氧化损伤以及与大量蛋白质氨基酸侧链官能团的交叉反应。从小肽激素催产素到 152kDa 的单克隆抗体Epratuzumab,这种温和的电化学方法通过对各种底物进行功能化,体现了非常优异的实用性。更重要的是,经过e-Y-click 修饰后,目标酶葡萄糖氧化酶的功能活性得以保留。
由于 e-Y-click 反应操作简便,具有良好的生物相容性,该反应后续被用于在酪氨酸残基上交联肽和蛋白质底物,无需金属催化剂或光照即可检测其三维结构[24]。这项研究包含了在 0.36 V 下进行的 e-Y-click 反应以及在-3.0 V 下对交联试剂中存在的二硫键进行的电化学还原。
Nakamura 课题组利用改进的 e-Y-click 反应,在表面暴露的酪氨酸残基上进行位点选择性生物偶联(图 2B)[25]。他们使用 N-甲基鲁米诺和 1-甲基-4-苯基脲唑衍生物作为电化学活性小分子修饰试剂,成功地在天然酪氨酸残基上修饰了受保护的八肽血管紧张素 II。与最初的苯基脲唑相比,第二代试剂(N-甲基鲁米诺和 1-甲基-4-苯基脲唑)的反应效率都有所提高,Gouin 课题组在 2021 年的一项研究中也进一步证实了这一现象[26]。但对更大的蛋白质人表皮生长因子受体-2(HER2)抗体曲妥珠单抗进行修饰时,苯基脲唑和 N-甲基鲁米诺均进展顺利,而 1-甲基-4-苯基脲唑的修饰效果却很差,这一实验结果的原因还需要进一步探究。此外,该反应采用全水性缓冲液(Tris,50 mM)、中性 pH 值(7.4)和温和的电化学条件(4-7 V),通过 2 步官能化实现了位点选择性。首先使用含叠氮化物的小分子对曲妥珠单抗进行 e-Y-click 修饰,然后再用官能化二苯并环辛烯(DBCO)试剂进行无铜点击反应(图 2C)。这两个步骤是成功标记所必须的,并且对溶剂暴露位点都更有利,因此与单步方法相比,在非溶剂暴露残基上标记的可能性大大降低,这个例子凸显了电化学功能化方法与现有正交生物偶联技术的兼容性。
无独有偶,雷爱文课题组在 2019 年报告了一种概念类似的酪氨酸修饰方法[27],即利用电化学方法活化吩噻嗪(PTZ)衍生物(图 3)。这种方法可快速获得一系列有价值的功能修饰肽和蛋白质,包括引入含生物素和尿酸药物丙磺舒的吩噻嗪。然而,该方法对含半胱氨酸的二肽不耐受,且转化过程中使用了乙腈和水缓冲液(1:1)的混合物,可能会限制该方法的生物相容性以及在各种蛋白质靶标上的广泛应用。外,尽管化学选择性很高,但最初的e-Y-click 和 PTZ 方法都缺乏区域选择性,在含有一个以上酪氨酸残基的底物中观察到多种修饰。因此,这些方法无法克服困扰现有生物偶联技术的特异性问题,并凸显了需要导向基来辅助位点选择性功能化的缺点。

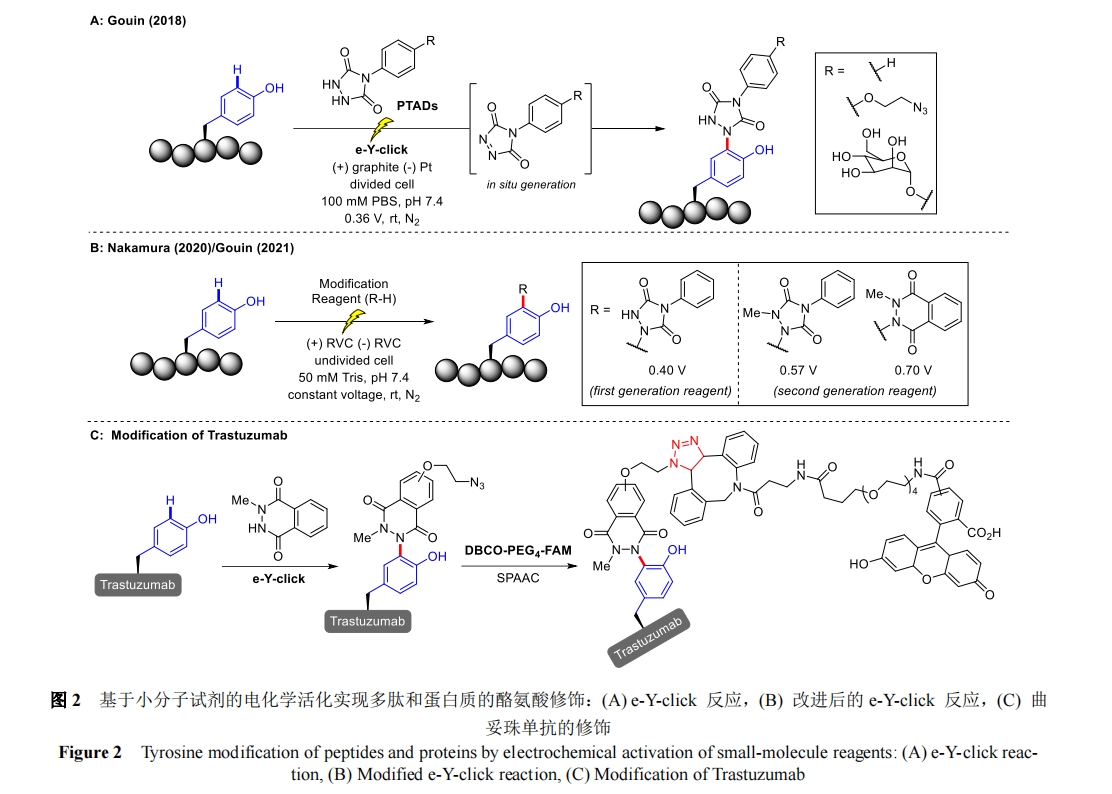
2021 年,Ackermann 课题组报道了电化学与过渡金属铑催化剂相结合,对 2-羟基苯甲醛酪氨酸类似物和炔烃进行环化反应[28],光电化学氧化介导的进一步氨基酸修饰可以获得 π-扩展肽(具有强烈的荧光),从而构建拟肽和荧光肽。除了制备各种修饰的二肽外,还用二苯基乙炔在羟基苯甲醛酪氨酸类似物上对五肽底物进行了官能化,以 80%的分离产率得到了相应的色酮(图 4)。该反应虽然由醛上的甲酰基-C―H 活化引发,但反应机理中的关键电化学步骤包括 Rh(III/IV/II)氧化诱导的还原过程。重要的是,与化学氧化剂相比,这种“铑-电催化”技术能更有效地获得取代色酮,展现出优异的区域选择性和较广的氨基酸底物容忍性。
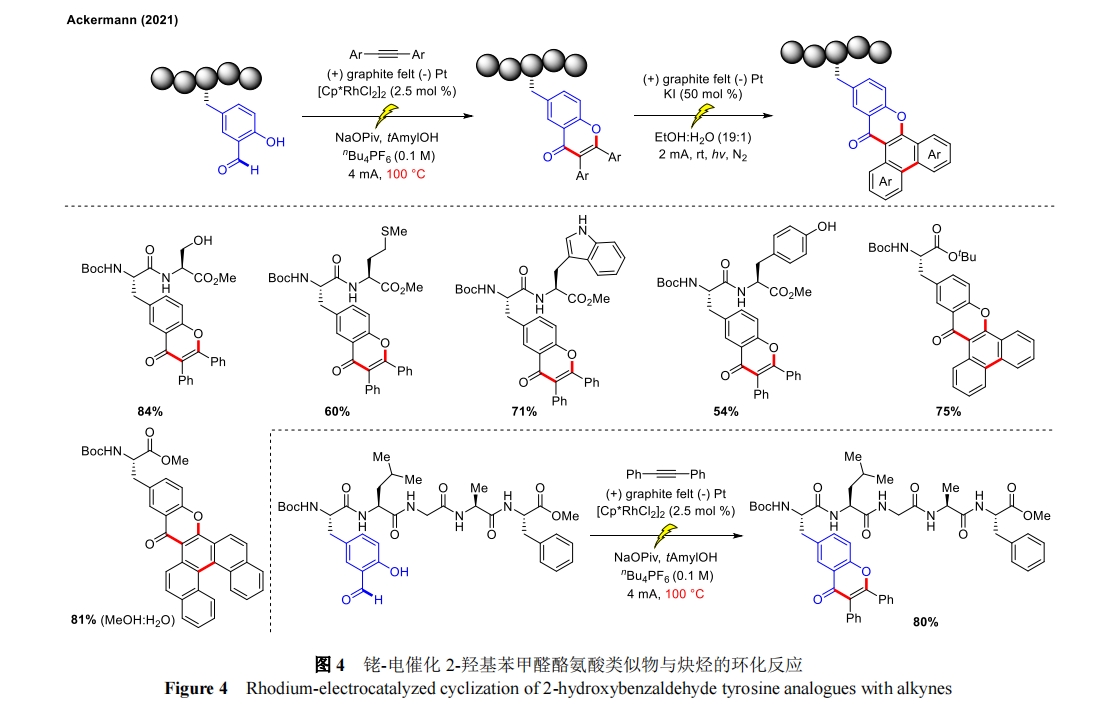
随后,Ackermann 团队又实现了钌-电催化 C―H 酰氧基化用于酪氨酸肽的后期修饰[29],酚羟基保护基后续可脱除(图 5)。当以化学氧化剂取代电子进行反应时并未获得目标产物,说明电化学环境保证了后期功能化的可持续性和稳定性。重要的是在含有脯氨酸的二肽或四肽底物中,脯氨酸的 α 位并未发生 Shono 氧化生成二次修饰的产物,体现出良好的位点选择性。机理研究中通过详细的 CV 研究和 DFT 计算为双环金属化络合物的形成以及 Ru(II/IV/II)氧化诱导的还原过程提供了强有力的支撑。该策略通过对酪氨酸衍生肽进行模块化后期酰氧基化,提供了获取大量修饰肽的便捷途径,突出了电化学和过渡金属催化之间的协同催化作用。
然而在高温(100 °C)下进行电解可能会限制这类方法用于具有易变性的二级或三级结构的大型蛋白质底物;与大多数金属催化修饰策略一样,铑或钌的使用也可能使后续纯化复杂化,或由于非特异性结合相互作用而导致肽失活。
最近,高梦课题组在前人工作的基础上报道了一种通过直接电化学活化酚羟基来促进含酪氨酸生物大分子与邻氨基苯甲酸衍生物转化的方法[30](图 6A)。该方法利用氟阴离子作为电解质和氢键添加剂,与酪氨酸酚羟基之间形成氢键,能够很好地标记酪氨酸残基,具有很高的化学和位点选择性以及出色的转化率。在温和的缓冲条件下,各种肽、药物和天然产物都具有很好的兼容性。此外,肌红蛋白也能被生物染色剂靛红顺利标记且不会发生分解。通过控制实验、HR-MS、1H NMR 和循环伏安法(CV)在内的机理研究合理地解释了酪氨酸残基直接选择性电化学活化的机制(图 6B)。首先,在氟阴离子的络合作用下,酪氨酸在阴极被还原释放 H2,生成苯酚负离子中间体。随后靛红与苯酚负离子中间体发生亲核加成反应,生成氧负离子中间体。在 H2O 的亲核作用下发生开环反应生成带有羧基的中间体,随后在阳极氧化脱羧生成最终产物。
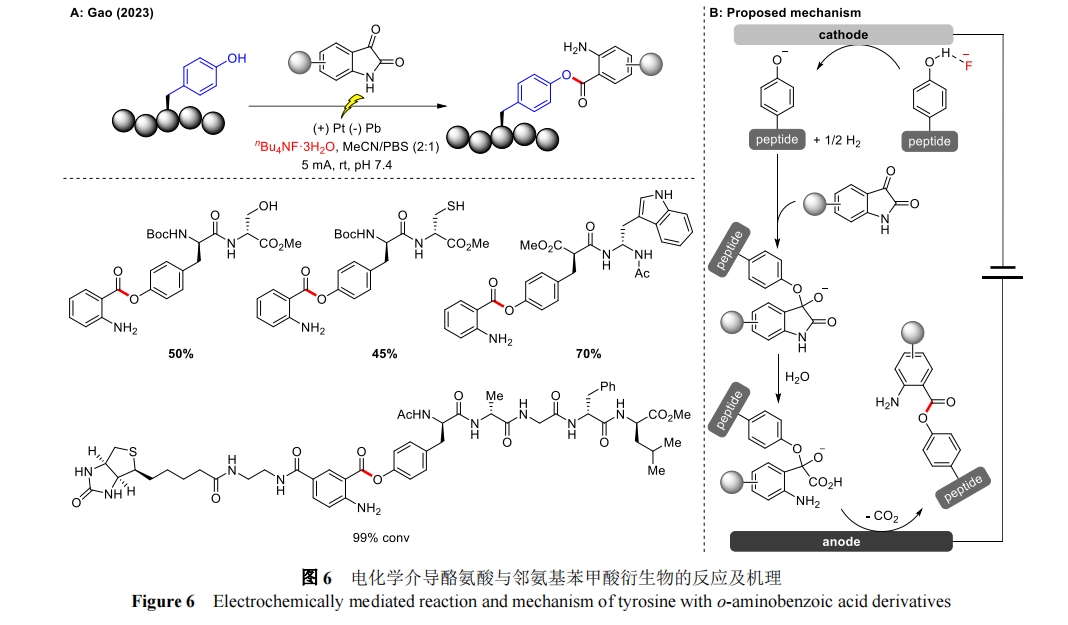
1.1.2 色氨酸
在前人的基础上,2019 年 Kanai 课题组提出了一种用于多肽和蛋白质的间接修饰方法[31],描述了利用原位生成的氧氨试剂对色氨酸的电化学修饰。这项工作的关键区别在于小分子试剂的电化学活化被认为是在试剂与蛋白质结合后发生的,这与上述酪氨酸的修饰方法不同(图 7)。该方法利用现有的生物偶联策略[32],无需化学氧化剂和添加剂,条件温和,避免了外部氧化剂参与的副反应。可能的机理揭示出色氨酸侧链在生物偶联反应的电化学步骤中起到了关键作用,其调节了具有电活性的氮氧化物自由基(酮-ABNO)的氧化电位,使酮-ABNO 和色氨酸侧链之间形成一种“预共轭复合物”,最终这种复合物的氧化电位明显低于酮-ABNO 或色氨酸本身。因此,该复合物可直接在阳极氧化或在电化学介质(如 4-O-TEMPO)之后被氧化。不仅如此,活化的复合物可以继续发生反应,形成酮ABNO 官能化生物偶联物。值得注意的是,该反应能够在水溶液中进行,可以与具有氧化还原活性的氨基酸残基(游离半胱氨酸除外)兼容,并应用于溶菌酶和牛血清白蛋白体系。
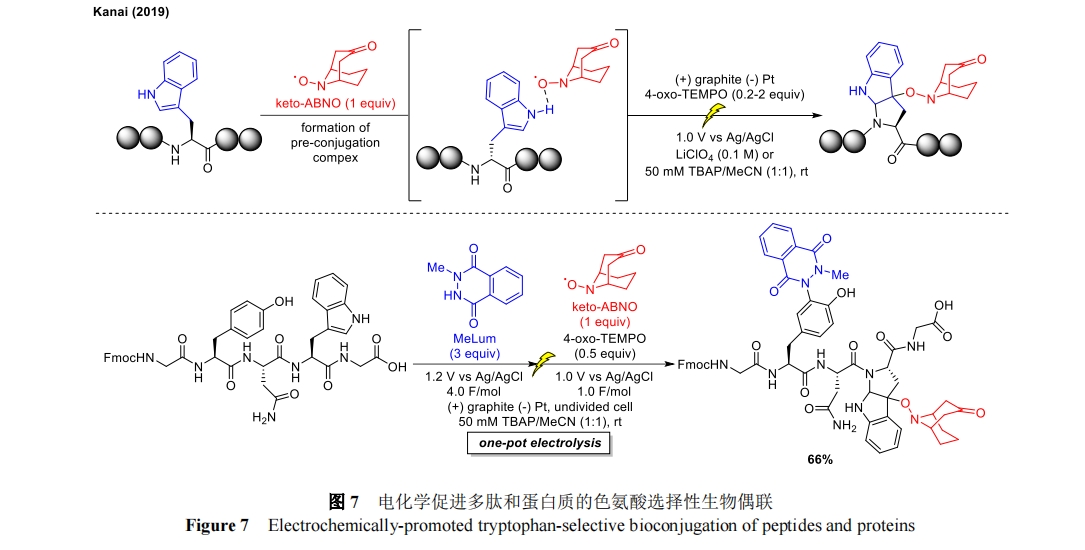
此外,这种方法还展示了如何利用电化学原理,通过调整外加电压和反应条件,轻松完成连续的正交生物偶反应。如图 7 所示,被 Fmoc 保护的五肽通过 e-Y-click 反应(见图 2)在酪氨酸(在 1.2 V 下使用电化学活化的 N-甲基鲁米诺)和色氨酸(在 1.0 V 下使用酮-ABNO/4-O-TEMPO 方法)上逐步进行功能化。这些例子凸显了电化学技术在获取具有多重修饰的肽和蛋白质方面的潜力。
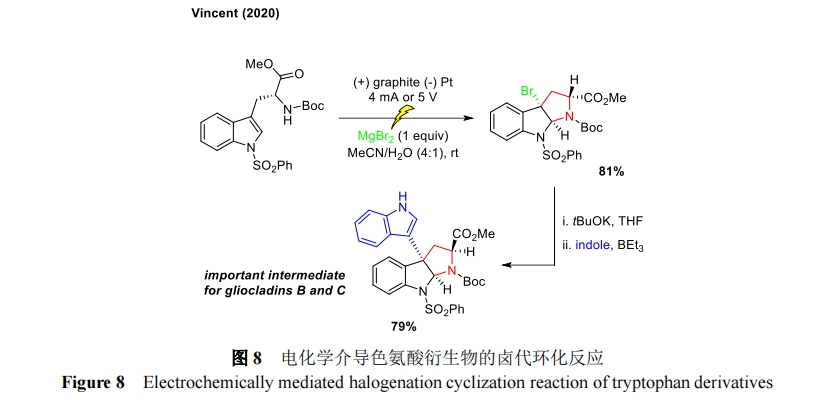
另外,Vincent 小组在 2020 年报道了一种高效环保的电化学方法用于色氨酸衍生物的脱芳基卤代环化[33],所获得的 3a-溴吡咯吲哚啉对天然产物全合成具有重要意义。这种去芳构化过程依赖于通过 MgBr2 的电化学氧化产生亲电卤素中间体,同时 MgBr2 在该反应中作为电解质避免了其他电解质的使用。以不同保护的 L 和 D-色氨酸衍生物进行溴环化反应,分别得到了相应的产物。通过 X 射线晶体结构证明了环化过程具有外显选择性。从 D-色氨酸获得的外-3a-溴吡咯吲哚啉可以通过在 t-BuOK 和三乙基硼烷的存在下引入吲哚将其转化为内-3a-吲哚-吡咯吲哚啉,这是神经胶质克隆蛋白 B 和 C 合成的重要中间体(图 8)。
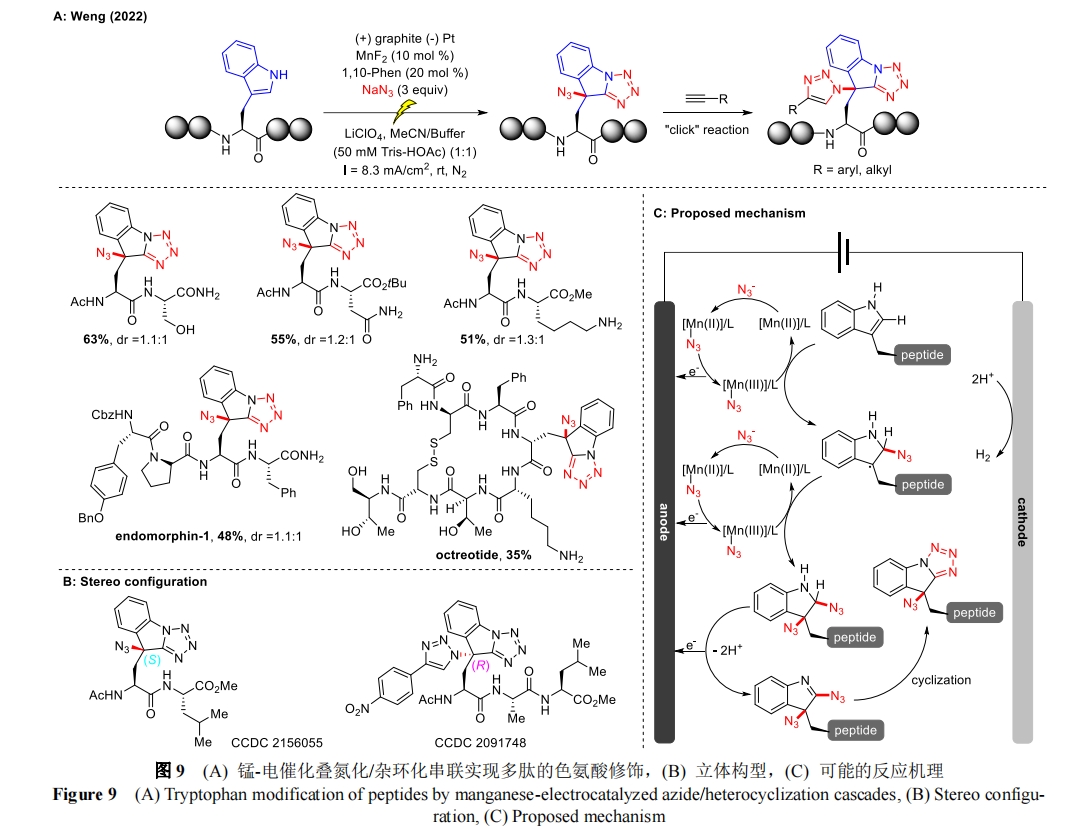
2022 年,翁意意课题组报道了一种通过锰催化串联自由基叠氮化/杂环化对含有色氨酸侧链的肽进行后期功能化的电化学方法[34](图 9A)。这种电化学氧化策略提供了叠氮基取代的四唑并[1,5-a]吲哚的多肽衍生物,具有广泛的官能团耐受性和高位点选择性,在温和的缓冲条件下依然能得到良好的收率(高达 87%)。不仅如此,对含有多种敏感氨基酸的多肽底物,如丝氨酸、赖氨酸、苏氨酸以及天冬氨酸等,该电化学条件下仍然是相容的。通过该方法阿片类肽内啡肽-1、药物奥曲肽也能成功地进行后期结构修饰。更重要的是,在 C3 位被叠氮基团修饰的色氨酸肽可以通过“点击”反应进一步衍生出一系列三唑产物,为构建各种衍生肽铺平了道路。通过 X 射线晶体学分析证明了电化学产物与二次“点击”反应最终产物的非对映异构体构型(图 9B)。机理研究表明色氨酸肽的重氮化是通过自由基加成途径而不是自由基阳离子途径进行的,通过循环伏安法(CV)和自由基抑制实验,合理地解释了叠氮自由基的电化学生成、自由基加成以及随后的脱氢和杂环化途径(图 9C)。
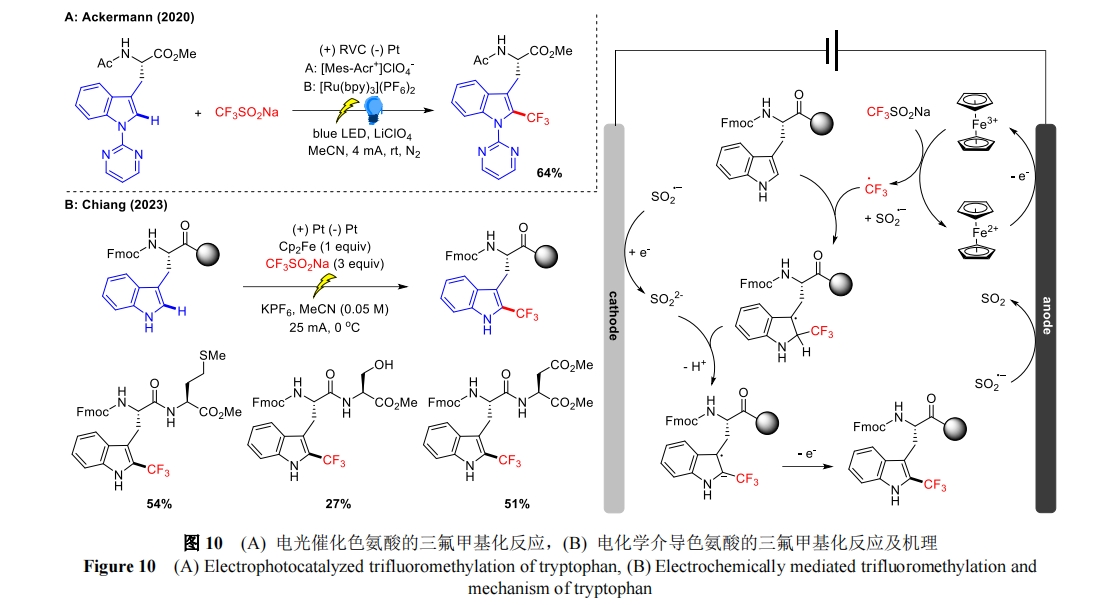
在此之前,2020 年,Ackermann 课题组就通过电光协同催化以 64%的产率实现了色氨酸吲哚环上 C2 位的三氟甲基化(图 10A)[35],电合成与光氧化还原催化的结合为三氟甲基自由基的生成提供了一种无需化学氧化剂的途径。近期,江建緯小组在该方法的基础上报道了一种间接电化学策略[36](图 10B),该反应以二茂铁作为介质,通过单电子转移(SET)途径氧化 CF3SO2Na 产生三氟甲基自由基,随后三氟甲基自由基加成到色氨酸残基上经脱质子化释放出相应产物。该方法仅需电化学催化,底物范围由单一的色氨酸拓展到了二肽底物,并且色氨酸的吲哚环无需被保护从而提高了步骤经济性。但一些含有敏感基团的二肽易分解或失活,仅有少量二肽底物可以顺利转化,生物兼容性差,限制了此方法的应用。
1.1.3 苯丙氨酸
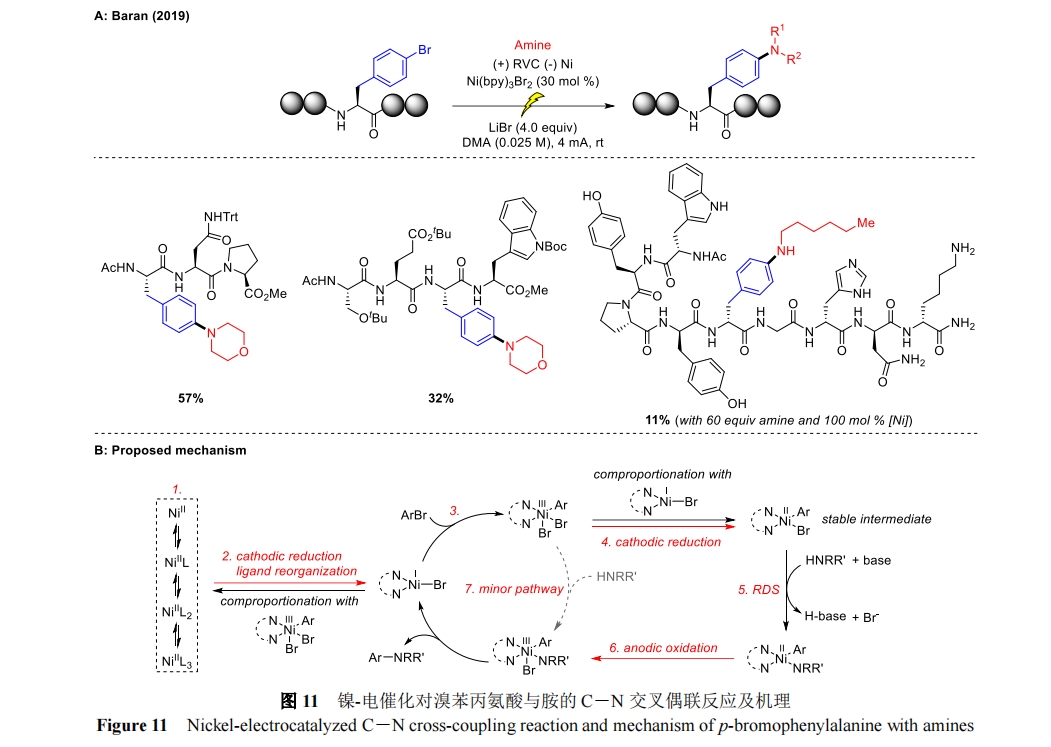
2019 年,Baran 课题组将镍催化与电化学相结合,实现了对溴苯丙氨酸及三肽、四肽和五肽等与胺的 C―N 交叉偶联反应[37]。此外,还对一种未受保护的壬肽进行了镍催化的芳基卤胺化,为具有氧化还原活性的酪氨酸和色氨酸残基提供了所需的胺化产物(图 11A)。值得一提的是,这是第一个通过镍催化在寡肽上形成 C―N 键的实例,尽管它的产率较低且需要镍催化剂和化学计量的胺偶联剂。机理研究证明催化循环过程中同时进行了阴极还原和阳极氧化。由 Ni(II)-预催化剂的阴极还原引发,形成 Ni(I)活性催化剂。然后芳基溴对 Ni(I)氧化加成形成 Ni(III),之后Ni(III)被 Ni(I)阴极还原生成 Ni(II)中间体。在碱的作用下,Ni(II)中间体与胺发生配体交换并再次被阳极氧化、还原消除生成所需的胺化产物(图 11B)。对生物应用而言,反应中使用的二甲基乙酰胺(DMA)和 LiBr 可能需要额外的纯化步骤,可能对该技术的工业化有一定影响。尽管如此,该方法作为一种组装高价值多肽 PTMs(尤其是与大环 RiPP 相关的独特交联)的方法,为生物大分子的特异性修饰提供了可能。2021 年叶金星课题组在上述方法的基础上以 73%的产率补充了对溴苯丙氨酸的氨甲基化实例[38],进一步探究了该反应的潜在应用价值。
1.1.4 脯氨酸
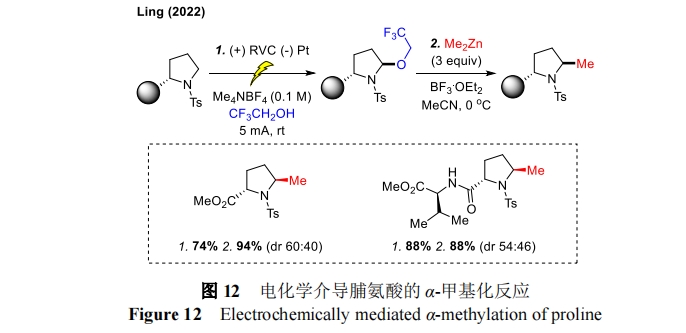
2022 年,林松课题组基于经典的 Shono 氧化报道了一种脯氨酸的位点选择性 α-甲基化方法[39](图 12)。在这项工作中,首先通过电化学驱动的 C-H 活化生成 N,O-缩醛化合物,随后在有机锌试剂的介导下进一步生成 α-甲基化产物。用三氟乙醇(TFE)替代常用的乙醇溶剂或亲核试剂,可以使惰性底物更容易被激活。此外,该策略还实现了各种结构复杂胺衍生物的后期功能化(LSF),如氨基甲酸酯类、磺胺类和酰胺类,具有反应范围广、官能团兼容性高和操作简单等特点。
1.1.5 半胱氨酸
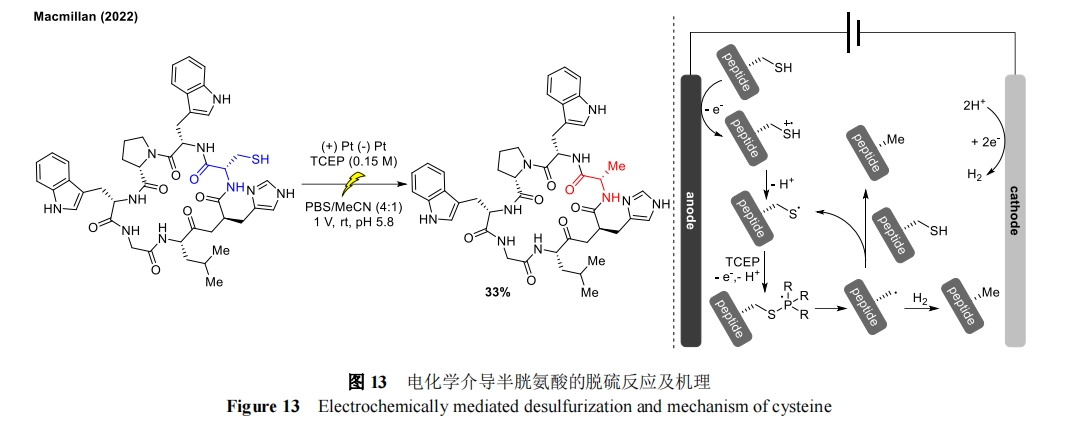
2022 年,Macmillan 小组通过电化学氧化实现了半胱氨酸的脱硫反应[40]。半胱氨酸残基经阳极氧化后生成自由基阳离子,去质子化形成烷基硫自由基。该硫自由基在三羧乙基膦(TCEP)的作用下形成膦自由基中间体然后发生 β 裂解,从而产生新的碳自由基,碳自由基可从起始原料或阴极产生的分子氢中攫取氢实现脱硫,同时释放硫自由基回到催化循环系统中。适用的底物除半胱氨酸外,还实现了多种短环肽的脱硫反应(图 13)。
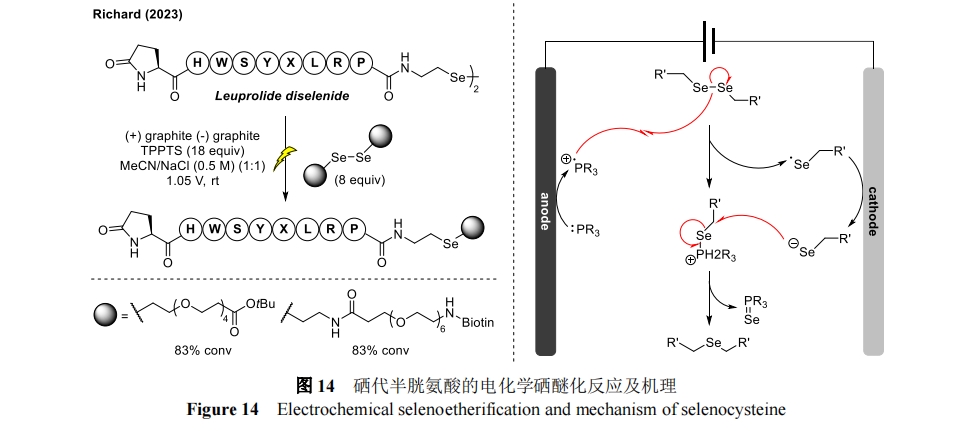
2023 年,Richard 课题组描述了一种电化学硒醚化(e-SE)策略,用于多肽的位点选择性功能化[41]。该方法受光催化二硒化物收缩(PDC)转化(使用铱光催化剂和膦在 45 nm 处辐照,将不对称或对称的二硒化物起始材料转化为相应的硒醚连接产物)的启发,利用硒代半胱氨酸的独特反应性,在温和的电化学条件下通过稳定的硒醚键形成有价值的生物缀合物。电化学可以精准的控制氧化还原电位,克服了 PDC 的局限性,包括与荧光底物不相容以及使用昂贵和水溶性差的光催化剂,实现了低成本、原子经济和生物相容的方法对硒代半胱氨酸残基进行位点选择性功能化。E-SE 的能力通过 FDA 批准的抗癌药物亮丙瑞林的晚期 C 末端修饰而突出显示。机理研究中,膦阳极氧化产生的自由基阳离子会诱导二硒化物均裂,由此产生的硒自由基经阴极还原会生成一当量的高亲核性硒酸盐。然后,这种活性物质可以攻击二硒化物裂解过程中产生的亲电硒基膦,从而得到所需的硒醚连接产物和硒化磷副产物(图 14)。
1.1.6 丝氨酸
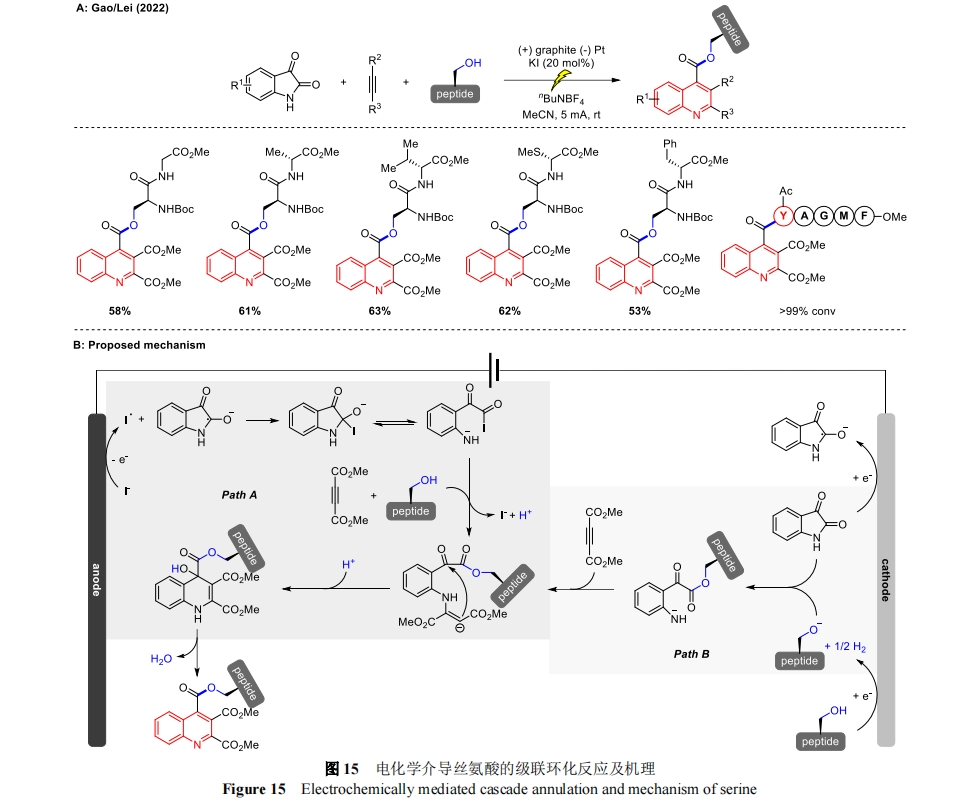
2022 年,高梦和雷爱文课题组共同报道了一种配对电解支持的级联环化方法,以靛红、炔烃和丝氨酸分子作为起始材料高效的合成了一系列高功能化的喹啉取代的生物活性分子[42](图 15A)。在温和的 pH 中性条件下,这种转化可以耐受广泛的官能团,包括丝氨酸残基、多肽、糖类、药物和天然产物,也可以作为药物研究和其他领域的功能化策略。通过循环伏安法(CV)和控制实验提出了可能的反应机理(图 15B)。首先,靛红在阴极被还原生成自由基阴离子,同时,KI 经阳极氧化生成碘自由基,靛红自由基阴离子与碘自由基交叉偶联生成氧负离子中间体。该中间体经过开环反应后,与丝氨酸残基和炔烃分别发生亲核取代和加成反应生成碳负离子中间体,碘阴离子再生完成催化循环(路径 A)。此外,丝氨酸残基可能在阴极被还原产生烷氧离子,然后与靛红反应生成开环氮负离子中间体,这一过程中 KI 作为阳极牺牲剂(路径 B)。最后经分子内环化脱水生成相应的喹啉产物。
1.1.7 甘氨酸
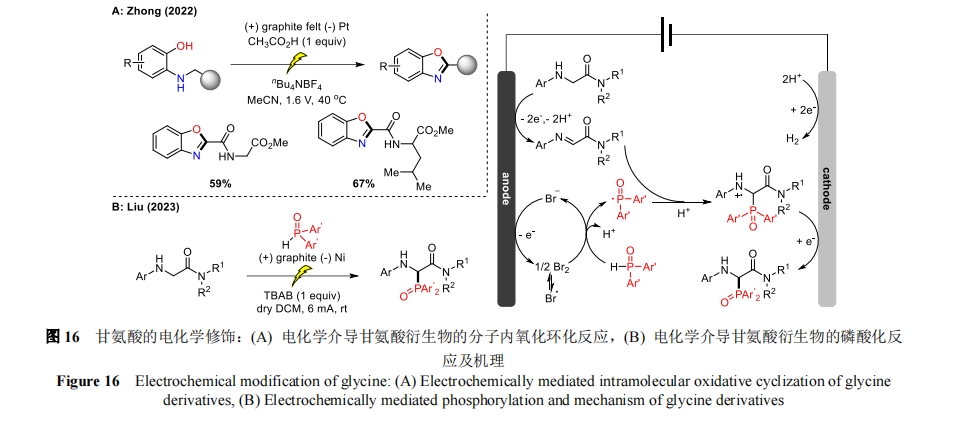
2022 年,钟为慧课题组开发了一种实用且原子经济的电催化策略[43],通过 Shono-型氧化偶联对甘氨酸衍生物进行分子内氧化环化(图 16A)。与之前的研究相比,该方法无需添加氧化剂和金属催化剂,原子经济性好,以中等至良好的产率合成多种 2-取代苯并恶唑,仅产生 H2 作为副产物。近期,刘晨江课题组通过 C(sp3)―H 官能化实现了甘氨酸衍生物与含 P(O)―H/P―H 的化合物的电化学氧化磷酸化反应[44](图 16B)。该方法具有广泛的底物范围和较高的官能团耐受性,将反应条件稍作改变后可进行克级规模反应。机理研究中以(E)-N,N-二甲基-2-(苯基亚氨基)乙酰胺代替模板底物在标准条件下进行反应,可以以 56%的产率得到目标产物。在标准反应 1h 后的反应液中也通过 HRMS 检测到了目标产物,这些结果表明(E)-N,N-二甲基-2-(苯基亚氨基)乙酰胺是这一转化过程中形成的重要中间体.
1.2 其他氨基酸与多肽侧链的电化学修饰
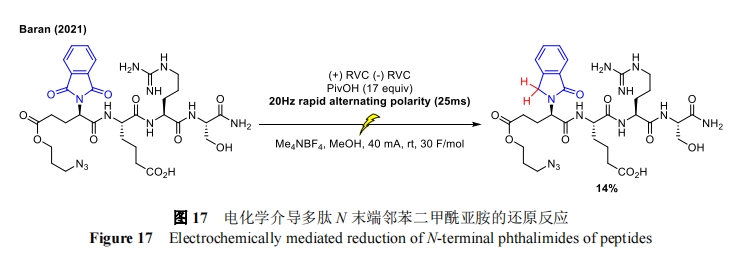
2021 年,Baran 课题组揭示了一种交流电解形式的实际应用[45],即使用快速交流电而非直流电。快速交替电极(rAP)可以区分在相同氧化还原电位下发生的化学反应速率,从而促进化学选择性电合成,而不仅仅依靠电化学电势来引导氧化还原化学反应。该方法通过选择性还原 N 末端邻苯二甲酰亚胺保护基团,得到相应的内酰胺,成功的实现了四肽模型(含有八个氧化还原不稳定位点)的选择性修饰(图 17),体现出电化学反应的高位点选择性。值得注意的是,多肽中存在大量的氧化还原活性官能团,能够在相同或相似电势下选择特定的氧化还原反应而不发生其他副反应。但是,由于使用 MeOH 作为溶剂,并且产率不高,因此需要进一步开发,才能将这种转化方法推广到更有实际意义的多肽或蛋白质系统中。尽管如此,这项研究也初步体现出电化学在真正选择性修饰肽和蛋白质方面的潜力。
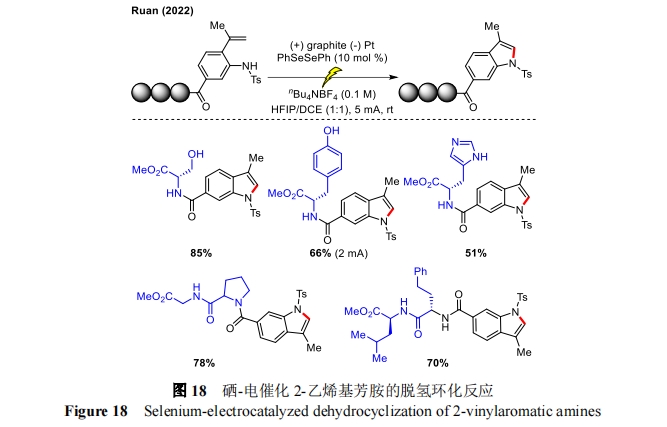
此外,阮志雄课题组报道了一种新型硒电催化 2-乙烯基苯胺的脱氢环化反应[46],通过 C―H/N―H 活化合成官能化吲哚多肽衍生物。以含有各种氨基酸的 2-乙烯基苯胺为底物,在二硒化物催化下进行温和的电氧化环化反应,成功地获得了一系列吲哚衍生物,且无外消旋化现象(图 18)。重要的是,丝氨酸和酪氨酸的游离羟基以及组氨酸的游离氨基在该电化学转化中被顺利保留,二肽、三肽和四肽底物也能很好的被兼容。该方法强大的脱氢环化能力,可对复杂的生物活性分子体系进行后期修饰,从而为多肽标记修饰吲哚的多功能合成奠定了基础。
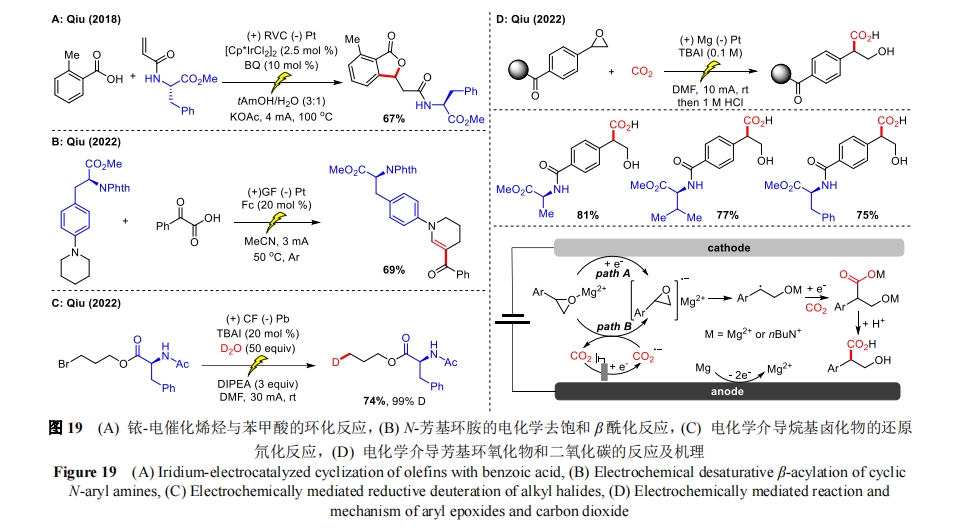
早在 2018 年,仇友爱课题组就将铱催化与电氧化相结合实现了含苯丙氨酸骨架的烯烃与苯甲酸的环化[47](图19A)。2022 年,他们又再次报道了 N-芳基环胺(含苯丙氨酸骨架)的电化学去饱和 β 酰化反应[48](图 19B)。随后又以简单的 D2O 作为氘源,实现了烷基卤化物(含苯丙氨酸和缬氨酸骨架)的电还原氘化反应[49],氘渗入率高达99%(图 19C)。同年,该课题组还报道了一种简便高效的方法制备具有重要合成价值的 β-羟基酸衍生物[50](图 19D)。该反应利用芳基环氧化物和二氧化碳为底物,在温和、可持续的电化学条件下实现了 β-羟基酸的选择性合成。该方法底物范围广,官能团兼容性好,一系列含有氨基酸骨架的芳基环氧化物均能转化为有用的羟基酸。此外,对复杂分子和药物衍生物的进一步后期修饰证实了该方法的潜在应用。机理研究根据芳基环氧化物的还原能力提出了两种可行途径。途径 A 芳基环氧化物直接发生电化学还原提供自由基负离子中间体。途径 B 则是通过 CO2 的单电子还原过程得到一个电子后再生成自由基负离子中间体。该中间体进行 C―O 键裂解,得到 C-中心自由基。随后经过另一次单电子还原和 CO2 的 C-亲核进攻,最后在盐酸水溶液的作用下生成 β-羟基酸。
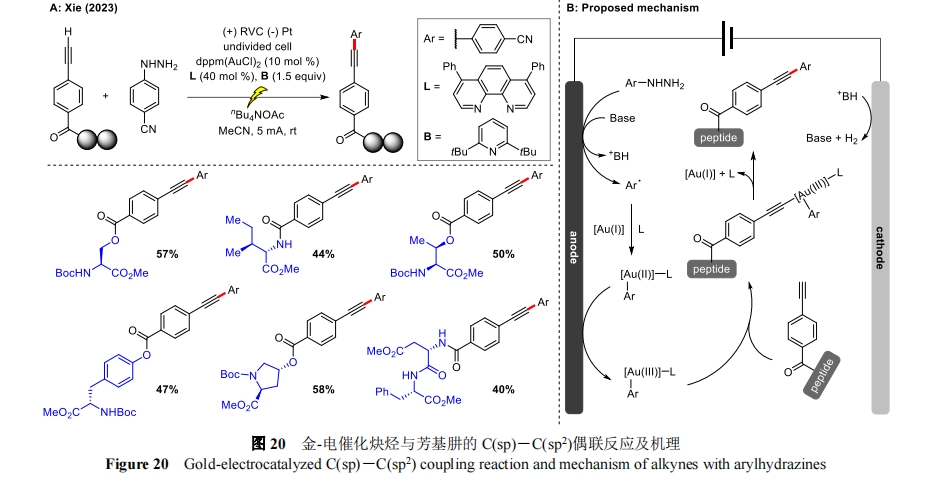
2023 年,谢劲课题组报道了在电化学条件下,由双核金催化结构多样的炔烃与芳基肼之间的 C(sp)-C(sp2)偶联反应[51],提供了一种实用的 C-C 氧化偶联方法(图 20A)。该方法对含有敏感官能团的醇类、胺类、硫化物和富电子烯类等具有极佳的兼容性,并且与氨基酸、多肽、核苷酸和糖等生物大分子相连的炔烃也能成功被修饰,突出了该方法的合成稳定性。机理研究表明,芳基肼首先在阳极被氧化形成高亲电性芳基自由基,该自由基可以跟 Au(I)催化剂生成 Au(II)物种,然后经阳极氧化产生高亲电性的 Ar-Au(III)中间体,然后与末端炔烃形成炔基 Au(III),最后经还原消除释放出偶联产物(图 20B)。
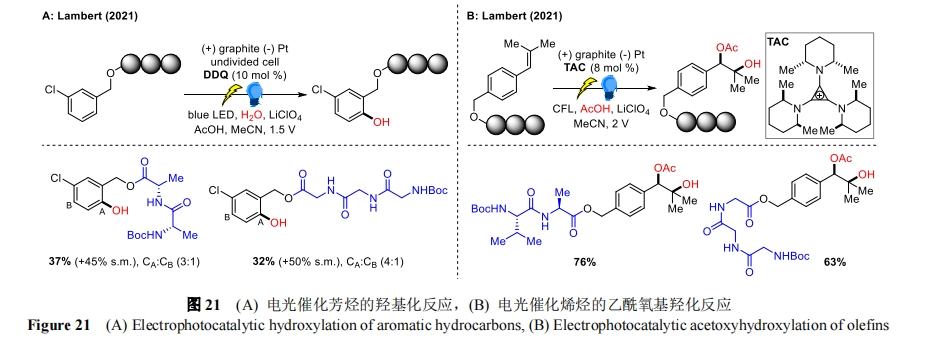
2021 年,Lambert 课题组使用 2,3-二氯-5,6-二氰基醌(DDQ)作为电光催化剂,开发了一种具有高化学选择性的芳烃羟基化方法[52],可以将水、醇、酸、酰胺或氨基甲酸酯添加到芳烃类化合物中,无需使用外部氧化剂,与多肽相连的芳烃也能顺利转化(图 21A)。机理研究表明,该过程通过 DDQ 的再循环来实现,其中光激发的 DDQ 经单电子转移(SET)氧化芳烃,从而提供一个可被亲核试剂捕获的自由基阳离子。同年,他们还报道了一种电光催化策略,采用三氨基环丙烯(TAC)离子催化剂,在可控的电化学电位下,实现了烯烃的乙酰氧基羟化反应[53],具有很高的化学和非对映选择性(图 21B)。机理研究表明强氧化中间体 TAC·2+*可触发烯烃底物的单电子转移生成烯烃自由基阳离子,然后被乙酸捕获,进一步氧化为氧碳中间体,最后水解释放出乙酰氧基羟化产物。
2 几种常见反应类型的氨基酸和多肽电化学修饰
2.1 脱羧反应
羧酸可通过阳极氧化作用脱羧形成烷基自由基,容易与双键发生加成反应,或在 Kolbe 电解法中结合成对称的二聚体。另一方面,在 Kolbe 条件下形成的自由基中间体可进一步氧化生成相应的碳正离子,这一过程被称为非Kolbe 电解或 Hofer-Moest 反应[54]。2019 年,王亚辉课题组以简单的 α-氨基酸为底物,多种唑类和酰胺类为 N-亲核底物,通过电化学氧化在非 Kolbe 条件下实现了 Csp3-N 脱羧偶联反应[55](图 22)。该方法避免了羧酸的预活化,也无需使用过渡金属和化学氧化剂,是光氧化催化 α-氨基酸脱羧 C-N 偶联的一种良好补充。

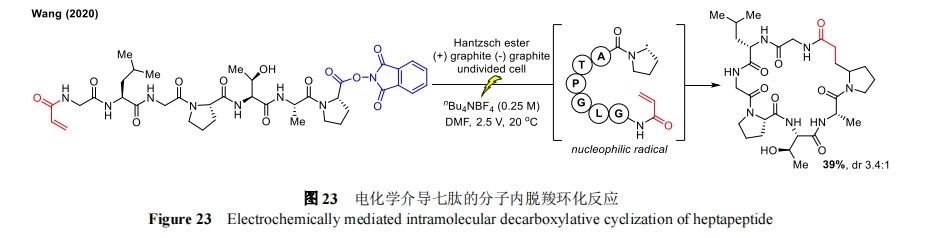
2020 年,王平课题组通过电化学诱导的 Giese 反应[56]实现了七肽的脱羧环化(图 23)。带有 C 端 N-羟基邻苯二甲酰亚胺氧化还原活性酯(RAE)的多肽在阴极还原脱羧后产生一个亲核碳中心自由基,该自由基会与位于 N 端的丙烯酰胺分子发生分子内反应。另外,烷基 RAE 的电化学脱羧反应也被用来实现烷基羧酸的简单硼酸化[57]。总之,这项工作补充了现有的镍催化[58]和光化学[59]多肽环化方法,并为进一步开发电化学脱羧多肽修饰方法奠定了基础。但由于需要经历脱羧环化,原子经济性会降低,而且相对较高的应用电位(2.5 V)可能与具有氧化还原活性的氨基酸侧链官能团(如酪氨酸、色氨酸)不兼容,可能会限制该方法在多肽和蛋白质环化中的广泛应用。
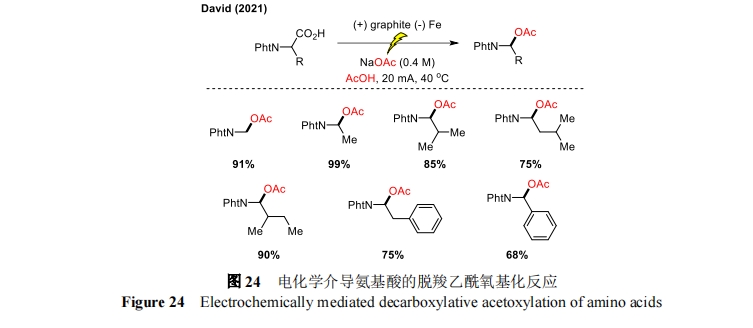
2021 年,David 课题组报道了一种利用间歇和连续流策略进行氨基酸阳极脱羧乙酰氧基化[60]的反应(图 24)。该方法已应用于多种天然和合成氨基酸的衍生化,包括合成活性药物成分的关键中间体。无论是单次反应还是电解液再循环,都实现了出色的转化率和选择性。但是这种电解方法并不适用于含有氧化不稳定官能团的天然氨基酸,如半胱氨酸等,底物方面存在一定的局限性。
20 世纪 80 年代末,Seebach 课题组发表了开创性文章[61],概述了如何利用电化学方法在甲醇溶液中直接阳极脱羧合成 N 末端保护的多肽。通过电化学生成相应的 N,O-缩醛,然后在酸性条件下水解得到多官能团化的多肽产物,或是被格氏试剂、亚磷酸盐亲核进攻,分别生成 C 端烷基/烯丙基或磷酸二酯官能化肽。这种后期修饰方法在恒定电流条件下的未分割池中进行,可以比较容易地获得各种 C 端官能化的多肽衍生物。近期,Malins 课题组将这种电化学氧化脱羧法应用到了双喹酰胺肽天然产物类似物的全合成中[62]。该策略利用关键的电化学氧化脱羧步骤生成活性 N,O-缩醛,能够与各种亲核物结合,通过 Friede-Crafts 反应、直接有机金属加成和磺酰化化学,完成了多种肌氨酸衍生物的发散合成(图 25)。这种方法提供了之前无法获得的 C 端功能多肽,避免了直接活化多肽末端的缺陷(如异构化),从而突出了电化学技术构筑功能化多肽方面的优势。
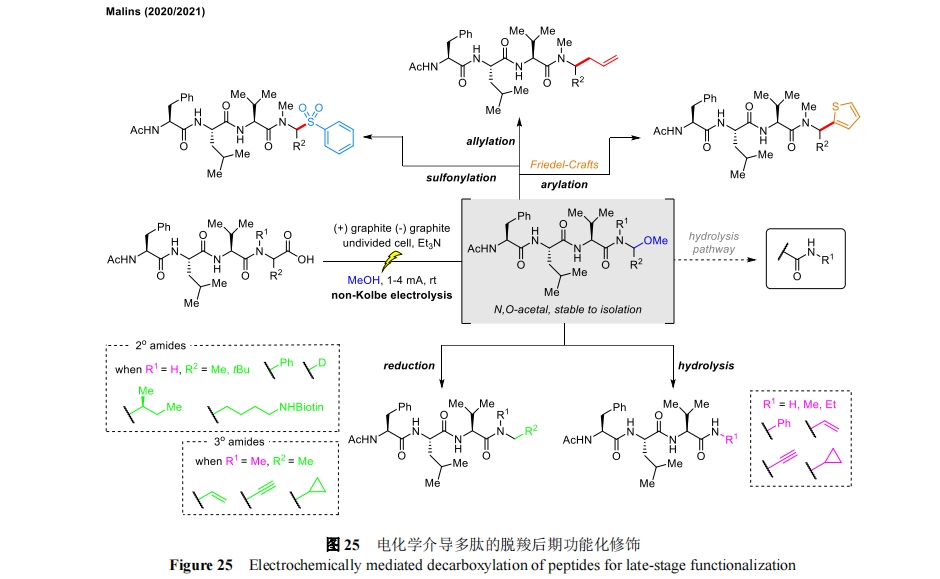
在这项研究中,作者注意到 N,O-缩醛中间体的水解是一个重要的竞争途径,特别是对于活性更强的 N,O-缩醛。所以后续的研究中通过最初的水解途径和更灵活的还原途径设计出了 α-酰胺多肽[63]。该方法可提供具有高价值功能基团的二级和三级酰胺,用于同位素标记和生物偶联反应。通过关键的非对映选择性还原,合成了天然产物嗜酸性酰胺 A 以及具有生物活性肽的相关类似物,包括抗艾滋病毒的先导肽和治疗癌症的亮丙瑞林。
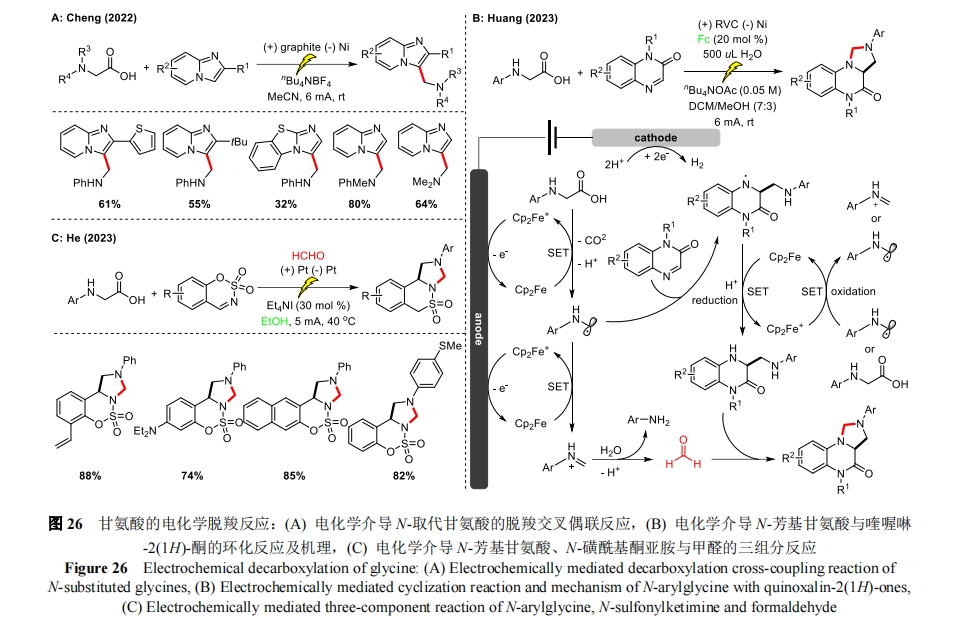
2022 年,程斌课题组实现了咪唑杂环与 N-取代甘氨酸的电化学脱羧交叉偶联反应[64](图 26A)。多种 N-取代甘氨酸在该温和条件下具有良好的耐受性,得到了一系列 C3 氨甲基化咪唑并[1,2-a]吡啶衍生物,并释放出 H2 和 CO2。机理研究表明直接与 N 相连的羧基亚甲基部分是形成临界自由基中间体的关键,并且脱羧对氨基亚甲基自由基的形成也十分重要。此外,黄精美课题组对这一脱羧反应进行了进一步的拓展,以二茂铁作为氧化还原催化剂,通过喹喔啉-2(1H)-酮与 N-芳基甘氨酸的电化学环化合成四氢咪唑并[1,5-a]喹喔啉-4(5H)-酮[65]。其中,N-芳基甘氨酸通过二茂铁阳离子的单电子转移脱羧后生成氨基亚甲基自由基,随后该自由基加成到喹喔啉-2(1H)-酮上,经二茂铁还原后生成 C3 氨甲基中间体。与上述不同的是,N-芳基甘氨酸产生的氨基亚甲基自由基会在二茂铁阳离子的作用下经另一途径氧化为亚胺离子,在水的存在下生成芳基胺和甲醛,甲醛会进一步与 C3 氨基甲基化中间体反应生成环化产物(图 26B)。在此反应中,二茂铁除了在阳极氧化,也作为中间产物的氧化剂,因此降低了该反应的耗电量。同年,何卫民课题组报道了电化学 EtOH 催化的 N-磺酰基酮亚胺、N-芳基甘氨酸和甲醛的三组分反应[66](图 26C)。其中,EtOH 兼具催化剂和反应溶剂的双重作用,简化了反应体系。
2.2 α-甲氧基化反应
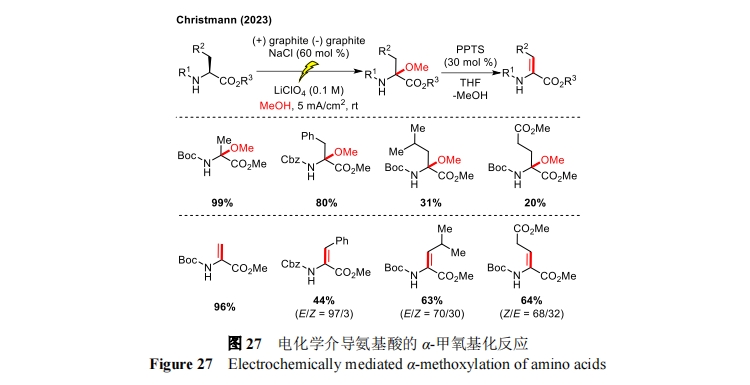
2023 年,Christmann 小组以 NaCl 为介质通过电化学氧化实现了氨基酸的 α-甲氧基化反应[67],随后通过酸催化脱氢可生成具有潜在生物活性的脱氢氨基酸衍生物(图 27)。当氨基被 Fmoc 保护时底物分解导致反应不兼容,可能是原位形成的甲氧基离子影响了碱诱导的脱保护作用。但利用碱诱导的甲醇消除作用可以实现脱氢赖氨酸和鸟氨酸的立体选择性获取。
2.3 C 末端羧基的修饰
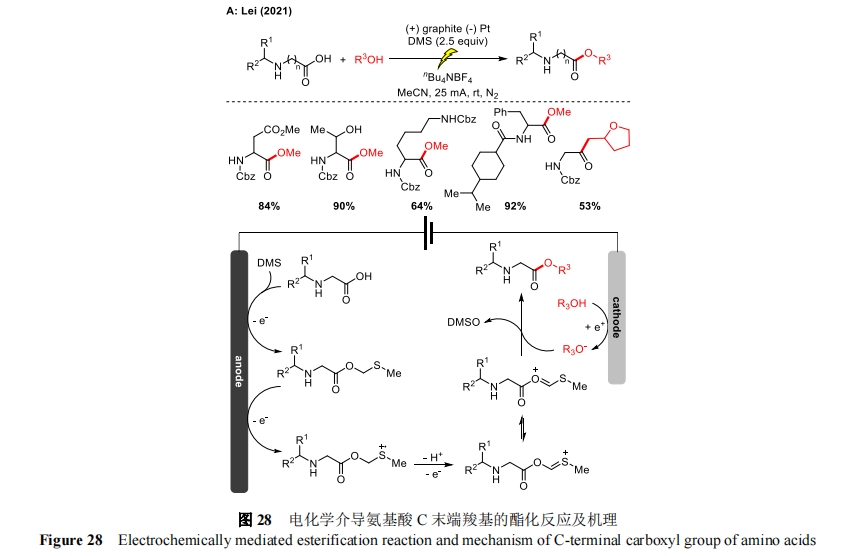
2021 年,雷爱文课题组首先报道了一种二甲基硫醚(DMS)介导的活化氨基酸的电化学氧化策略[68]。一系列氨基酸可以与醇反应,得到良好的酯化产物(图 28)。其中,纳格列奈作为治疗糖尿病的有效药物,也能在该反应中顺利得到修饰。机理研究表明,DMS 作为一种媒介在氨基酸的转化过程中起着至关重要的作用,能促进氨基酸的酯化,最后以 DMSO 的形式离去。
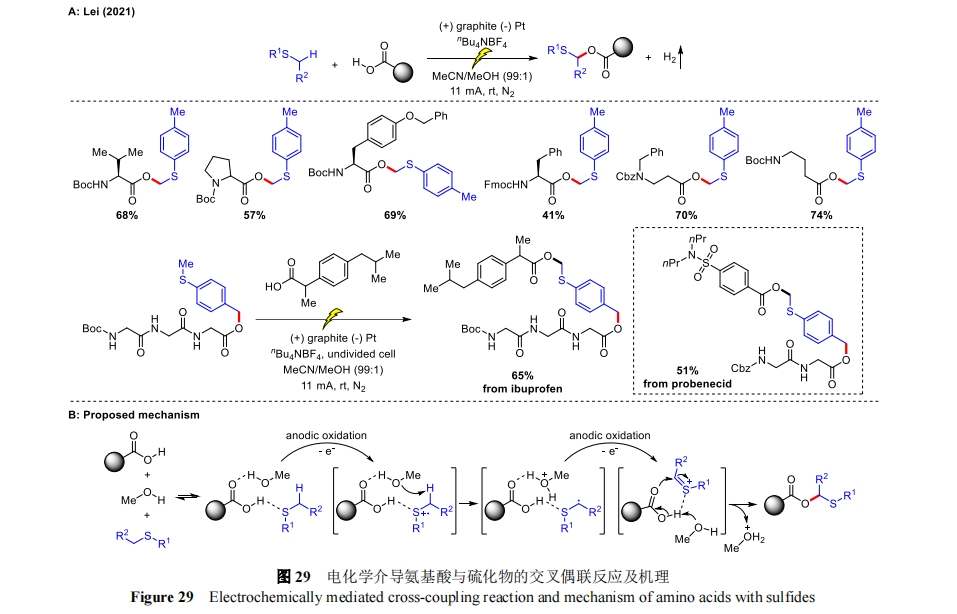
综合以上反应,从合成化学的角度发现,C―O 键的构建是 α-酰氧基硫化物合成的关键。与邻近 O/N 原子的 C-H 键活化相比,α-硫 C―H 键官能化具有较大的挑战性,因为硫原子的价态更为复杂。在氧化剂的作用下,硫化物总是很容易被氧化成硫醚或砜[69]。例如,雷爱文课题组通过阳极氧化诱导 α 硫 C―H 键活化,实现了氨基酸与硫化物的交叉偶联反应[70],合成出一系列 α-乙酰氧基硫化物(图 29A)。实验发现多种 α-氨基酸衍生物均可在室温下进行这种 C-H 键酰氧基化反应。此外,β-和 γ-氨基酸也能以良好的收率得到相应的产物。将含甲基硫化物与氨基酸片段结合后可以与含羧酸的药物分子连接,羧酸基团和甲基硫醚成功地作为目标基团准确地对多肽和药物分子进行位点选择性合成,如布洛芬和丙磺舒。更重要的是,该反应适用多种不同的亲核底物,如苯并三唑衍生物(氮杂化)、醇(醚化)和乙酸铵(酰氧基化)。值得一提的是,一种受保护的蛋氨酸衍生物也能与苯并三唑衍生物顺利进行 α-硫氮杂化生成相应产物。其中,增大电流(从 11 mA 到 25 mA)促进了含蛋氨酸二肽的酰氧基化。这种转化虽然只是单个氨基酸和二肽,但却存在着特殊意义,因为其利用了原生蛋白质的功能,突出了蛋氨酸硫醚侧链进行生物共轭的电化学潜力。机理研究表明自组装诱导的 C(sp3)-H/O-H 耦合途径具有协同效应,MeOH 的加入是该方案具有区域选择性和广泛适用性的关键所在。硫化物、羧酸和 MeOH 组装成加合物,羧酸和硫原子之间的氢键可促进硫化物的 SET 氧化。不仅如此,MeOH 可选择性地捕获质子,形成具有高区域选择性的自由基中间体,接着,被阳极氧化失去一个电子生成硫正离子中间体,最后被羧酸亲核攻击得到所需的产物(图 29B)。
3 电化学多肽合成
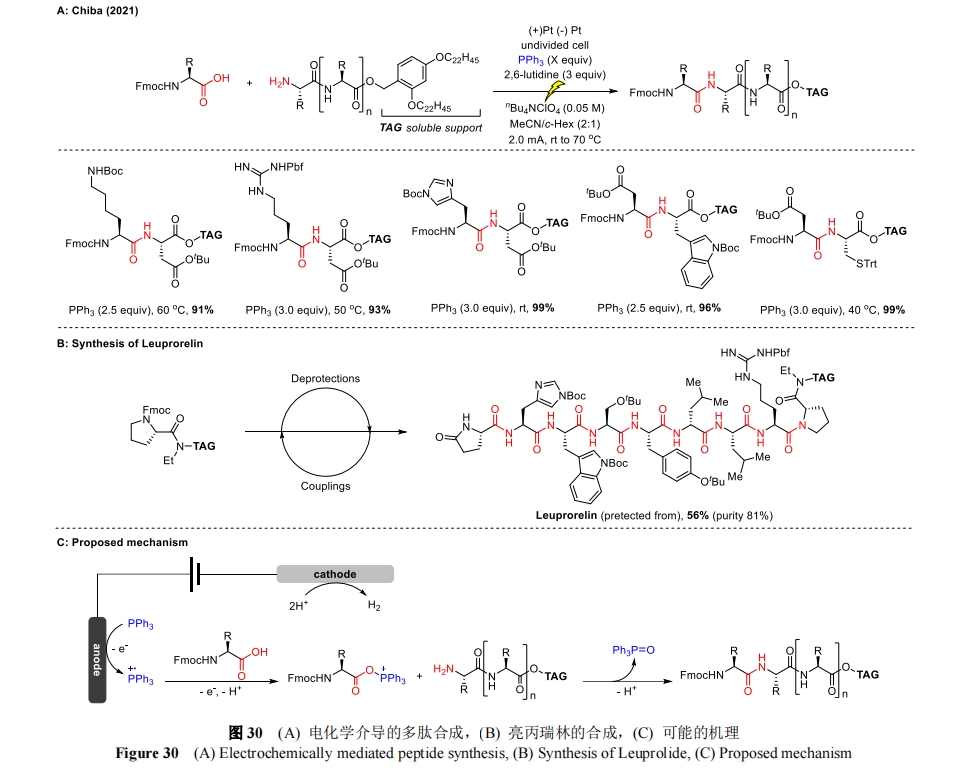
除了氨基酸残基与多肽侧链的修饰外,小分子试剂的间接电化学活化开发出了一种肽偶联方案,与传统方法相比,该方案提高了原子经济性,减少了浪费。在先前报道的电化学酰胺键构建[71]的基础上,Chiba 教授将电化学与新型的可溶性支持物辅助策略结合起来,促进了酰胺骨架的高选择性合成[72],并且不会发生显著的差向异构化。该方法利用三苯基膦的阳极氧化作用生成膦自由基阳离子,该阳离子被羧酸偶联剂捕获,形成活化的酰氧基三苯基膦离子。胺偶联物随后进行亲核进攻完成缩合反应,并释放出三苯基氧膦(TPPO)作为化学计量副产物(图 30C)。重要的是,所有常见的蛋白氨基酸,无论是作为 Fmoc 保护的羧酸偶联物,还是作为 C 端标记的胺偶联物都与该方案兼容。值得注意的是,当 Fmoc-His(Trt)-OH 偶联时观察到了部分异构化现象,以 Boc 替代 Fmoc 作为组氨酸侧链的保护基团后可以解决这一问题(图 30A)。除了二肽模块外,Chiba 还合成了亮丙瑞林(Leuprorelin),它是一种含8 个残基的多肽,作为活性药物成分具有重要的商业价值(图 30B)。最后,每一步 Fmoc 的脱保护和电化学肽偶联的平均收率都大于 95%,满足了固相肽合成(SPPS)化学所要求的迭代脱保护和偶联循环的效率标准。
上述方法之所以能够取得成功,是因为使用了一种独特的双相系统,该系统由乙腈和环己烷[73]以及极疏水的 C端标签组成。这种设计可以使三苯基膦和羧酸(在乙腈中)与胺偶联物和延长的肽链(在环己烷中)分离,从而推动电化学反应的完成,并防止胺起始物和偶联产物发生副反应。此外,该方法还能方便地从 TPPO 副产物中分离和回收所需的肽。因此,这项技术凸显了电化学方法的可持续性和多功能性,为如何利用电化学来重新设计现有的反应(如羧酸的活化)提供了一个很好的例子,并解决了多肽合成中长期存在的难题。考虑利用电化学技术在纯水介质中高效合成多肽也很有意义,尽管最近取得了一些进展[74],但这仍然是该领域的一项重大挑战,特别是对于长度超过 10 个氨基酸残基的多肽而言。
4 总结与展望
本文总结了近五年来电化学修饰氨基酸和多肽类化合物的方法,根据氨基酸种类及相关反应类型进行了分类。这些方法反应条件温和,具有固有的可调性,可以选择原生功能来修饰氨基酸和多肽底物,最大限度的保留了氨基酸侧链的兼容性。但是目前氨基酸的电化学修饰主要集中在酪氨酸和色氨酸残基上,其他氨基酸残基的修饰仅有少量报道。一方面,反应类型主要集中于脱羧反应,通过电化学实现多肽合成的研究仅有一例,后续可通过调节反应条件,设计多肽中给定残基周围的微环境,调整其氧化还原电位以实现其他氨基酸的电化学修饰,丰富反应类型。另一方面,目前对于氨基酸和多肽的立体选择性(不对称)修饰也鲜有报道,未来可考虑在反应中加入手性配体或设计含有手性中心的底物以诱导实现不对称合成,由此作为多肽修饰的一个发展方向。值得注意的是,迄今为止的大多数研究工作都是在有机溶剂和未分割的电解池中使用恒流电解法进行的。因此,后续需要探索水性溶剂与氨基酸侧链兼容的新型修饰技术,以确保最大限度地适用于各种底物。此外,也应探索分割电解池与恒压电解的应用,虽然在操作上会更为复杂,但这些反应设置可以提供更好的控制和可调性,从而提高化学选择性。另外,现有方法中使用的电极配置范围很广,这凸显了筛选各种电极材料对于探究反应选择性和最大化产率的重要性。一般地,碳电极和铂电极由于其稳定性和惰性,以及(碳电极)相对较低的成本,可能会继续作为最佳电极选择。最后,希望利用电化学策略的温和性、“无残留”性和界面性能为选择性修饰氨基酸和多肽提供独特的方法和光明的前景。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。






























