
摘 要 抗菌肽是大多数生物体中均存在的阳离子型短肽,其构成了生物免疫系统的重要部分。抗菌肽具有广谱高效的抗菌性和细胞选择性,其独特的膜破坏杀菌机制不易引起病原体的耐药性突变,有望成为新一代控制病原体的有效“抗生素”。但天然抗菌肽的提取成本高、产率低且周期长,不利于大规模生产推广,所以依托化学合成方法合成抗菌肽及其模拟聚合物应运而生。该方法为抗菌肽的设计及合成提供无限可能。本文介绍了抗菌肽的来源、结构和其作用机理并对现有的抗菌肽合成方法进行综述,阐述了现今抗菌肽及类抗菌肽的研究进展以及抗菌肽组装体的应用,最后对抗菌肽及类抗菌肽的发展前景作了展望,为开发高效、低毒的“新一代”抗生素提供重要信息和策略。
引言:作为二十世纪最伟大的医学发明之一,抗生素广泛应用于治疗各类感染性疾病,成为人类健康的卫士[1 ~ 3]。然而,近年来抗生素的大量使用乃至滥用[4],诱导了细菌耐药性的产生[1, 2, 4],导致众多耐药菌甚至超级细菌的不断出现[5 ~ 7]。据我国细菌耐药监测网( http:/ / www. carss. cn) 2015 年的监测报告显示,常见革兰氏阳性菌甲氧西林金黄色葡萄球菌(MRSA)的检出率达 35.8% ,甲氧西林耐药凝固酶阴性葡萄球菌检出率甚至高达 79 4% ,常见革兰氏阴性菌大肠埃希菌对第三代头孢菌素耐药率也居高不下,达 59% ,由此可见细菌耐药性问题日益严峻[5, 6]。与此同时,新的抗生素的研发速度远落后于新的耐药菌产生速度,而且部分制药公司由于抗生素研发成本高、经济效益逐步降低、报批挑战性大等原因退出新药研制的舞台,因此,新型抗生素的数量也在不断减少[8, 9],面对越来越严峻的事态,高效低毒、不易诱导耐药性产生的抗菌药物的研发迫在眉睫。
抗菌肽大多数生物体抵抗病原体的天然免疫防御机制的重要组成部分[10 ~ 12],具有优异的广谱抗菌性、低的生物毒性[13, 14],值得关注的是,其独特的膜破坏杀菌机理不易诱导细菌产生耐药性[12, 15],其表面正电荷与细菌膜表面负电荷间发生静电吸附,随后肽疏水端插入细胞膜内部,破坏膜结构、干扰胞内外渗透压导致病原体细胞最终死亡[12, 15, 16]。抗菌肽的开发为解决传统抗生素耐药性问题提供一个行之有效的方向,是极具发展前景的“新一代抗生素”[12]。
众多研究者对抗菌肽的理化性质、生物活性及抗菌效果等进行了研究,发现常见的抗菌肽具有两大特征:含有带正电荷的氨基酸残基(如赖氨酸、精氨酸) 和疏水氨基酸残基 ( 如苯丙氨酸、 丙氨酸等)[12],该特性是抗菌肽分子具有众多优良性能的结构基础。除去优良的抗菌活性,抗菌肽还具有抗病毒、抗肿瘤、免疫调节和促进伤口愈合等功效,不仅可以作为临床抗菌药物,也可以应用于动植物的抗感染、食品防腐等,乳酸链球菌素( nisin)在 50 多个国家和地区被批准用作奶制品、肉制品等防腐剂[17];Cubit Pharmaceuticals 公司研发的达托霉素(Daptomycin)于 2003 年获得 FDA 批准上市用于革兰氏阳性菌引起的局部感染治疗[18]。目前仍有部分抗菌肽处于临床试验审查阶段。此外,抗菌肽分子的两亲性还赋予了其在水溶液中进行自组装的能力,该组装体综合了组装体和抗菌肽的优势,拓宽了抗菌肽在药物封装、靶向释放等生物医学领域的应用[19, 20]。
本文对抗菌肽的来源、结构、作用机理以及合成方法进行了综述,并且总结了国内外类抗菌肽和抗菌肽组装体的研究进展,最后总结了抗菌肽的研究缺陷和应用壁垒,并对其应用前景进行了展望。
2 抗菌肽
最早发现的天然抗菌肽是来自于植物体内的硫素(thionin),Caleya 等通过实验证实了该多肽对多种植物病原菌的抑制作用[21, 22]。直到 20 世纪 80年代,瑞典科学家 Boman 等对惜古比天蚕蛹中提取得到的抗菌性多肽天蚕素(Cecropins)的报道[23],越来越多具有生物活性的抗菌肽才从微生物、两栖类动物、植物、哺乳动物甚至人类中分离出来,目前发现的来源于不同生物体的抗菌肽有 2900 多种,Wang[24]基于2013 年抗菌肽数据库分析了抗菌肽来源的分布,动物(76% )、植物(13% )和细菌(1.8% )是天然抗菌肽的主要来源。
细菌抗菌肽又被称为细菌素,通过细菌在代谢过程中通过核糖体合成机制产生[25],其对耐甲氧西林金黄色葡萄球菌(MRSA)和万古霉素耐药性肠球菌(VRE)等耐药菌也能起到良好的抑制作用,具有较高的选择性[25]。按照生物化学性质,细菌素又可以细分为Ⅰ类细菌素、Ⅱ类细菌素、Ⅲ类细菌素和Ⅳ类细菌素[25, 26]。Ⅰ类细菌素是一种由 19 ~ 37 个氨基酸组成的小分子修饰肽,又称羊毛硫抗生素,其分子活性部位通常含有少见的羊毛硫氨酸、甲基羊毛硫氨酸、脱氢酪氨酸和脱氢丙氨酸等氨基酸衍生物结构,如 nisin、mersacidin 等。Ⅱ类细菌素是具有热稳定性的一类未修饰的小分子多肽,包含 pediocinPA⁃1、leucocin A 等。相比于Ⅰ类和Ⅱ类细菌素,Ⅲ类细菌素是一类热敏感的大分子多肽,通常分子量大于 30 kDa,如 zoocin A、lysostaphin 和 helveticin J等。Ⅳ类细菌素是一类除蛋白之外含有脂质或碳链化合物的复合大分子聚合物, 如 plantaricin S 和leuconocin S 等。
抗菌肽作为非特异性免疫防御系统的重要组成部分,对不具备特异性免疫系统的植物体尤为重要[27]。植物抗菌肽对植物病原体以及感染人的细菌病原体都具有活性作用,基于氨基酸和二级结构的差 异, 常 见 的 植 物 抗 菌 肽 可 以 分 为:硫 素(thionin)、植物防御素、环肽类蛋白、脂质转移蛋白、橡胶素、打结素、凤仙花素、荠菜素和蜕皮素[27, 28]。
动物抗菌肽是动物机体在外界条件诱导下产生的免疫防御性活性成分,动物抗菌肽不仅具有优异的抗菌作用,还能在体内进行多种多样的免疫调节,因此其又被称为宿主防御肽[14]。动物抗菌肽来源广泛,又可以细分为昆虫抗菌肽、鱼类抗菌肽、哺乳动物抗菌肽、爬行动物抗菌肽等[29, 30]。
抗菌肽的一级结构特征是其氨基酸序列结构,一般由 10 ~ 60 个氨基酸残基组成[12, 31]。根据对天然抗菌肽的统计结果发现,天然抗菌肽通常含有赖氨酸和精氨酸,能够与水中氢离子结合赋予多肽分子正电性,所以常见抗菌肽均为阳离子型多肽[11]。在天然抗菌肽中,除了含有亲水氨基酸赖氨酸、精氨酸,同时含有多种不同的疏水氨基酸[12, 32]。抗菌肽的这种结构,使其能与带负电的细菌细胞膜的磷脂双分子层产生静电作用稳定吸附于细菌细胞膜上,随后其疏水组分插入磷脂双分子层的疏水内部从而破坏细菌的细胞膜结构[15, 16]。正电性和疏水组分是抗菌肽区别于传统抗生素抗菌机理的结构基础。
抗菌肽的二级结构复杂多样,按照其二级结构的不同,大致可以分为 α⁃螺旋结构、β⁃折叠结构、同时含有 α⁃螺旋和 β⁃折叠结构和伸展性结构[24]。α⁃螺旋结构抗菌肽中通常不含半胱氨酸,这类抗菌肽较为常见, 占目前已知二级结构的抗菌肽中的14.63%[24],如人体抗菌肽 cathelcidin LL⁃37 和秀丽线虫抗菌肽 caenopore⁃5 等。β⁃折叠结构抗菌肽中通常含有半胱氨酸形成分子内二硫键,形成特定的折叠空间结构,如植物抗菌肽 kalata B1 和人体抗菌肽 α⁃defensin HNP⁃1 等。部分抗菌肽同时含有 α⁃螺旋和 β⁃折叠结构,如贻贝抗菌肽 MGD⁃1 和人体抗菌肽 β⁃defensin HBD⁃1。除此之外,还有部分抗菌肽既不是 α⁃螺旋也不含 β⁃折叠结构,如牛抗菌肽indolicidin,其链段通常呈线型,通常称之为伸展性结构。相对于种类繁多的天然抗菌肽,目前已知的抗菌肽结构十分有限,据统计,仍有约 39.92% 的抗菌肽结构不明确[24],所以明确抗菌肽的结构特征及其生物活性的相关性依旧任重道远。
目前对于抗菌肽具有广谱抗菌活性的机理仍存在一定的争议[3, 16],不论其精确的作用方式如何,抗菌肽的活性几乎普遍依赖于抗菌肽与细菌细胞膜的相互作用,带正电的抗菌肽与脂质膜头部的负电荷产生静电作用从而稳定吸附于细胞膜上,随后疏水链段与脂质膜疏水内部作用引起脂质膜结构变化[16, 29]。针对抗菌肽与细菌细胞膜的具体作用方式,研究者们提出了 4 种膜通道形成的模型(环形孔模型、桶板模型、地毯模型和聚集模型)[33, 34]。
环形孔模型中抗菌肽的亲水部分与脂质膜的极性头部结合,疏水部分和非极性尾部结合,当抗菌肽聚集体达到一定值,抗菌肽定向垂直嵌入脂质膜中,该位移造成脂质膜向内弯曲同时疏水内部因为抗菌肽聚集体的存在形成 1 ~ 2 nm 的孔洞,导致细胞内遗传物质外渗、不能维持正常渗透压而死亡[33]。抗菌肽 magainins、蜂毒素和 LL⁃37 以环形孔模型实现抑菌作用[35 ~ 38]。桶板模型中抗菌肽聚集垂直定向嵌入磷脂双分子层中,抗菌肽成为该“桶”型簇中的“板条”,该模型与环形孔模型的区别在于垂直嵌入脂质膜时抗菌肽的正电荷面向“桶”型簇中间的空腔,不与脂质膜的极性头部相互作用[33];而环形孔模型中抗菌肽的亲水部分始终与脂质膜上极性头部作用。抗菌肽gramicidin S 通过桶板模型发挥抑菌作用[39]。
与环形孔和桶板模型相反,地毯模型中抗菌肽与脂质膜表面负电基团作用在膜表面平行排列,像地毯一样覆盖在膜表面,且当达到一定浓度后,抗菌肽像去污剂一样部分裂解脂质膜形成胶束[33],从而导致膜的不完整、细胞内物质外渗。除此之外,还有一种聚集模型,该模型中抗菌肽无特定取向,嵌入细胞膜与磷脂分子形成胶束复合物,以聚集物的形式跨越细胞膜[40, 41]抗菌肽通过跨膜通道进入细胞膜内发挥抑菌作用。
抗菌肽的杀菌作用不仅仅通过破坏细胞膜实现,部分抗菌肽还能转移穿过细胞膜,与细胞质中特定物质靶向结合,干扰细胞正常新陈代谢从而杀菌[16]。已经证实的抗菌肽非膜破坏型作用机制包括抑制核酸(DNA 和 RNA)合成,抑制蛋白质合成、折叠,抑制酶活性和抑制细胞壁合成等。
抗菌肽在生物体内发挥抗菌作用的同时对正常细胞具有良好的生物相容性,具有较为优良的选择性,这一性质主要基于细菌细胞和哺乳动物细胞的细胞膜的差别[15]。细菌细胞膜磷脂双分子层外单层富含带负电的磷脂组分,抗菌肽与带负电的细菌膜之间的静电相互作用是两者结合的主要驱动力。相比之下,哺乳动物细胞的细胞膜磷脂双分子层的外层主要由无净电荷的中性脂质组成,带负电荷磷脂大多数被隔离在磷脂双分子层的内单层,因此抗菌肽与哺乳动物细胞膜的相互作用主要是两者疏水部分的疏水相互作用(憎水而聚集),相比于静电作用,疏水相互作用很弱,抗菌肽会优先与细菌细胞作用。此外,哺乳动物细胞膜含有丰富的胆固醇,增强了细胞质膜的稳定性且削弱抗菌肽对宿主细胞的毒性。
早期,天然抗菌肽全部由研究者们从生物体中直接提取分离得到[42 ~ 45],但这种方法相对难度较大,产率低、技术要求高、成本高,无法应用于抗菌肽的规模化生产,所以抗菌肽的人工合成也是数十年来研究者们不断探索创新的热点。
研究者们主要通过氨基酸的缩合反应合成具有特定氨基酸序列的抗菌肽,合成过程中通常需要利氨基酸的官能团保护和脱保护来达到定向合成的目的。多肽的化学合成按照合成过程是否采用固相载体可以分为液相合成法和固相合成法两种。液相合成中氨基酸或短肽在溶液中进行反应,合成过程中需对中间产物进行提纯,效率低、难度大,故而目前抗菌肽合成中使用较少。
固相合成也有合成时间长、成本高等限制,且不利于多肽大批量生产和临床应用。20 世纪 40 年代, 出 现 了 一 种 用 α⁃氨 基 酸⁃N⁃羧 基 酸 酐 ( N⁃carboxyanhydrides,NCA) 开环聚合法合成聚多肽的方法[56]。NCA 开环聚合通过氨基作为亲核试剂诱导单体开环得到均聚、无规共聚、接枝共聚、嵌段共聚等结构多样的聚氨基酸产物。NCA 开环聚合具有生产成本低、产率高等优点,且能够较为便捷地合成高分子量聚多肽。但该方法所制备的聚多肽分子量分布较宽,且若是两种或多种单体共聚,其结构不均一, 难 以 用 来 研 究 其 结 构 与 其 性 能 的 关 系。Aliferis 等[57]通过改进的真空聚合法解决了这一难题。随后, Zhou 等[58]使用真空 NCA 开环聚合法合成了赖氨酸与疏水氨基酸共聚的无规两亲性聚多肽。该类抗菌肽的成功合成及对其抗菌性的探究,证明了天然抗菌肽的膜破坏抗菌机理的正确性。而且与其他研究者所设计并合成的抗菌肽不同,由于该方法中 NCA 开环聚合氨基酸序列是随机的,通常不能得到 α⁃螺旋或 β⁃折叠结构,该类多肽通常是无规线团结构。Zhou 等[59]进一步利用 NCA 开环聚合合成了由赖氨酸(K)和苯丙氨酸(F)构成的两亲性嵌段抗菌肽 Kn⁃b⁃Fm ,嵌段抗菌肽的最低抑菌浓度(MICs)低至 8 μg / mL(针对大肠杆菌)和 2 μg / mL(针对金黄色葡萄球菌),低于无规共聚抗菌肽(其对大肠杆菌和金黄色葡萄球菌的最低 MICs 均为 16μg / mL),这一结果说明嵌段结构比无规结构具有更优良的杀菌性能,这是由于嵌段结构中疏水氨基酸长链相较于无规结构中的疏水性氨基酸,能够更有效地插入细胞膜导致膜破坏。Li 等[60] 还利用具有优良生物活性的壳聚糖引发氨基酸 NCA 开环聚合,得到多肽接枝的壳聚糖共聚物,在维持抗菌活性的同时降低了生物毒性,获得良好的生物相容性。
3 类抗菌肽
Lam 等[65]利用端氨基的树枝状高分子 PAMAM引发赖氨酸和缬氨酸 NCA 单体开环聚合得到星型类抗 菌 肽, 称 之 为 结 构 化 纳 米 抗 菌 肽 聚 合 物(SNAPPs),该星型聚合物显示出了极其优良的杀菌活性,最低杀菌浓度(MBCs) 能够低至亚微摩尔级别,远低于常见抗菌肽,同时具备较低的生物毒性,为临床试验提供可能。他们还验证了线型聚合物的MBCs 值至少是星型聚合物的 40 倍,表明星型结构能够有效提高抗菌性,这可能是由于纳米结构促使局部正电荷和肽的浓度增加,增强聚合物和细胞膜的离子作用,在溶液中更易达到促使细胞膜破坏的高阈值浓度。创新的星型类抗菌肽为高效抗菌剂的研发提供了一种新的优化策略,有望成为抗击耐药菌的强有力武器。
另一类为非肽基抗菌聚合物,也可称之为聚阳离子型聚合物。这类聚合物模拟抗菌肽的正电荷来源,在聚合物的侧链上含有氨基或季铵盐(带正电荷),同时在聚合物中引入了疏水性共聚单体以模拟抗菌肽的疏水氨基酸残基。目前研究较多的聚阳离子型聚合物有以下几种:甲基丙烯酸甲酯基类抗菌肽[66 ~ 69]、尼龙⁃3 基类抗菌肽[70 ~ 72]、降冰片烯基类抗菌肽[73 ~ 76]、马来酰亚胺基类抗菌肽[77] 和乙烯醚基类抗菌肽[78]等。
上述聚阳离子型类抗菌肽均为二元无规共聚物,分别包含阳离子侧链和疏水性侧链,其杀菌作用机制与抗菌肽类似,阳离子侧链通过静电作用与负电性的细菌细胞膜结合,随后将疏水基团插入细胞膜中,导致膜破裂和细菌细胞死亡[79]。通常这种二元类抗菌肽聚合物比天然抗菌肽具有更高的电荷密度和更广泛的疏水表面,抗菌性良好的同时也体现了较大的毒性,这极大地限制了类抗菌肽的生物学应用。Chakraborty 等[80] 创新地提出增加“中性”组分的三元尼龙⁃3 无规共聚物,显著降低毒性的同时维持抗菌活性。研究者们受到天然抗菌肽中常见甘氨酸和丝氨酸残基的启发,选用类甘氨酸链段(β⁃丙氨酸残基,HG)或类丝氨酸链段(β3⁃高丝氨酸残基,HS)为“中性”组分即既不具有正电性也无疏水性,打破疏水性和总阳离子量的联动性,允许改变疏水性而不影响总正电荷量或改变总电荷而不改变疏水性,从而实现维持理想抗菌活性的同时降低溶血活性。
4 抗菌肽组装体
1993 年 Zhang 等[81] 发现了第一条自组装多肽EAK16 ( n⁃AEAEAKAEAEAKAK⁃c) 后,大量研究表明多肽组装体在现今功能材料制备、基因治疗、生物传感器、组织工程以及临床医疗等领域具有广阔的应用前景,因此多肽的自组装逐渐成为多肽研究领域的研究热点。抗菌肽作为一种至关重要的功能性多肽,其组装体的研究与应用对生物医学的发展意义重大。组装体形貌受聚合物结构、亲疏水组分比例和组装环境等影响,能够组装成囊泡、胶束、纳米片层结构等。
Gao 等[82]合成一种抗菌肽接枝的超支化聚合物,其能够组装形成具有低阳离子电荷( + 6.1 mV)的纳米片层结构。该研究指出在杀菌过程中纳米片层结构能够有效包裹细菌并穿透细胞膜导致细菌死亡,即使在较低的阳离子电荷浓度下也能达到高效杀菌(MICs = 16 μg / mL)。这一独特的“包裹穿透”作用机制为新型抗菌剂的结构设计提供新的思路。
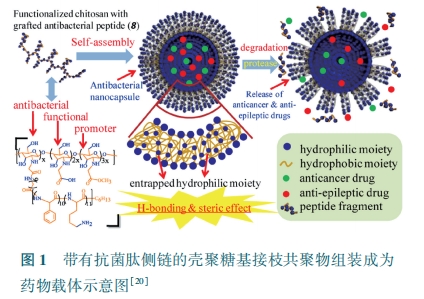
除去搭载抗癌药物外,Zhou 等[64] 还设计合成了一种类肽交替共聚物囊泡,搭载骨修复生长因子,在发挥抗菌作用改善骨修复中的炎症问题的同时,释放生长因子促进骨修复。由此可见,抗菌肽组装体作为多功能的药物载体,能够在递送生物活性分子或药物的同时极大地减少了临床医疗过程的病菌感染等并发症影响,尤其,抗菌肽囊泡还能实现药物的可控释放,提高药物利用率,在临床医药领域具有广阔的应用前景。
5 总结与展望
抗菌肽及类抗菌肽的聚合物是具有广泛前景的抗生素替代物,其独特的抗菌机制是对抗耐药菌威胁的有力武器,抗菌肽的深入研究将会开创新型抗菌药物开发的新纪元,在动植物抗病、食品防腐剂、化妆品、临床抗菌药物等方面具有广阔的应用前景,其多功能组装体进一步拓宽抗菌肽在药物包载、临床医疗、组织工程、生物传感等领域的应用范围。
目前,实现抗菌肽的生产与应用仍有诸多问题需要探索。首先,抗菌肽杀菌分子机制尚未有明确的定论,此外,目前针对抗菌肽的毒性与其结构的研究缺乏。抗菌肽普遍通过膜相互作用来实现抗菌作用,不可避免会对正常细胞产生毒性。肽的溶血活性与正电荷密度、疏水性、两亲性和螺旋度的相关性已有一定的研究基础,为高选择性高效抗菌肽的合理设计、优化提供理论依据。其次,尽管抗菌肽具有很高的体外抗菌活性,但是在体内环境下抗菌活性会受到一定影响。部分肽的盐敏感性导致其在生理盐水中受到强烈拮抗,降低生物活性。此外,抗菌肽在体内的药效学和药代动力学的研究也存在严重不足,涉及抗菌肽在体内的聚集问题、体内半衰期特别是对哺乳动物体内酶的敏感性以及所需的给药频率等。这些问题的解决对合理设计给药方案、最小化生物毒性、增加抗菌肽耐受性等具有重要意义,也将推动抗菌肽的临床应用稳步前进。
不可忽视的是,合成抗菌肽的高成本依旧是其广泛应用于临床的主要壁垒,一直以来抗菌肽的制备一直存在着成本高、产率低、工艺复杂等问题。随着对抗菌肽的研究日益深入,对商业规模的抗菌肽生产平台的需求也日益增长,目前发展方向倾向于效果优异的短肽开发,这是降低合成成本的有效途径。
适于临床应用的抗菌肽应当具备以下特点:在复杂的不同环境下包括人体内(血清、组织液等)具有稳定的抗菌活性、抵抗体内蛋白酶的迅速降解、无显著生物毒性。随着对抗菌肽、类抗菌肽的作用机理、构效关系、药效学等的深入研究,抗菌肽一定会得到长足的优化,在制药行业、化学防腐剂、医疗器械抗菌涂层等方向持续发挥作用,特别是制药行业,成为解决传统抗生素的耐药性的重要武器,对人类健康事业产生深远的影响。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。