
摘 要 金属元素常见于天然蛋白质分子中,并扮演着不可或缺的重要角色。对金属与氨基酸的配位方式的不断深入理解,有助于人工设计新型的金属⁃多肽配位模式,并在多肽结构功能优化、分子组装、标记与成像以及药物设计等领域获得更广泛的研究和应用。本文首先简要介绍蛋白质中的不同基团与金属离子之间的配位模式以及具体的研究案例,进而介绍了金属配位在多肽分子的二级结构调控、超分子结构组装、多肽及蛋白质的荧(磷)光标记、蛋白质折叠方式分析等基础研究中的应用。最后,对上述研究领域为金属⁃多肽类分子探针或药物的设计优化所提供的发展潜力进行展望。
在天然生物分子中,金属元素扮演着不可或缺的重要角色。例如在已知结构的蛋白质分子当中,大约有近一半的分子含有一个或多个金属元素。这些金属元素通过配位相互作用,同肽链中的咪唑基、巯基、羧基、氨基或其他基团形成稳定结构,在多种重要生物学现象,如光合作用、酶催化反应、DNA 复制、RNA 转录、蛋白质翻译等中起着关键作用。随着多年来的研究,人们对一些常见金属元素如铁、铜、锰、锌、钙、镁,以及自然界较少见的金属元素如镍、钒、铂、金、铱或类金属元素如砷等与蛋白质多肽分子之间作用机理的了解不断加深。这些认识进一步推动了新型金属配位化合物的人工设计与合成,并用于蛋白质和多肽的功能研究。
金属元素在天然生物分子体系中的作用大致可以分为两个方面,一方面是金属对蛋白质分子起到了结构性的稳定与维持作用,例如在核酸转录因子中常见的锌指结构,锌原子通过与蛋白质序列中的组氨酸与半胱氨酸的组合配位,形成非常特征的 β转角结构,以满足与 DNA 结构相结合的需要。另一方面是金属及其复合物参与了生物过程并提供不可替代的功能性作用,例如在血红蛋白中的二价铁离子,通过与氧分子的结合和释放,承担了在血液中输氧的功能。在人工设计的金属(类金属) 与多肽蛋白质的配位相互作用中,金属也可以从上述两个方面发挥作用,例如提供针对特定多肽序列或蛋白质构象的结构稳定与组装功能,以及提供包括荧(磷)光成像、放射性治疗、核磁造影等内在功能,并可在进一步优化设计后构建具有复合功能的生物探针或治疗分子,用于生物医学的研究。
本文首先回顾和例举多肽与蛋白质中的不同基团与金属或类金属离子之间的主要配位作用方式,进而归纳近年来在该领域中比较突出的几类应用实例,例如金属配位化合物在多肽分子的二级结构调控、超分子结构组装、多肽及蛋白质的荧(磷) 光标记与示踪、蛋白质结构域折叠方式分析等基础研究领域的不同程度的应用,并展望了上述研究为金属⁃多肽类分子探针或药物的设计优化所提供的发展潜力。
2 多肽序列中的配位化合物结合位点
在许多生命活动中,金属离子的配位可以有效地影响多肽的二级结构,驱动蛋白质折叠和组装,从而调控功能蛋白质的生物活性。了解多肽链中各基团与不同金属离子的配位方式和能力将有助于人工设计和优化多肽与金属的配位结构。而对天然的功能多肽片段,则有望通过配位化合物的结合,模拟天然的结构,获得优化的生物活性。作为多肽的结构单元,常见的 20 种氨基酸均由 C、H、O、N、S 等元素组成。其中,以羧基(—COOH)中的氧原子、咪唑基团所含的氮原子以及巯基(—SH)所含的硫原子的给电子能力最强,最易参与配位反应。利用蛋白质数据库(Protein Data Bank, PDB)分析发现,在生物系统中各种氨基酸残基参与金属离子配位的频率最高的是谷氨酸(Glu)和天冬氨酸(Asp)的羧基,组氨酸( His) 的 咪 唑 基 团 以 及 半 胱 氨 酸 ( Cys) 的 巯基[1,2]。
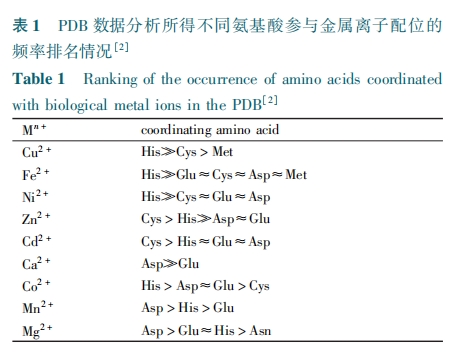
羧基在生理 pH 条件下完全去质子化,提供具有很强配位能力的—COO- 基团,在与金属离子的相互作用中扮演重要的角色。例如脊椎动物的肌肉收缩就需要通过肌钙蛋白与 Ca(Ⅱ) 的相互作用来进行调控[3]。一般来说,肌钙蛋白中 Ca(Ⅱ) 结合位点有多个,而在无脊椎动物中,却会因为关键结合位点的氨基酸不同,而丢失部分 Ca(Ⅱ) 的螯合能力[4]。参与 Ca(Ⅱ) 配位的关键氨基酸残基便是Asp 和 Glu 的 羧 基[5]。近 期 围 绕 帕 金 森 病(Parkinson̓s disease, PD)的研究表明,PD 相关基因PARK9 编码的蛋白质主要通过 Asp 和 Glu 的羧基以及 His 的咪唑基团螯合 Mn(Ⅱ),来防止 Mn(Ⅱ)引发的 PD 相关症状[6]。常见的通过 Asp 和 Glu 与多肽配位结合的过渡金属主要包括:Ca ( Ⅱ)、Mg(Ⅱ)、Mn(Ⅱ)等[7]。
通过 N 原子提供配位电子的基团主要包括—NH2和咪唑基团。位于肽链主链 N 末端的伯胺基团(α⁃NH2 ,pKa = 8.9)具有较好的参与配位的能力,相对而言赖氨酸侧链末端的氨基 ( ε⁃NH2 , pKa =10.79)在中性条件下的配位能力则很弱。在常见的 20 种氨基酸中,组氨酸与金属离子之间的配位作用,在天然生命活动过程中具有十分重要的意义。组氨酸的咪唑基团上的 3 位氮原子在中性条件下(pKa = 6.04)即可去质子化,为金属离子与蛋白质的结合绑定提供了重要的接入位点,调控各种蛋白质的功能。
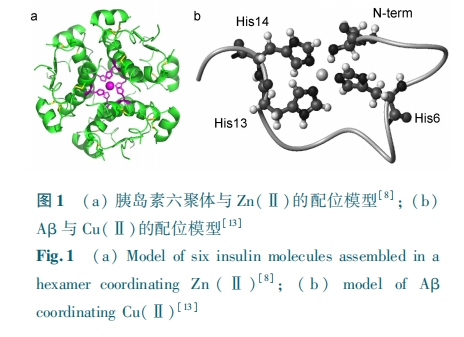
另据报道,Cu(Ⅱ) 和 Zn(Ⅱ) 都可以与 β⁃淀粉样蛋白多肽 ( amyloid β, Aβ) 结合,导致 Aβ 聚集,与老年痴呆症 (Alzheimer.s disease) 的进程密切相关[11]。Cu(Ⅱ) 或 Zn(Ⅱ) 的配位会导致 Aβ 多肽的结构变化[12,13],参与配位的关键位点正是多肽序列中 N 末端的氨基和三个组氨酸的咪唑基团(图1 b)。
这些例子都表明,针对特定金属离子所设计的多肽类螯合剂,在相关疾病的治疗中具有广泛的应用前景。而另一方面,也显示出组氨酸的咪唑基团作为关键氨基酸残基,参与配位反应的能力和应用的广泛性。因此,在多肽的设计中,组氨酸可以很好的为配位化合物的结合提供位点。常用的通过组氨酸与多肽配位结合的过渡金属主要包括:Zn(Ⅱ)、Cu(Ⅱ)、Ni(Ⅱ)、Co(Ⅱ)、Pd(Ⅱ)及 Ru(Ⅱ)[14] 和Ru(Ⅲ)[15]等。

某些富含半胱氨酸、有突出的金属配位能力的蛋白质被统称为金属硫蛋白(metallothioneins)[18]。正是巯基中硫( S)原子良好的给电子能力,使其可以作为良好的电子供体参与配位反应,从而让半胱氨酸成为多肽序列中良好的锚定位点,被广泛应用于配位化合物参与的多肽结构稳定的设计领域。与含有半胱氨酸的多肽配位结合能力较强的金属离子还包括:Pb (Ⅱ)[19],Cd (Ⅱ)[20,21], Hg (Ⅱ)[22],Ni(Ⅱ)[23],以及类金属元素例如下文将提到的 As(Ⅲ)等。
3 金属配位对多肽结构的影响
天然多肽序列由于结构上过度柔性,导致稳定性差,面临着易被体内尤其是胃肠道的各类酶水解,体内循环滞留时间短等问题。功能多肽的生物利用率低,限制了多肽作为药物制剂的实际疗效[24]。大部分处于蛋白质与蛋白质相互作用(PPIs)关键界面的多肽序列的结构特征与多肽的生物活性之间存在着必然的联系。配位化合物的绑定,对多肽结构具有显著的影响:一方面,体现在对多肽结构柔性的改善,使其获得受到限制的稳定构象,有效地提高抗酶解能力和识别受体的选择性;另一方面,这种配位可以驱动结构松散的多肽序列折叠或组装形成固定的结构,从而具有更好的生物活性。
因此,人工设计的功能多肽序列前体,通过在特定位点引入的特殊氨基酸残基为配位化合物的绑定提供位点,即可以配位结合的方式限制多肽,使其维持稳定的、具有更好生物活性的特殊结构。让多肽模拟其在天然蛋白质中稳定的构象,有效地提高其稳定性和抗剪切能力。同时,这种模拟可以转化成多肽药物前体新陈代谢的稳定性、识别专一性以及生物活性,让多肽展示出更好的生物学功能,并保留其优良的生物相容性和安全性[25]。大量的报道表明,金属离子的螯合可以引发或影响多肽的折叠,这里将主要介绍一些利用配位化合物使多肽获得固定的构象和优化的生物功能的具体设计方案。
针对 PPIs 的分析表明,许多处于关键交互界面的多肽为环状(loop)结构[26]。多肽的环化,是对天然蛋白质功能结构的模拟,可以让多肽具有在蛋白质中明确的构象。某些具有靶向识别功能的短肽序列,将其首尾连接形成环状结构,可以有效地提高其结构的稳定性和受体的亲合力,展示出更优越的生物活性。例如整合素靶向短肽序列 RGD[27]、N⁃钙粘 蛋 白 靶 向 肽 HAV[28]、 黑 色 素 瘤 靶 向 肽 α⁃MSH[29 ~ 31]、conotoxin等。
除了传统的通过二硫键或首尾酰胺缩合的方法让多肽成环之外,利用金属配位化合物与多肽相互作用来构建环化结构的方法,为多肽的环化设计注入了新的思路。利用金属铼( rhenium, Re) 和锝(technetium, Tc)配位化合物与半胱氨酸配位,研究人员成功地使 α 促黑激素肽(α⁃MSH)形成稳定的环状结构,有效提升了其靶向功能[29]。基于有机环金属 Ir(Ⅲ) 配位化合物与组氨酸的配位方案,也被成功用于 HRGDH 多肽的环化,有效提升了靶向多肽的选择性[33]。
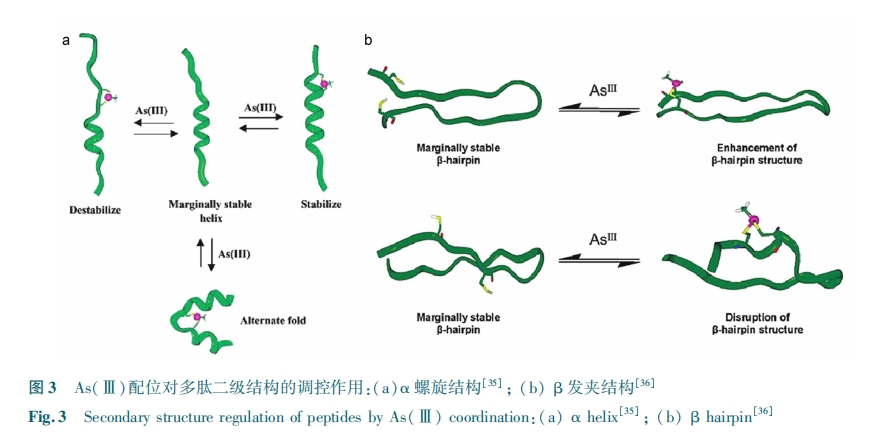
金属元素与多肽的多价化配位结合模式决定了其不但可以在分子内提供多肽折叠成具有特殊二级结构,还可以介导分子间的相互作用,构建出理想的三级或四级结构,有望进一步用于超分子功能多肽/蛋白质架构自组装的设计和调控。
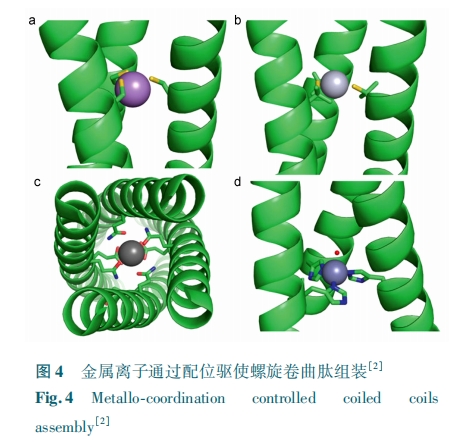
通过在多肽结构上进行配位氨基酸的多价位设计,可以进一步利用金属配位,实现对多肽自组装的诱导与结构强化。例如,利用 Zn(Ⅱ) 与组氨酸配位, 实 现 β 淀 粉 样 多 肽 组 装 的 控 制[39];利 用Pb(Ⅱ), Zn(Ⅱ), Cd(Ⅱ), Hg(Ⅱ)与 β 折叠多肽内设计的半胱氨酸的配位,可以同时实现 β 折叠结构的稳定以及多肽水凝胶的形成[40];通过在 α 螺旋肽的 i, i + 4, i + 7, i + 11 位置上引入羟基谷氨酸,可以使其在 Ca(Ⅱ)离子存在的情况下,产生螺旋,并自组装形成平行或反平行的结构组合[41,42]。金属元素通过配位反应控制多肽材料的组装和功能复合化将有望应用于组织修复与再生等医学领域。
4 基于配位作用的多肽荧光标记在生物学中的应用
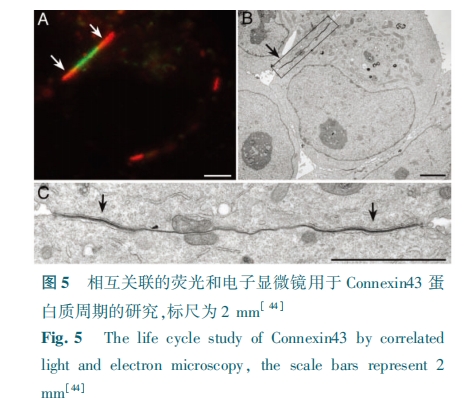
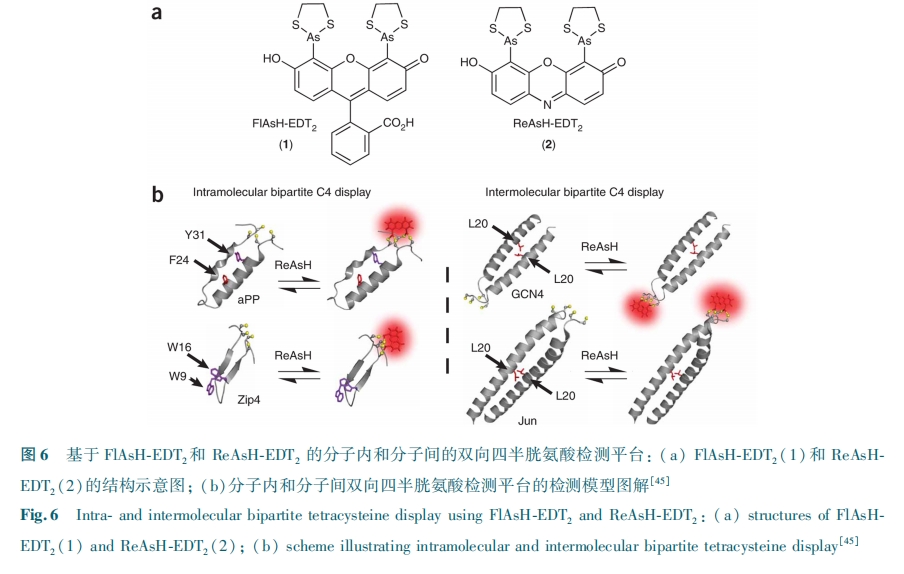
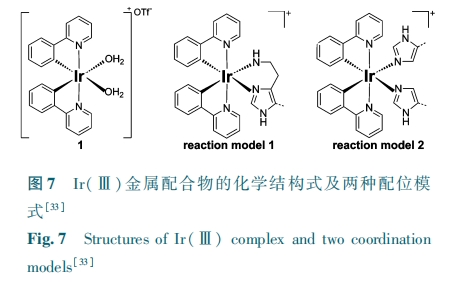
这种 Ir(Ⅲ) 配合物与组氨酸之间的第二种配位模型被进一步应用于多肽结构上的稳定环化,同时赋予多肽复合物良好的多重生物学效应包括优化的入胞效率、靶向性以及与毒性多肽 KLA 耦联后展示出的选择性抗癌活性等[33]。
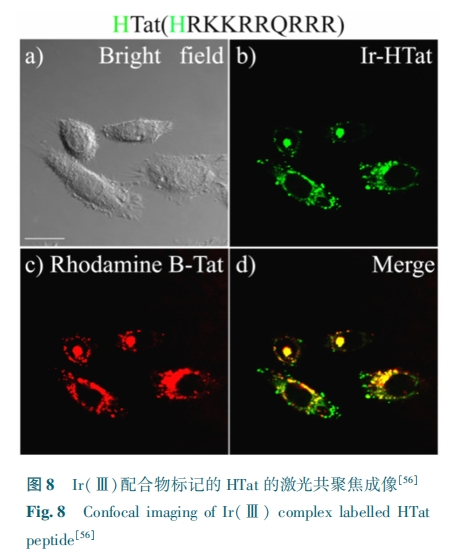
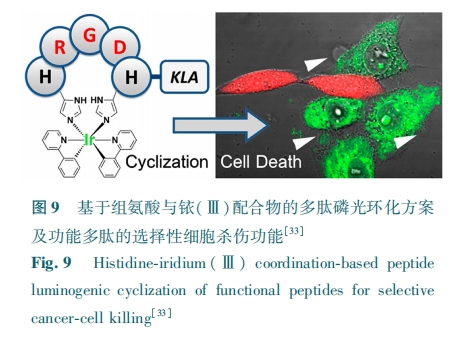
总的来说,这种新型的磷光多肽环化方法是多肽标记和结构优化的理想结合。配位反应带来的磷光为功能多肽的追踪提供了必要的监测信号,为后续的细胞行为观测和机理分析提供了极大的便利。而配位赋予多肽环状结构的同时提供了良好的亲脂性,对多肽本身的生物功能以及入胞能力都有显著的优化效果。
5 展望
不同的配位化合物与多肽的结合,具有各自特殊的氨基酸偏好。而这种配位反应所具备的选择性,让我们可以根据不同的情况和需求设计多肽序列,让配位发生在我们预期的位点,从而用于限制多肽的二级结构,驱动多肽的折叠,优化其生物活性等。虽然有大量的报道不断揭示着各种氨基酸与不同金属离子之间的配位模型,但真正将这种相互作用深入应用到生物学中的成功案例并不多见。本文着重介绍的两类具有代表性的带有荧/ 磷光的配位模式,其配位反应机理明确,选择性强,尤其重要的是配位产物所产生的荧/ 磷光信号。这类配位体系具有独特的优势:(1)与传统的利用 EDC、琥珀酰亚胺等共价连接荧光素分子的多肽荧光标记方法相比,这种基于配位化合物与多肽的配位反应具有反应过程简单快速、条件温和、反应效率高、选择性高等优点;(2) 配位反应发生与荧/ 磷光信号的产生直接关联,可以用于辨析配位反应的发生,同时有效降低多肽蛋白质标记的背景荧光信号;(3) 配位反应一般为多价的配位模式,即同时需要多个特殊位点的氨基酸提供锚定位点,有效地保证了标记反应的特异性。一般来说,配位相关的位点(价态)越多(高),配位反应发生的特异性就越强。在活细胞的蛋白质/ 多肽标记的应用中,通常需要更高的特异性,而在蛋白质折叠和相互作用分析的应用中,较低的配位价态可以带来更普遍的结构适用性。
此类配位化合物与特定的多肽序列配位产生的荧光信号,可以用于蛋白定量分析、细胞成像与多肽类药物示踪,以及蛋白质折叠的检测、驱使未闭合的环状多肽参与相关 PPIs 以及针对目标分子亲合力的高通量筛选。我们期望通过本文为化学与生物学领域的研究者提供一个多肽与金属配位研究的概述,期待未来化学生物学领域的研究继续发展高质量分子探针,让配位化学在生物学中展示更大的魅力和实用价值。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。