
摘 要: 细胞穿透环肽能够穿透细胞膜,特异性地靶向细胞内靶标,并具有较好的体内稳定性,因而具备很好的成药性,并受到研究者越来越多的关注。目前,主要有两种方式获得细胞穿透环肽,即从天然产物中获得和对已有的环肽或线性肽进行化学修饰。本文主要对上述两方面进行简要综述,重点介绍两类细胞穿透环肽天然产物以及通过化学修饰方法得到细胞穿透环肽的策略,并探讨细胞穿透环肽的结构-活性关系及其细胞穿透机理。
多肽类药物是新兴的生物药物研发热门领域,全世界已经获批上市的多肽类药物超过 50 个。与小分子药物比较[1,2],多肽类药物具有结合面更大、作用靶向性更强、更安全、副作用更小、很少引起严重的免疫反应等优点[3,4],已经广泛应用于癌症、心血管病、代谢类和传染性病等各类疾病的治疗。
但是,常见的多肽分子存在无法跨越细胞膜,酶解稳定性差和口服生物利用度低等问题[5],导致大多数具有治疗作用的多肽药物很难进入细胞内发挥药效,且容易在体内降解[6],因此,多肽药物在实际应用中受到了极大的限制。为了克服多肽药物存在的问题,人们发现并发展了一类细胞穿透环肽分子,它们具有穿过细胞膜的能力,并能特异性地靶向细胞内靶标,体内稳定性高,口服生物利用度好,更具成药前景。另一方面,蛋白化学合成领域取得的一系列重要进展[7 ~ 15],促进研究者发展了一系列化学合成环肽的方法[16 ~ 20],为研究和改造环肽从而得到细胞穿透环肽奠定了技术基础,有效解决了细胞穿透环肽分子的获取问题。
本文重点介绍目前已经发现的细胞穿透环肽及其透膜机理,同时也简述各种获得细胞穿透环肽的化学修饰策略,最后讨论该领域存在的问题,并展望细胞穿透环肽的应用前景。
2 天然产物中的细胞穿透环肽
环肽是自然界中一类广泛存在的天然产物,可以通过核糖体或非核糖体途径合成,具有抗菌、镇痛、抗肿瘤、抗免疫等生理作用。其中,某些环肽具有穿透细胞膜的能力,即本文所述的细胞穿透环肽环孢素( cyclosporine A)和植物环肽( cyclotides)。
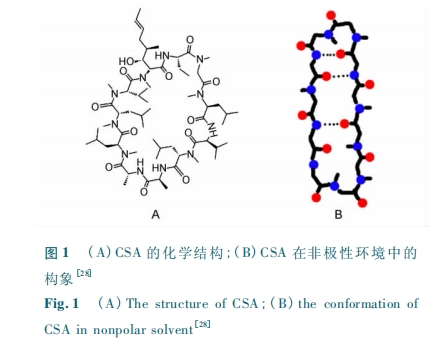
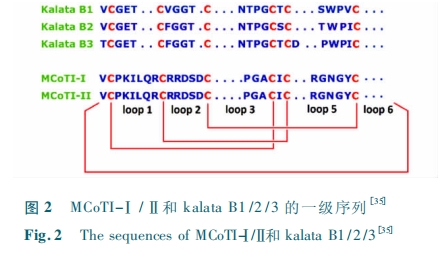
研究表明,现已发现的植物环肽来源的 4 个细胞穿透环肽的跨膜机理各不相同。MCoTI-Ⅱ通过细胞主动摄取的方式进入细胞。荧光成像跟踪技术表明,MCoTI-Ⅱ出现在吞噬小体中,并且细胞摄取过程对温度敏感,说明 MCoTI-Ⅱ 的跨膜过 程 是 主 动 过程,需要消耗能量[36]。MCoTI-Ⅰ的跨膜机理则较为复杂,是流体相内吞作用( fluid-phase endocytosis)、依赖脂质的内吞作用和网格蛋白介导的内吞作用等共同作用的结果[35]。而植物环肽 kalata B1 有细胞毒性,超过一定浓度时会导致细胞膜破裂,引起细胞死 亡。实 验 发 现,kalata B1 和 磷 脂 酰 乙 醇 胺( POPE ) 有 相 互 作 用,可 以 引 起 POPE 外 翻( transbilayer movement),从而导致细胞膜两侧的不对称。Craik 等猜测 kalata B1 通过与细胞膜的相互作用,改变细胞膜的曲率,从而引起细胞的内吞作用[36]。另一方面,kalata B1 与细胞膜的亲和性与脂筏相关,带负电的胆碱并不是细胞膜与 kalata B1 发生强相互作用的原因[37]。
植物环肽细胞穿透过程的研究还处于较初级的阶段。一方面,其结构在跨膜过程中的作用还不够明确。在研究植物环肽的跨膜过程时,实验条件的差异会导致不同的实验结果。比如实验中选择的细胞系对内吞方式的偏好程度不同、所用植物环肽的浓度不同等,都会对结果产生影响。同时,当前只能通过改变残基的方式来探究各个位点对整个跨膜过程的贡献,还无法实时监测环肽的构象变化对跨膜过程的影响。另外,对跨膜过程中的细胞吞噬行为的理解十分有限。除对网格蛋白介导的吞噬作用和细胞膜窝样内陷( caveolae) 介导的吞噬作用理解较多外,生物学家对其他类型的细胞内吞行为的理解并不深入。这也阻碍了研究者对植物环肽跨膜过程的进一步理解。因此,发展新型技术研究植物环肽跨膜特性的结构-活性关系仍是一个尚待解决的科学问题。
3 人工改造的细胞穿透环肽
细胞穿透环肽具有很好的成药前景,这促使研究者利用化学合成手段对多肽分子进行改造,以期获得兼具强生理活性和跨膜能力的环肽分子,甚至环肽库。下面将从 CSA 的改造、植物环肽的改造和线性肽环化等三方面策略进行介绍。
基于 CSA 的细胞穿透环肽的设计思路包括调节环肽的构象和多肽骨架酰胺 N-甲基化两方面。
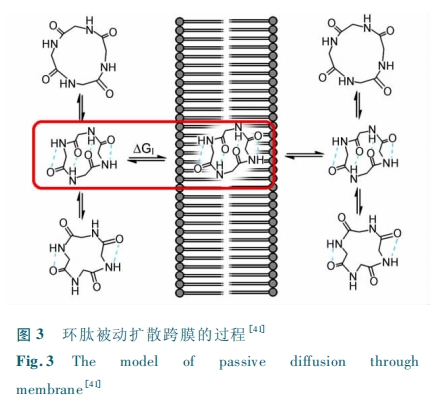
为了更加定量地研究并预测环肽被动扩散跨膜的能力,Lokey 和 Jacobson 等提出了一种新的预测方法[42]。假设环肽在细胞膜中的构象(低介电环境构象 low-dielectric conformation,LDC) 只有一种,他们指出,经典的扩散模型 Pe = KpD / d 中的 Kp应理解为 LDC 在细胞膜和水相中的分配系数,而不是通常实验所测得的所有构象下的平均值。他们提出,可以通过分子动力学计算得到 ΔGI ( 利用公式 ΔGI =- RTlnKp ),从而可以理论计算出渗透率。他们指出,这个模型的预测能力比预测氢键数目和预测极性表面积更加准确。尽管他们计算出的 ΔGI和实验测得的 lnPe呈线性关系,但比例系数却并不一致,因为计算中没有考虑熵效应;另外,环肽分子尺寸和形状等因素也没有考虑在内,并且实验验证量很小,其模型的正确性还有待检验。
对经被动扩散跨膜的环肽而言,预测并通过化学修饰的方法改变 LDC 构象,从而减小环肽从水相向细胞膜迁移中的吉布斯自由能变是研究的关键点。所以,认识化学修饰对环肽构象的影响是其中重要的科学问题。然而,在现有的被动扩散跨膜的环肽实例中,其残基基本都是不带电荷并且是非极性的,说明这种跨膜策略对氨基酸残基的要求较高,对极性和带电荷的残基的容忍度较低。针对这个问题,可以适当引入容忍度较大的非天然氨基酸以提高被动扩散策略下环肽的多样性;另一方面,可以利用细胞内外 pH 或酶活性的差异,设计 pH 响应或酶响应残基,在细胞外其极性被掩蔽,在细胞内去掩蔽,激活环肽的正常生理活性。
除了多肽构象变化对跨膜能力有贡献,多肽骨架的酰胺 N-甲基化对跨膜能力也有影响。骨架酰胺 N-甲基化修饰在天然产物中很常见。在特定位置引入 N-甲基可以增强多肽与受体间的相互作用、增强多 肽 对 靶 标 的 选 择 性 或 改 变 蛋 白 的 聚 集 行为[43 ~ 45]。
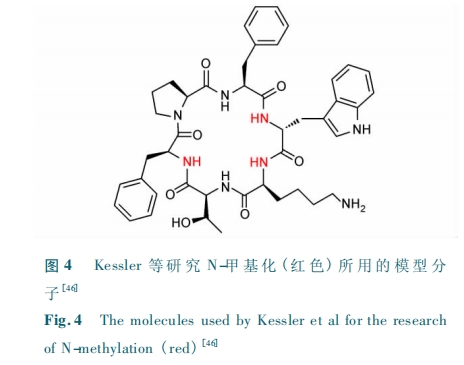
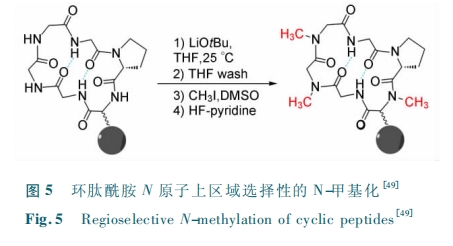
以上工作表明,N-甲基化可以通过改变环肽在水相中的构象来提高其跨膜能力。在前人工作的基础上,Kessler 等系统地研究了 N-甲基化对环肽构象的影响[50]。他们选择环六肽 cyclo( -D-Ala-Ala5 -) 作为研究对象,分析不同 N-甲基化衍生物在水相中的二维核磁结构。他们认为 N-甲基化会从以下三方面影响环肽 β-转角结构的形成,从而导致跨环分子内氢键的出现: ( 1 ) 肽键的顺、反式; ( 2 ) 对骨架上N—H 氢键的掩蔽作用;(3 ) 扭曲环肽原本的结构。他们发现,实验中所得到的一些典型的 β-转角结构在前人 发 现 的 N-甲 基 化 细 胞 穿 透 环 肽 中 有 对 应物[22,4 6 ,47]。另外,他们指出某些结构特殊的氨基酸可以起到在环肽中引入 N-甲基化或 D-型构象的作用,例如 α-N 甲基化的脯氨酸和具有对称性的甘氨酸。
以上这些发现对细胞穿透环肽的设计有指导作用,但是其中仍存在一些问题。比如,研究系统多是环六肽,所以无法知晓当环增大后,跨环氢键与 N-甲基化之间具有怎样的协同或其他相互影响。同时,其他位置 N-甲基化对 β-转角的形成有怎样的影响也不明了;同时,环增大后,基于筛选的 N-甲基化策略将变得更为困难,因为需要合成的衍生物数量呈指数上升。所以,需要发展可以快速得到大量细胞穿 透 环 肽 的 N-甲 基 化 修 饰 方 法。Jacobson 和Lokey 等[49]报道的选择性甲基化的工作对此具有一定启发性,但是距离目标实现还有较大差距。
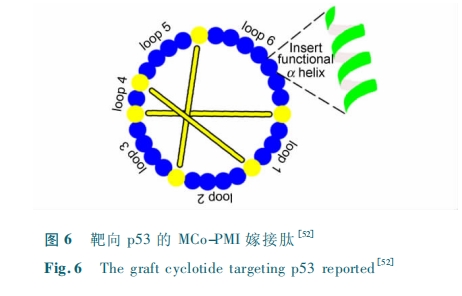
虽然目前已经发现一些植物环肽可以通过细胞膜,并且其中的某些环肽如 MCoTI 和 Kalata B 作为多肽骨架被用于嫁接多肽的研究,但是由于植物环肽的跨膜方式多为细胞主动摄取,需要消耗能量,并且过程复杂,机理不明。同时,其过程不像被动扩散一样广泛存在于小分子药中。因此,植物环肽跨膜效率仍不明确,对不同细胞的耐受度也不清楚。故而,需要进一步搞清介导植物环肽跨膜的分子机制;同时,还需要系统地研究可以进入细胞膜的植物环肽在人体内的药代动力学,搞清其跨膜效率及在体内的分布状况。在对植物环肽的跨膜结构基础和药代动力学认识深入后,可利用化学手段优化环肽结构,使其在体内的行为更符合成药的要求。
为使线性肽环化后得到环肽具有细胞穿透能力,通常使用的策略包括侧链环化的“订书肽”策略和在环肽中引入细胞穿透序列。
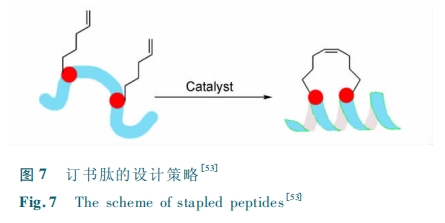
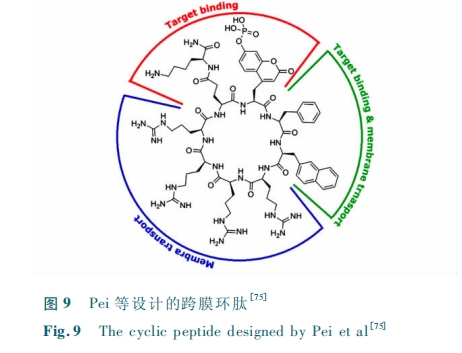
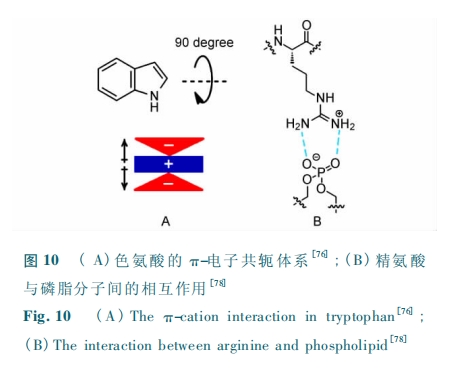
细胞穿透肽 ( cell penetrating peptides,CPP) 是一 类 能 够 穿 过 细 胞 膜 的 线 性 肽,包 括 穿 膜 肽( penetratin )[60]、转 录 激 活 因 子 ( trans-activator oftranscription,Tat ) 片 段[61]、Pep-1[62]、多 精 氨 酸( polyarginines)[63] 等。CPP 可 以 通 过 细 胞 主 动 摄取[64]或非能量依赖的转运过程[65,66]进入细胞,并能将与之共价或非共价连接的蛋白或核酸运入细胞。细胞穿透肽常带有相当多的精氨酸,表面带正电,能够与细胞膜表面的负电荷发生静电作用,增强与细胞膜的相互作用。这类多精氨酸的 CPP ( arginine richpeptides,RRP) 通过与细胞膜相互作用使细胞膜变薄,产生瞬时孔从而穿过细胞膜。利用 CPP 能够将与其共价连接的分子带入细胞的特点,Pei 等将 CPP共价地连接到环肽分子上,成功实现了环肽分子跨膜[67]。但是,直接修饰的 RRP 分子细胞穿透能力差,有时具有细胞毒性,引起细胞坏死[68 ~ 70]。
4 结论
与普通线性多肽相比,细胞穿透环肽具有较好体内稳定性,并能够穿过细胞膜而特异性结合细胞内靶标,具备很好的成药性,因此细胞穿透环肽已经成为当前药物研究的新热点。本文从天然产物来源和人工改造来源两方面综述了细胞穿透环肽领域的研究进展及发展前景。在化学合成获得所需环肽分子的基础上,我们仍然需要进一步理解环肽分子的跨膜机理、环肽分子与受体或膜间相互作用的分子机制和具体过程,以设计、改造得到具有细胞穿透活性的环肽药物。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。