
摘要:氨基酸是生命之源, 其中L⁃精氨酸(L⁃Arg)是生物体进行新陈代谢的一种重要氨基酸, 同时也是重要的肿瘤标志物之一. 因此, 开发高选择性的L⁃Arg检测方法在生物分析领域十分重要. 本文在Uniprot数据库29185个蛋白质序列中筛选出特异性结合L⁃Arg的多肽序列(序列为 CFGHIHEGY), 经ITC验证后, 将其作为识别元件固定在子弹形纳米孔道尖端表面. 在纳米空间限域效应下, 利用多肽与L⁃Arg特异性结合前后构象由伸展状态向蜷缩状态的变化, 调控纳米孔道离子输运特性变化, 从而实现对L⁃Arg的选择性检测. 实验结果表明, 多肽修饰纳米孔道对L⁃Arg具有高灵敏度和高选择性, 线性范围为1~100 nmol/L, 检出限低至1 nmol/L. 该研究为氨基酸高选择性、 高灵敏检测提供了新方法, 同时也为多肽修饰仿生离子通道的构建提供了新思路.
L⁃精氨酸(L⁃Arg)作为一种常见的氨基酸, 广泛存在于生物体内, 是人体内的一种必需氨基酸[1]. 对于人体来说, L⁃Arg在新陈代谢过程中起到了重要的作用, 尤其在心血管、 免疫系统和内分泌系统中具有重要的生物调控功能[2~4], 能够促进伤口愈合、 调节血管张力、 促进激素分泌和调节内分泌功能[5]、 调节内皮细胞功能[6]以及促进肠道健康[7]. L⁃Arg也是保证人体内T细胞活力的重要物质, T细胞内L⁃Arg可以促进细胞的氧化代谢, 增加细胞活性、 持久性和体内抗肿瘤反应[8]. 此外, L⁃Arg可为某些营养缺陷性肿瘤提供养分, 是重要的肿瘤标志物[9];同时, L⁃Arg可用于治疗多种疾病[10]. 因此, 人体内L⁃Arg的检测在临床诊断、 治疗和生物功能研究中具有重要意义.
迄今, 在生命健康领域中L⁃Arg的检测主要通过高效液相色谱(HPLC)[11]和液相色谱-质谱联用(LC-MS)[12]进行. 这两种方法虽然检测精确, 但需要专门的设备且样品制作繁琐、 检测成本高. 为了实现L⁃Arg的快速、 简便检测, 近年来已开发了许多新型检测方法, 如荧光检测法、 比色检测法及电化学检测法等[13~15], 这些方法虽然能够实现高度灵敏和快速的检测, 但仍有许多需要改进的地方, 如传感器微型化、 实时响应、 传感探针的简易制备和材料的生物相容性等.
1 实验部分
聚对苯二甲酸乙二醇酯(PET)薄膜(厚度 13 μm, 双轴取向), 德国Goodfellow公司;多肽(序列为CFGHIHEGY), 纯度98.85%;氯化钠、 氢氧化钠、 磷酸磷酸二氢钠、 磷酸氢二钠、 L⁃半胱氨酸和乙酸, 分析纯, 上海国药集团化学试剂有限公司;一水合吗啉乙磺酸, 分析纯, 上海麦克林生化科技有限公司;L⁃精氨酸, 分析纯, 日本Sigma-Aldrich公司;L⁃丙氨酸、 L⁃色氨酸、 L⁃酪氨酸、 L⁃甘氨酸、 L⁃高半胱氨酸、 L⁃苯丙氨酸、 L⁃赖氨酸、 L⁃丝氨酸、 L⁃苏氨酸、 L⁃天冬氨酸、 L⁃组氨酸、 L⁃谷氨酸、 L⁃谷氨酰胺、 L⁃异亮氨酸和L⁃脯氨酸, 分析纯, 上海阿拉丁生化科技股份有限公司;Dowfax 2A1表面活性剂, Dow Chemical Company;实验用水为超纯水(电阻率≥18.3 MΩ·cm).
CHI-760B型电化学工作站, 上海辰华仪器有限公司;Ag/AgCl电极, 上海仙仁仪器仪表有限公司;TESCAN MIRA LMS型扫描电子显微镜(SEM), 捷克泰思肯有限公司;K-Alpha型X射线光电子能谱仪(XPS), 美国赛默飞世尔科技公司.
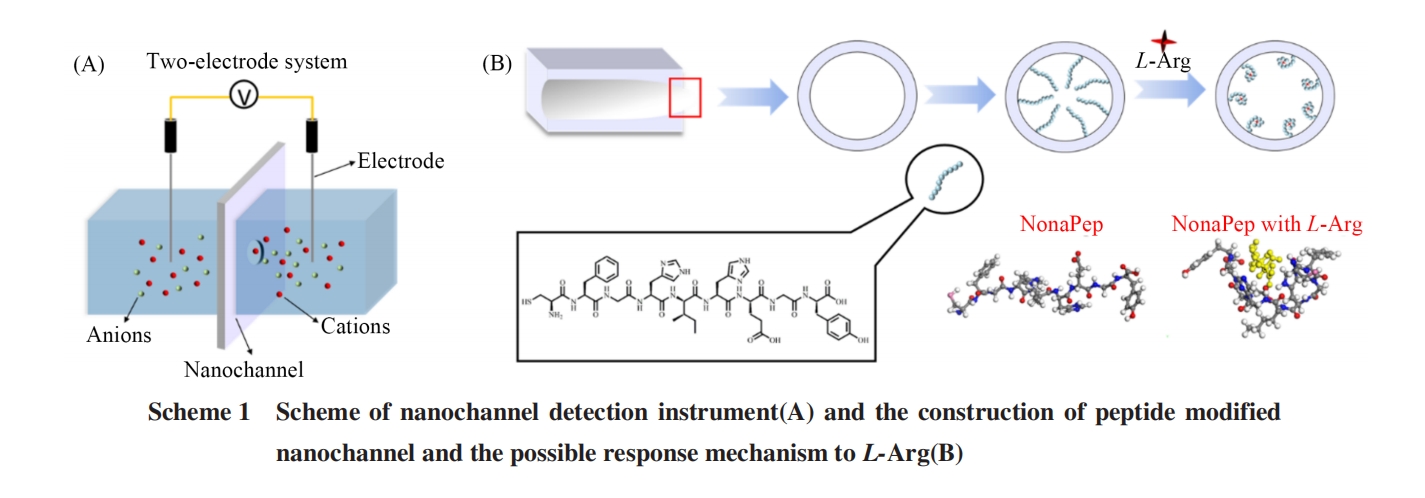
采用离子径迹刻蚀法制备多种形态纳米孔道[28]. 首先使用Xe轰击PET薄膜(8.98 MeV/u)获得单个径迹的PET薄膜, 随后用紫外灯对PET薄膜进行单侧照射, 照射时长为12 h. 照射完成后, 在60 ℃下用6 mol/L NaOH和Dowfax 2A1混合溶液(体积分数0.05%)对PET薄膜进行不对称刻蚀, 刻蚀4 min后得到子弹形纳米孔道. 刻蚀完成后, 用蒸馏水清洗, 将其置于Milli Q超纯水中静置过夜.
圆锥形纳米孔道的制备与子弹形纳米孔道类似, 用紫外灯对 PET 薄膜的正反面进行照射, 照射时长均为12 h. 照射完成后, 在分散槽中对PET薄膜进行不对称刻蚀得到圆锥形纳米孔道(刻蚀液为 9 mol/L NaOH溶液, 停止液为1 mol/L KCl和1 mol/L醋酸溶液). 利用电化学工作站对开孔情况进行监测, 施加1 V的电压, 用双电极体系记录电流随时间的变化来表征纳米孔道是否贯通. 当电流上升到一定大小(根据所需尖端孔径大小确定)时, 用停止液替换刻蚀液以停止刻蚀. 用超纯水洗涤3遍, 然后将其置于超纯水中静置过夜.
对纳米孔道进行化学刻蚀后, 其表面会暴露大量的羧基(—COOH)基团. 利用这一特性, 在纳米孔道中可以固定含氨基(—NH2)的识别原件. 将PET薄膜放置在50 mmol/L EDC和250 mmol/L NHS混合的MES溶液(0.1 mol/L, pH=4.7)中, 浸泡1 h后从混合液中取出, 使用超纯水将PET 薄膜冲洗干净. 随后, 将多肽溶液(0.2 mg/mL, pH=7.4)加入至纳米孔道孔径较小一侧对应的聚四氟乙烯分散槽中, 孵育1 h后, 用超纯水冲洗PET薄膜, 除去未固定的多肽. 最后, 用含有1 mol/L NaCl的PBS缓冲液(10 mmol/L, pH=7.4)为电解液, 测量电流-电压(I⁃V)曲线, 检测多肽是否已修饰.
锥形纳米孔道尖端部分孔径(d)根据与I⁃V曲线线性区域获得的电导率(G)的依赖关系确定, 相关公式如下:
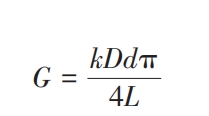
式中:G为电导率, 通过I-V曲线线性区斜率可算得;k为电解液的离子电导率;L为纳米孔道长度 (13 μm);D为基底端孔径, 其大小由刻蚀时间t计算得出, 关系式为D=5t(实验中使用多孔径迹腐蚀膜确定系数为5).
通过检测I⁃V曲线对制备的单孔PET薄膜进行了表征. 使用两电极体系[Scheme 1(A)]检测纳米孔两端电流, 首先将单孔膜夹在两个聚四氟乙烯分散槽之间, 在膜两侧加入 1 mol/L NaCl电解质溶液. 随后, 在两侧分散槽溶液中各放置1个Ag/AgCl电极, 使用电化学工作站测量稳定电压下单孔膜的离子电流. 在单孔膜两侧施加-1~1 V的电压, 每0.1 V记录对应电流大小并绘制I⁃V曲线图, 观察离子电流大小及整流系数变化, 施加-60~60 mV的电压, 每10 mV记录对应电流大小并绘制I⁃V曲线图, 计算斜率得到纳米孔道电导率.
使用Materials Studio软件对多肽结合L⁃Arg过程进行模拟. 首先构建精氨酸和九肽分子的三维立体模型, 随后在Forcite模块中进行几何优化, 拟合得到多肽识别L⁃Arg的构象变化. 利用perl脚本将精氨酸从多肽分子N端移动到C端, 得到多种可能的构象变化, 通过计算找出能量最低的构象, 即为最稳定的构象.
2 结果与讨论
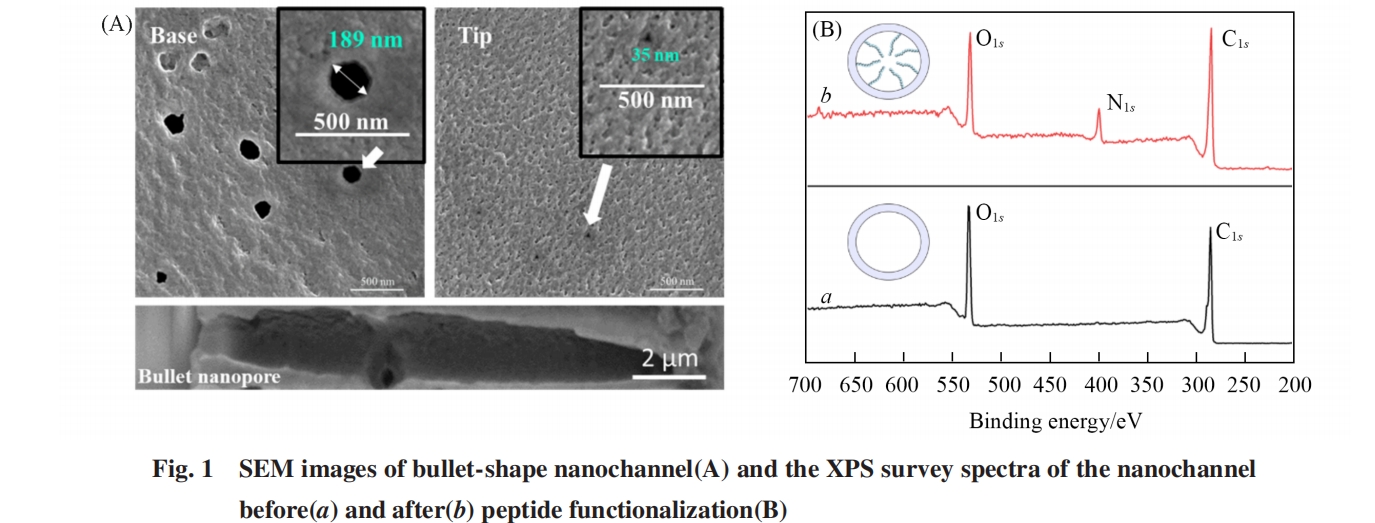
纳米孔道经过化学刻蚀后, 孔道内聚合物链段的酯键水解, 其表面被羧基覆盖[31], 基于氨基和羧基的共价偶联, 利用EDC/NHS作为偶联剂将多肽固定在纳米孔道内表面. 为了进一步验证多肽已修饰在纳米孔道的内表面, 对未修饰纳米孔道薄膜和多肽修饰纳米孔道薄膜进行了XPS表征. 如图1(B) 所示, 未修饰的纳米孔道薄膜(谱线a)只有O1s 和C1s 峰清晰可见, 这是PET薄膜材料自身所含元素. 在纳米孔道薄膜修饰多肽后(谱线b), 除O1s 和C1s 峰外, 还存在N1s 峰(399 eV). 这表明在多肽修饰后, 纳米孔道中引入了N元素, 由于多肽中含有氨基和肽键, 因此N元素的引入证明多肽已被固定.
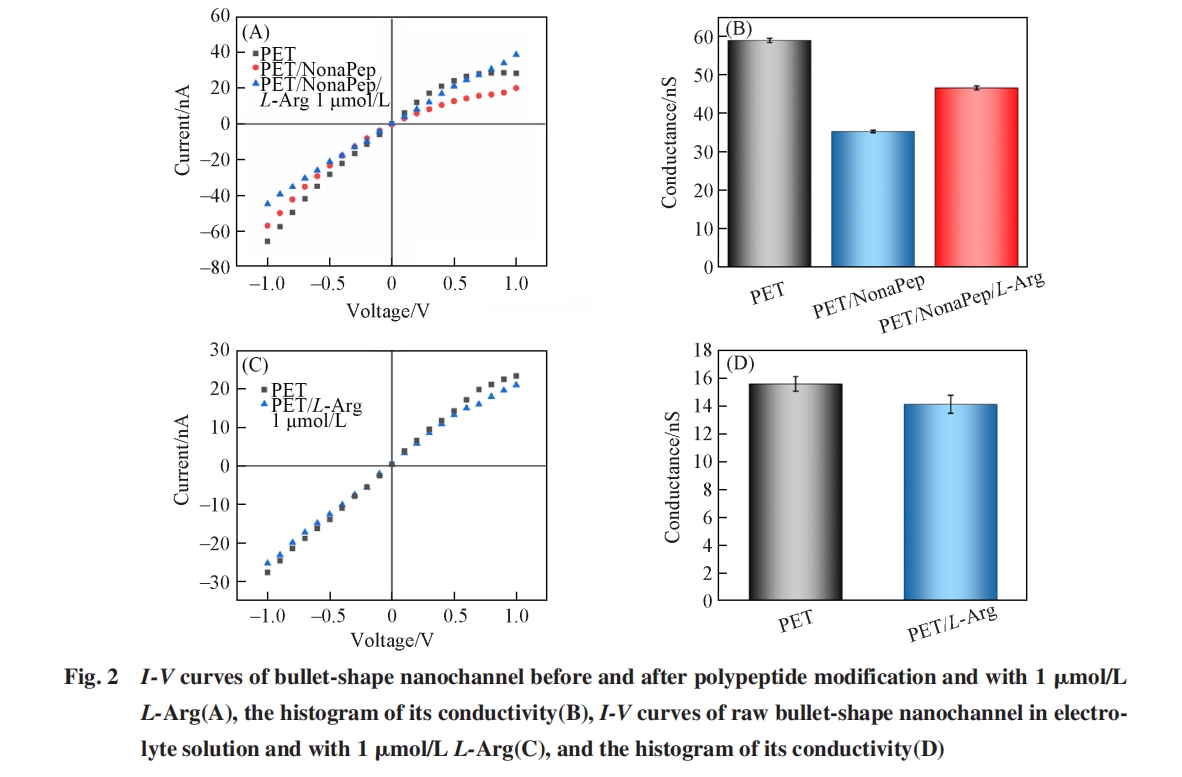
为了验证多肽对L⁃Arg的特异性识别, 使用裸孔进行了离子电流检测. 如图2(C)和(D)所示, 在加入L⁃Arg后, 裸孔的离子电流和电导率未发生明显变化. 以上结果表明, 多肽修饰纳米孔道在L⁃Arg识别过程中, 多肽是L⁃Arg的识别元件.
为了探究纳米孔道中多肽修饰和L⁃精氨酸识别过程中孔道有效孔径的具体变化, 使用圆锥形纳米孔道替换子弹形纳米孔道重复上述实验. 圆锥形纳米孔道形状规整, 在不使用SEM表征孔径大小的情况下, 可以通过电导率的大小估算出纳米孔道的尖端孔径[32]. 实验结果如图S1(见本文支持信息)所示, 裸锥形孔的电导率G1为2.0 nS, 修饰多肽后电导率G2减少至0.9 nS, 加入1 nmol/L L⁃Arg后电导率G3增加至1.3 nS. 根据锥形纳米孔道电导率与孔径关系式, 计算得出裸孔的尖端孔径d1为14.7 nm, 修饰多肽后尖端孔径d2减小为6.6 nm, 加入L⁃Arg后尖端孔径d3增大为9.5 nm. 上述数据表明, 纳米孔道尖端内表面的多肽及其周围水分子组成的多肽膜厚度为4.1 nm, 加入L⁃Arg后多肽膜厚度变为 2.6 nm.
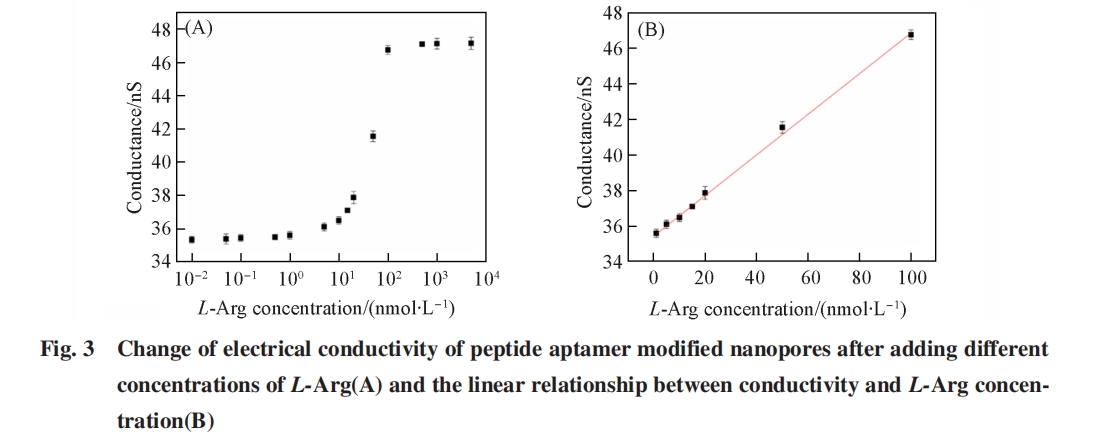
将多肽修饰纳米孔道对L⁃Arg的检测性能与其它方法检测L⁃Arg的性能进行比较发现(表S3, 见本文支持信息), 该方法具有更低的检出限.
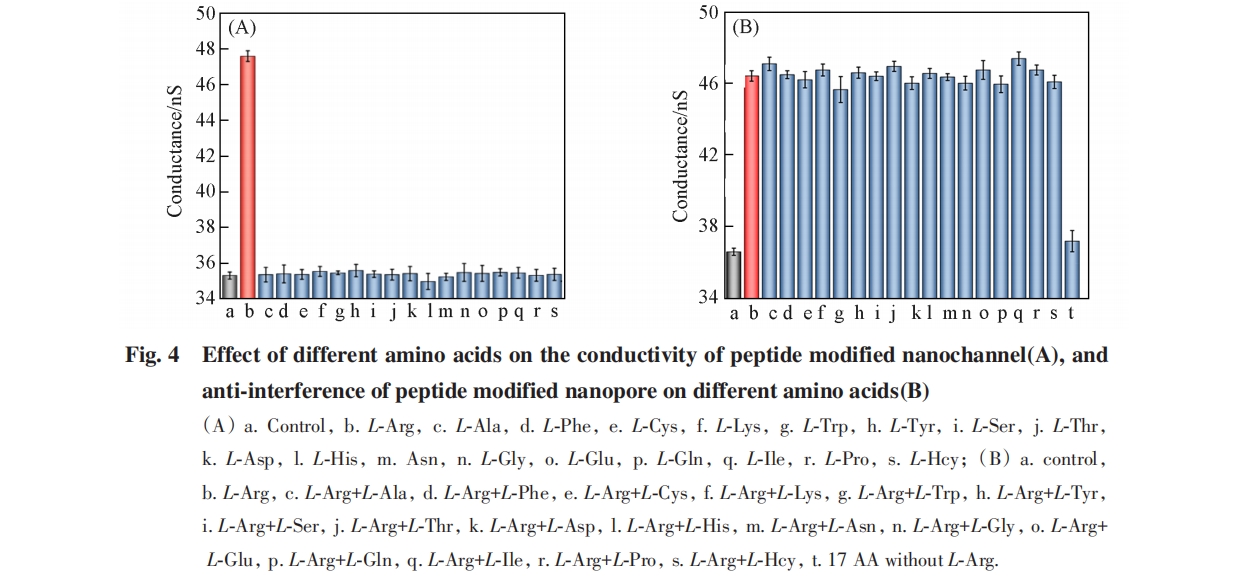
通过考察多肽修饰纳米孔道对L⁃Arg和不同氨基酸混合物的响应情况研究了其抗干扰性. 实验选择L⁃半胱氨酸、 L⁃色氨酸、 L⁃酪氨酸、 L⁃高半胱氨酸、 L⁃苯丙氨酸和L⁃赖氨酸等17种氨基酸作为干扰物, 考察了加入50 nmol/L的L⁃Arg和500 nmol/L的干扰物混合物后, 纳米孔道的电导率响应情况. 如 图4(B)所示, 加入干扰物后电导率响应情况与单独加入L⁃Arg一致, 且多肽修饰纳米孔道对其余17种氨基酸的混合物无明显电导率响应. 由此可知, 多肽修饰纳米孔道可以在多种氨基酸混合物中选择性识别L⁃Arg, 具有良好的抗干扰性, 可用于选择性检测L⁃Arg.
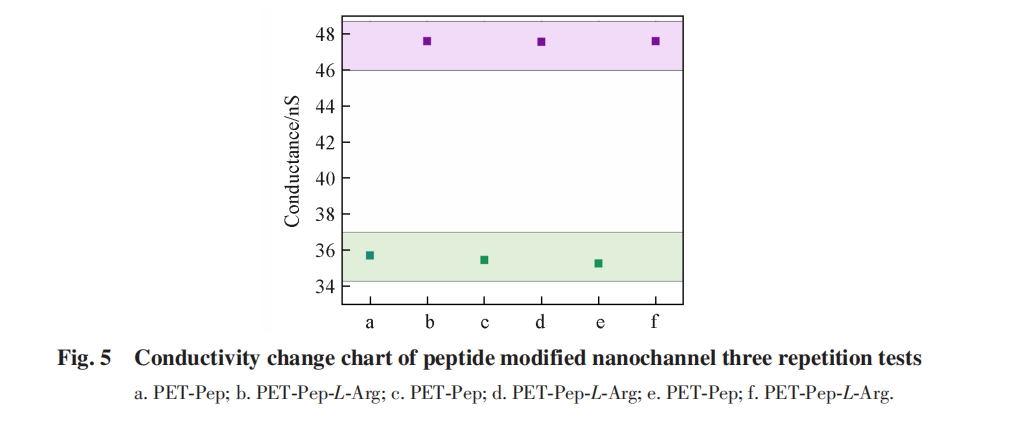
3 结论
基于多肽修饰的纳米孔道开发了一种选择性检测L⁃Arg的新方法. 首先制备了子弹形纳米孔道, 使用SEM对子弹形纳米孔道的形貌进行了表征. 通过纳米孔道内表面的羧基基团及多肽自身的胺基基团将多肽固定在纳米孔道内表面, 并使用XPS表征了修饰的多肽. 由于多肽对L⁃Arg的特异性识别与结合, 加入L⁃Arg后纳米孔道的电导率会随之变化, 以此可实现对L⁃Arg的定量分析. 该方法具有优异的选择性, 线性响应范围为1~100 nmol/L. 与其它方法相比, 该方法具有更低的检出限, 且检测时间短, 不需要昂贵的仪器. 同时, 由于纳米孔道自身的微型尺寸, 在后续的研究中可以将纳米孔道集成在微流控设备中, 为氨基酸传感器的微型化、 柔性化提供了研究思路. 此外, 纳米孔道的制备材料为PET薄膜, 对人体无害且具有柔性, 因此纳米孔道传感器在未来也可广泛地应用于可穿戴式传感器领域.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。