
摘 要 肿瘤靶向纳米递药系统是指利用肿瘤组织特殊的生理病理特点,由纳米载体包载肿瘤诊疗药物构建而成的对肿瘤组织具有靶向定位功能的药物递送系统。多肽介导的肿瘤靶向纳米递药系统是肿瘤靶向递药领域较新的一个研究方向,本文综述了该研究方向的四个重要发展历程,单功能靶向、双功能靶向、肿瘤穿透和环境响应型靶向纳米递药系统。并介绍了各类递药系统的设计原理和典型研究案例。此外,对目前多肽介导的纳米递药系统存在的优势与不足进行了分析, 最后,针对当前主动靶向肿瘤递药系统存在的研究困境,提出了一种新型肿瘤靶向递药策略--“系统性靶向策略”, 随着相关学科和多学科交叉的发展,多肽介导的肿瘤靶向纳米递药系统将在肿瘤治疗中扮演更为重要的角色。
肿瘤靶向纳米递药系统是指利用肿瘤组织特殊的生理病理特点,由纳米载体包载肿瘤诊断或治疗药物构建而成的对肿瘤组织具有靶向定位功能的药物递送系统,临床上常规化疗药物对肿瘤组织无靶向性,加大给药剂量常导致对正常组织严重的毒副作用,而降低给药剂量会引起肿瘤的复发和耐药性,由于纳米载体在提高药物稳定性、改善药物体内行为、增加对肿瘤组织靶向性等方面的优良表现,已受到了研究者的广泛关注。
肿瘤靶向按其机理可分为三类:被动靶向、物理化学靶向和主动靶向。被动靶向是一种基于肿瘤组织的EPR(增强渗透和滞留)效应使递药系统靶向分布于肿瘤组织的策略。物理化学靶向递药系统借助特定的物理化学方法靶向于肿瘤组织,包括磁靶向、PH敏感、温度敏感递药系统等,主动靶向是在被动靶向的基础上,借助肿瘤组织高表达的特异性受体的介导作用,增加递药系统在肿瘤组织、细胞或细胞器内分布的策略。
主动靶向递药系统由于可以显著增加药物被肿瘤细胞的摄取量,增强药物抗肿瘤作用,逐渐成为近年来肿瘤靶向递药研究领域的热点,该系统一般是将靶向分子直接或通过连接臂偶合到载药纳米粒子表面而构成。与被动靶向和物理化学靶向递药系统类似,常用的纳米载体包括脂质体、纳米粒、聚合物胶束、枝状聚合物和囊泡等;连接臂为一定分子量的亲水性大分子链,PEG最为常用。靶向分子一般为与肿瘤组织内特异性受体有亲合性的物质,主要包括抗体或抗体片段、多肽、小分子营养物质等。多肽介导的肿瘤主动靶向纳米递药系统作为近年来较新的一个研究方向,发展迅速,本文将对该方向近年来的重要进展作一综述。
2 多肽介导肿瘤靶向的生理学基础
肿瘤的生理学特征是设计肿瘤靶向递药系统的基础。首先,肿瘤组织的一个重要生理学特征是对纳米颗粒的EPR效应。当肿瘤生长到 2mm3后,由于现有的肿瘤血管无法满足肿瘤快速生长所需营养,因此开 始 出 现 肿 瘤 血 管 和 肿 瘤 淋 巴 管 新 生 现象。但是肿瘤新生血管的血管壁间隙较宽且通透性较大,而肿瘤组织中心的淋巴管一般不具备正常功能,造成肿瘤组织中淋巴回流缺失,导致一定大小的大分子类物质如脂质颗粒等对肿瘤组织具有选择性高通透性和滞留性。这种现象被称为实体瘤的EPR效应。 其次,肿瘤细胞一般会过度表达一些在正常组织低表达或不表达的受体,常见的如叶酸受体、转铁蛋白受体、生长抑素受体、血管活性肠肽受体和胆囊收缩素受体等。另外,在肿瘤血管表面也会表达一些特异性受体,如VEGF受体,整合素、内皮细胞选择素等,最近在肿瘤淋巴管表面也发现了一些特异性受体,如P32受体。此外,由于肿瘤的供血不足,无法及时清除肿瘤细胞代谢产生的酸性物质,导致肿瘤组织内的酸性环境,胞外PH值可达6.0。另外供血不足也会导致肿瘤组织的局部缺氧,而这又会加剧肿瘤酸性环境的产生。除了上述特征!肿瘤组织还具有高间质液压,存在特异性酶和氧化应激等生理特征。
多肽一般由 2-50个氨基酸组成,与蛋白质不同,多肽由于分子量小,因此不存在高级结构。而且多肽除了天然存在形式外,还可以进行化学合成,数量庞大,结构多样,比较容易找到肿瘤受体的特异性配体多肽。配体多肽与受体结合后,与多肽连接的纳米载体一般经受体介导内吞的方式进入细胞。多肽与受体的结合会导致局部吉布斯自由能降低,继而局部细胞膜包裹纳米粒形成封闭囊泡结构,脱离细胞膜进入细胞质,与其他囊泡融合形成内涵体,最终与溶酶体融合,纳米粒在溶酶体内发生降解或逃离溶酶体进入细胞质。肿瘤细胞表面的受体通常分为内化受体与非内化受体两类,内化受体可介导配体内化进入细胞,而非内化受体的配体则主要分布在细胞膜表面,无法进入细胞。由于药物只有进入细胞质才能发挥药效,因此内化受体比非内化受体更适合用作肿瘤靶向纳米递药系统的介导受体。
3 多肽介导的肿瘤靶向纳米递药系统
多肽介导的肿瘤靶向治疗在近几年内得到了快速发展,是肿瘤内科治疗、药剂学领域中最活跃的研究领域之一,其经历了单功能靶向、双功能靶向、肿,瘤穿透、环境响应型靶向等发展过程,详见表1,下面进行逐一介绍。
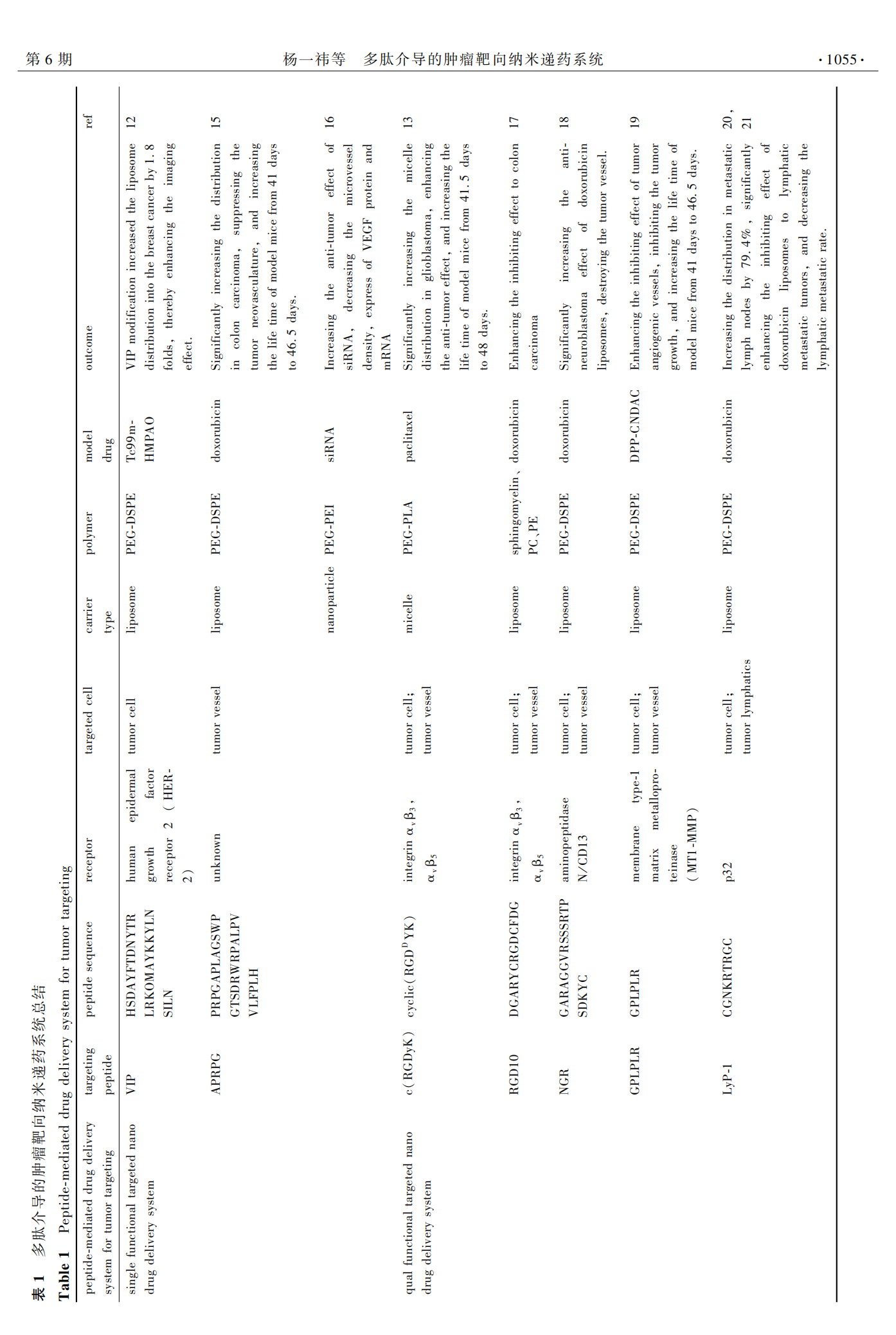
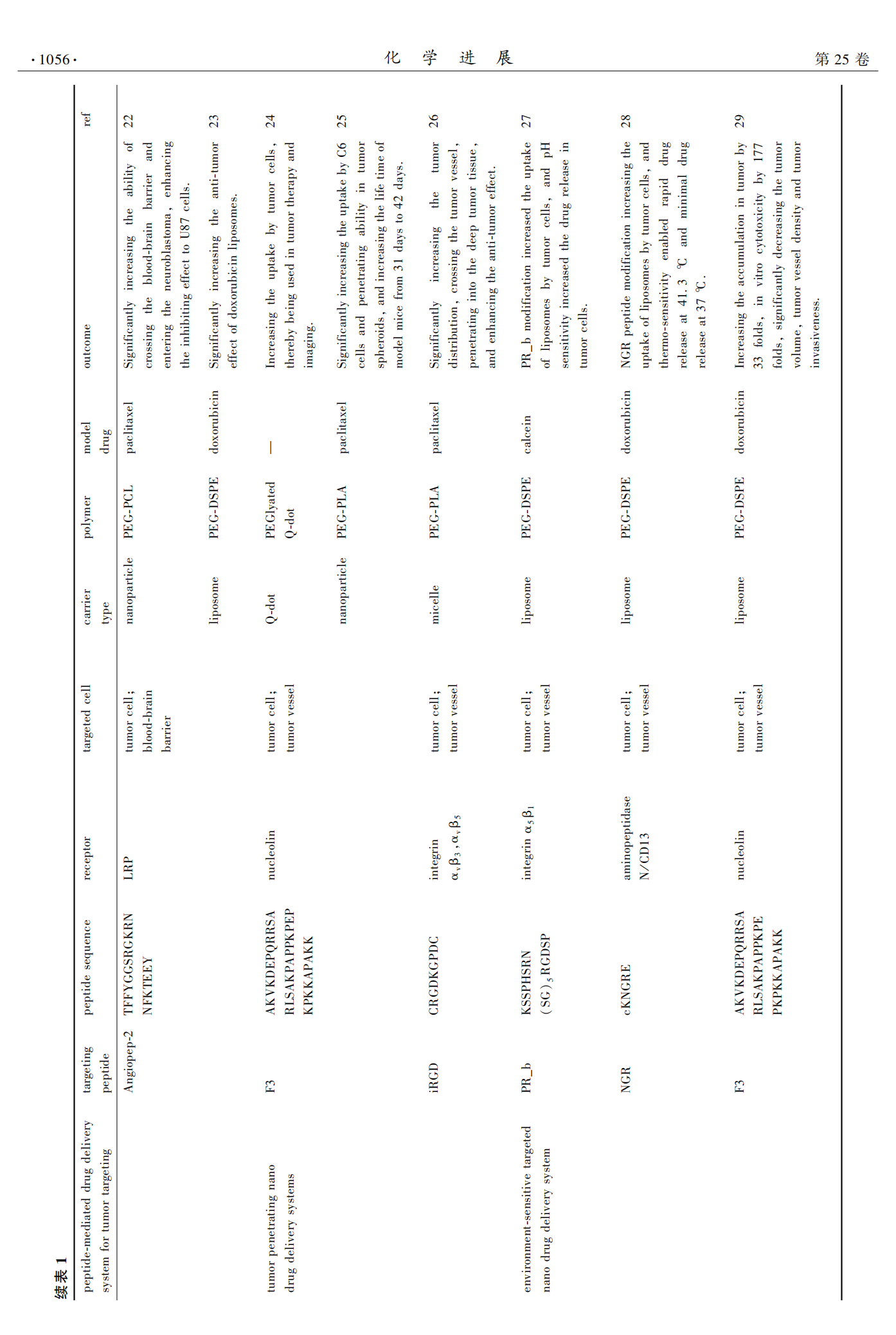
3.1 单功能靶向纳米递药系统
单功能靶向纳米递药系统是指针对肿瘤组织中单个靶点的递药系统。由于肿瘤组织中肿瘤细胞、细胞外基质、肿瘤血管内皮细胞或肿瘤淋巴管内皮细胞等表面均有区别于正常组织的特异性受体表达,将能与该受体特异性结合的靶向分子偶合到递药系统表面,递药系统注射到体内后,首先在EPR效应介导下进入肿瘤组织,然后在受体介导作用下主动与靶细胞结合,增加靶细胞的药物摄取量,为防止网状内皮系统的吞噬,一般采用PEG化递药系统,实现药物在体内的长循环。例如,在人乳腺癌细胞上高表达一种血管活性肠肽受体(VIP-R)研究者使用血管活性肠肽(VIP),一种 28肽,作为乳腺癌细胞靶向分子共价修饰到脂质体表面,并包裹放射性核素Tc99m-HMPAO,进行乳腺癌的显像诊断,结果显示,无论脂质体上是否修饰VIP,其在乳腺癌组织的分布量都显著高于正常乳腺,证明了脂质体对癌症组织的被动靶向性。更重要的是,VIP修饰的脂质体在乳腺癌中的分布量为未修饰脂质体的1.8倍,且前者靶向指数(乳腺癌中分布量与正常乳腺中分布量的比值)也显著高于后者。显示了VIP脂质体对乳腺癌的主动靶向性。
单功能靶向纳米递药系统虽较被动靶向治疗肿瘤有了很大进展,但其对肿瘤组织的靶向性仍不理:想,可 能 的 原 因 有:(1)纳 米 递 药 系 统 首 先 要 通 过EPR效应进入肿瘤组织,然后才能发挥靶向分子的介导作用,导致与肿瘤细胞的接合效率不高;(2)对某些特殊部位的肿瘤,如脑部肿瘤,靶向效率低。 递药系统要进入脑部肿瘤首先要先通过血脑屏障(BBB)或者血脑肿瘤屏障(BBTB),这大大降低了其对脑肿瘤的靶向效率。为进一步增加纳米递药系统对肿瘤组织的靶向性,研究者设计了多种双功能靶向纳米递药系统,一般采用能同时靶向两个靶点的多肽分子或者采用两个靶向不同靶点的多肽分子同时修饰在纳米载体表面构建而成。目前常见的双功能靶向纳米递药系统有以下三类。
大量研究表明,在肿瘤血管表面表达有一些区别于正常血管的特异性受体,通常这些受体也同时在肿瘤细胞表面高表达,如整合素、核仁蛋白等,采用其配体多肽修饰的纳米递药系统具有同时靶向肿瘤血管和肿瘤细胞的功能。对肿瘤血管的靶向性可增加递药系统在肿瘤血管附近的滞留量,从而增加其进入肿瘤组织的分布量,进而在肿瘤细胞表 面 受 体 的 介 导 下 发 挥 抗 肿 瘤 细 胞 生 长 作用。例如,RGD肽,一类含有精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp)的短肽,是整合素的一种配体多肽。Zhan等制备了RGD修饰的紫杉醇胶束用于神经胶质瘤的靶向治疗,与未修饰胶束相比,其对U87神经胶质瘤细胞的体外生长抑制作用提高了2.5倍,在体内神经胶质瘤组织分布显著增加,并将 荷 瘤 裸 鼠 的 生 存 周 期 从41.5天 延 长 至48天。
肿瘤组织中肿瘤淋巴管的生成对肿瘤发生淋巴转移起着极大促进作用,研究表明在肿瘤淋巴管和肿瘤细胞表面表达有一些共有的特异性受体,利用其配体修饰的纳米递药系统具有同时杀伤肿瘤细胞和破坏肿瘤淋巴管的作用,从而抑制肿瘤生长并抑制肿瘤发生淋巴转移。如p32受体是表达在多种肿瘤细胞和肿瘤淋巴管上的受体,LyP-1为其配体多肽。Yan等制备了LyP-1修饰的阿素脂质体用于淋巴转移肿瘤的靶向治疗,实验结果显示,其同时具有靶向肿瘤细胞和肿瘤淋巴管的功能,与未修饰脂质体相比,其对淋巴转移肿瘤的抑制效果显著增强,并显著降低了肿瘤的淋巴转移率,使淋巴结转移率从33.3%降低为16.7%,髂淋巴结转移率从66.7%降低为0
BBB的存在可维持脑组织中微环境的稳定,但也导致了100%的大分子药物以及98%的小分子药物难以入脑,从而使脑部疾病的药物治疗成为一大难题。纳米递药系统进入脑部肿瘤首先需要跨越BBB入脑,然后再进入脑肿瘤。BBB靶向递药系统可增加药物入脑量,但对脑肿瘤无主动选择性,而脑肿瘤细胞单功能靶向递药系统则难以跨越BBB入脑。将BBB靶向分子和肿瘤细胞靶向分子同时修饰或者将BBB和肿瘤细胞的共同靶向分子修饰到纳米递药系统表面构建的双功能(双级)靶向递药系统可具有跨越BBB和靶向肿瘤细胞的双重功能。增加对脑部肿瘤的靶向性。如低密度脂蛋白(LRP)是一种BBB和神经胶质瘤细胞表面的共有受体,研究者将其配体多肽Angiopep-2修饰到紫杉醇纳米粒表面用于神经胶质瘤的靶向治疗,Angiopep-2的修饰增加了纳米粒在脑部和神经胶质瘤的分布量,并使紫杉醇纳米粒对肿瘤的生长抑制率从36.1%提高至65.6%,使荷脑瘤裸鼠的生存周期从30天延长至37天。
前两类肿瘤靶向纳米递药系统大大推进了肿瘤靶向治疗的研究进程,但是,从其静注给药入血到与肿瘤细胞发生接合的过程中,仍受到两大屏障的制约——肿瘤血管屏障和肿瘤基质屏障。肿瘤血管屏障是指由于血管壁的存在,血管壁孔径大小不一,肿瘤内高间质液压等因素导致的递药系统从血管跨血管壁进入肿瘤这一过程遇到的障碍。肿瘤基质屏障是指由于肿瘤自外周向中心逐渐增高的间质液压、肿瘤间质纤维阻滞等因素导致的递药系统从肿瘤血管附近穿过肿瘤间质进入肿瘤组织内部这一过程遇到的障碍。 有研究表明,这两大屏障的存在使抗 肿 瘤 药 在 肿 瘤 内 最 远 仅 能 到 达 距 离 血 管40-50um(相当于约10个细胞直径)的位置,大部分肿瘤细胞则无法接触到药物。最近有研究者通过多肽筛选技术筛选出一类具有肿瘤血管穿透性和肿瘤组织穿透性的多肽,这类多肽可介导与其共价连接的药物分子或纳米递药系统穿透肿瘤血管壁并渗透进入肿瘤内部,分布到整个肿瘤组织中,这类多肽被称为"肿瘤穿透肽"。肿瘤穿透肽修饰到纳米递药系统表面即可构建成为肿瘤穿透纳米递药系统。 如有报道显示通过噬菌体展示技术筛选出的RGD衍生多肽iRGD,除了具有传统RGD肽对肿瘤血管和肿瘤细胞靶向性的特点外,还具有穿透肿瘤血管和肿瘤组织的能力;传统RGD多肽只能将递药系统靶向至肿瘤血管处,而iRGD多肽则能介导递药系统穿透血管并渗透进入肿瘤组织内部,后者在肿瘤部位的浓度可达前者的10倍,抑制肿瘤生长的作用也有显著提高。目前肿瘤穿透纳米递药系统已被成功应用于胰腺癌、乳腺癌、和前列腺癌等肿瘤的靶向治疗。
上述几类纳米递药系统通过表面修饰靶向多肽,很好地实现了向肿瘤组织的有效靶向递药,但是在肿瘤部位的药物释放仍存在问题。很多纳米递药系统在肿瘤部位难以有效释放药物,或者在肿瘤细胞内释药时间、速率或方式不当,造成了药物低效或者浪费。由于肿瘤部位具有与区别于正常组织的微环境,如低PH、温度较高、缺氧、存在特异性酶等。肿瘤微环境响应型递药系统在过去二十年里已有较大进展,研究主要集中于PH敏感与温度敏感型系统,将这些递药系统表面修饰肿瘤靶向多肽分子后,构建成环境响应型靶向纳米递药系统,可使其同时具有肿瘤主动靶向性能和肿瘤微环境敏感性能,改善药物释放行为,提高药效。
很多纳米递药系统在肿瘤组织中释药速率过慢,或者有些药物在强酸环境中不稳定、易失活。通过设计PH-敏感型纳米递药系统,使其在弱酸性环境中变得不稳定,从而在肿瘤细胞间液、内涵体或者早期溶酶体中加速释放药物,增加药物释放量,并保证其在到达晚期溶酶体前将内容物释放到细胞中,最大限度地保持药物活性、增强药效。该类递药系统已引起研究者很大的兴趣。Garg等选用在肿瘤细胞和肿瘤血管表面特异性表达的整合素a5B1的靶向多肽分子PR_b修饰到PH敏感聚乙二醇化脂质体表面,PR_b 的修饰大大增加了脂质体被肿瘤细胞的摄取,PH敏感性能的加入又增加了其在肿瘤细胞内的药物释放速率。Moura等将肿瘤穿透肽F3修饰到 PH敏感型脂质体表面构建了PH敏感型靶向脂质体,其在体内肿瘤部位蓄积量是普通脂质体的 11 倍,使阿霉素对肿瘤细胞和内皮细胞的细胞毒性分别提高了177和 162倍,并显著降低了肿瘤大小、血管密度和肿瘤侵袭性。
温度敏感型递药系统是指通过温度变化来控制药物释放的递药系统。大部分实体瘤都比周围的正常组织温度高,利用该原理设计温度敏感型递药系统可增加递药系统在肿瘤部位的药物释放,再整合肿瘤主动靶向性能,即可构建成为温度敏感型靶向纳米递药系统。Negussie等构建的环状NGR多肽修饰的温度敏感型脂质体,可主动识别肿瘤血管或者肿瘤细胞表面高表达的CD13/氨肽酶N受体而 被 摄 取 进 入 细 胞。 药 物 体 外 释 放 试 验 显 示NGR多肽修饰的温度敏感型脂质体在41.3摄氏度时可快速释放药物(4S内释放超过 75%)而在37摄氏度则释放极少。
4 多肽介导肿瘤靶向递药系统的优势与不足
多肽介导的纳米递药系统仍存在以下一些不足。虽然纳米递药系统经多肽修饰后可赋予其肿瘤主动靶向性能,但是这也增加了其被网状内皮系统的捕获几率,因此往往多肽修饰的递药系统在肝脏、脾脏的分布大于未修饰递药系统,长期给药易造成对肝脾功能的损害。肿瘤血管的孔隙率和大小随着肿瘤类型和发病位置的不同而不同;肿瘤组织表达的特异性受体也经常表现出个体差异性,甚至同一个体的不同位置、不同阶段的肿瘤也存在差异,即肿瘤组织存在异质性,这大大增加了多肽介导递药系统发挥药效的不确定性。另外目前所采用的靶向多肽分子几乎全部为L型多肽,而体内存在多种类型的多肽降解酶,因此很多靶向分子在体内易被降解,导致递药系统失去靶向性能。此外,如表1所示,虽然多肽的修饰可不同程度地增加纳米递药系统对肿瘤的靶向效率,但是其在肿瘤部位的绝对分布量仍很低,如VIP修饰的脂质体在肿瘤部位的分布量仅占总给药量的0.2%,因此多肽介导的肿瘤靶向纳米递药系统仍有待进一步研究,以提高其靶向效率。
5 总结和展望
经过研究人员的不懈努力,多肽介导的肿瘤靶向纳米递药系统向着多功能、智能化的方向发展,已取得了很多研究成果,在肿瘤的靶向诊断和治疗方面显示出很大的应用潜力。但是由于肿瘤的特殊性和复杂性,现有的递药系统仍无法克服体内传递过程中遇到的所有屏障并高效抑制肿瘤生长。
一方面,从"时间" 角度来讲,递药系统从给药到发挥药效的整个体内过程面临多重屏障,包括在循环系统、肿瘤组织和靶细胞三个传递过程的屏障。如在循环系统中面临网状内皮系统吞噬、酶降解等屏障,在肿瘤组织传递过程中面临肿瘤血管壁、肿瘤基质阻碍、高间质液压等屏障,在靶细胞传递过程中面临细胞摄取、溶酶体逃逸、药物适时释放等屏障,目前绝大部分研究均只致力于解决其中一种或几种屏障问题。但是,肿瘤靶向治疗的最终实现,需要同时解决递药过程中所遇到的所有屏障。
另一方面,从"空间"角度来讲,肿瘤细胞并不是孤立存在的,肿瘤微环境对于肿瘤的生长与转移有极大影响,如肿瘤干细胞、肿瘤新生血管、肿瘤新生淋巴管、肿瘤相关巨噬细胞、细胞外基质等,这些都是肿瘤发生、发展和转移的"生态学"因素。 这些因素与癌细胞相比,总体来说遗传较稳定,具有很少的耐药性产生可能。 破坏肿瘤生长发展所依赖的微环境,对实现肿瘤的靶向治疗至关重要
综上,针对目前肿瘤靶向纳米递药系统遇到的困境,我 们 提 出 一 种 新 型 肿 瘤 靶 向 递 药 策 略——"系统性靶向"策略,发展"系统性靶向"纳米递药系统,使其具有如下功能:从"时间"角度上,能在体内稳定存在并克服体内层层屏障进入靶部位高效释放药物;从"空间"角度上,在靶向杀伤肿瘤细胞的同时,破坏其赖以生存的肿瘤微环境,最终实现对肿瘤的"系统性靶向"治疗。其可能的实现途径有以下三种。
上述三种途径中,第一种途径是通过整合跨越多种递药屏障的功能,并包载多种药物,制备出多功能多靶标的一种递药系统,此递药系统结构复杂,制备繁琐,较难实现,并且易造成靶向分子和药物的浪费;第二种途径可针对不同靶细胞分别制备不同靶向分子和药物的递药系统,联合给药,此方法可行性大大增加,但对每种递药系统进行功能整合仍较难实现;第三种途径提供的材料制备简单,功能多样,但是其合理化设计较困难,需要科研人员的进一步努力。"系统性靶向"这一目标的实现任重道远,需要肿瘤学、分子生物学、细胞生物学、材料学、药剂学等学科各领域科研人员的共同努力。肿瘤发生发展的机制需要深入研究!发现特异性高的新型肿瘤标志物,为肿瘤靶向递药系统的设计提供理论基础;针对肿瘤靶点,利用计算机辅助设计或噬菌体展示技术等筛选出主动识别能力强、稳定性好、组织渗透性强的靶向分子;针对肿瘤细胞和肿瘤微环境特点,设计结构简单、对肿瘤环境具有高响应性能的智能化新材料;利用新材料设计制备出多功能、智能化的肿瘤靶向递药系统;对纳米递药系统与生物体之间的相互作用进行系统化研究!包括纳米递药系统在体内血液,肿瘤组织和细胞内的动力学行为,以找出纳米递药系统以及生物体中影响药效发挥的各个因素,发现各因素之间的相互关联以及限制其发挥药效的关键限速因素等,这些数据对“系统性靶向”的实现至关重要,可大大简化"系统性靶向"递药系统所必需的功能,为其设计提供科学指导。纳米递药系统与生物体之间相互作用的研究缺乏也是目前制约肿瘤靶向纳米递药系统发展的重要原因,仍需要大力开展相关的研究。相信随着相关学科领域和多学科交叉的发展,我们会设计制备出更为多功能、智能化的、系统性靶向"纳米递药系统",实现对肿瘤的高效靶向治疗。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。