
摘要 环二肽由两个氨基酸通过肽键环合形成, 在氢键相互作用驱动下具有较强的自组装倾向. 本工作研究了 c-SF, c-SY, c-SH 及 c-DF 等四种环二肽的自组装行为和组装体的荧光特性. 实验结果表明, c-SH 为无规卷曲而其他三种环二肽均采取 β-sheet 二级结构, 且除 c-SH 未形成明显组装体外, 其他三种环二肽均形成不同尺寸的纳米纤维. 荧光光谱检测发现环二肽在不同波长的激发下存在多个不同的荧光发射峰; 对于 c-SH, 侧链咪唑基官能团与 Zn(II)配位可以增大荧光发射的强度; 对于 c-SY, 侧链酚羟基的氧化也可以增强荧光强度. 推测在氢键作用的驱动下环二肽分子可以逐个堆叠形成纳米纤维, 自组装导致的分子聚集和分子的侧链结构均可使环二肽具有可调变的荧光性能.
在生命体系中, 多肽、蛋白质、RNA、DNA、磷脂等分子是各种生物功能的物质基础, 这些分子可以聚集组装形成高级有序结构, 由此产生新的性质和功能[1~3]. 多肽分子可以在氢键作用、疏水作用以及静电相互作用等多种非共价作用力的驱动下自组装成各种纳米结构,并由此产生种种新性质以及在生物医学、材料学、光学等领域的新功能[4~11].
环肽是指氨基酸残基的 N 端和 C 端以酰胺键依次连接成环状的多肽分子. 环肽的结构同大环超分子, 如冠醚、环糊精、杯芳烃等有所相似, 容易形成氢键网络, 此外环肽还存在内在构象约束, 已经在超分子化学及分子识别方面引起了人们的注意[12]. 环二肽(CDPs), 又名2,5-二氧哌嗪或 2,5-二酮哌嗪, 由两个氨基酸通过肽键环合形成, 是最小的环肽. 天然的 CDPs 一般由 α-氨基酸(常为 L-氨基酸)形成稳定的六元环, 存在于动植物中, 微生物发酵和食品加工过程也有 CDPs 形成[13]. CDPs 的两个酰胺键存在四个氢键位点(两个供体和两个受体), 独特的氢键作用模式使 CDPs 具有高度的自组装倾向, 分子聚集体具有优异的结构刚性、酶稳定性和生物活性[14,15]. 除 2,5-二酮哌嗪环之间的氢键作用外, CDPs 侧链官能团之间的其他非共价键相互作用, 如芳香环的π-π 相互作用、范德华力、静电作用和离子配位作用也会影响其组装聚集行为[16], 这主要取决于氨基酸的类型和 α-碳原子上的立体化学构型. CDPs 分子可通过形成一维的分子链或二维的分子层来促进自组装和复杂超分子结构的构建[17~21].
相对于线性短肽, CDPs 能够抵抗在生理条件下的快速酶促降解, 其在生物医学领域的应用具有一定优势[13,22]. CDPs 是次生代谢产物, 存在于从细菌到人类等各种生物体中, 并且在进化过程中得到保护[22]. CDPs及其衍生物是一类具有生物功能的重要活性分子, 如细菌群体感应功能[23]、抗菌[24]和抗癌性能[25,26]等. CDPs 的生物学性能与氨基酸侧链官能团密切相关, 可通过改变氨基酸残基种类来改变和调节. 除生物学功能外, CDPs 的聚集和自组装产生的量子限制效应和光致发光特性, 赋予了其材料学功能. Tao 等研究了含 F 的环二肽的光吸收和能量传递功能, 提出组装体可用于构建半导体材料[27]. 基于 W 的芳香环二肽可自组装成二聚体量子点(QD), 通过调节激发光波长可使其发光波长覆盖大部分可见光到近红外波长区域[28]. 这为体内生物成像材料提供了新的选择.
目前 CDPs 自组装研究的工作大都采用有机溶剂体系[29~31], 为使其有更广泛的应用, 我们在水溶液中研究了 CDPs 的自组装行为, 并考察了溶液条件、金属离子配位等因素的影响. 多肽材料荧光发光一般来自于所含氨基酸侧链的芳香环[32]、分子聚集发光[33]或形成 QD[28], 我们也基于此考察了 CDPs 的荧光性能. 所研究的四种含有不同氨基酸残基的 CDPs 可组装成纳米纤维或厚度均匀的分子层, 在不同的激发波长下分别具有不同的荧光发光特性, 其荧光性能来自于二酮哌嗪结构.
2 结果与讨论
为考察不同类型氨基酸对 CDPs 自组装行为的影响, 我们设计 c-SF、c-SY、c-DF 及 c-SH 等四种 CDPs, 如图 1 所示. 通过丝氨酸侧链羟基极性的加入来增加CDPs在水中的溶解度, 而CDPs中的另一个氨基酸残基分别为非极性的苯丙氨酸(F)、极性氨基酸酪氨酸(Y)、正电性组氨酸(H)以及负电性天冬氨酸(D), 藉此考察氨基酸残基的带电性和亲疏水性对 CDP 自组装行为的影响. 通过荧光光谱仪考察了 CDPs 及其组装体的荧光性能.
2.1 CDPs 的自组装及其荧光性能
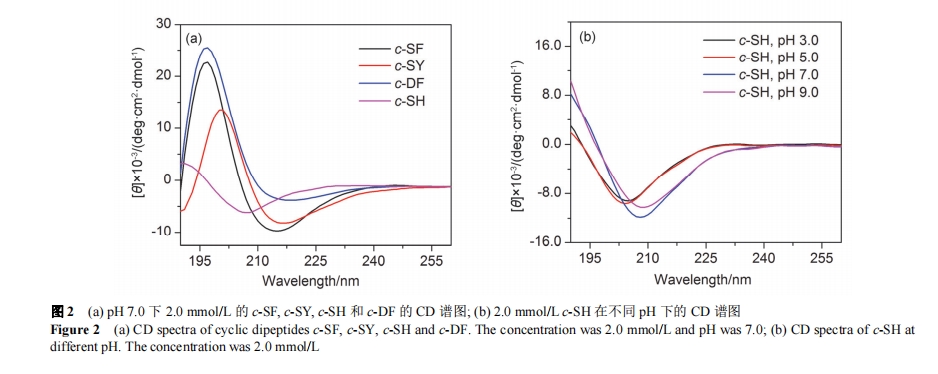
由于 CDPs 中含有两个酰胺键即四个氢键位点, 其在水溶液中易于氢键作用力的驱动下发生有序聚集. 我们通过圆二色光谱(CD)考察了环二肽自组装体的二级结构, 如图 2 (a)所示. CD 结果表明, 在 pH 7.0, 浓度为2.0 mmol/L 的不带有电荷的 c-SF 和 c-SY 均在 195 nm处有正峰, 在212 nm左右处存在负峰, 为典型的β-sheet的二级结构. 这是由于 CDPs 的二酮哌嗪环所包含的四个氢键位点之间产生了较强的氢键相互作用, 从而使得二酮哌嗪环逐个相互平行堆叠形成 β-sheet 二级结构. FTIR 谱图在 1640 cm-1处的酰胺 I 带吸收峰也证实了其β-sheet 二级结构[图 S1 (a)和 S1 (b)]. 在酸性条件下, c-SH 的组氨酸侧链官能团发生质子化, 带有较强的正电荷, 由此带来的静电排斥作用使得 c-SH 的二酮哌嗪环无法平行地堆叠形成 β-sheet二级结构[图 2 (a)和图 S1 (d)]. 我们尝试通过改变溶液的 pH 将 c-SH 中的咪唑环去质子化以消除静电斥力影响, 虽然在 pH 为 7.0 和 9.0时, CD 结果负峰发生了明显的红移, 但仍然没有形成β-sheet 结构, 如图 2 (b)所示. 我们初步推断去质子化的咪唑环也可能与二酮哌嗪环产生氢键相互作用从而阻碍了 β-sheet 二级结构的形成.
通过 AFM 表征了 CDPs 的组装体形貌并跟踪了c-SF 和 c-SY 在不同时间段形貌的变化. 实验结果表明, c-SH 在水溶液中所有 pH 下都不能形成有序组装体, c-SF 和 c-SY 自组装形成了细小的短棒状纳米纤维, 长度约为 100 nm, 直径约为 0.5~1.0 nm[图 3 (a)和图 3 (d)]. 结合 CD 结果, 可以初步推断 CDPs 纳米纤维是由二酮哌嗪环有序地堆叠形成的. 由图 3 (b)可知, 7 d 后, c-SF 自组装形成的纳米纤维数量略有增加, 但长度仍为100 nm, 并且直径也较为均匀地分布在 1.0 nm 左右, 与一个 c-SF 环二肽分子的直径相符, 也说明 c-SF 的自组装体为单分子堆积. 进一步延长组装时间到 15 d, c-SF组装体的形状无明显变化[图 3 (c)]. 对于 c-SY, 7 d 后的组装体纳米纤维尺度有所增大, 长度约为 300~500 nm, 直径为 2.0~3.0 nm[图 3 (e)]. 静置 15 d 后, 纳米纤维长度和直径进一步增加, 长度为 800~1000 nm, 直径为3.5~5.0 nm; 并且纳米纤维之间发生一定程度的聚并和缠绕, 形成了三维网状结构[图 3 (f)]. 我们推测 c-SY 的初级自组装体可在侧链芳香环基团 π-π 堆积作用和酚羟基氢键相互作用的驱动下进一步分级自组装, 形成高级有序结构. 同时为证实二酮哌嗪环在自组装过程中的作用, 与对应的线性二肽 NH2-FS-COOH(FS)和 NH2-YSCOOH(YS)进行了对比, AFM 实验表明两种线性二肽均未发生自组装现象. 也进一步证实了 CDPs 中的二酮哌嗪环所提供的氢键相互作用是 CDPs 分子自组装的主要驱动力.

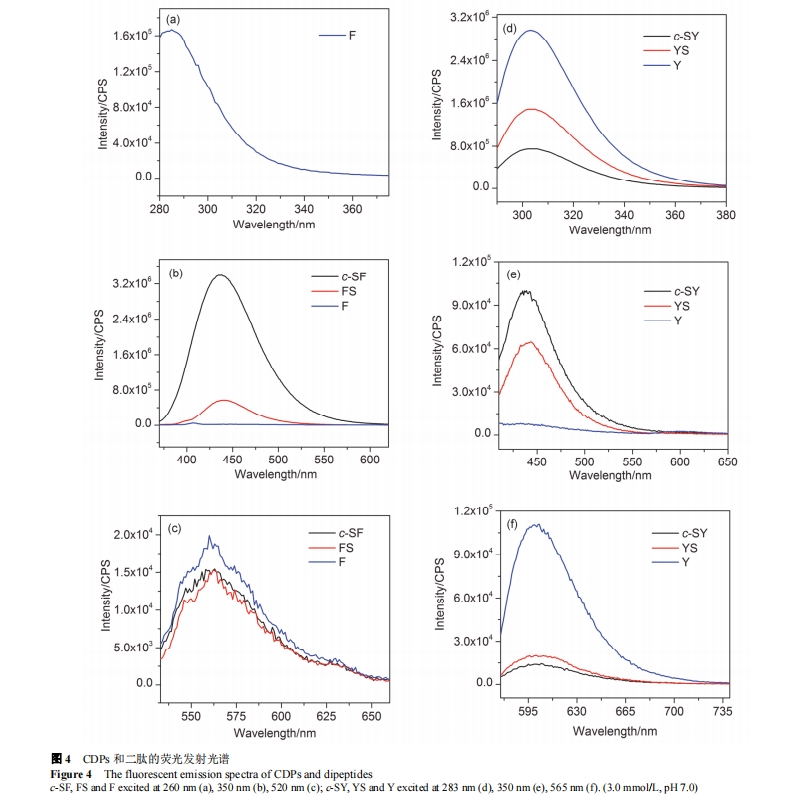
由于 CDPs 中二酮哌嗪环是稳定的六元环, 分子具有一定刚性, 并且 CDPs 中带有芳香环结构, 因此 CDPs应该具有荧光性能. 荧光光谱也表明, c-SF 在 350 nm 激发波长下在 437 nm 处有荧光发射峰, 在 520 nm 激发波长下在 560 nm 处有荧光发射峰; c-SY 在 283 nm 激发波长下发射光谱特征峰位于 305 nm 处, 在 350 nm 和 565 nm 激发波长下, 发射光谱特征峰分别位于 439 nm 和600 nm 处. 我们同样考察了对应线性二肽 FS 和 YS 以及游离苯丙氨酸(F)和酪氨酸(Y)的荧光性能. 如图 4 (a),4 (b)和 4 (c)所示, 游离苯丙氨酸在 260 nm 激发光下在285 nm 处有荧光发射峰, 但 c-SF 和 FS 在此波长激发下不存在荧光发射峰. 在 350 nm 激发光下, c-SF, FS 和 F在437 nm附近发射峰强度的大小顺序为: c-SF>>FS>F. 使用 520 nm 激发时, 三种分子在 560 nm 处的荧光发射峰强度近似, 但都较弱. 同样对于均含有 Y 的 c-SY, YS 和 Y 三种分子, c-SY 在紫外区荧光发射强度和红色荧光发射强度弱于线性二肽或游离氨基酸, 但所发射蓝色荧光的强度明显大于另外两者[图 4 (d), 4 (e), 4 (f)]. CDPs 在蓝色区域的荧光发射强度较大与二酮哌嗪环中酰胺键影响侧链芳环结构的电子云排布, 使得其电子跃迁能级落在蓝色区域有关. 我们将 c-SF 和 c-SY 的浓度缩小 30 倍至 0.1 mmol/L(此时 CDPs 为未组装的游离状态), 在荧光光谱中发现同一 CDP 在 3 mmol/L 的组装体的荧光强度远大于 0.1 mmol/L 时游离分子荧光强度的30 倍(图 S2). 这一结果证实了组装体的形成可以增强CDPs 的荧光性能. 此外, 实验考察了组装体的浓度对其荧光强度的影响, 发现随组装体浓度的增加, 其发蓝色荧光的强度逐渐增强(图 S2).
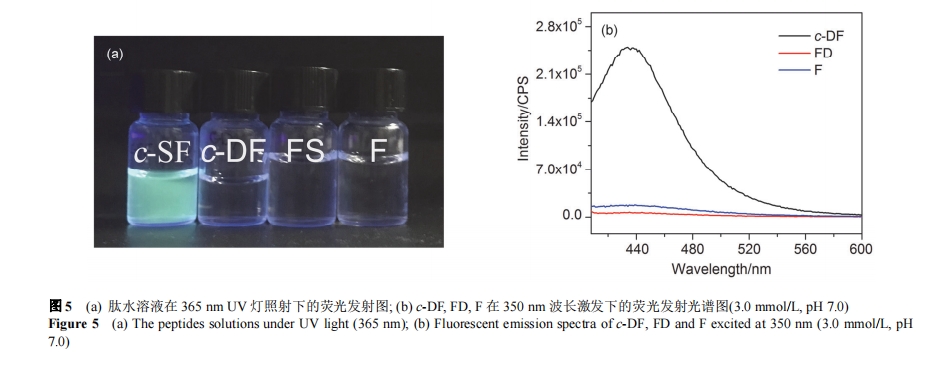
为进一步验证 CDP 中二酮哌嗪环对荧光性能的作用, 我们对比了 c-DF, c-SF, FS, FD 和氨基酸 F 的荧光性能与其自组装行为. 如图4 (b)和图5 (b)所示, 在350 nm波长激发下c-DF的荧光发射强度较c-SF小一个数量级, 这可能与 c-DF 所带负电荷导致部分荧光猝灭有关. 然而, c-SF 和 c-DF 在 350 nm 激发下的荧光发射峰强度都远大于线性二肽 FS 和 FD 以及氨基酸 F. 在 365 nm UV灯照射下, 同等浓度(3.0 mmol/L)的 c-SF, c-DF, FS, F 溶液中, 只有 c-SF 可以发出肉眼可见的蓝绿色荧光[图 5 (a)]. 这说明CDPs分子中二酮哌嗪环状结构可以使芳香环带来的荧光发射强度大幅度提高. 与 c-SF 类似, CD和 FTIR 结果显示 c-DF 同样在水溶液中采取 β-sheet 二级结构, 自组装形成直径 1.0~2.0 nm、长度约为 1 μm的纳米纤维结构[图 2 (a), S1 (c), S3 (b)]. 虽然天冬氨酸残基侧链的 β-COOH 的带电性受 pH 影响, 但在所考察的 pH 范围内 c-DF 的 β-sheet 二级结构并未受到 pH 值的影响[图 S3 (a)], 说明了二酮哌嗪环结构氢键作用力的稳定性. 与之相比, 线性二肽 FS 和 FD 则不能形成有序组装体.
2.2 Zn(II)对 CDPs 自组装及其荧光性能的影响
金属离子对多肽自组装行为有着显著的影响, 可以改变多肽二级结构并进一步影响其组装形貌及功能, 且特定金属离子的存在可以使荧光材料的荧光性能显著增强[28,34~37]. 考虑到组氨酸侧链咪唑官能团与金属离子有很强的配位作用, 我们研究了 Zn(II)离子对 c-SH 自组装行为及荧光性能的影响.
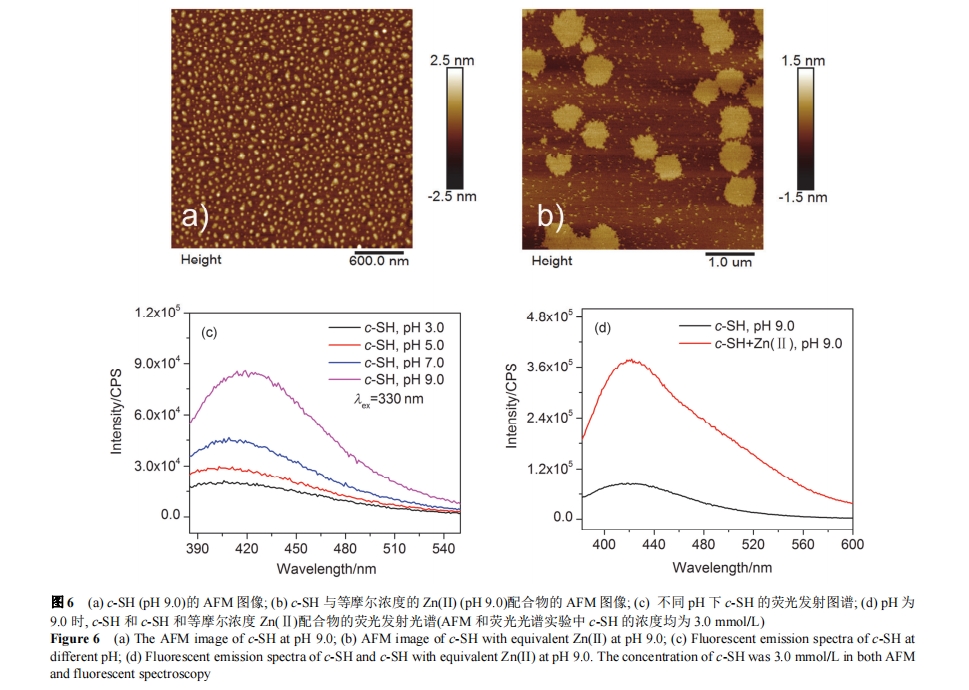
实验发现, pH 3.0 时, 等物质的量 Zn(II)的加入对c-SH 二级结构、组装形貌及荧光性能没有明显影响. c-SH 侧链咪唑基带电状态受 pH 影响, 在去质子化状态下易于和Zn(II)发生配位. UV-Vis结果表明, 当pH由3.0升高到7.0和9.0时, 在305 nm处出现了新的吸收峰, 说明发生了配位作用(图 S4). 如图 6 (a)和图 6 (b)所示, pH 9.0 时, Zn(II)和 c-SH 配位形成单分子膜状结构, 高度约为 0.7 nm; 而不加 Zn(II)时, c-SH 无序聚集为纳米球状形貌. 采用椭圆偏振光谱测定了薄膜厚度随时间的变化, 发现 30 min 内分子层的厚度稳定在 0.7 nm 左右[图 S5 (a)], 这也证明了 c-SH 与 Zn(II)的配合物可以形成稳定的厚度均匀的单分子层膜状结构.
如前所述, 随pH升高, c-SH的CD负峰发生了红移. 我们也同样考察了 pH 对 c-SH 荧光发射强度的影响. 如图6 (c)所示, 3.0 mmol/L的c-SH在330 nm激发下在405 nm 处有荧光发射峰, 且强度随 pH 的增大而增强, 这说明荧光发射强度与咪唑基去质子化的程度有关. 在 pH为 9.0 时, c-SH 和 Zn(II)配位后的荧光发射强度远大于c-SH 的荧光发射强度[图 6 (d)], 证明金属离子 Zn(II)与c-SH 的配位可以显著提高组装体的荧光发射强度. 且固定 c-SH 的浓度为 4.0 mmol/L, 改变与其配位的 Zn(II)的浓度从 0 mmol/L 到 32.0 mmol/L 发现, 随 Zn(II)浓度的升高配合物的荧光发射强度逐渐增强. 在 Zn(II)为 8.0 mmol/L 时有最大荧光发射强度, 当 Zn(II)浓度再次升高时荧光强度开始降低, 这可能与 c-SH 和 Zn(II)的配位方式有关[图 S5 (b)].
2.3 氧化剂对 CDPs 组装体的影响
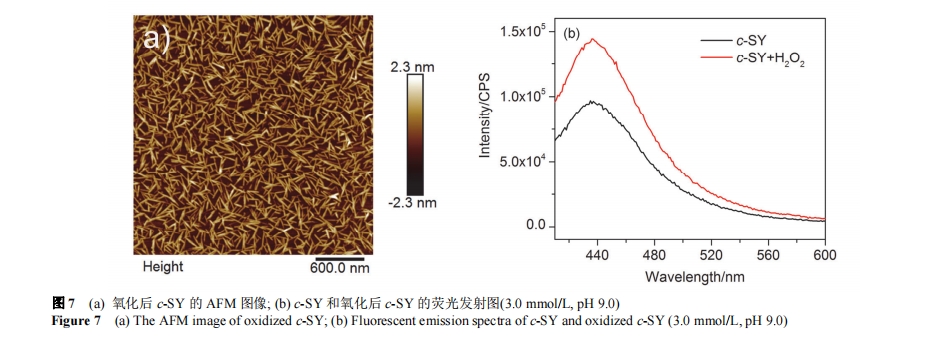
由于酪氨酸的侧链酚羟基容易被氧化, 例如在 UV灯照射下, 酪氨酸在富氧和无氧条件下分别被氧化成黑色素和双酪氨酸[38]. 我们也考察了酪氨酸氧化对 c-SY组装和荧光性能的影响. 将 3.0 mmol/L 的 c-SY 溶液 pH调至 9.0, 并向溶液里加入 1.3 倍过量的 H2O2. UV-Vis 结果表明在 290 nm 处出现了新的吸收峰[图 S6 (b)], 说明c-SY 确被氧化. 静置 7 天后进行 AFM 表征, 被氧化后的 c-SY 自组装体的形貌没有发生明显变化, 依旧为直径约 1.0~2.0 nm、长度 250 nm 左右的纳米纤维[图 7 (a)]; 静置 15 天后, 组装体的形貌及尺寸也未发生明显变化[图 S6 (a)]. 荧光光谱表明在 350 nm 的激发光下被氧化后的 c-SY 在 439 nm 的荧光发射强度得到明显提高[图 7 (b)]. 我们也分别考察了温度和 pH 对 c-SY 氧化后荧光性能的影响, 结果发现温度对 c-SY 氧化后荧光发射强度无影响[图 S6 (d)], 但其氧化后的荧光发射强度会随 pH 的升高而增强, 这可能是由于 H2O2在碱性条件下对酚羟基氧化能力更强, c-SY 被氧化的程度增加[图S6 (c)]. 以上结果说明酪氨酸的氧化可以在一定程度上增强 c-SY 的荧光发射性能.
3 结论
CDPs 的二酮哌嗪环结构所提供的四个氢键位点是其自组装的重要驱动力. 在自组装过程中, CDPs 采取β-sheet 的二级结构, 二酮哌嗪环中两个酰胺键形成分子间氢键, 分子逐个堆叠形成纳米纤维, 纤维直径为单个CDP 分子尺寸. 在其他非共价相互作用, 如酚羟基之间的氢键作用下, CDPs 初级组装体可以发生有序的二次聚集, 形成尺寸较大的组装体. 荧光发射光谱表明CDPs 的二酮哌嗪环结构和自组装聚集行为均可以使其荧光发射能力增强. c-SH 中咪唑基和 Zn(II)发生配位作用后, 会促进二维单分子层纳米片结构的形成, 并且配位作用还可以明显提高荧光性能. 酪氨酸的氧化也可提升 c-SY 的荧光发光性能. 因 CDPs分子量小且不易被酶降解, 其自组装体纳米结构为生物细胞成像材料的研发提供了新的可能.
4 实验部分
4.1 溶液的配制
使用超纯水(≥18.2 MΩ•cm)配制所需浓度的环肽溶液, 涡旋震荡后室温下超声 30 min 使其充分溶解, 用0.1 mol/L 的 NaOH 和 0.1 mol/L 的 HCl 将溶液调至设定的 pH 值, 在室温下保存.
4.2 圆二色光谱(CD)实验
配制浓度为 2.0 mmol/L 的多肽溶液, 并将其 pH 调至特定值, 使用 Bio-Logic MOS-450 圆二色光谱仪进行测试. 数据采集的波长范围为 190 nm 至 260 nm, 采集步长为1.0 nm, 使用光程为0.1 mm的石英比色皿, 温度为室温, 每个样品均采集至少 5 次, 数据扣除背景后取平均并平滑, 得到的椭圆率(θ)数据通过公式(1)转换为摩尔残基椭圆率([θ]):

其中, [θ]—摩尔残基椭圆率, 单位为 deg•cm2•dmol-1; θ—椭圆率, 单位为毫度(milidegree); n—多肽残基数; c—多肽溶液浓度, 单位为 mol/L; l—光程, 单位为 cm.
4.3 紫外-可见光谱(UV-Vis)实验
配制所需 pH 值且浓度稀释至 1.0 mmol/L 的多肽溶液, 使用紫外-可见光谱仪(Shimadzu UV-2450)测试其紫外-可见光谱. 石英比色皿光程为 1.0 cm, 实验温度为室温, 测定波长范围为 190~800 nm.
4.4 原子力显微镜(AFM)实验
取15.0 μL溶液(3.0 mmol/L)滴到刚剥离的新鲜云母片表面, 常温下吸附 15~20 min, 随后在氮气气流下轻轻吹扫云母片表面至干燥. 干燥后的样品使用 Nanoscope IVa Multi Mode (Digital Instruments, Santa Barbara, CA)进行扫描, 使用轻敲模式(Tapping Mode)及 TESP硅探针, 扫描角度为 0, 扫描速率为 1 Hz, 图像分辨率为 512×512.
4.5 荧光光谱表征
将待测样品(3.0 mmol/L)加入到 3 mm 的石英比色皿 中 , 选择扫描模式为 Emission, 数据模式为Fluorescence, 设置激发波长, 狭缝宽度为 2.5 nm, 室温下测定样品的荧光光谱.
4.6 椭圆偏振光谱仪实验
首先用5%(V/V)的Decon 90溶液及去离子水交替清洗单晶硅片, 并利用椭圆偏振光谱仪测量三个位置的厚度, 确保硅片上无杂质. 待测的溶液(3.0 mmol/L)盛放在液体池中, 入射偏振光以 70°角照进液体池, 收集偏振光在硅片表面上的反射, 测量电压为 2~4 eV. 采用Jobi-Yvon 的 DeltaPsi 2 软件拟合实验数据, 得出样品在固体表面的吸附厚度.
4.7 傅里叶变换红外光谱仪(FTIR)实验
先用D2O配制4.0 mmol/L的肽溶液, 常温自组装一周后进行表征. 实验设置参数: 扫描波长范围为 4000~400 cm-1, 扫描次数为 256 次, CaF2池子厚度为 0.2 mm. 实验前先扣除 D2O 背景再对样品进行扫描.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。








