
摘要 构建了一种近红外二区成像探针, 能对脑部病变进行近红外二区荧光成像. 利用脑靶向肽 Angiopep-2 对 Ag2S量子点进行修饰, Ag2S 量子点和 Angiopep-2 多肽经 EDC 和 NHS 介导, 通过氨基和羧基的缩合反应进行连接, 采用琼脂糖电泳、动态光散射及透射电镜等方法对材料进行表征, 并观察了材料对脑胶质瘤细胞 U87MG 的细胞毒性、材料在该细胞中的分布、摄取以及在实体瘤荷瘤鼠中的分布情况. 结果显示, Ag2S 量子点水合粒径约为 6 nm, 经肽修饰后粒径约为 8 nm, 表面 zeta 电位正电性增强, 在琼脂糖电泳中, 肽修饰后 Ag2S 迁移距离较 Ag2S 短, 表明 Angiopep-2 多肽修饰到了量子点上. 经过细胞实验发现, 修饰后的 Ag2S 量子点在 100 μg/mL 以下没有细胞毒性, 脑胶质瘤 U87MG细胞对 Angiopep-2 多肽修饰的 Ag2S 较 Ag2S 具有更高的摄取. 经过初步的实体瘤动物实验发现, Angiopep-2 修饰的Ag2S 能在皮下瘤模型中出现分布和聚集, 说明修饰后的 Ag2S 量子点具有一定脑胶质瘤细胞的靶向性.
近年来, 中枢神经系统疾病如脑肿瘤、神经退行性疾病的发病率和死亡率在不断升高, 但是血脑屏障(blood brain barrier, BBB)系统的存在阻碍了诊断及治疗药物从血液向脑内转运[1,2], 几乎 100%的大分子和 98%以上小分子不能通过血脑屏障系统, 极大地限制了脑部疾病的诊断和治疗[3~6]. 脑靶向分子的发现[7~9]和纳米成像探针[10~15]的研究为脑部病变的诊断和药物的脑靶向输送带来了新的契机. Yan 等[16]利用 PAMAM 树枝状结构特点, 构建了血脑屏障和脑肿瘤双级靶向修饰的成像纳米探针, 以光学和磁共振双重模式对胶质瘤进行成像, 发现在胶质瘤的早期, 纳米探针可以跨越血脑屏障在胶质瘤内聚集, 实现了早期胶质瘤的双模式成像. Bruun 等 [17] 将脂质体表面用低密度脂蛋白配体(Angiopep-2)进行修饰, 内部包裹 siRNA, 跨越血脑屏障, 针对性地沉默胶质瘤细胞内的目的基因, 从而抑制肿瘤细胞的增殖. Kumar 等[18]将狂犬病毒糖蛋白(RVG)结合在 siRNA 上, RVG 成功将 siRNA 运输到脑部发挥作用. Li 等[19]将 Pep TGN 多肽连接到 PEG-PLGA 纳米颗粒的表面, 利用 Pep TGN 多肽的脑靶向性, 携带纳米颗粒穿过血脑屏障, 到达脑部. 纳米材料为脑部成像探针的构建和跨脑药物输送提供了有利的载体.
Ag2S QDs (quantum dots)是一种新型的近红外二区(NIR, 1.0~1.4 μm)量子点, 2010 年, 王等[20]首次报道了这种新型量子点的近红外二区荧光特性, Ag2S 量子点发射荧光峰位于近红外二区, 作为新型的NIR-II 荧光纳米探针具有高的量子效率, 高的荧光强度且不会淬灭, 表面经过生物分子修饰后, 在细胞和动物上均未见明显的毒性[21,22], 因此在活体成像中的应用研究倍受关注. 目前常用的荧光探针按照荧光发射的波长可以分为可见光区(450~750 nm)、近红外一区(NIR-I, 750~900 nm)、近红外二区(NIR-II, 900~1400 nm)[22]. 可见光区的荧光探针会存在生物组织中的一些生物分子吸收或者散射, 导致成像的深度非常有限[23]. 近几年在 NIR-I 成像染料和探针方面也取得了可喜的进展, 如 Wang[24]、Ji[25]等利用聚集诱导发光(AIE)原理设计成像探针, 不仅使荧光强度增强, 而且使其荧光发射峰落在近红外波段, 可用于细胞的荧光成像和细胞内炎症过程动态检测等方面. 此外, 稀土掺杂的纳米颗粒、新型的铜铟硫量子点以及粒径小于 2 nm 的水溶性手性金纳米团簇都展示出了良好近红外区的荧光性能[26~28]. 这些探针发射光谱多位于近红外一区, 在细胞成像方面取得了良好的成像效果, 而在动物及组织成像方面, 会受组织穿透深度的限制. Ag2S QDs 具有优良的 NIR-II 荧光特性, 与其他NIR-I 的荧光探针相比, NIR-II 荧光在整体动物成像方面具备明显的优势: (1)具有更高穿透深度及高成像信噪比; (2)具有更高的分辨率和较低的自发荧光[22].
基于 Ag2S 量子点在活体成像中的优势[29,30], 在EDC/NHS 的介导下[31], 我们将 Ag2S 进行脑部靶向分子 Angiopep-2 (ANG)多肽的修饰, Angiopep-2 多肽是由低密度脂蛋白受体相关蛋白(LRP)配体抑肽酶 Kunitz 结构域设计演化而来的短肽(包含19个氨基酸残基)[32], 在BBB 和胶质细胞瘤中有大量 LRP1 表达, Angiopep-2 能被 LRP1 特异性地识别、结合, 细胞膜内陷形成内化小泡, 穿透 BBB 进入脑内, 对血脑屏障和胶质瘤细胞(U87MG)具有双重靶向性. 相对于其它的脑靶性策略, 如转铁蛋白或其它小分子, 脑靶向肽类具有容易合成、竞争结合不明显、免疫原性低及受体内环境干扰小等优点, 其中 Angiopep-2 入脑效率要明显优于转铁蛋白[33], 而且容易修饰, 因而被广泛应用于脑靶向材料的修饰中[34~45]. 因此, 本研究利用 Angiopep-2 多肽修饰 Ag2S量子点构建具有脑靶向的近红外二区分子成像探针, 并对其体内外性质进行初步的探讨.
2 结果与讨论
2.1 Ag2S-ANG 量子点的表征
2.1.1 琼脂糖凝胶电泳
从外观看, 经过 ANG 多肽修饰后, 溶液的颜色和荧光性质没有明显的变化, 电泳结果显示, 修饰 ANG多肽的Ag2S量子点的条带位置要比未修饰ANG多肽的Ag2S 量子点条带距离上样孔位置近(图 1), 琼脂糖电泳是根据分子量进行分离的, 也就是说 Ag2S-ANG 量子点的分子量增加.

2.1.2 水合粒径(DLS)和 zeta 电位
经动态光散射检测发现 Ag2S 量子点的水合粒径约为 6 nm, Ag2S-ANG 的水合粒径约为 8 nm, 修饰了 ANG多肽的 Ag2S 量子点的粒径增大(图 2a, 2b), 经进一步检测材料的 zeta 电位发现, Ag2S 量子点表面呈负电性,zeta电位是-11.47±1.56 mV, 而修饰了 ANG 多肽的 Ag2S量子点的电位是+28.7±1.35 mV(图 2c), 带正电. ANG多肽的等电点是 10, 所以在该溶液中带正电, 而修饰了ANG 多肽的 Ag2S 量子点带正电.
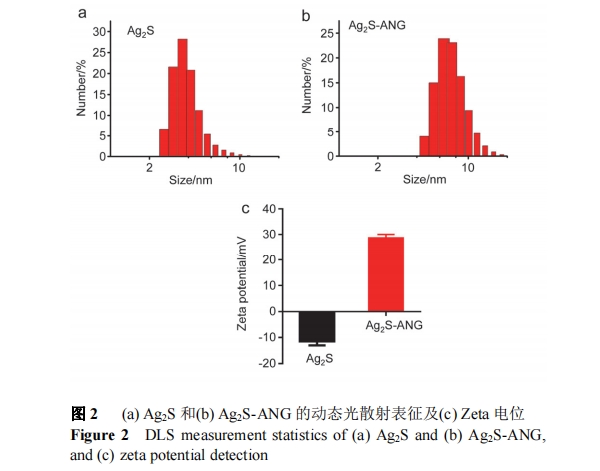
2.1.3 透射电子显微镜(TEM)
利用 TEM 对 Ag2S 和 Ag2S-ANG 量子点的粒径进行表征(图 3), 随机选取 50 个量子点, 用 Gatan Digital Micrograph 软件分别统计 Ag2S 和 Ag2S-ANG 量子点的大小, 结果发现, Ag2S 量子点的粒径约 5 nm, Ag2S-ANG量子点的粒径约为 7 nm, 经过修饰后粒径增大. 结合电泳和 DLS 及 zeta 电位结果, 表明 ANG 短肽成功修饰在Ag2S 量子点上.

2.1.4 吸收及荧光发射光谱
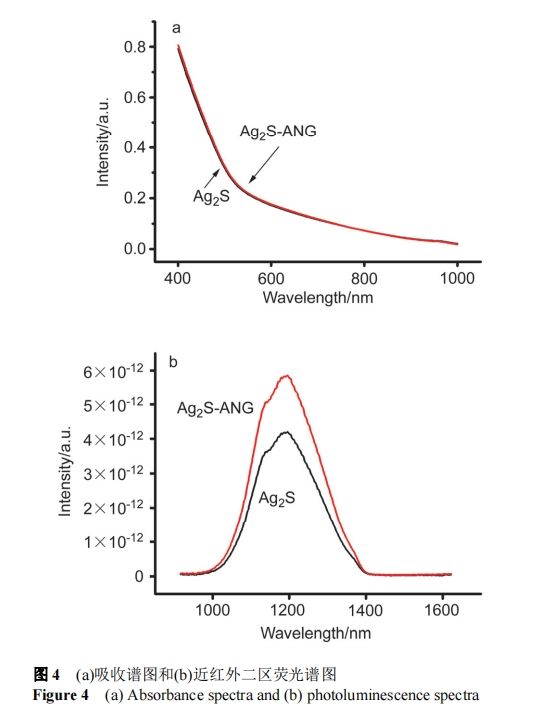
为了考察肽修饰前后 Ag2S 量子点的吸收光谱和荧光发射光谱是否有变化, 我们分别检测了修饰前后的吸收和发射光谱, 从吸收谱看(图 4a), Ag2S 量子点修饰前后没有明显变化. 从发射光谱看(图 4b), 修饰多肽后荧光强度有明显的增强, 原因可能是修饰多肽后, 多肽分子较大, 包裹在量子点表面, 减少了量子点的表面缺陷, 使得荧光增强.
2.2 细胞毒性
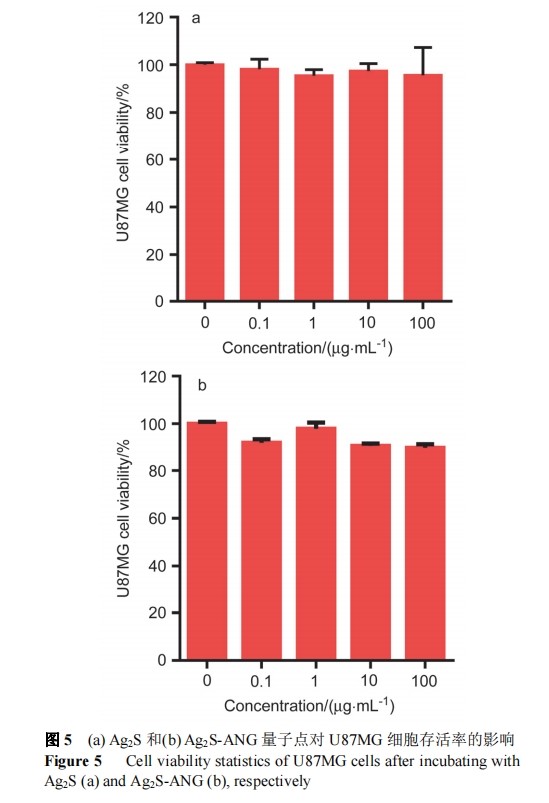
采用噻唑蓝(MTT)法评价 Ag2S 及 Ag2S-ANG 的细胞毒性. 其检测的原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性 MTT 还原为水不溶性的蓝紫色结晶甲瓒(Formazan)并沉积在细胞中, 而死细胞没有此功能. 还原生成的 Formazan 结晶可被酸化的十二烷基磺酸钠(SDS) (pH 3.0~4.0)溶解, 利用酶标仪测定 570 nm 处的光密度 OD 值, 以反映出活细胞数目. 根据 MTT 的结果显示, Ag2S 和 Ag2S-ANG 量子点与 U87MG 细胞共孵育24 h 后, 在低于 100 μg/mL 时, 细胞存活率接近 100%, 修饰前后对该细胞均未显示明显的毒性(图 5).
2.3 ANG 多肽促进 U87MG 细胞对 Ag2S 量子点的摄取
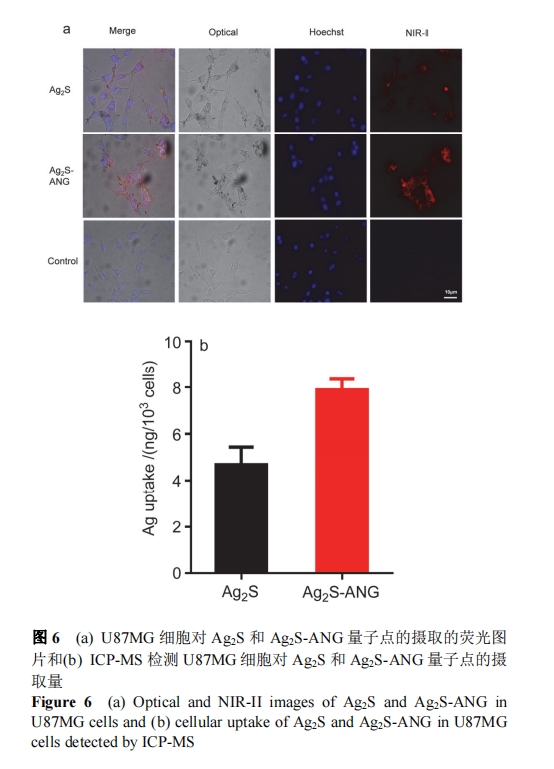
ANG 多肽是低密度脂蛋白受体的配体, 能够靶向U87MG 细胞, 将 ANG 多肽修饰到 Ag2S 量子点的表面, 利用 ANG 多肽与 U87MG 细胞上的受体结合, 携带Ag2S 量子点进入细胞, 通过对细胞进行近红外二区荧光成像可以看出, 经 ANG 修饰后的量子点在细胞中的荧光强度较未修饰的量子点明显增强(图 6a), 进一步用ICP-MS 分析细胞对修饰和未修饰 ANG 的 Ag2S 量子点的摄取情况发现, Ag的含量比未修饰的量子点高出将近1 倍(图 6b), 表明 ANG 的修饰增加了 U87MG 细胞对Ag2S 量子点的摄取.
2.4 Ag2S-ANG 量子点在荷瘤鼠中的分布及近红外二区荧光成像
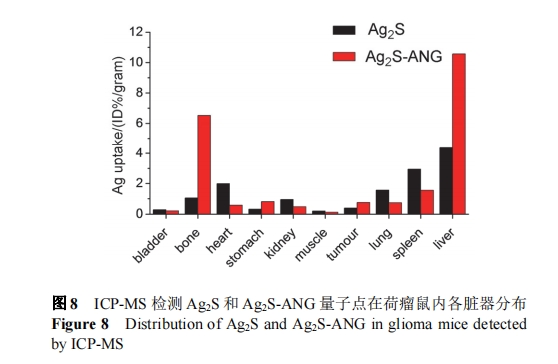
荷瘤鼠的皮下瘤长到约 4~5 mm2 时, 进行近红外二区成像(图 7a). U87MG 细胞具有荧光素酶(luciferase)报告基因, 在近红外二区成像前, 先注射 luciferase 的底物, 用生物发光系统检测其肿瘤的大小及边界, 然后经尾静脉注射 Ag2S 或 Ag2S-ANG 两种量子点, 在近红外二区成像系统进行肿瘤成像(图 7b, 7c). 经生物发光检测皮下瘤已经形成且在后肢大腿外侧, 近红外二区成像中未检测到 Ag2S 量子点在肿瘤部位的聚集, 而Ag2S-ANG 量子点在注射后 12 h, 在肿瘤部位检测到比较明显的聚集, 但同时, 两种量子点在肝、胃、脾、肾、肺、骨骼等部位具有较高的分布(图 8).
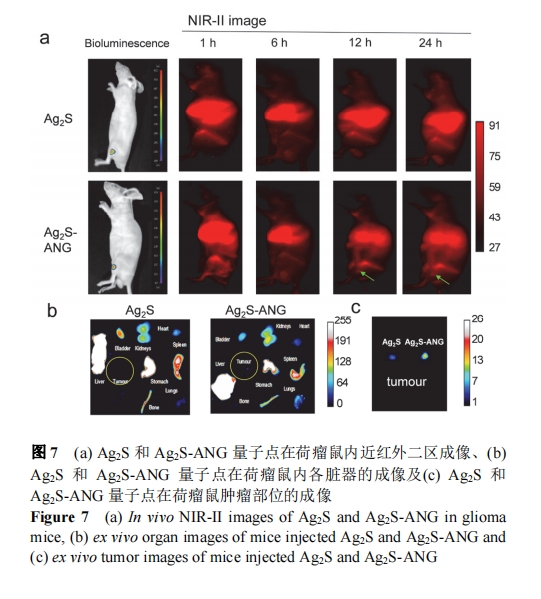
进行完近红外二区荧光成像, 将小鼠的肝、心、脾肺肾等解剖 , 对脏器进行称重 , 然后用消解液(HNO3/H2O2, V∶V=7∶1)在 100 ℃下进行消解 30 min, 消解完成后再将消解液稀释到 2%, 用 ICP-MS 进行 Ag元素的含量分析, Ag2S 和 Ag2S-ANG 两种量子点主要分布在肝、脾等组织, 而修饰 ANG 的 Ag2S-ANG 量子点在肿瘤部位也有所聚集, 此外在骨骼和肝脏部位分布增加了近一倍, 在肺、脾、肾等部位分布量较 Ag2S 减少, 在肿瘤部位的分布增加, 表明 ANG 的修饰增加了 Ag2S对脑胶质瘤的靶向, 减少了 Ag2S 在肺、脾、肾等脏器的分布, 为脑肿瘤的近红外二区成像探针的设计提供了初步的思路, 如何使肿瘤部位有更高的摄取和滞留的同时, 减少其在主要脏器(肝、脾等)的分布, 还需要后续通过摸索最佳的靶分子数量和最佳的成像时间等进一步探讨.
3 结论
设计合成了一种基于 Ag2S 量子点的近红外二区的荧光成像探针 Ag2S-ANG, 该探针细胞毒性低, 在脑胶质瘤细胞中具有较高的摄取, 初步的荷瘤鼠实验也显示其对胶质瘤具有一定的靶向性, 在脑部病变的近红外二区成像方面具有潜在的应用前景.
4 实验方法
4.1 Ag2S QDs 的合成及表面修饰 ANG 多肽
4.1.1 表面修饰有羧基 (COOH) 的硫化银量子点Ag2S-COOH 的合成
将 0.1 mmol 的二乙基二硫代氨基甲酸银、10 g 十二硫醇混合置于烧瓶中, 在 N2 气氛中升温至 200 ℃保持1 h, 最后待溶液自然冷却至室温后, 加入50 mL无水乙醇, 经离心、洗涤, 分散在环己烷中; 进一步将 0.15 g硫辛酸加入上述环己烷中, 再加入同等体积的无水乙醇, 搅拌 48 h, 然后离心, 洗涤, 用去离子水分散得到羧基修饰的水溶性 Ag2S 量子点.
4.1.2 Ag2S-COOH 量子点表面脑靶向肽 Angiopep-2 (ANG)修饰
在交联剂 EDC/NHS 介导下, Ag2S 量子点的-COOH和 ANG 多肽的-NH2通过缩合反应进行连接, 再加入少量 NH3•H2O 保持溶液 pH 的稳定, 利用 EDC 和 NHS 交联反应要优于醛类交联剂, EDC 只是帮助分子的羧基和氨基之间形成酰胺键, 而本身并没有成为实际交联的一部分, EDC 首先是和羧基形成一个 O-异酰基脲结构, 这一活化中间物并不稳定, 而 NHS 通过形成更稳定的酯而增强该活化中间物的稳定性可以消除并被清洗掉[16]. 整个过程分为三步:
(1)称量 EDC (5.34 mg)、NHS (18.45 mg)、ANG (0.49 mg), 根据相对分子质量将 EDC 和 NHS 配制成 2 mmol/L 的溶液, 将 ANG 配制成 200 μmol/L 的溶液.
(2)取 15 μL Ag2S-COOH (10 μmol/L)量子点, 加入等体积的 ANG, 再加入等体积的 EDC/NHS, 此时溶液变浑浊, 再慢慢加入稀释过的氨水, 待溶液变澄清后, 再将混合液在控温振荡器(300 r/min)震荡 30 min.
(3)然后再加入三倍体积的 EDC/NHS 在控温振荡器(300 r/min)震荡 8 h.
(4) 8 h 后, 将溶液转移至超滤管, 在 3000 g 条件下离心 15 min, 然后倒置超滤管在 1000 g 条件下离心 10 min, 收集溶液.
4.2 Ag2S-ANG QDs 的表征
4.2.1 琼脂糖凝胶电泳
取 0.3 g 琼脂糖粉末置于烧杯中, 加入 15 mL TBE, 15 mL 去离子水, 混匀, 在微波炉中加热使琼脂糖全部溶解, 配成质量浓度为 1%的琼脂糖凝胶液, 然后倒入电泳槽中, 成胶后进行电泳. 将Ag2S和Ag2S-ANG稀释到同一浓度(1 mg/mL), 分别在不同的上样孔中上样 10 μL, 100 V 电泳 20 min, 取出胶置于近红外二区成像仪中进行成像, 同时拍摄白光照片.
4.2.2 Zeta 电位及水合粒径表征
将 Ag2S 和 Ag2S-ANG 稀释到同一浓度(20 μg/mL), 然后将稀释后的溶液放入比色皿中, 分别置于纳米粒度及电位分析仪中进行动态光散射和 ξ 电位分析, 每个样品设三管重复样, 进行检测.
4.2.3 透射电子显微镜(TEM)表征
TEM 表征要事先制样, 将 Ag2S 和 Ag2S-ANG 稀释到相同的浓度, 每个样品取10 μL, 滴在两个铜网上, 让其自然风干, 然后置于 TEM 下进行粒径分析.
4.2.4 吸收光谱和荧光光谱检测
将 Ag2S 和 Ag2S-ANG 量子点稀释至相同的浓度, 置于紫外-可见光谱仪上进行吸收光谱测定, 然后置于近红外荧光光谱仪上进行荧光发射光谱测定.
4.3 细胞毒性
细胞毒性采用的是 MTT 方法, 具体实验步骤如下:
(1)将对数生长期的 U87MG 细胞用胰酶消化, 制成单细胞悬液, 以每孔 100 μL (1×104个细胞)的体积将单个细胞悬液接种于 96 孔板中, 置于 37 ℃、5% CO2的恒温培养箱中培养 24 h.
(2)培养 24 h 后, 弃去 96 孔板中旧的培养基, 加入不同浓度的 ANG 多肽修饰的 Ag2S 量子点(终浓度分别为 100, 10, 1, 0.1 μg/mL), 与细胞共培养 24 h.
(3)共培养至 20 h, 向 96 孔板中加入 10 μL MTT 溶液(5 mg/mL), 其终浓度是 0.5 mg/mL, 继续培养至 24 h.
(4)共培养至24 h, 每孔加入110 μL酸化的SDS (pH 3.0~4.0), 孵育过夜, 充分溶解.
(5)过夜后, 吸出 96 孔板中的溶液至 1.5 mL 离心管中, 14000 r/min 离心 15 min, 离心后, 取 200 μL 上清于新的 96 孔板中, 酶标仪 570 nm 检测各孔吸收值, 计算细胞存活率.
4.4 细胞摄取
取对数生长期的 U87MG 细胞, 胰酶消化后, 铺到confocal 皿中, 每孔 5×104 个细胞, 设定 Ag2S 和Ag2S-ANG两组, 每组3个平行样, 细胞培养过夜后, 分别加入终浓度为 20 μg/mL 的 Ag2S 量子点和 Ag2S-ANG量子点, 继续培养 24 h.
(1)吸去旧培养基, PBS洗三次, 用质量浓度为4%的多聚甲醛溶液(PFA)固定细胞 30 min; 固定完成后 PBS洗3次; Hoechst染料染核10 min, 染核完毕PBS洗三次, 即可在显微镜下拍照.
(2)吸去旧培养基, 收集各个皿中的细胞, 再用 70%的浓硝酸消解, 然后稀释硝酸到 2%, 利用 ICP-MS 进行样品中 Ag 含量测量.
4.5 荷瘤鼠近红外二区成像
首先制备皮下瘤荷瘤鼠模型, 将对数期的脑胶质瘤U87MG 细胞进行消化, 离心收集细胞, 用 PBS 将细胞制成 2.5×107 个/mL 的细胞悬液, 为了方便成像, 减少了裸鼠本身的一些组织的干扰, 肿瘤细胞接种于裸鼠左后肢外侧, 每只裸鼠注射的量为 200 μL 的细胞悬液, 细胞数量为 5×106. 接种肿瘤后 1~2 周即可生成肉眼可见的皮下瘤. 皮下瘤不宜过小, 否则成像强度不够; 也不宜过大, 过大肿瘤组织可能会坏死, 影响成像, 待肿瘤长到约 4~5 mm2 左右时进行成像. 经尾静脉给荷瘤鼠注射浓度为 1 mg/mL 的 Ag2S 或 Ag2S-ANG 量子点, 每只鼠注射 100 μL, 分别在注射后 5, 10, 15, 30 min, 1, 3, 6, 12, 24 h 在近红外二区成像仪中进行成像.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。








