
摘要 生物分子自组装对生物体有重要意义, 利用生物分子构筑具有功能性的有序组装体一直是人们关注的焦点. 肽分子是一类重要的组装基元, 肽的超分子自组装可形成多种纳米或微米尺度的结构, 并可应用于能源、医药等领域. 如何实现肽自组装结构的精准调控以及精准调控肽自组装实现功能化, 是目前该领域面临的新挑战. 肽的自组装是基于非共价键力的协同作用实现的, 通过各种因素调节这些非共价键力的作用, 是实现自组装结构调控和功能化的关键. 虽然自组装结构调控可以通过改变外部环境调控, 但是通过精确分子设计、组装基元分子间的相互作用调控可以更好地实现结构的精准调控; 并有利于进一步通过引入功能性分子作为组装基元, 实现自组装体的功能化. 本文将针对肽自组装体的结构调控以及功能化两个方面对相关研究进行综述.
生物分子自组装是生命的基础, 它在生物体中普遍存在, 从简单的脂质分子组装形成磷脂双分子层、肽链折叠形成蛋白质结构以及 DNA 双螺旋结构, 到更为复杂的细胞器、细胞、组织器官等, 都是由生物分子在不同尺度上分级自组装构建而成的, 这些高度协调自组装体系为生命体实现其功能性和活性提供了有利的保障. 生物分子自组装过程是在动力学与热力学控制下自发形成有序聚集体的过程. 该过程中, 各种非共价键力包括氢键力、静电力、疏水作用、π-π作用以及范德华力间的协同作用是决定自组装体形貌和功能的关键[1]. 受生物体系启发, 利用生物分子作为组装基元构筑各种尺度以及形貌的纳米结构, 一直受到人们广泛关注和研究[2]. 肽分子是一种较为常用的组装基元, 它由几个或多个氨基酸序列构成, 并具有很多优势比如生物兼容性、生物降解性、结构易编辑性、低免疫原性等[3~5]. 肽分子可自组装形成多种纳米或微米尺度的结构, 并可应用于生物医药、纳米科技、能源等多个领域[6~9].
随着科技的发展, 使得肽分子自组装的研究也面临新的挑战: 不仅只局限于组装体纳米结构(以下简称为“组装结构”)的单一调控, 更要将相关研究拓展为利用肽分子分级自组装构建复杂结构的功能体系[10,11], 即实现肽自组体纳米结构的精准调控(以下简称为“结构调控”)以及精准调控肽自组装实现功能化. 因此, 本文将从这两个方面对相关研究进行综述.
2 肽分子自组装的结构调控
各种非共价键力, 包括氢键、疏水作用、静电作用、π-π堆积以及范德华力的协同作用是决定肽分子自组装结构和性质的关键[1,12]. 通过调控组装基元的分子结构以及组装环境因素(包括 pH、温度、浓度、外场等)可以调控这些非共价键力的相互作用, 进而实现对自组装过程的热力学和动力学控制[12]. 氢键作用具有高度选择性和方向性, 是诱导生物分子长程有序结构形成的关键性因素. 肽分子含有许多氢键形成位点, 包括肽链骨架上的酰胺基团以及侧链上的氨基和羧基, 因此氢键在形成和稳定肽链的二级结构和蛋白质的折叠构象中起到重要作用. 疏水作用是两亲性生物分子自组装的主要驱动力, 疏水作用不具有方向性, 在生物体中, 由于水分子的存在, 疏水作用往往伴随着氢键作用协同影响肽分子的自组装. 静电作用和π-π堆积作用分别对荷电性的和具有芳香环类的肽分子有明显影响. 但是与苯环的疏水作用不同的是, π-π作用中的苯环可以形成有序的堆积结构. 范德华力是一种重要且普遍存在的非共价键力, 但它往往需要与其他非共价键力协同影响自组装过程.
肽超分子自组装的结构化以及功能化都是基于这些非共价键力的协同作用实现的; 反之, 如何通过各种因素调节这些非共价键力的作用, 成为人们实现组装结构有效调控的关键. 目前, 自组装体结构调控的方式主要有两种: (1)通过改变外部环境调控; (2)通过组装基元分子间的相互作用调控.
肽分子的自组装是在热力学和动力学协同控制下的过程: 热力学上, 肽分子与溶剂间的非共价键相互作用决定了组装体的热力学稳定结构, 但是由于非共价键间弱的相互作用, 在不同的溶剂环境中, 即在不同 pH、温度、对离子等动力学因素影响下, 肽分子可以通过不同的二级结构(比如 β-折叠和 α 螺旋)构筑不同尺度的结构, 包括纳米管[13]、纳米纤维[14,15]、微球[16]以及微米级的纤维束结构等. 各种动力学因素可以有效地改变肽分子与溶剂分子的作用, 从而影响肽自组装体的形貌, 对组装动力学过程亦有重要调控作用[17,18].
例如, Kim 等[19]报道了二肽二苯丙胺酸(FF)在不同水环境中形貌与 FF-水分子间相互作用的关系: XRD 结果表明纳米管与纳米线的晶体结构是一致的, 而引起FF 形貌不一致的原因在于所形成晶体中 FF 与水分子相互作用的区别. 这说明 FF 与水分子作用程度不同, 会直接影响自组装体的形貌. 因此, 增加溶液离子强度, 离子的水合效应会与 FF 的水合作用相竞争, 最终导致FF 水合程度的改变, 从而可以有效地调控 FF 形貌的转变 . 另外 , 通过增大环境湿度或增加体系中水含 量[20~23], 亦可诱导肽纳米管生长为多级结构. 通过调节水溶液 pH[24]和温度[25], 可以获得不同形貌的自组装体. Xu 等[26]引入乙腈增加水溶液的疏水性, 可以有效影响两亲性寡肽分子与水分子间的氢键作用, 从而改变所形成纤维的形貌.
简而言之, 作为一种较为广泛和常用的调控手段, 该方法主要通过改变溶剂环境包括 pH、离子强度、浓度、温度等外部因素来改变组装分子与溶剂间的非共价键相互作用, 通过自组装过程的热力学和动力学控制实现肽分子组装结构的改变和调控[12].
虽然仅通过改变基元分子的外部环境来改变自组装结构的方法较为普适和简单, 但该方法同时也存在较大的局限性, 即无法实现精准调控. 而通过特定的分子设计[27~32], 亦或控制两种或两种以上的组装基元间的相互作用, 可以更有效地实现对组装体结构的精准调 控[33~35].

Yan 等[40]通过向二氯甲烷中引入微量溶剂(乙醇、N,N-二甲基甲酰胺、丙酮、水)的方法, 研究了氢键作用对二肽(FF)自组装的调控能力. 由于引入的微量溶剂含量较低, 可以将微量溶剂分子当作溶质分子, 这些微量溶质分子与 FF 分子发生共组装, 从而作为主导因素来调控二肽的自组装行为. 结果发现氢键作用力在 FF 纤维化过程中是关键的诱导因素, 添加的具有成氢键能力的微量溶剂可以有效地影响 FF 分子中 C=O 和 N—H的氢键作用; 氢键的方向性可以诱导 FF 分子在长程方向上的有序排列, 最终导致纳米纤维以及纳米带结构的形成.
Xu 等[41]利用不同的核苷对多肽进行了分子设计和改性, 之后将得到的核苷-肽分子两两混合, 可以得到同纤维结构的凝胶, 该凝胶具有很好的生物兼容性且对蛋白酶 K表现出很好的抗水解性, 在所形成的纤维结构中, 不同结构的核苷-肽分子间的氢键和疏水协同作用是使体系稳定的关键因素.
通过改变二肽的性质可以有效调控自组装结构, 用L-Lys-L-Lys (KK)代替 FF 与卟啉共组装后, KK-卟啉分子间的静电作用和氢键作用、以及卟啉-卟啉分子间的π-π作用协同诱导卟啉分子形成具有 J 聚集结构的 KK-卟啉纳米棒. 在短程的范德华力作用下, 纳米棒聚集成多级的长程纤维束结构, 纳米棒的进一步聚集可用Onsager 理论中的平动熵和转动熵变来解释(图3a 和3c). 最终形成的纤维束结构具有很好的光催化活性和光稳定性, 可用于催化还原生成Pt纳米球或Pt纳米线[45]. 结合全原子分子动力学模拟(MD)以及耗散粒子动力学模拟(DPD), 细化研究了卟啉与两种不同的二肽形成不同纳米结构的原因: 虽然 FF 与 KK 都会诱导卟啉形成 J聚集的纳米棒结构, 但是由于 FF 分子的强疏水性使 FF更倾向于插入卟啉 J 聚集体内部, 而亲水的 KK 分子则被固定在卟啉 J 聚集体的表面, 从而增强了卟啉纳米棒的方向性, 并促使纳米棒定向生长成纤维束结构[46].
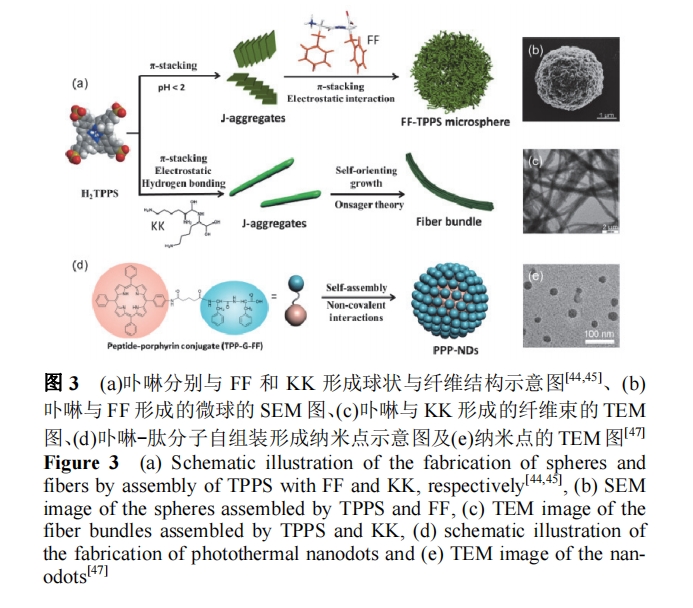
以上是卟啉类分子与不同的寡肽分子共组装, 通过分子间作用力的协同以形成不同的组装结构. 而设计将卟啉和二肽分子通过共价键合成为一个分子后, 则可以形成有趣的纳米点, 卟啉的π-π作用以及整个分子的疏水效应是形成的纳米点的主要驱动力. 肽分子中的电荷端基有效地防止了卟啉分子过快的π堆积, 从而起到了稳定纳米点的作用(图 3d 和 3e)[47].
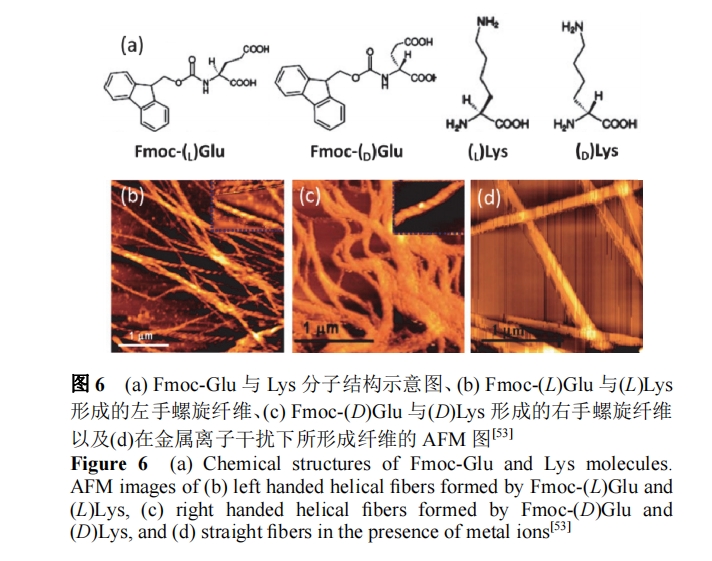
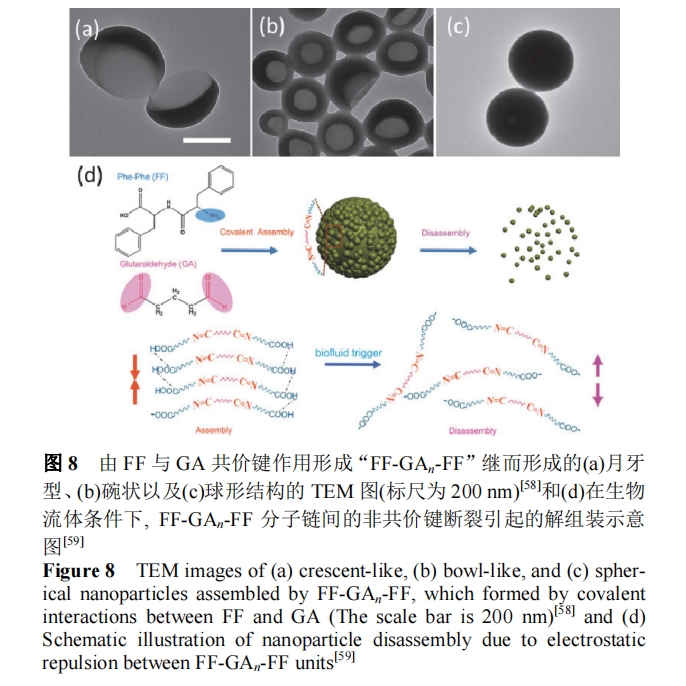
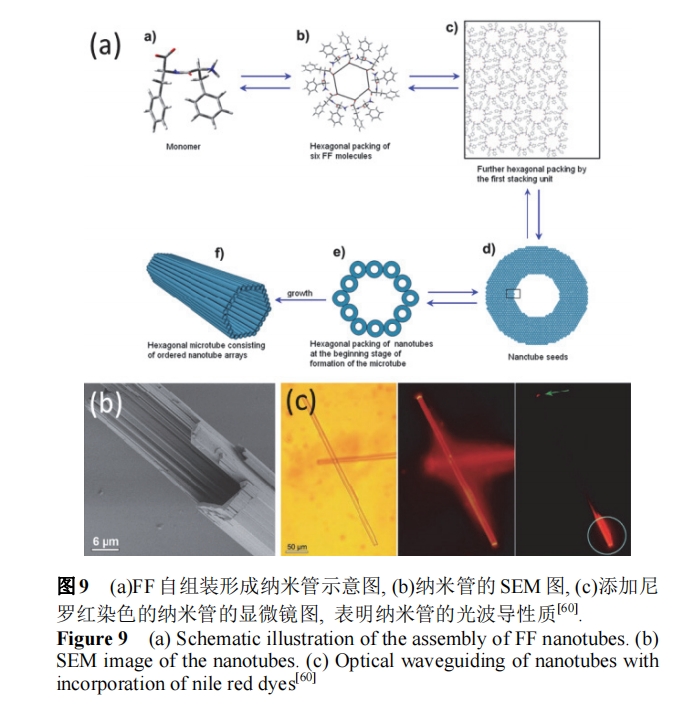
综上所述, 利用两种或两种以上的组装基元间的相互作用可以提高自组装结构的精准性, 更有利于通过特定的分子设计, 实现自组装体的功能化.
3 肽分子自组装的功能化
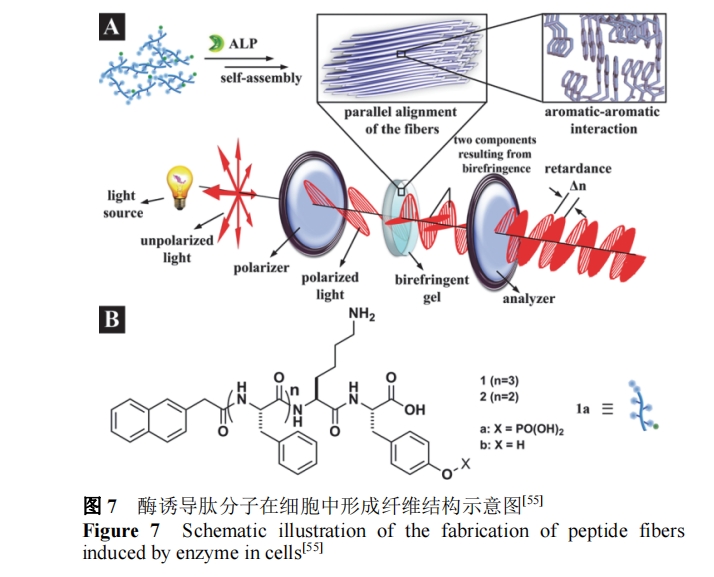
自然光合成系统能将太阳能高效转化为化学能, 模拟和创建这类系统为人们更大程度地利用太阳能提供了机遇. 在自然界中的光合成系统中, 最有效实现光捕获以及能量转移的方式即是利用蛋白质/肽与具有发色基团的、功能性的分子共组装形成的自组装体, 而如何通过精准的人工调控, 来增强光捕获、电荷分离和催化反应的持续性, 是构建模拟光合成系统的关键科学问题.
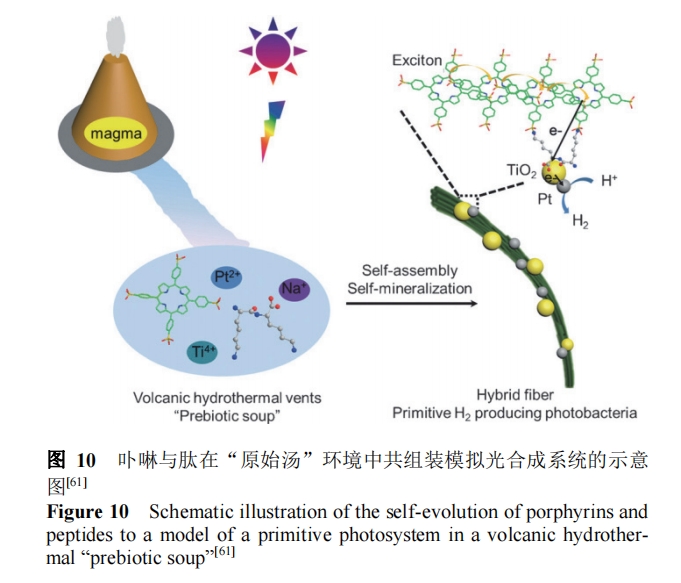
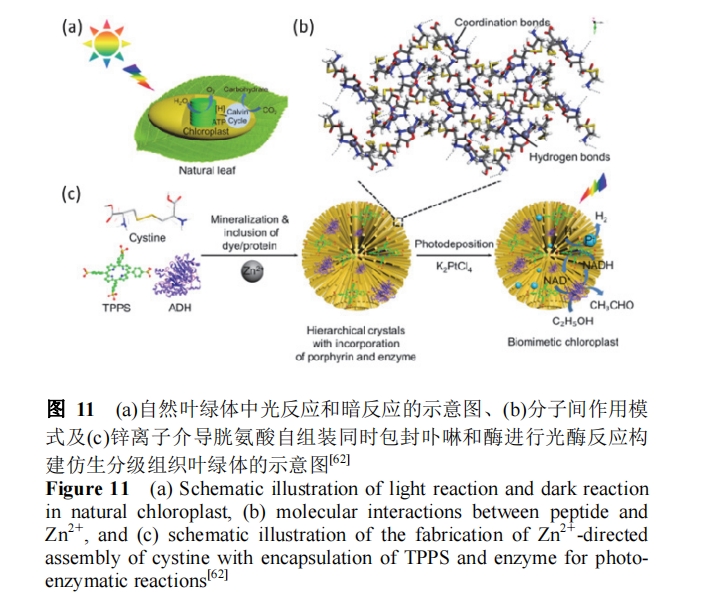
根据肽分子自组装体的结构特点, 还可以仿生比如光催化产氧. 由于肽分子自组装的多样性和可控性, 在模拟生物体系(无论是结构仿生, 还是功能仿生)方面都有很大优势, 值得人们深入探究.
利用化学药物的毒性是治疗肿瘤常用的方式之一. 通过分子设计可以有效地将化学药物包载到肽自组装体中. Li 等[63]利用酶响应性的树状型肽分子连接化学药物 Dox, 设计的分子可自组装形成表面带负电荷的球型粒子, 由于疏水作用, Dox 基团集中在粒子内部, 因此有效降低了 Dox 对生物体的毒性作用. 在酶的刺激下, 体系发生解组装后释放出 Dox, 从而达到治疗的目的.
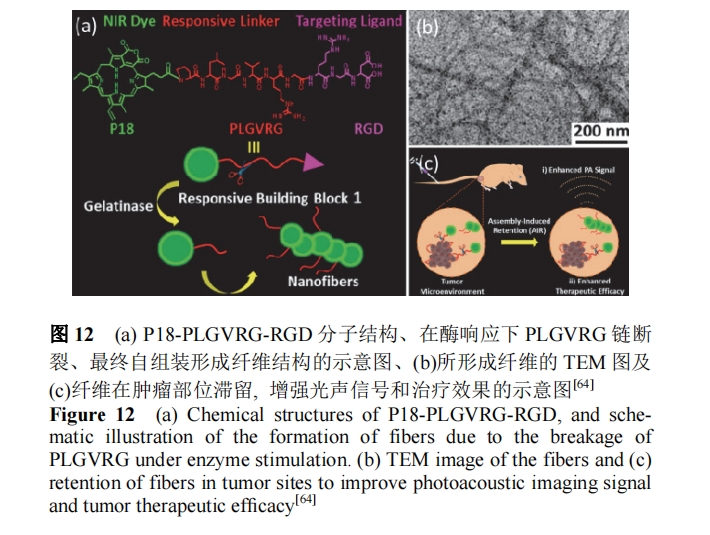
光动力和光热治疗是一种光辅助非侵入的肿瘤治疗方式, 在治疗肿瘤、皮肤病和微生物感染等疾病中有着重要应用. 光动力和光热治疗具有操作简单、选择性高、毒副作用小等优势, 近年来得到了迅速发展, 已有一些药物被批准用于临床应用. 通过引入合适的光敏剂与肽共组装[66], 一方面可实现自组装体结构的精准调控, 另一方面, 有利于提高药物的生物活性以及生物兼容性.
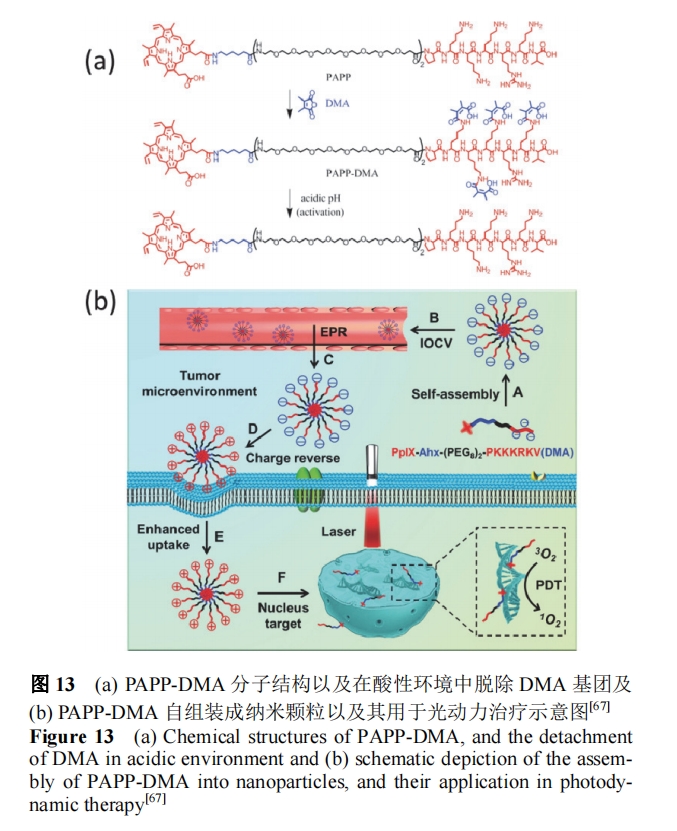
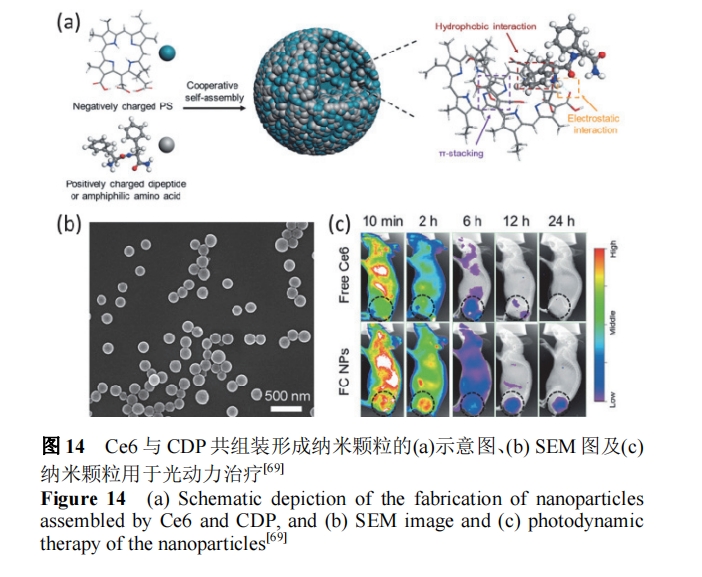
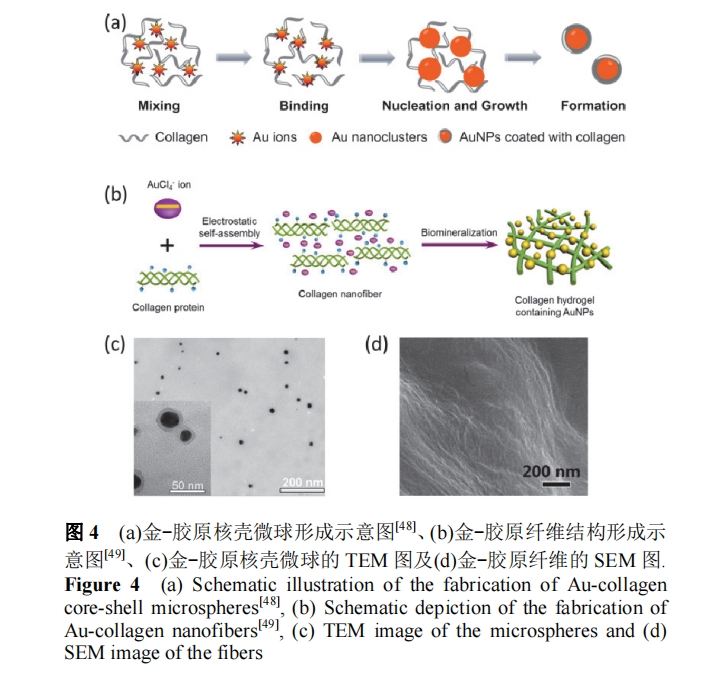
Yan 等[47]还利用化学键连接的卟啉-二肽复合分子自组装形成具有很好的光热效果的纳米点. 纳米点结构中卟啉π-π作用所形成的 J 聚集结构可以有效地抑制荧光发射以及单线态氧的产生, 从而使整个纳米在光照条件下具有很高的光热转换效率, 进而用于肿瘤的光热治疗中. 利用原位矿化反应制备的包含 Au 颗粒的可注射的水凝胶, 可作为药物载体负载药物后直接被注射并保留在肿瘤内部, 进行有效的光动力治疗[49]. 另外, 由于金纳米颗粒本身具有很好的光热效果, 因此, 这种胶原-金杂化水凝胶亦可用于肿瘤的光热治疗以及光热-光动力联合治疗中[70].
其他一些具有光、电、磁的分子亦可引入肽分子自组装体系中, 并有效地增强体系的性能, 为肽自组装的功能化提供了有利支撑.
4 总结与展望
肽超分子自组装在众多交叉领域, 包括化学、材料、以及生物科学, 都有重要的研究意义. 肽分子可自组装形成管、线、颗粒、纤维等多种从纳米至微米尺度的材料, 这些材料在生物医药中具有广泛应用前景. 由于肽自组装过程是在各种非共价键包括氢键、π-π堆积、疏水作用、静电力以及范德华力的协同作用下实现的, 因此, 合理地调节这些力的相互作用, 便可从动力学和热力学上对自组装体结构进行调控, 从而实现自组装体功能的多样化.
虽然通过调控组装环境因素(包括 pH、温度、浓度、外场等)可以很好地改变体系中非共价键的相互作用, 但是该方法过于单一且不利于自组装体功能化的实现. 而通过调控组装基元的分子结构、亦或设计两种(及以上)组装基元间的共组装将更有利于获得结构可调的自组装体, 同时引入光敏剂、化药、酶等功能性分子与肽分子进行共组装, 可以有效提高肽自组装的性能, 实现材料功能的多样化. 例如, 同样是利用二肽与卟啉分子进行共组装, 但是通过改变二肽分子的性质, 便可获得不同结构的自组装体, 而卟啉的引入赋予材料光捕获、以及光敏等特性, 使材料可以有效地应用于产氢、光动力治疗等领域[44,45].
在后续对肽分子自组装的研究中, 不能只局限于对自组装体形貌结构的单一调控, 更需要进一步拓展: (1)注重如何实现精准调控, 包括在特殊尺度上的控制、对特殊功能的调控. 在分子设计过程中, 细小因素的引入或改变, 都可能对自组装体的形貌和功能产生巨大影响. 利用多种手段比如分子动力学模拟, 从多尺度角度理解这些细小因素对体系内非共价键相互作用力的改变[81], 可以更有效地实现精准调控的目的. (2)与此同时, 要关注功能化的自组装体在复杂环境比如生理环境中的组装/解组装和稳定性等问题. 一方面有助于深入理解生物分子在复杂环境下的作用机制; 另一方面也为肽自组装体系在生物医药、绿色能源等多个领域的应用提供更有效的支撑.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。