
摘 要 多肽在机体中具有重要的生理功能 ,并且它具有化学合成和修饰的便利性 ,因此吸引了越来越多的化学、生物学及其交叉领域研究人员的研究兴趣。神经肽 FF(NPFF) 作为阿片调节肽在阿片耐受等药理学方面具有重要的调节作用。然而迄今为止仍缺乏 NPFF 受体高选择性的激动剂和拮抗剂 ,从而阻碍了NPFF 药理学功能及其作用机制的研究。本文简述了 NPFF 的发现 ,综述了近几年来在 NPFF 的前体、受体和生理学功能等方面所取得的最新进展。结合本实验室的工作 ,重点介绍了 NPFF 构效关系方面的研究 ,并展望了该研究方向今后的发展趋势。
具有调控作用的多肽与其受体 (一类含有10 % —20 %多糖的糖蛋白) 的相互作用是研究与评价生物大分子(蛋白质、多糖和核酸等) 与小分子识别作用的重要组成部分之一。细胞功能、胞间信号转导和免疫应答的调控大多数都是通过肽2蛋白质之间的非共价作用模式来实现的 ,机体中内源性的生物活性肽具有重要的生物学功能[1 ] 。然而 ,除胰岛素、催产素和降血钙素等少数肽之外 ,绝大部分内源性的活性肽都不能直接作为药物来使用 ,而在临床上经常使用的药物为这些肽类配体的类似物 ,即其相应的激动剂或拮抗剂[1 ] 。因此 ,肽类配体的构建和筛选已成为开发全新的药物和药物前体、生物学和药理学工具的重要策略之一。
根据近年来一些最新的药理学研究结果推测 :阿片受体的激活会引起机体内的抗阿片系统出现相应的活化 ,并在机体内达到生理平衡[29 ] 。我们试图通过深入地了解内源性抗阿片系统的作用机制来全面理解阿片的痛觉调节、耐受和成瘾等药理学功能。神经肽 FF(NPFF) 是最具代表性的抗阿片肽之一 ,我们研究组最近 3 年来围绕其构效关系及其相关的药理学活性等研究内容开展了一些初步的研究。由于篇幅等方面的考虑 ,本文主要阐述了 NPFF 构效关系研究方面的最新进展。
1 神经肽 FF 及其受体的发现
1977 年 , Price 和 Greenberg 从 软 体 动 物 蛤(macrocallisa nimbosa) 的体内分离出具有心脏兴奋功能的四肽 FMRF2NH2(Phe2Met2Arg2Phe2NH2)[30 ] 。发现在线虫、果蝇和蝗虫等无脊椎动物体内都存在着FMRF2NH2 样的免疫反应 ,进一步分离得到一系列 C末端均以 RF2NH2 结构结尾的新肽 ,于是将这些结构相类似的肽都归为一个家族 ,即 FMRFa 相关肽(FaRPs) 家族 ,近期研究人员也将它们称为 RFa 肽(RFamide peptides)[31 ] 。
然而 ,在脊椎动物体内寻找 RF2NH2 肽的工作进展比较缓慢 ,直到 1981 年 ,Weber 等[32 ] 首次证实了在脊椎动物体内也存在着类似 FMRFa 的 RF2NH2肽。随后 ,Dockray 等[33 ] 于 1983 年利用抗 FMRFa 的抗体进行放免分析 ,从鸡脑中分离出脊椎动物体内的第一个 RF2NH2 肽 ———LRLRFa。有趣的是 ,随后发现阿片肽甲七肽 ( YGGFMRF) 的 C 末端四肽序列结构与 FMRF2NH2 的氨基酸残基序列完全一致 ,从而推测 FMRF2NH2 可能是与脑啡肽一起协同进化而来的[34],然而药理学研究结果却显示甲七肽和 FMRFa表现出完全相反的生理功能[34 ,35] 。为了进一步探讨FMRF2NH2 样物质的生物活性 ,1985 年 , Yang 等[36] 运用免疫亲合的技术 ,用抗 FMRF2NH2 的血清从牛脑中分离得到了两种新的具有抗阿片活性的 RF2NH2 肽 ,即八肽结构的 NPFF(FLFQPQRF2NH2) 和十八肽结构的 NPAF(AGEGLSSPFWSLAAPQRF2NH2 ) 。
虽然 NPFF 和 NPAF 是作为吗啡的调节肽被发现的 ,其功能并不仅仅局限于对阿片系统的调节。已有的报道表明 , NPFF 不仅具有抗阿片的活性(anti2opioid) ,它还具有加强阿片作用 ,即原阿片活性(pro2opioid) ,因此早期的抗阿片肽也都被归为阿片调节肽 (opioid2modulating peptides)[29 ] 。大量的研究表明 ,NPFF 及其相关肽在痛觉、阿片耐受和成瘾、心血管系统、摄食、体温、消化道运动、水平衡和内分泌等方面都具有重要的调节作用[37 ] 。
自从 NPFF 和 NPAF 发现之后 ,进一步的实验发现在其它几种哺乳动物的中枢神经系统中也同样存在着 NPFF 样的免疫反应 ,但是未能从它们体内分离纯化出新的 NPFF 相关肽。直到 1995 年 ,才从大鼠的脊髓和脑中分离出一种 NPFF 样物质 ———NPSF[38 ] 。随着近年来分子生物学技术的发展 ,在人、牛、大鼠和小鼠体内分别克隆得到了编码 NPFFΠAFΠSF 的基因 (pro2NPFFA 前体的基因)[39 ,40 ] 。与此同时 ,Hinuma 等(2000 年) 和 Liu 等(2001 年) 还分别利用表达序列标签 ( ESTs ,expressed sequence tags) 在Gen2Bank 数 据 库 中 寻 找 新 的 RF2NH2 相 关 肽(FaRPs) ,在此过程中 ,发现了一个新的 NPFF 的前体 ———pro2NPFFB 前体[41 ,42 ] 。进一步的分离鉴定发现 ,在不同的种属中 ,NPFF 的两个前体蛋白的结构和酶切方式也有所不同 ,从而得到了一系列 NPFF相关肽。前体 pro2NPFFA 经酶切后得到两种不同序列的神经肽 : (1) 含有 NPFF(FLFQPQRF2NH2) 序列的肽 ; (2) 含有 NPSF (SLAAPQRF2NH2) 序列的肽。而pro2NPFFB 前体也能生成两种类型的 RF2NH2 肽 : (1)含有 LPQRF2NH2 序列的神经肽 ; (2) 含有 LPLRF2NH2 序列的神经肽[43 —45 ] 。这些神经肽的具体序列结构如表 1 所示 ,但表中所列出的一些肽的酶切位点仍需进一步的实验证实。

虽然较早就发现了 NPFF ,但受到早期研究手段的限制 ,对 NPFF 受体的研究相对比较滞后。最初 ,只能用放免结合实验寻找 NPFF 的结合位点来研究其受体的可能分布区域[46 ,47 ] 。2000 年 ,利用分子生物学技术 ,日本、英国和美国的 3 家实验室几乎同时发现 了 NPFF 的 两 种 不 同 的 G 蛋 白 偶 联 受 体(GPCR) ,即 NPFF1 和 NPFF2 受体 (具体见表 2) ,且NPFF1 与 NPFF2 间 只 有 50 % 的 氨 基 酸 序 列 相同[42 ,48 ,49 ] 。原位杂交实验表明它们在体内的分布也存在一定的差异 ,其中 NPFF1 受体主要分布于丘脑的束旁核上 ,而 NPFF2 受体却主要分布于脊髓和丘脑的外侧区域[41 ] 。
与已鉴定的 GPCRs 相比较 ,发现 NPFF 受体与一些介导摄食功能的 GPCRs 结构相类似 ,如 NPFF1受体与人类的 26RFa 的受体 ( GPR103 ,也被命名为SP9155ΠAQ27 , 49 %)[50 ] 、食 欲 素 受 体 1 ( orexin1 ,37 %) 、食欲素受体 2 (orexin2 ,35 %) 、神经肽 Y Y2 受体 (NPY Y2 , 34 %) 、胆囊收缩素 A 受体 (CCKA ,34 %) 、神经肽 Y Y1 受体(NPY Y1 ,32 %) 、促乳腺素释放肽受体( GPR10 ,32 %) 和神经肽 Y Y4 受体(NPYY4 ,31 %) 等受体之间都具有一定的同源性[49 ] 。有趣的是 ,最近新发现的孤儿 GPCRs 也能被 NPFF相关肽结合并激活 ,如最近新发现的一个在哺育动物体内特异性表达 Mrgs (mas2relatedgenes) 受体家族 (2001 年) ,包含有 50多种孤儿 GPCRs ,它们都特异性地分布于人和鼠的背根神经节小神经元和三 叉 神 经 元 等 感 觉 神 经 元 细 胞上[51 ,52 ], 而 表 达 MrgA1、MrgA4 和MrgC11 受体的 HEK 细胞能被 NPFF和 FMRFa 激活[52 —54 ] 。
通过放射性配体结合实验 ,发现NPFF 与两种受体有着较高的亲合力 ,但不同的 NPFF 相关肽对两个受体的亲合力有所不同[41 ,45 ] 。利用放射性配体结合实验和体外功能性检测实验初步研究发现 ,由 pro2NPFFA 前体酶切得到的 NPFF 相关肽 (如 :NPA2NPFF ,NPAF , EFW2NPSW) 与 NPFF2 受体有较高的亲合性 ,并具有一定的选择性(约 100 倍) ;相反 ,由 pro2NPFFB 前体剪切而来的 NPVF 对 NPFF1 受体具有轻微的选择性(35 倍左右)[45 ] 。
2 神经肽 FF 化学修饰
NPFF 作为一种重要的内源性阿片调节肽 ,其药理学作用及其机制的研究对于揭示阿片系统的作用机制也有着极其重要的地位。然而 ,迄今仍缺乏研究 NPFF 受体的有效药理学工具。特别是NPFF1 和 NPFF2 受体出现后 ,这两种受体的高选择性激动剂和拮抗剂将成为阐释 NPFF 及其受体药理学作用的有力工具。虽然已有的 NPFF 及其相关肽的构效关系研究发现了一些 NPFF 受体的肽类和非肽类的配体[55 ],但仍缺乏对于 NPFF1 和 NPFF2 受体具有高选择性且高亲合力的理想配体 ,特别是高选择性的拮抗剂。
NPFF的发现已经有 20 多年的历史 ,但其构效关系方面的研究相对有些缓慢 ,其原因是多方面的 ,如缺乏 NPFF 受体的突变和晶体结构等受体构效关系的数据 ,这些阻碍了配体和受体结合关系的研究 ;NPFF 受体的发现相对滞后 ;并且已有的 NPFF 构效关系研究也相对有限。在此文中将按照肽类激动剂和拮抗剂设计的一般思路 ,将已报道的 NPFF 的构效关系数据做一初步的归纳和分析 ,希望有助于设计和筛选出新的 NPFF 受体高效的肽类和非肽类配体。
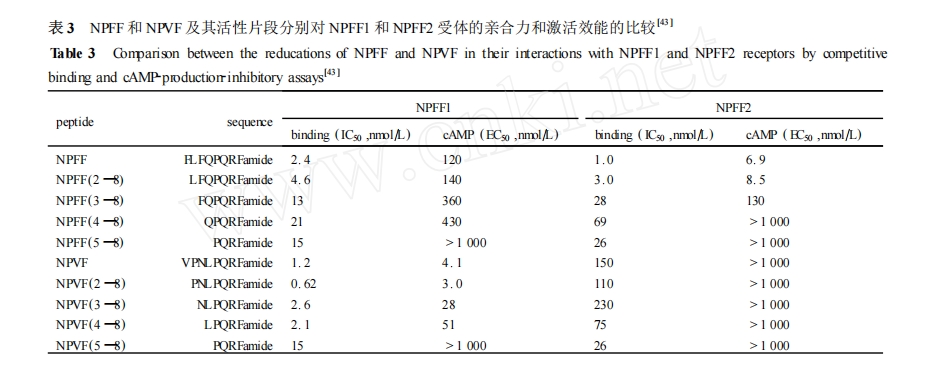
对于 NPFF ,每删除 N 末端的一个氨基酸残基 ,它与 NPFF1 和 NPFF2 受体的亲合力及其体外药理学活性就出现相应的降低 ,在删除第 1 位 Phe 后其受体亲合力和生物活性未受明显的影响 ,但是删至第 3 位和第 4 位氨基酸时 ,其受体亲合力和生物活性都出现明显的降低。令人诧异的是 NPVF 删除 N末端的第一个氨基酸残基后 ,它与 NPFF1 和 NPFF2受体的亲合力和生物活性反而都出现了升高 ,并且删掉第 2 位和第 3 位氨基酸后 ,它的受体亲合力和生物活性都下降得不太显著。而第 4 位的 Leu 的删除会导致其对 NPFF1 受体的亲合力和生物活性的大大降低。这些数据表明 NPFF 和 NPVF 的 N 末端四肽结构是影响它们结合并激活 NPFF1 和 NPFF2受体的关键区域 ,其中决定它们受体选择性的是NPFF 的 Phe3 和 Gln4,NPVF 的 Leu4 。
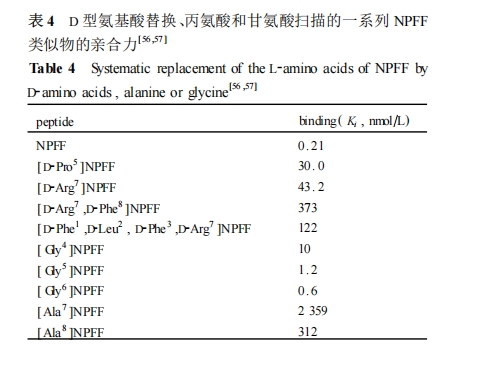
两种 NPFF 受体亚型的出现 ,必然给构效研究带来新的问题 :是否存在 NPFF 受体的选择性配体 ?初步的研究发现 ,由不同前体酶切而来的 NPFF 相关肽对 NPFF1 和 NPFF2 受体的选择性也有所不同。此外 ,从 NPFF1 和 NPFF2 受体的序列结构分析发现 ,它们胞外环形结构上的氨基酸残基差异性较大 ,而跨膜区域的结构相对保守 ,从而提示了 NPFF1 和NPFF2 受体的配体结构不同 ,或者同一配体对两种受体的结合能力存在差别。
此外 ,由 NPFF 的两个前体衍生而来的一系列NPFF相关肽 ,通过检测它们与 NPFF1 和 NPFF2 受体的亲合能力 ,可以推测出 NPFF 相关肽的 N 末端区域的氨基酸序列结构决定了它分别与 NPFF1 和NPFF2 受体亲合力的不同 ,从而造成了它对 NPFF 受体亚型选择性的差异。NPFF、NPSF 和 NPVF 为 3 个结构类似的八肽 ,它们具有相同的 C 末端四肽结构 ,但是它们与 NPFF1 和 NPFF2 受体的亲合力存在很大的不同[45 ,58 ] 。对于 NPSF 肽 ,可以通过延长其 N末端氨基酸序列来提高其结合 NPFF2 受体的能力 ,而结合 NPFF1 的能力改变不大 ,从而使得由 NPSF的 N 末端延长而来的 QFW2NPSF 和 EFW2NPSF 能选择性地结合 NPFF2 受体。同样延长 NPFF 的 N 末端也能选择性地提高其结合 NPFF2 受体的能力 ,因此由 NPFF 的 N 末端延长的 NPA2NPFF、SQA2NPFF 和SPA2NPFF 对 NPFF2 受体也具有较高的选择性[45 ,58 ] 。值得注意的是 ,NPAF 也可以看作 NPFF 的 N 末端延长而来的十八肽 ,但是其 N 末端的延长不仅没有提高它结合 NPFF2 受体的能力 ,反而使它结合 NPFF1受体的能力降低了[45 ,58 ] 。这些推论仍需运用系统的构效关系研究来进一步探讨。
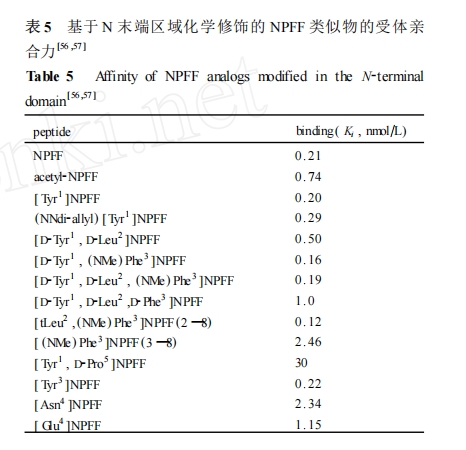
由于早期的亲合数据主要是采用匀浆后的大鼠脊髓细胞膜为材料来检测的 ,而已有的研究表明大鼠脊髓主要分布的是 NPFF2 受体 ,因此这些亲合数据主要反映的是替换后的类似物与 NPFF2 受体的亲合力 ,从而缺乏这些类似物与 NPFF1 受体的结合数据。这些氨基酸替换修饰的研究结果与前一部分构效关系的结论基本一致。通过分析 NPFF 的 N 末端化学修饰的构效关系研究结果不难发现 ,虽然NPFF(5 —8) 仍具有一定的结合和激动活性 ,但 NPFF的 N 端区域的构象改变 ,能直接影响它对 NPFF 受体的亲合性和选择性 ,因此 ,N 末端的氨基酸残基位点是决定 NPFF 类似物对 NPFF1 和 NPFF2 受体亲合力和选择性的关键区域。
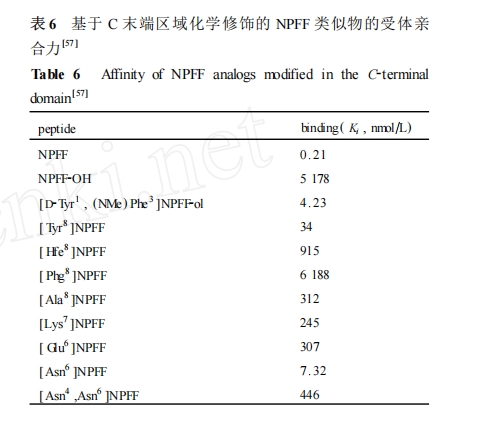
同样 ,表 6 中所列出的亲合数据不能反映出这些类似物对两种不同的 NPFF 受体的选择性。但是从这些构效关系研究结果可以推测出 NPFF 的 C 末端的 RF2NH2 结构为其“信使域”,是决定它结合并激活 NPFF 受体的关键位点 ,即影响 NPFF 类似物效能的重要区域。已有的 NPFF 受体肽类拮抗剂的设计和化学改造也主要集中于此结构区域 ,具体将在后面部分作详细的介绍。
为了进一步评价 NPFF 的 C 末端的 RF2NH2 结构对其药理学活性的影响。基于 NPFF 的 C 末端的四肽结构 ,并在 N 末端引入丹酰化修饰来增强其受体亲合能力 ,我们实验小组设计合成了 4 个具有荧光活性的 NPFF 类似物 :C 末端中含有“2RF2NH2”结构的 dansyl2PQRF2NH2 和 dansyl2GSRF2NH2 ; 以及 C末端 以“2R2NH2 ”结 构 结 尾 的 dansyl2PQR2NH2 和dansyl2GSR2NH2 。通过一系列体外和体内药理学实验系统地探讨了其化学结构的变化对其药理学功能的效能和效价的影响 ,研究进一步验证了 NPFF 的 C末端2RF2NH2 结构决定了其类似物效能 ,还发现2RF2NH2Π2R2NH2 的 N 末端的氨基酸残基对其效价的大小也具有一定的影响。此外 ,还发现新设计的dansyl2GSRF2 NH2 为一种高效的、具有荧光活性的NPFF 受体激动剂[59 ,60 ] 。

在此构效研究的工作基础上 ,同时用 Pro1 和Phe2 来替换 FMRFa 而获得的四肽结构 PFRFa 为NPFF 受体的假定激动剂 ,利用结构限制性的 Tic 来替换这个激动剂 4 位的 Phe 得到了一个新的 NPFF类似物 PFR(Tic)2NH2 ,并且此类似物在大鼠整体血压的测定中能使大鼠平均动脉压下降 ,它在阿片成瘾实验中表现出弱拮抗剂的活性[62 ,63 ] 。但是最近的离体功能测定实验中发现 , PFR ( Tic)-NH2 表现为NPFF1 和 NPFF2 受体的一个“超激动剂”[64 ,65 ] 。为了进一步评价 PFRFa 的结构改变对其心血管活性的影响 ,我们用一系列 Phe 的类似物来替换其 Phe4,药理学检测发现 C 末端 Phe 侧链的空间伸展方向和芳香环上的电子云分布的改变都对其心血管调节作用产生一定的影响(待发表的实验结果) 。
3 神经肽 FF 受体拮抗剂的研究进展
通过构效关系研究先后发现了一些 NPFF 受体的激动剂 ,而 NPFF 受体拮抗剂的研究进展相对缓慢。最近 NPFF 受体的选择性拮抗剂 RF9 的发现使此方面的研究工作取得了突破[66 ], 但是 RF9 对NPFF1 和 NPFF2 受体的选择性不强 ,因此 ,迄今为止仍缺乏 NPFF1 和 NPFF2 受体的专一性的拮抗剂。在此将 NPFF 受体拮抗剂的发展作一简述。已报道的 NPFF 受体的拮抗剂或假定拮抗剂主要分为肽类和非肽类两大类。
NPFF 受体的肽类拮抗剂都是基于其母体或母体的 C 末端四肽的序列结构而衍生出来的 ,但是已报道的这类拮抗剂都对 NPFF 的“信使域”做了一定的化学修饰 ,它们与 NPFF 受体的亲合力一般都较低 ,并且这些肽类拮抗剂都是通过药理学活性实验筛选出的 ,都缺乏生化鉴定的数据支持。
早期的研究表明 ,NPFF 的 C 末端的 RF2NH2 是决定 NPFF 激动活性的关键位点 ,因此研究人员设计肽类拮抗剂的思路主要是通过删掉 NPFF 及其激动剂的 C 末端的 Phe 而使它们从激动剂转化成拮抗剂。最早报道的 NPFF 的假定拮抗剂为 daY8Ra(desaminotyrosyl2Phe2Leu2Phe2Gln2Pro2Gln2Arg2NH2) ,其对应的激动剂为 daY9Fa ,进一步的药理学活性检测发现它在大鼠脊髓细胞膜上的亲合力 Ki =840 nmolΠL ,并且它能减弱吗啡的耐受 ,减轻高剂量的NPFF 在正常大鼠上引起阿片成瘾戒断样反应[67 —69 ] 。最近的研究还发现静脉注射 daY8Ra 对大鼠的平均动脉压无影响 ,但它能有效地减弱 NPFF所引起的升压作用[70 ] 。在随后的构效研究工作中又发现脂溶性的类似物 dansyl2PQRF2NH2 具有 NPFF样的激动活性。在 daY8Ra 的设计思路的启示下 ,设计并合成了 NPFF 受体的可能的脂溶性假定拮抗剂dansyl2PQR2NH2[71 ] 。在随后的活性检测中发现它能与 NPFF 受体有一定的结合 ( Ki = 1316μmolΠL) ,并且它在阿片成瘾和环境位置偏爱(CPP) 实验中表现出拮抗剂的活性[63 ,72 ] 。最新的报道还发现静脉注射dansyl2PQR2NH2 能引起一明显的降压作用 ,并且它能减弱 NPFF 所引起的升压作用[59 ,70 ] 。以 dansyl2PQR2NH2 为化学模板 ,利用组合化学的方法通过保留 Arg 残基而分别替换 Pro 和 Glu 残基 ,从化合物库筛选优化得到一个亲合性更高的类似物 ———dansyl2GSR2NH2 ( Ki = 114μmolΠL)[68 ] 。
NPFF受体非肽类拮抗剂都是在 NPFF 的 C 末端 RF2NH2 的基础上通过化学修饰而得到的 ,目前已报道的主要有以下系列 : (1) BIBP3226 及其衍生物 ; (2) RF 系列化合物(图 1) 。
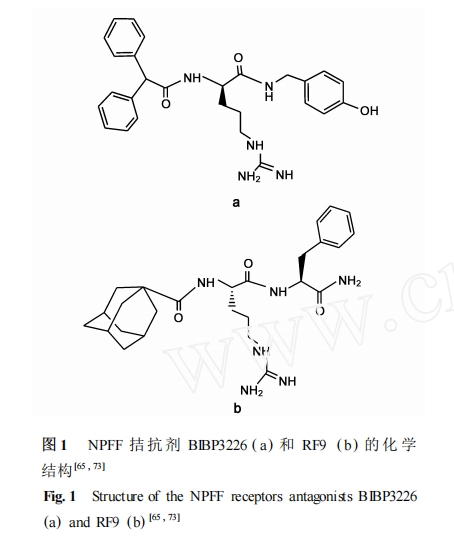
BIBP3226 最初是作为 NPY Y1 受体的选择性拮抗剂而被发现[73 ,74 ],最近的研究表明它也能结合NPFF 受体 ,特别是 NPFF1 受体 ,并且在体外的检测中表现出拮抗活性[45 ,49 ,64 ,75 ] 。我们进一步的研究还发现 BIBP3226 在一系列的体外和体内药理学活性实验中都能拮抗 NPFF 和 NPVF 所引起的激动活性[76 ,77 ] 。有趣的是 ,NPY受体的一些其它非肽类配体也能有效地结合 NPFF 受体 ,如 NPY Y1 受体的选择性拮抗剂 BIBO3304 和 NPY Y1 受体拮抗剂/Y4 受体激动剂 GR231118 , 并有报道表明 BIBO3304 和GR231118 在体外的功能实验中分别表现为 NPFF 受体的拮抗剂和激动剂[45 ,75 ] 。此外 ,为了进一步优化BIBP3226 来寻找 NPFF 受体的选择性拮抗剂 ,设计合成了一系列 BIBP3226 类似物 ,虽然部分类似物对NPFF1 和 NPFF2 受体具有一定的选择性 ,但遗憾的是 ,它们同时也与 NPY Y1 受体结合从而限制了它们在药理学功能鉴定中的广泛使用[45 ] 。
最近的报道表明 ,根据 NPFF 的 C 末端的关键位点 RF2NH2 结构 ,以 RF2NH2 为模板 ,通过其 N 端连接不同的衍生基团而获得了近百个非肽类的化合物 ,并通过活性检测发现这些类似物中的 RF2、RF9和 RF48 对于 NPFF 受体有较好的亲合力[65 ] 。RF9对于 NPFF1 和 NPFF2 受体的亲合力最高 ,而且其对于阿片受体和其他的 RF 家族相关受体都没有结合 ,因此 RF9 是一个对于 NPFF 受体具有选择性的高效拮抗剂。在体的研究表明 ,RF9 本身不影响大鼠的血压和心率 ,却可以抑制 NPFF 引起的大鼠平均动脉压和心率升高 ,所以 NPFF 对于血压和心率的调节是直接通过其受体作用的。使用 RF9 本身不影响大鼠的基础痛阈 ,而 RF9 可以通过阻断 NPFF的受体有效地抑制长期注射海洛因引起的痛敏和耐受[65 ] 。因此 ,NPFF 受体高效拮抗剂的发现对于提高吗啡治疗慢性痛的效果有重要的药用价值。我们还发现 RF9 能有效地拮抗 NPFF 在体温和痛觉调节中的激动活性(待发表的实验结果) 。
此外 ,药物公司利用一些有机小分子来模拟NPFF 的 C 末端化学结构 ,从而发现了部分有机小分子也具有较好的 NPFF 拮抗活性[55 ] 。
4 结语
随着近年来内源性阿片调节肽在阿片的耐受和依赖中的作用越来越受到人们的关注 ,NPFF 药理学功能的研究也备受重视。与此同时 ,最近几年来RFa 肽家族新成员的出现 ,RFa 肽相关的论文也不断增多 , 特别是去年国际多肽领域的知名刊物Peptides 专门出版了一期以 RFa 肽为主题的特刊 ,这也给 NPFF 的研究带了新的发展机遇。揭示 NPFF1和 NPFF2 受体ΠNPFF 系统的药理学功能及其作用机制必将成为 NPFF 及 RFa 肽研究的热点问题之一。发展 NPFF1 和 NPFF2 受体的选择性拮抗剂和激动剂 ,对于促进 NPFF 的研究具有十分重要的意义。
利用多肽化学生物学等研究手段进一步系统地研究 NPFF 的构效关系对于探讨 NPFF 的结构与功能之间的关系具有重要的促进作用 ,这将为 NPFF受体的选择性激动剂和拮抗剂的设计提供理论依据 ,并进一步为 NPFF 相关肽及其受体的研究提供有效的药理学工具。此外 ,设计、优化和筛选 NPFF1和 NPFF2 受体专一性的有机小分子配体也是寻找有效的 NPFF 药理学研究工具的捷径 ,并且这些高效的配体都具有潜在的临床应用价值。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。