
摘要:肿瘤是由细胞、细胞外基质及微环境等多因素组成的复杂系统, 不同因素在肿瘤的发生和发展中发挥关键作用. 肿瘤细胞、细胞外基质及微环境的特异性分析对于肿瘤的精准诊断和靶向治疗至关重要. 多肽探针具有特异性高、生物相容性好、组织穿透能力强和易于制备等优点, 已被广泛用于肿瘤的特异性成像研究. 本文综述了多肽探针对肿瘤细胞、免疫细胞等细胞靶点的特异性成像; 并介绍了以胶原蛋白、纤维蛋白等外基质蛋白为靶点的肿瘤特异性多肽探针的成像研究. 本文还总结了对肿瘤微环境中弱酸性、高酶活性等因素响应的肿瘤特异性多肽探针及其生物成像应用. 最后, 本文总结并讨论了肿瘤特异性多肽探针所面临的挑战与机遇, 展望了其在肿瘤精准诊断和个性化治疗领域的前景.
肿瘤是包括肿瘤细胞、细胞外基质及微环境等不同组分的复杂生化系统, 不同组分在肿瘤的发生、发展和转移中发挥重要作用[1-2]. 肿瘤具有区别于正常组织的病理性细胞外基质(ECM)、新生血管和淋巴管网络, 以及异常的细胞表型[3-4]. 同时, 缺氧、弱酸性和高基质金属蛋白酶(MMPs)活性等因素是肿瘤微环境与正常生理环境的重要差异[5-6]. 肿瘤细胞、细胞外基质及微环境的组成、结构和生化性质的改变已成为影响肿瘤多样性和侵袭性的关键原因, 并会影响抗癌药物的组织渗透和靶细胞敏感性[7⇓-9]. 因此, 肿瘤细胞、细胞外基质及微环境的可视化分析对肿瘤的病理分析、早期诊断及治疗具有重大意义[10-11].
分子特异性成像探针的开发已逐渐成为肿瘤可视化领域的热点. 抗体、多肽和核酸适体等特异性分子是探针的核心组件, 用于肿瘤标志物的特异性识别[12⇓⇓-15]. 同时, 连接环境敏感型组件的分子探针能够特异性的分析肿瘤的pH 值变化、酶活性和氧气水平[16]. 顺磁性物质、放射性核素、荧光分子和纳米粒子等物质作为报告基团, 已在磁共振成像(MRI)、单光子发射计算机断层成像术(SPECT)、正电子发射断层成像术(PET)和荧光成像中广泛应用[17⇓⇓⇓⇓⇓-23]. 分子特异性成像探针已成为极具潜力的临床造影剂.
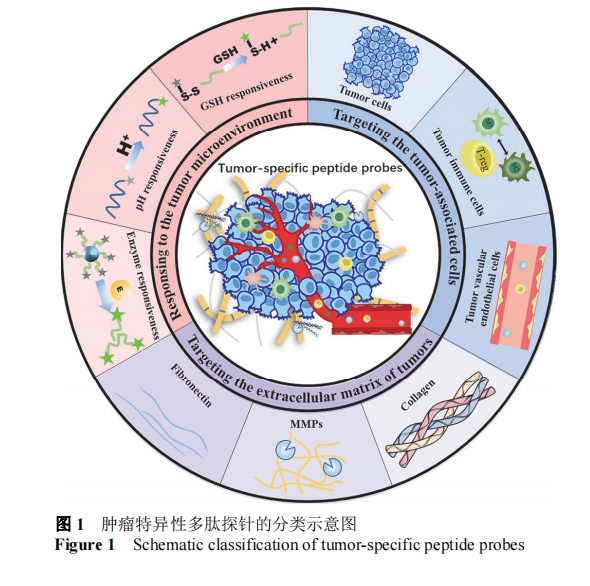
肿瘤特异性多肽探针的开发为肿瘤的精准成像提供了更多的机会和可能. 我们将以肿瘤相关细胞、肿瘤细胞外基质蛋白以及肿瘤微环境响应因素三个方面对肿瘤特异性多肽探针进行分类综述. 本文将系统地介绍肿瘤特异性多肽探针的研究进展, 并概述其在生物成像领域的应用.

2 肿瘤相关细胞靶向多肽探针
肿瘤的发展是极其复杂的过程, 涉及不同类型细胞的共同作用. 肿瘤细胞是肿瘤发展的执行者, 其增殖、迁移等过程直接反映了肿瘤的发展阶段. 免疫细胞通过分泌不同的细胞因子, 执行抗肿瘤或促肿瘤的双向作用. 肿瘤内皮细胞位于肿瘤血管或淋巴管中, 控制物质与肿瘤组织的传输交互, 参与肿瘤的转移和扩散[2,32-33]. 因此, 肿瘤细胞、免疫细胞和肿瘤内皮细胞的特异性检测, 对肿瘤的精准诊断和预后分析具有重要意义.
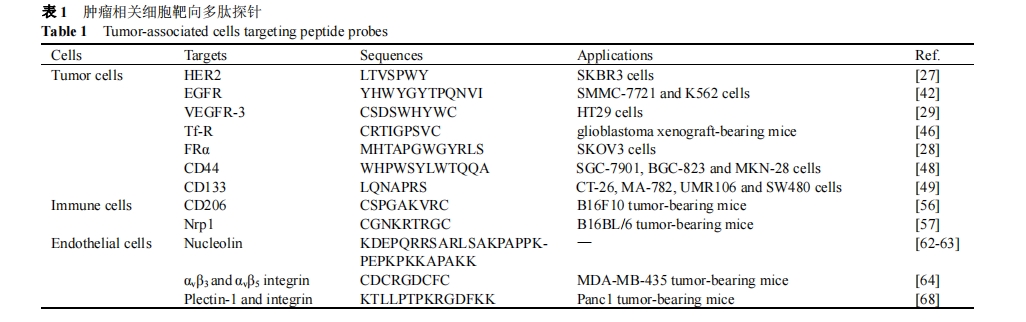
Zhang等[29]开发了多肽探针FITC-CSDSWHYWC (FITC-P1), 用于VEGFR的特异性检测. FITC-P1的细胞成像表明FITC-P1与表达VEGFR-3的HT29细胞特异性结合, 但不能结合EVC304细胞. Sun等[44]利用低密度脂蛋白受体相关蛋白1的特异性多肽Angiopep-2修饰的Ag2S 量子点, 构建了近红外二区分子成像探针用于脑胶质瘤细胞的靶向成像. p32蛋白在多种肿瘤中高表达, 与癌症的恶性程度相关. Yan等[45]通过将p32靶向肽CGNKRTRGC (LyP-1)与生物合成的GVs结合, 开发出由LyP-1修饰的气体囊泡LyP-1-GVs, 并实现了荷瘤小鼠的超声成像.
叶酸受体(FRα)是卵巢癌检测中常用的肿瘤标志物. Wang等[28]开发了FRα特异性多肽探针FITC-MHTAPG- WGYRLS (FITC-C7). 在肿瘤细胞成像的研究中, FITC-C7特异性识别FRα表达阳性的人卵巢癌细胞SKOV3, 而与FRα表达阴性的肝癌细胞HepG2无结合. 转铁蛋白受体(Tf-R)是人胶质母细胞瘤检测中常用的肿瘤标志物[46]. Tf-R的环状靶向多肽CRTIGPSVC被用于胶质母细胞瘤小鼠组织中Tf-R的特异性成像[47].
CD44和CD133是肿瘤进展中常见的糖蛋白标志物, 已经成为恶性肿瘤检测的重要靶点[48-49]. Lu等[50]开发了CD44靶向多肽探针FITC-WHPWSYLWTQQA, 该探针与高表达CD44的胃癌细胞SGC-7901和BGC-823特异性结合. Xu等[51]开发了CD44 靶向的多肽自组装探针, 用于膀胱癌的稳定成像. DBCO修饰的CD44v6靶向多肽首先与肿瘤结合; RAP多肽随后发生点击反应与靶向多肽连接并驱动自组装形成纳米网络. Li等[52]开发了CD133靶向多肽探针FITC-LQNAPRS (FITC-LS-7). FITC-LS-7与CD133抗体成像小鼠结肠癌细胞CT-26, 两者几乎重合的荧光信号表明了FITC-LS-7特异性地定位CT-26细胞中的CD133.
免疫细胞是肿瘤微环境的重要组成部分, 参与肿瘤进展的不同阶段. 免疫细胞的浸润是肿瘤发生和转移的重要标志, 常见的免疫细胞包括肿瘤相关巨噬细胞(TAMs)、调节性T细胞(Tregs)和树突状细胞等. 它们通过消除细胞毒性T淋巴细胞(CTL)介导的免疫反应, 促进肿瘤的生长[32].
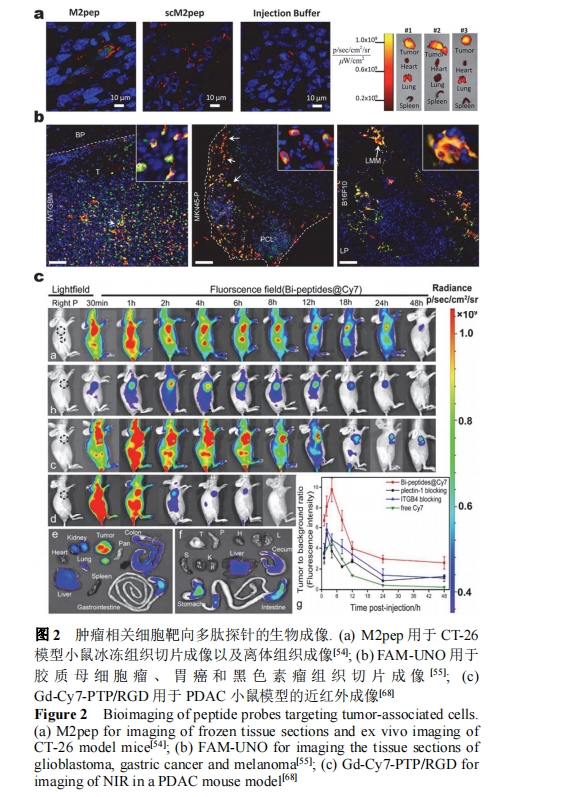
调节性T (Treg)细胞诱导的肿瘤微环境中的免疫抑制被认为是肿瘤免疫逃逸的关键机制, 是癌症免疫治疗的主要障碍. 神经皮素-1 (Nrp1)是研究Tregs的重要标志物, Kim等[57]构建了Nrp1的靶向多肽纳米探针Cy5.5-CGNKRTRGC-hNPs (Cy5.5-tLyp1-hNPs). 人前列腺癌细胞DU145的细胞成像和B16BL/6荷瘤小鼠肿瘤的单细胞悬液实验证明Cy5.5-tLyp1-hNPs与Treg细胞特异性结合.
树突状细胞(DCs)是肿瘤免疫中最重要的抗原呈递细胞, Mohamadzadeh等[58]通过噬菌体展示技术筛选了DCs靶向多肽序列FYPSYHSTPQRP, 并与链霉亲和素- Alexa488偶联用于DCs的特异性成像. CD11c是一种在DCs 表面高度表达的膜蛋白. Gahmberg等[59]筛选出了CD11c的高亲和力多肽P-D2, 其序列为GGVTLTYQF- AAGPRDK.
Plectin-1在胰腺癌细胞的增殖、迁移和侵袭过程中具有重要作用. Tian等[68]构建了整合素和Plectin-1双特异性的多肽探针Gd-Cy7-KTLLPTPKRGDFKK (Gd-Cy7-PTP/RGD). Gd-Cy7-PTP/RGD被用于高水平表达Plectin-1和整合素的胰腺导管腺癌(PDAC)小鼠模型的磁共振和近红外双模成像, 双重靶向有效提高了探针对胰腺癌的检测能力(图2c). Liu等[69]构建了89Zr标记的整合素和VEGFR双特异性的多肽探针并用于U87MG荷瘤小鼠的PET成像.
3 肿瘤细胞外基质靶向多肽探针
ECM中蛋白质含量和结构的变化, 调控肿瘤的侵袭和转移. 在肿瘤发展过程中, I型胶原蛋白的交联增加了ECM密度和硬度, 为肿瘤的侵袭提供“高速通道”[70-71]. 肿瘤中高表达的MMPs通过降解细胞外基质蛋白构成的生理屏障, 促进肿瘤细胞的转移[1,5,31]. 同时, 纤维蛋白、纤维连接蛋白(FN)和腱生蛋白(TN)等外基质蛋白通过调控细胞外基质与肿瘤细胞的粘附作用, 参与肿瘤的发展过程[72⇓⇓-75]. 肿瘤细胞外基质已成为肿瘤病理研究和早期诊断的重要靶点.
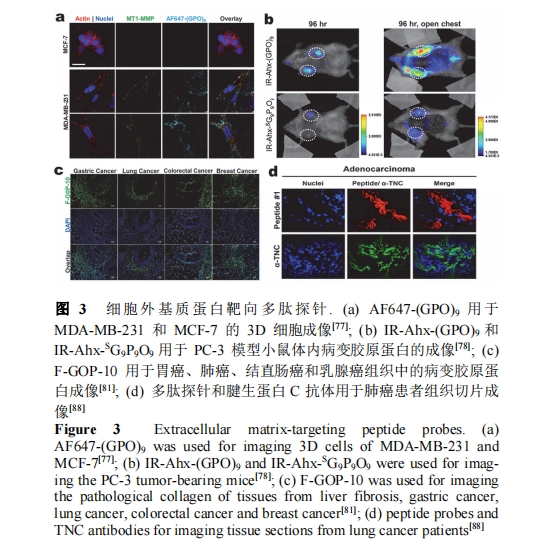
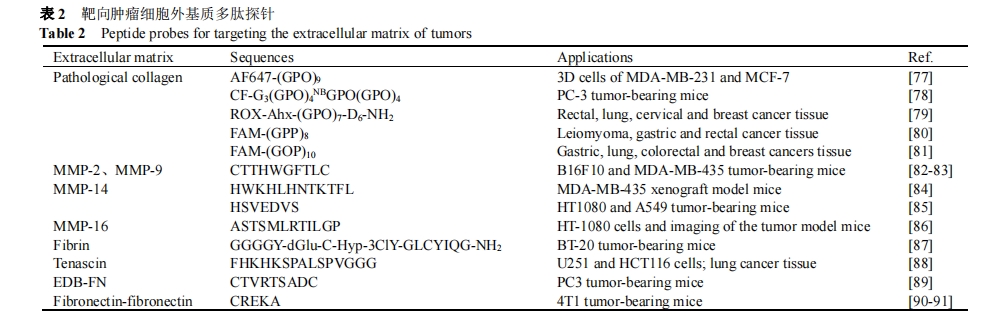
Xiao等[79]通过静电排斥策略, 构建了室温单链的多肽探针ROX-Ahx-(Gly-Pro-Hyp)7-(Asp)6-NH2, 并用于肿瘤病理组织中病变胶原蛋白的荧光成像. Xiao等[80]使用Pro替代(Gly-Pro-Hyp)n序列中的Hyp, 构建了4 ℃时仍是稳定单链结构的多肽探针FAM-(Gly-Pro-Pro)8 (FAM-GPP). FAM-GPP被用于平滑肌瘤、胃癌和直肠癌的组织成像. 通过交换(Gly-Pro-Hyp)n序列中Pro和Hyp的位置, Xiao等[81]首次构建了完全单链的病变胶原蛋白靶向探针FAM-(Gly-Hyp-Pro)10 (F-GOP-10), 实现胃癌、肺癌、结直肠癌和乳腺癌等肿瘤组织中病变胶原蛋白的靶向成像(图3c).
MMPs调控肿瘤的侵袭和转移, 已成为肿瘤检测中重要的细胞外基质靶点. Weber等[82]通过噬菌体展示技术成功筛选出环肽yCTTHWGFTLC (CTT), 用于MMP-2和MMP-9的特异性识别. Anderson等[83]通过引入同位素标签64Cu-DOTA, 构建了microPET成像探针64Cu-DOTA-CTT. 64Cu-DOTA-CTT对MMP-2和MMP-9具有高亲和力, 成功用于荷瘤小鼠的microPET体内成像. Chen等[84]构建了MMP-14特异性的多肽探针Cy5.5-HWKHLHNTKTFL (Cy5.5-MT1-AF7p), 并实现了探针Cy5.5-MT1-AF7p对MDA-MB-435移植瘤小鼠的体内成像. Fang等[85]通过噬菌体展示技术筛选出MMP-14特异性的多肽探针Cy5.5-HSVEDVS (Cy5.5-HS7). 与Cy5.5-MT1-AF7p相比, Cy5.5-HS7具有更高的MMP-14亲和力, 且Cy5.5-HS7展现出更长的体内成像半衰期. Fang等[86]构建了靶向MMP-16的量子点-多肽探针QD@MT3-AF4p及对照探针QD@MT-scr. 相比于QD@MT-scr染色的HT-1080细胞无明显荧光, QD@MT3-AF4p染色的HT-1080细胞显示强烈的荧光, 表明其对MMP-16过量表达的HT-1080细胞的特异性.
纤维连接蛋白的B结构域(EDB-FN)是肿瘤特异性成像的常见靶点. Lu等[89]构建了EDB-FN的特异性多肽探针Cy5-CTVRTSADC (Cy5-ZD2). Cy5-ZD2被用于前列腺癌细胞PC3荷瘤小鼠和良性前列腺增生小鼠的体内荧光成像. 与良性前列腺增生相比, Cy5-ZD2对前列腺肿瘤表现出更强的结合能力. Lu等[90-91]进一步构建了靶向纤维连接蛋白-纤维蛋白复合物的多肽探针Cy5.0-PEG-CREKA, 并分别与纤维连接蛋白抗体和纤维蛋白抗体共定位染色4T1肿瘤组织.
4 肿瘤微环境响应型多肽探针
肿瘤微环境具有区别于正常生理环境的弱酸性和高酶活性, 同时肿瘤微环境中内源性谷胱甘肽(GSH)表达量过高, 这些特征为肿瘤的特异性检测提供了理想靶点[5,31,92]. 基于肿瘤微环境的特征, pH响应、酶响应和氧化还原响应的肿瘤特异性多肽探针体系被相继开发. 肿瘤微环境响应型多肽探针通过荧光、磁共振以及PET等成像方法, 实现肿瘤转移、侵袭和分期的精准检测.
肿瘤微环境的显著特征之一是弱酸性的pH, 能够作为肿瘤特异性检测的靶点[5,93]. 在肿瘤微环境中, 由于肿瘤细胞的乏氧性糖酵解, 乳酸在肿瘤区域的大量积累造成肿瘤微环境呈现弱酸性的pH. 低pH值响应的插入肽(pHLIPs)和组氨酸pH响应探针已被开发用于肿瘤的特异性成像.
pHLIPs包括极性末端和含有天冬氨酸残基的中央跨膜结构域. pHLIPs在中性pH下与细胞膜间的相互作用很弱; 而在肿瘤的弱酸性pH值下, 跨膜结构域中酸性氨基酸残基的质子化导致pHLIPs形成α-螺旋构象, 从而具有了插入肿瘤细胞膜的能力[94]. Andreev等[95]构建了pHLIPs探针AAEQNPIYWARYADWLFTTPLL- LLDLALLVDADEGTCG, 并用于肿瘤的特异性成像. 转移性黑色素瘤细胞系M4A4和非转移性人乳腺导管癌细胞NM2C5肿瘤小鼠模型的活体成像结果证明, 肿瘤中pHLIPs的积累与肿瘤的侵袭性紧密相关. Reshetnyak等[96]通过使用Lys和Asn取代原序列的Asp, 分别构建变体探针ACEQNPIYWARYANWLFTTPLLLL- NLALLVDADEGTG (N-pHLIP)和ACEQNPIYWARYA- KWLFTTPLLLLKLALLVDADEGTG (K-pHLIP). Asp的取代导致探针插入肿瘤细胞膜能力降低, 进而影响探针对肿瘤的特异性.
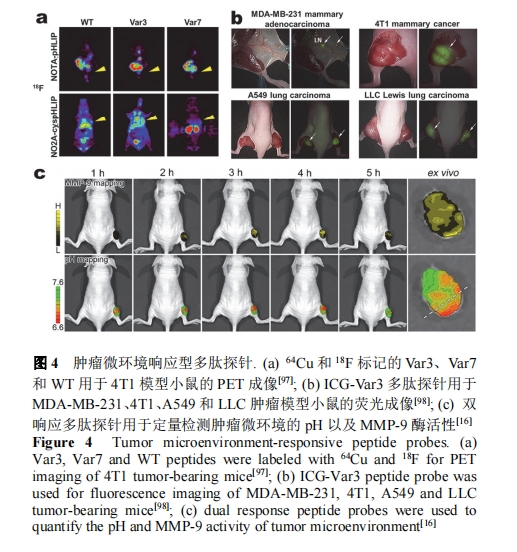
组氨酸多肽体系能够特异性地响应肿瘤微环境pH (6.5~7.0), 组氨酸的咪唑基团在肿瘤微环境下由无电荷转变为正电荷基团, 实现对肿瘤的靶向检测. 基于此原理, Stupp等[99]构建了包含H6序列和两亲性多肽序列(PAs)的pH响应型自组装多肽探针PA1和PA2, 两种多肽探针分别自组装成纤维状和球形. PA1和PA2对MDA-MB-231肿瘤模型小鼠离体成像的结果表明, 纤维状探针比球形探针具有更高的肿瘤特异性. 实验结果证明自组装多肽探针的形态会影响探针对肿瘤的靶向效果.
MMPs和组织蛋白酶通过降解肿瘤ECM, 促进肿瘤细胞的转移和肿瘤血管的生成. 在肿瘤微环境中高表达的MMPs和组织蛋白酶已经成为肿瘤特异性检测的靶点. MMPs和组织蛋白酶的响应型多肽探针已被用于肿瘤的特异性成像.
MMP-2通过调节多种细胞信号通路影响着肿瘤的浸润、转移及预后. Nagano等[100]设计了无磺基荧光基团修饰的MMP-2响应型探针(BODIPY)650/665-PLGLAG (BODIPY-MMP), 并构建含有磺基荧光基团的SulfoCy5-PLGLAG (SulfoCy5-MMP)作为对照探针. HT-1080小鼠移植瘤模型的近红外成像结果证明, BODIPY-MMP探针具有比SulfoCy5-MMP更长的肿瘤停留时间和更高的信噪比. Wang等[101]构建了包含MMP-2响应肽GPLGVRGK和神经皮素-1 (Nrp-1)靶向肽CRGDK的纳米囊泡N-G-C, 实现了HT29肿瘤模型小鼠的特异性近红外成像.
Yang等[102]开发了具有肿瘤细胞穿透能力的MMP-2响应型磁性纳米探针. 该探针由红色荧光蛋白mCherry、低分子量鱼精蛋白、MMP-2的特异性底物肽PLGVR和聚组氨酸(His6)组成. 镍铁氧体纳米颗粒(MIONs)通过镍离子和His6之间的螯合作用, 合成了自组装多肽探针rCCMH. 探针rCCMH在高表达MMP-2的HT-1080荷瘤小鼠中实现了体内成像. Zhang等[103]制备了以树枝状大分子聚酰胺-胺(PAMAM)为核心、PEG为外壳的MMP-2响应探针. 探针的PEG层通过响应MMP-2的酶切作用与PAMAM分离, 实现MCF-7和L02细胞成像以及肿瘤模型小鼠的体内成像.
MMP-14在胶质瘤中过表达, 而在正常大脑中表达可以忽略不计, 是胶质瘤检测的生物标志物. Warram 等[104]构建了具有MMP-14响应序列RSCitG-HPhe-YLY和MMP-14结合序列为HWKHLHNTKTFL的PET/近红外双模成像多肽探针. U87胶质瘤小鼠模型的近红外荧光-PET双模成像结果证明, 多肽探针通过响应MMP-14实现胶质瘤的特异性成像.
组织蛋白酶B和组织蛋白酶S参与肿瘤细胞外基质的异常降解, 促进肿瘤新生血管的形成和肿瘤的转移, 与肺癌、乳腺癌等肿瘤的发展密切相关. Yoon等[105]通过GFLG序列连接氰化酶CyA和CyB, 构建了组织蛋白酶B响应型NIR荧光多肽探针CyA-P-CyB. Shabat等[106]基于GFLG序列合成了分子内电荷转移(ICT)激活机制和荧光共振能量转移(FRET)激活机制的组织蛋白酶B响应的多肽探针. 两种探针的4T1肿瘤模型小鼠体内荧光成像表明, 两种探针在被组织蛋白酶B酶切时均表现出荧光增强, 但ICT探针在OFF状态下的近红外荧光明显低于FRET探针. 成像结果证明ICT探针实现了更高的信噪比.
Garrison等[107]将响应组织蛋白酶S的多肽连接物(CSLs)与N-(2-羟丙基)-甲基丙烯酰胺(HPMA)相连, 制备出可裂解的共聚物CSCs. CSCs中的CSLs由DOTA螯合物、组织蛋白酶S响应序列PMGLP、清除序列G-(D)S-SD(S)以及连接基团四个部分组成. 177Lu修饰的CSCs被用于人胰腺腺泡上皮癌(HPAC)模型小鼠的SPECT/CT成像, 结果表明CSCs通过响应肿瘤微环境中的组织蛋白酶S, 实现肿瘤的特异性成像.
肿瘤微环境呈现高氧化还原水平, 直接影响肿瘤细胞代谢, 促使肿瘤细胞的增殖和迁移[5,31]. GSH是调控细胞氧化还原平衡的主要分子, 在肿瘤组织中的含量远高于正常组织. 因此, 基于肿瘤微环境中GSH的高水平表达, 氧化还原响应的多肽探针被设计并用于肿瘤的特异性成像. 二硫键结构连接的多肽探针在富含GSH的肿瘤微环境下发生断裂, 这一反应成为肿瘤检测的新策略. Choi等[108]通过二硫键将光敏剂与肿瘤标志物EGFR的靶向多肽YHWYGYTPQNVI (GE11)连接以构建多肽探针RedoxT. 三阴性乳腺癌小鼠的体内成像证明, 探针在小鼠肿瘤部位特异性积累.
肿瘤是一个复杂的生物体系, 对肿瘤微环境中多种异常特征的同时检测能够有效地提高肿瘤检测的特异性和准确性[109]. 肿瘤微环境的多重响应多肽探针体系被开发, 以实现肿瘤的精准检测. MMP-2和MMP-7在肝癌细胞中的表达水平高于正常肝细胞. Tang等[110]通过半胱氨酸残基将同时响应MMP-2和MMP-7的多肽序列GPLGVRG-VPLSLTMG连接在金纳米粒子表面, 构建了MMP-2和MMP-7双响应的金纳米粒子多肽探针. 镧系配合物BCTOT-Eu111和7-氨基-4-甲基香豆素(AMC)分别修饰在多肽的N端和C端. 在350 nm的单波长激发下, 探针具有449 nm (AMC)和613 nm (BCTOT-Eu111)两个完全分开的发射峰. 该探针对人正常肝细胞HL7702和人肝癌细胞HepG2的细胞成像证明, 多肽探针通过同时响应肿瘤细胞分泌的MMP-2和MMP-7, 特异性识别人肝癌细胞.
基于肿瘤微环境中酸性pH和高活性MMPs的特性, pH和MMPs双重响应的多肽探针被开发并用于肿瘤的检测. Gao等[16]设计了双响应的比率探针用于肿瘤微环境pH和MMP-9活性的定量检测. 该探针是由pH敏感染料ANNA、MMP-9响应多肽GGKGPLGLPG、近红外染料Cy5.5以及四氧化三铁纳米颗粒组成的荧光共振能量转移(FRET)系统. 探针被用于人结肠癌LS180小鼠肿瘤模型的近红外和磁共振双模成像. 结果证明了MMP-9在肿瘤微环境中的高表达在时间和位置上都与pH的异常密切相关, 并且MMP-9和pH的协同作用控制了恶性肿瘤的异质性侵袭(图4c).
Jiang等[111]设计了同时响应pH和MMPs的活细胞穿透肽探针dtACPPD. 该探针由聚阳离子的细胞穿透肽R9 (CPP)、带负电以掩蔽CPP内化功能的pH响应肽和MMP-2响应多肽组成, 其中MMP-2响应多肽插入到pH响应肽和细胞穿透肽R9之间, 形成“分子内发夹结构”. dtACPPD在生理环境中带负电荷; 而在肿瘤微环境中, 多肽探针同时响应弱酸性pH和MMP-2, 变为不带电或正电荷的形式后被肿瘤细胞摄取. dtACPPD探针的神经胶质瘤小鼠模型体内成像证明, 探针响应肿瘤微环境的pH和MMPs后, 在小鼠肿瘤部位特异性积累. Wang等[112]设计了同时响应肿瘤微环境弱酸性pH和MMPs的自组装多肽探针P-S-H, pH响应序列(HLA)2HHLAHLAH和MMP-2响应序列GPLGIAGQC与PEG末端偶联. 人神经胶质瘤U87细胞成像和U87肿瘤小鼠体内成像结果证明, P-S-H在响应肿瘤细胞高表达的MMP-2和肿瘤弱酸性pH后发生重组, 重组后的P-S-H识别人神经胶质瘤U87细胞并在U87肿瘤小鼠体内特异性积累.
5 结论与展望

肿瘤特异性多肽探针具有出色的肿瘤成像能力, 有望成为肿瘤的手术导航工具. 多肽探针分子量较小, 在人体中的半衰期短, 代谢速度快. 这一特点使肿瘤特异性多肽探针能在手术过程中进行即时注射和手术导航, 提高了手术效率; 然而, 这一特点也造成了手术窗口期短的问题. 因此, 提高肿瘤特异性多肽探针的稳定性和生物可用性成为本领域的关键挑战. 高稳定性和宽手术窗口期将使肿瘤特异性多肽探针的临床手术导航成为可能.
面对不同肿瘤类型间的差异性以及新兴肿瘤靶点的产生, 靶点的多样性成为肿瘤特异性多肽探针的另一挑战. 新靶点的特异性多肽的筛选是提高多肽探针多样性的重要环节. 新靶点多肽探针的开发将推动不同种类肿瘤的精准诊断. 同时, 基于新靶点的肿瘤特异性多肽探针的生物成像与免疫疗法等新型肿瘤治疗方法的联用, 能够为肿瘤诊疗一体化方法的开发提供新契机.
总之, 随着材料科学、分子生物学、肿瘤药理学等学科的跨学科发展, 我们相信肿瘤特异性多肽探针的生物成像将成为肿瘤临床诊断的重要方法. 同时, 肿瘤特异性多肽探针将逐步突破阻碍, 进入肿瘤的临床应用, 为肿瘤的精准治疗提供工具. 肿瘤特异性多肽探针的发展, 将服务于肿瘤的精准诊断和个性化治疗, 进一步提升人类生命的长度和质量.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。