
摘 要 环肽分子通过主链骨架中C=O和 N—H 形成分子间网络氢键,以 β-片层反平行方式堆积可形成中空管状结构。通过控制环肽的结构和尺寸,或修饰具有不同功能的基团,可获得多种结构和性能的肽纳米管。本文综述了环肽分子自组装成纳米管的应用研究成果。首先介绍了带合适疏水性侧链的环肽纳米管在模拟生物跨膜离子通道方面的实验和理论研究进展,重点论及环肽纳米管的结构、极性和侧链的疏水性等对离子通道传输行为的影响以及分子动力学(MD)模拟研究水通道的进展。进而介绍了环肽纳米管用作生物传感器模板,与功能性(如电性、光学性和磁性)纳米材料合成制备生物传感器的实验研究成果,接着介绍了环肽纳米管作为药物或药物载体潜在的应用前景,特别是在某些抗菌和抗感染药物开发设计中的应用以及环肽在不同极性环境中自组装过程微观机制的 MD 模拟研究,最后介绍了环肽纳米管作为模板,制备磁性、电性纳米材料方面的实验和理论研究进展。
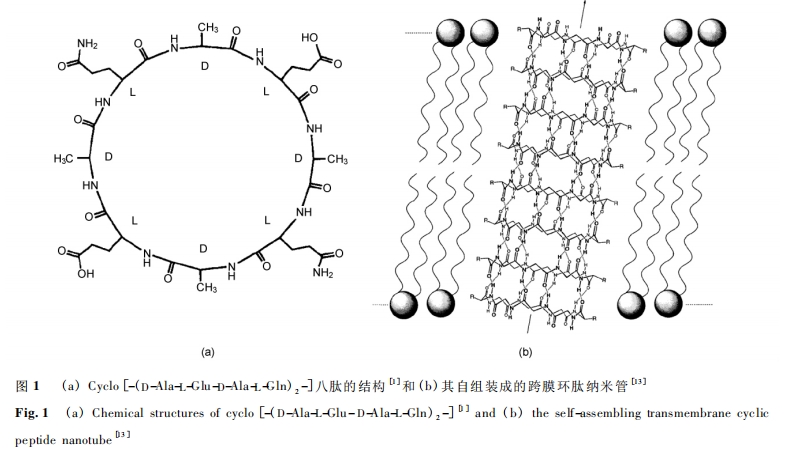
目前,除了交替 D,L-α 氨基酸外,交替 α-,β-、交替 α-,γ-、β-、δ-、ε-氨基酸等也已用于环肽纳米管的合成[2—8]。通过改变氨基酸个数与种类或修饰上某些基团可调节纳米管的管径和内外壁的性质。环肽纳米管具有种类多样化、管径可调、相对稳定、良好的生物相容性和可调控的生物降解等特性,在化学 、生物化学、材料科学和医学等领域具有潜在的、广阔的应用前景[9—13],是近年来纳米材料的研究热点之一。
2 环肽纳米管的应用研究
在生物体系中,细胞或细胞器通过生物膜与外界进行物质交换,选择性地吸收所需要的养料,同时排出废物以维持正常的功能。一些离子、相对较大的极性或带电分子的运输主要通过载体蛋白和离子通道蛋白的介导。中空管状结构的环肽纳米管具有良好的生物兼容性,可以模拟此类膜蛋白的通道作用。实验[14,15]发现,具有合适疏水性侧链的环肽能快速进入脂质双分子层的生物膜,然后在膜中通过氢键自组装成离子或分子运输通道,如 图 1 ( b) 所示,不同管径的肽纳米管能传送不同大小的离子或小分子。
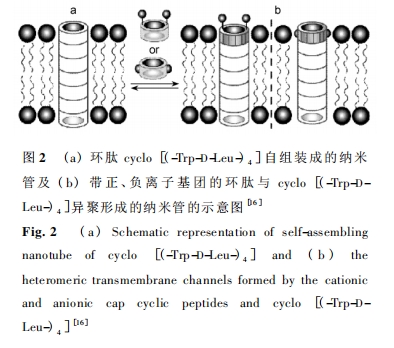
与 D,L-α 环肽纳米管相比,β-环肽子结构通过分子间氢键以平行方式堆积,导致 β-肽管具有巨大的偶极矩。在跨膜离子通道中,巨大的偶极矩能改变离 子 传 导 率[17]。Buehler 等[18]发 现 cyclo [( -β3-HTrp) 4 -]和 cyclo[( -β3-HTrp-β-HLeu) 2 -]能 插 入 到脂质双分子 层 的 膜 中,自 组 装 成 管 径 为 2. 6—2. 7的纳米 管,通 过 监 测 对 pH 值 敏 感 的 染 料 5 ( 6 ) -carboxyfluorescein (CF) 的 荧 光 光 谱,发 现 膜 两 边 的质子浓度梯度被破坏,说明两种肽纳米管显示出强的质子传输能力,实验结果也表明它们能有效运输K + ,传导率为 1. 9 × 107ions/s。
环肽纳米管 模 拟 跨 膜 离 子( 分 子) 通 道 微 观 行为的理论 研 究 也 十 分 活 跃[19],特 别 是 分 子 动 力 学(molecular dynamics,MD) 方 法 可 以 观 察 离 子 或 分子在纳米管中运动的微观过 程[20—23]。计 算 机 的 高速发展使得 MD 模拟可达到几十万个原 子、数 百 纳秒,采用某些近似处理方法,甚至可以达到微秒级。Cheng 等[24]用 MD 方法模拟了 cyclo[(1R,3S) -γ -Acc-D-Phe]3 自组 装 的 PNT 对 CHCl3 的 吸 附 过 程,研究结果表明该环肽的四聚体结构很稳定,且能进一步组装成纳米管,管内外壁均具有一定的疏水性,能够吸附 CHCl3 分子。Schatz 等[25]用 SMD ( steeredmolecular dynamics) 方 法 模 拟 了 Na + 和 K + 在 cyclo[( -D-Ala-Glu-D-Ala-Gln-) 2]纳米管中的渗 透 性,发现在管的进口和出口处有约2. 4kcal / mol的能垒,在管中间存在势阱。对 Na + 的模拟产生较多且深的势阱,表明 Na + 在管内 的 停 留 时 间 更 长,K + 比 Na + 的透过率高。在不同介质中形成的 PNTs 对离子渗透性也有差异。Chipot 等[26]模拟了 cyclo[( -D- Leu-LTrp-) 4 ]PNT 在 水 溶 液 和 POPC (palmitoyl-oleylphosphatidylcholine)膜双分子层中对 Na + 的渗透性,水环境中形成的 PNT 中部有一个很深的势阱,Na +可以很容易进入纳米管,但一旦进入不易再出来;在膜环境 下 形 成 的 PNT 中,势 阱 深 度 很 浅,Na + 通 过PNT 可以很容易穿越膜双分子层,说明 PNT 对离子的通透性不仅与它自身的结构有关,也与它周围的环境有关。Tarek 等[27]通过在膜两边放不同数目的Na + 和 Cl- ,离子在膜双分子层两边的非对称分布产生跨膜电势,从而模拟真实生物条件下离子在环肽纳 米 管 中 的 运 动,估 算 出 Na + 在 cyclo[( -Trp-DLeu-) 6]十二肽纳米管中的电导为 186 ps,与在 cyclo[( -Trp-D-Leu-) 4]八 肽 纳 米 管 中 实 测 的 电 导 值 55ps[14]相 比 基 本 合 理。Engels 等[28]进 行 了 0. 76 ns的动力学模拟,研究了水分子在 cyclo[( -Gln-D-AlaG1u-D-Ala-) 2]八肽十聚体纳米管中的结构,结果显示水在管中 形 成 了 一 种 交 替 式 的“1—2”水 分 子 结构,即每个多肽环 C α 形成的平面内有一个水分子,而每两个多肽环之间有两个水分子。Tarek 等[29]模拟了 cyclo[-( Trp-D- Leu) 3Gln-D-Leu]纳米管在水化的 DMPC ( dimyristoyl phosphatidyl choine) 膜双分子层组成的跨膜通道中水分子的运动,管中的水分子以协同的方式运动且流动不具有方向性,在模拟过程中,纳米管中的水链会间歇性地断开,这种现象在aquaporin-1 水通道中也能观察到[30]。
将功能性(如电性、光学性和磁性) 纳米材料固定在生物大分子上,能够形成对特定种类化学物质或生物活性物质具有选择性和可逆响应的生物传感器。环肽纳米管可以通过调节孔径,修饰具有一定功能的基团,使灵敏度大幅提高,缩短检测时间,是一种潜在的极具应用前景的生物传感器分子识别元件。某些表面具有羟基或羧基等基团的环肽纳米管可作为生物传感器的模板,因为它们不需要任何表面修饰就能附着目标抗体,如某些生化酶,从而制备出具有高 度 选 择 性 的 生 物 传 感 器。Cho 等[31]先 用PNT ( cyclo[( -Gln-D-Leu-) 4 ]) 修 饰 碳 电 极,然 后 将大肠杆菌的某种抗体与碳电极上的 PNT 结合,制备了电化学免疫传感器并进行循环伏安测试。研究发现,电流的峰值随着表面修饰的不同而有很大变化,这是一种高灵敏度、易制备、低成本、可以针对特定抗原,能同时用于实验室和现场操作的电化学免疫传感器。修饰的环肽纳米管可以用于构造各种不同的高敏感性传感器,结构的生物兼容性和化学灵活性 能 够 使 它 们 应 用 于 免 疫 测 定 和 电 化 学 探 测。Motesharei 等[32]将硫化物先组 装 到 Au 薄 膜 基 底 上形成 SAM ( self-assembled monolayers) ,再 放 入 环 肽( cyclo[( -D-Leu-L-Trp-) 4 ]) 的 乙 醇 溶 液 中,获 得 垂直于 SAM 的肽纳米管,通过循环伏安法和交流阻抗谱分析其 性 质,发 现 络 合 离 子[Fe( CN) 6 ]3 - 和[Ru(NH3 ) 6 ]3 + 能 够 通 过 该 纳 米 管 通 道,而 [Mo(CN) 8]4 - 则无法进入管内,这种多肽纳米管能够识别一定大小的分子或离子,可能用于生物传感器的制备。
环肽分子在膜双分子层中自组装成的纳米管,具有良好的生物相容性、较高的抗菌活性,以及降解后的产物对生物无毒害,故在新抗菌药剂和细胞毒药物的研发中展 现 出 极 好 的 应 用 前 景[33]。环 肽 子结构通过酶的不稳定键能进入特定的细胞靶向点,在特定的细胞识别部位,目标基团的断开导致多肽浓度增加,从而有利于纳米通道的形成,引起细菌细胞膜两边的离子势发生变化,使细胞快速死亡,这一特性已被应用于某些抗菌和抗感染药物的设计[34]。环肽纳米管具有能快速杀菌的作用,使它能够代替传统的抗生素,有效减弱细菌抗药性。天然的抗菌多肽表现出良好的抗菌活性,但因具有强的溶血作用,限制了它 们 的 应 用;而 D,L-α 环 肽 纳 米 管 可 以选择不同的氨基酸组成来提高它们对细菌细胞膜的选择性和渗透性,增强对蛋白酶的稳定性,降低对人工红细胞的溶血作用,增加生物药效率。
肽 纳 米 管 作 为 基 因 或 药 物 载 体 的 研 究 已 有 报道。Li 等[35]将 NH2—Phe—Phe—NH2 二 肽 阳 离 子形成的肽纳米管稀释到浓度低于8mg /ml时,发现纳米管自发地转变形成表面静电吸附带负电荷 ssDNA的囊泡结构,通过细胞的内吞作用进入细胞,从而实现将 ssDNA 传 输 到 细 胞 内 的 过 程。环 肽 纳 米 管 也可应用于药物载体[36],某些多肽自组装纳米管可以与细胞膜作用,生成传递 药 物 分 子 的 通 道。Ghadiri等[38]合成了管 径 为 10 的 十 环 肽 cyclo[L-Gln-( D-Leu-L-Trp) 4 -D-Leu]组装的纳米管,发现其在脂质双分子层膜中能 有 效 地 转 运 葡 萄 糖 分 子[37]和 亲 水 性物质谷氨 酸。人 们 希 望 根 据 待 转 运 药 物 分 子 的 大小,设计尺寸合适的环肽,跨越脂质双分子层形成纳米通道,运输难以转运的药物分子进入细胞或组织,有望实现将难以跨膜吸收的活性分子开发成疗效显著的临床药物,对药物生物利用度的提高和药物不良反应的降低有着重要的意义。
将环肽纳米管应用到抗菌药剂和药物传递制剂中,环肽在膜中自组装成中空的纳米管是至关重要的一步。探索自组装过程的微观机制在实验上是比较困 难 的,MD 模拟则是一种有效的研究手段。Khurana 等[39]对 cyclo[( -L-Trp-D-Leu-) 4 ]的 二 聚 体在极性(水) 和非极性(壬烷) 溶剂中的行为进行了10 ns 的 MD 模拟,发现其二聚体仅在壬烷中保持稳定,在水中所有的氢键最终被破坏,直到两个环肽完全分开。具有两亲性的单环更易接近于壬烷 /水的界面,且更靠近壬烷,说明该纳米管的自组装很可能发生在膜双分子层的疏水区域。为了进一步理解自组装 的 机 理,2008 年,Khurana 小 组[40] 采 用 CG( coarse-grained ) -MD 模 拟 cyclo [( -L-Trp-D-Leu-) 4 -]2 在液-液界 面 的 自 组 装,单 环 几 乎 完 全 位于油-水界面的外表面,有序地形成二聚体、三聚体和四聚体,这些寡聚体重新结合进一步组装成纳米管,并且其管轴几乎完全平行于界面。Chipot 等[41]提出了不同的假说,认为环肽在膜界面的自组装只是初始阶段的行为,形成的纳米管插入到质膜中,一旦界面的浓度达到合适值,质膜的一段就被多肽纳米管包裹并移走,从而形成了纳米通道。目前尚未能通过理论模拟方法验证这一假设。同样采用 CGMD 方法,Hwang 等[42]进 行 了 100 ns 的 模 拟,验 证了 cyclo[( -L-Trp-D-Leu-) 4 -]2 八肽纳米管能够插入脂 质 双 分 子 层,且 管 轴 与 膜 平 面 的 法 线 夹 角 为34. 2 °,与实测值基本一致[13]。他们认为环肽纳米管在脂质双分子层发生倾斜是因为脂的亲水性头部与管的疏水性侧链之间的相互作用导致的,倾斜角大小可能与纳米管的长度有关[43]。
绝大多数肽纳米管不具有磁性,因而在磁性材料的应用 上 受 到 限 制。Matsui 等[44]从 细 菌 中 提 取出磁性纳 米 晶 体( Fe3O4 ) ,连 接 到 环 肽 纳 米 管 模 板上,合成了一种新型生物磁性纳米管。细菌磁性纳米晶体在纳米管内排列成单一的线形链,与磁性纳米线行为相一致。这篇报道给磁性多肽纳米管的研究提供了新思路,拓宽了多肽纳米管的应用范围。
PNTs 外表面受所有的氨基酸残基侧链限制,其外表 面 性 质 可 以 由 设 计 环 肽的结构来调节。Ashkenasy 等[45]开展了对环肽纳米管的电学性质研究,设计了带 4 个阳离子侧链的 D,L-α 氨基酸构成的环八肽,在氧化还原作用的激发下自组装成稳定的肽纳米管。该 PNT 能 物 理 吸 附 在 羟 基 化 疏 水 热解石墨和硅的氧化物等固体表面,且电子处于高度的离域状态,这一特性使之可能应用到电传感器的设计中。2005 年,Biesalski 等[46]在环肽侧链修饰特定的引发基团,引发 N-异丙基丙烯酰胺单体在肽纳米管表面的聚合反应,形成了一种以肽纳米管为核,高分子为外壳的混合材料,结构由多肽的种类决定,表面化学性质由所选择的高分子的性质决定。该纳米管具有低临界溶解温度特性,可能用于导电纳米装置的制备。这项工作提供了一种制造大量形状稳定的混合纳米材料的新方法,这是通过其他方法很难实现的。组成纳米管的环肽可以是不同种类的。Granja 等[47]合 成 了 以 γ-Acp 和 γ-Ach 为 结 构 单 元的 α,γ –环肽形成的异型二聚体,其产量是对应的同型二聚体的 30 倍,表明异型二聚体比它们的同型二聚体具有更好的稳定性。他们联合应用受激准分子和荧光共振能量转移( FRET)方法报道了 α,γ –异型二聚体与同 型 二 聚 体 的 荧 光 信 号[48]。在 此 研究基础 上,Granja 等[49]在 两 种 α,γ 环 肽 外 表 面 上分别修饰一 个 电 子 受 体( C60 ) 和 一 个 电 子 供 体( 四硫富瓦 烯,exTTF) ,通 过 氢 键 获 得 了 异 型 二 聚 体。稳态光谱和时间分辨的发光光谱清楚地显示电子从exTTF 转移到光激发的 C60上的过程,表明此类环肽能成功用于捕光与光转化混合体系的合成,可望用于纳米管电池和分子开关的设计,其研究拓展了肽纳米管的种类和应用。
鉴于已有各种不同结构、性质特殊的环肽纳米管相继被合成,对环肽纳米管结构及其潜在的应用研究也在 不 断 深 入。Lewis 等[50]研 究 了 cyclo[( DAla-Glu-D-Ala-Gln) m]( m = 1—4 ) 纳 米 管 体 系 的 电子结构、振动模式以及热力学性质,得到了 HOMO—LUMO 很大的带隙( ~ 5. 0 eV) ,预测其可能 应 用 于独 特 的 生 物 电 子 器 件 中。Parrinello 等[51] 和Fukasaku 等[52]分别用 密 度 泛 函 理 论( DFT) 和 从 头计算方法( ab initio)计算了 cyclo[(Gln-D-Ala-Glu-DAla) 2]纳米管的能带结构。带隙约为 4 eV,推测该纳米管是一种半导体。Sanyal 等[53]采用 DFT 方 法研究了过渡态 金 属 原 子 Co 掺 杂 的 β-环 肽 纳 米 管,获得了 β-环肽的优化结构、态密度和能带结构。计算表明这类掺杂纳米管具有带隙很大的半导体性质,同时,发现 Co 掺 杂 的 β-PNTs 是 一 种 很 强 的 铁磁性材料。
3 环肽纳米管的研究前景
环肽纳米管作为一个新兴的研究领域,表现出优越的性能和广阔的发展空间,但在应用上还面临很多的挑战,各方面的研究还有待进一步完善。随着实验技术和计算机软、硬件的快速发展,对其研究也逐步深入。在今后的研究中,一方面继续寻找新的具有特殊功能的环肽纳米管,另一方面是加深对机理的探讨,以拓展肽纳米管日益广阔的应用前景。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。