
摘要:蛋白多肽药物具有良好的特异性和生物相容性,治疗效果较好。由于口服给药途径的患者顺应性和安全性更佳,蛋白多肽药物的口服递送已成为当前材料学与药剂学领域的研究热点之一。然而,口服生物大分子药物在胃肠道的稳定性及吸收程度却非常受限。脂质纳米载体能通过化学修饰、疏水离子配对等多种方式有效包载亲脂或亲水性蛋白多肽药物,同时经表面修饰后的脂质纳米载体能克服口服吸收的众多生理屏障,继而促进药物在混合胶束中溶解,增强淋巴摄取,因此具有良好生物相容性和体内稳定性。本研究综述了脂质纳米载体对蛋白多肽药物的包载方式及其克服生理屏障的相应机制,介绍了其提高蛋白多肽药物口服生物利用度的重要特性和最新研究进展,并展望了其潜在应用及发展前景。
蛋白多肽药物( protein and peptide drugs,PPDs) 具有生物活性高、特异性强、溶解性强、毒性低等优点,通过调节生理或病理过程来治疗或预防疾病,随着生物技术的迅速发展,在临床疾病治疗上越来越多地被开发应用。尽管非胃肠道给药是PPDs 最常用的给药途径,但患者顺应性往往较差。与静脉给药相比,口服给药途径在患者顺应性、安全性、长期剂量和制造成本方面具有优势 [1]。然而,与小分子药物相比,PPDs 的广泛应用受到了稳定性和吸收程度的限制。
新型口服促吸收技术的开发已成为提高 PPDs生物利用度的一种方式,目前已推出的口服多肽和蛋白质制剂的数量正在不断增加。2001 至 2006 年美国 Emisphere 公司进行了首个口服胰岛素制剂Ⅰ期和Ⅱ期临床试验,研究显示口服制剂与安慰剂没有显著差异。2014 年,由以色列 Oramed 公司开发的 ORMD-0801 被美国 FDA 批准进行Ⅲ期临床试验。Emisphere 公司开发了一种口服吸收促进剂 N-[8-(2- 羟苯甲酰氨基 ) ] 辛酸钠 (SNAC),先被用于改善胰岛素的口服吸收,最终被用于改善索马鲁肽的口服吸收 [2]。2019 年,由丹麦诺和诺德公司开发的全球首个口服胰高血糖素样肽 -1(GLP-1) 受体激动药索马鲁肽 ( 商品名 Rybelsus) 被美国 FDA 批准用于治疗 2 型糖尿病。随后在 2020 年通过引入瞬时渗透型增强剂 (transient permeability enhancer,TPE) 技术制备了奥曲肽口服肠溶胶囊( 商品名 Mycapssa),也获得了美国 FDA 的批准 [3]。目前针对 PPDs 的口服给药系统,众多学者还构建了水凝胶、微球、纳米粒、脂质纳米粒等多种递送策略,以提高药物的口服生物利用度。在过去几十年中,纳米载体技术因可增加生物膜透过性、改变药物体内分布、调节释药速度等功能而在药品、化妆品等领域中展现出巨大潜力,口服递送 PPDs 的纳米载体逐渐成为研究热点。近期有研究设计使用耐酸金属 - 有机骨架纳米粒来包载足够剂量的胰岛素,并在表面修饰靶蛋白,以实现高效的胰岛素口服给药,原理是通过受体介导的跨细胞途径,使该纳米粒能实现高效的肠上皮转运,并在生理条件下控制胰岛素的释放,具有显著的降糖作用 [4]。
对于 PPDs 的口服递送,理想的纳米载体应具备优良的稳定性和生物相容性、较高的载药量等特性。20 世纪 90 年代脂质纳米载体 ( lipid nanocarriers,LN) 发展成熟,它以生物相容的脂质材料 ( 如甘油三酯和脂肪酸 ) 为载体,将药物溶解或包裹在脂质核心或吸附于纳米粒表面,包括固体脂质纳米粒 (solid lipid nanoparticles,SLNs)、纳米结构脂质载体 (nanostructured lipid carriers,NLCs)等,具有减少胃肠道酶解、促进小肠上皮吸收、生物相容性好等优势,适合生物大分子类药物的口服给药,并具有工业化生产的可能 [5—6]。本研究总结了 PPDs 胃肠道吸收的障碍机制及口服递送策略、脂质纳米递送载体促进 PPDs 口服吸收机制及其用于口服递送 PPDs 的应用进展,并进一步探讨其挑战与机遇。
1 PPDs 口服给药现状
在胃肠道中,PPDs 一方面易受胃酸降解破坏,或改变解离状态,导致结构或功能改变,另一方面各种消化酶也会降解 PPDs[7]。同时,部分 PPDs 由于亲水性较强 ,无法有效穿透小肠黏液层和细胞间紧密连接的上皮层 ( 系 PPDs 吸收过程的 2 道物理屏障,前者阻碍药物向吸收膜表面扩散,后者形成了抑制药物渗透的密封壁垒,导致膜通透性较差 [8—9]),导致 PPDs 很难被吸收 [10]
1.2 PPDs 口服递送的一般策略
1.2.1 化学修饰PPDs 口服生物利用度往往受到药物自身亲水性、相对分子质量及对酶和 pH 敏感等理化性质的影响,因此常采用化学修饰策略来改变 PPDs 的相应性质 [11—12]。首先考虑通过添加非极性基团或去除极性基团来增加药物的亲脂性,以利于药物在肠黏膜上的扩散,但 PPDs 的水溶性降低会导致与受体的亲和力降低,故还需辅以聚合物材料进行优化。其次,由于肠道细胞膜上的糖蛋白带负电荷,阳离子药物对肠黏膜的通透性更强 [13—14]。但多肽阳离子化可能会产生免疫原性及潜在毒性。最后,聚乙二醇 (PEG) 化可通过空间位阻而阻挡 PPDs 与蛋白水解酶的结合,延长其半衰期 [15],也是增加药物吸收的一个有效途径,但相对分子质量的增加也会导致颗粒增大、黏度增加及细胞亲和力降低等问题。目前,脂基颗粒、多糖基颗粒等多功能颗粒系统能通过多重化学修饰而实现治疗性 PPDs 的有效口服递送 [16]。

2 LN 实现包载亲水性 PPDs 的多重机制
为了将亲水性 PPDs 整合到 LN 中,必须设法提高其亲脂性,而传统的化学修饰方法可提供一些思路。首先,大多数多肽都至少含有一个伯氨基、羟基或羧基官能团,可通过酯键或酰胺键与脂肪酸共价结合。此外,二硫键也可被用作连接臂 [22]。多肽环化也能改变多肽的理化性质,使构象刚性变强而形成分子内氢键,亲脂性随之增加,同时亲脂性的非带电环肽可通过跨细胞途径被动扩散穿透细胞膜 [23]。然而,这些方法需要复杂的合成和纯化步骤,同时化学修饰产生的新活性药物成分必须通过监管机构的审批,相对来说非共价结合的多肽可能是较优选择 [24]。
非共价结合作用包括氢键、疏水作用和离子相互作用等,其中较有效的方法是离子相互作用,即通过阴离子、两性或阳离子表面活性剂中和多肽的净电荷来增加多肽亲脂性 [22]。
HIP 作为一种将带电的亲水分子与带相反电荷的反离子通过离子相互作用结合转变为疏水络合物的策略而得到广泛关注。反离子至少包含一个疏水结构域,作用过程中亲水分子的电荷被疏水结构域屏蔽,减少了在极性溶剂中的溶解度 ;而多肽至少含有一种可电离的氨基酸,通过调至等电点以上的 pH 值,使多肽产生负电荷,反之则产生正电荷。因此,HIP 可有效提高亲水性多肽的亲脂性并将其封装到纳米载体中 [25]。
一系列研究表明,利用 HIP 原理可增加多肽的亲脂性,使其溶解在油相中。基于阴离子表面活性剂和正电荷蛋白质的相互作用,研究者通过 HIP 将胰岛素包裹在硬脂酸固体脂质纳米粒中 [26]。为获得较高的有效载荷,有学者研究了亮丙瑞林 (LEU)、胰岛素 ( INS) 和去氨加压素 (DES) 等阳离子多肽与阴离子表面活性剂二十二烷磺酸钠、十二烷基硫酸钠 (SDS) 和油酸钠的 HIP 络合物在各种溶剂中的溶解度,证明多肽药物的有效载荷可达到 10%以上 [27]。NAZIR 等进一步考虑了 Lipinski 五法则及氢键供体和受体亚结构对膜通透性的影响,认为提高多肽亲脂性的关键因素是降低其氢键潜力,因此提出了疏水氢键配对 (hydrophobic H-bond pairing,HHP) 法,即亲水性大分子药物通过氢键与非离子表面活性剂 ( 如以蔗糖为亲水性头基、脂肪酸为亲脂性尾基 ) 形成亲脂性复合物,从而改善膜通透性,并证明 HHP 通过引入亲脂性亚结构和消除氢键供受体亚结构对改善 LEU 的亲脂性和膜渗透性有较大作用 [24]。
3 LN 提高 PPDs 口服生物利用度的机制
口服 PPDs 面临的主要障碍是胃酸和酶,会导致 PPDs 特定结构和功能的丧失 [28]。经过适当包衣的 LN 已被证明可避免胃酸及蛋白酶降解,同时HIP 的形成大幅增加了 PPDs 的亲脂性,使其可溶解在纳米载体的亲脂相中。且 HIP 不受竞争性反离子的影响,而酶由于亲水特性不能进入亲脂相,因此治疗性 PPDs 在 LN 中可受到保护、不被降解 [15]。
有研究评估了用于 NLCs 的表面活性剂对PPDs 提供酶保护的影响 [31]。首先将胰岛素作为模型肽与 SDS 通过离子键形成复合体 ( INS-SDS)以提高亲脂性 ( 胰岛素的 logP 从 –1.8 升至 2.1)。然后通过溶剂扩散法制备了 3 种 NLCs[ 分别含有PEG 酯、PEG 醚和聚甘油酯 (PG 酯 ) ],再进行体外脂解和模拟胃肠液中的蛋白质水解研究。结果表明,含 PEG 醚的 NLCs 对胰岛素复合体的保护效果最好,这是因为制品中缺乏酯基结构,不易受胰酶、脂肪消化酶的影响。蛋白降解研究表明,INS-SDS复合分子能被胰酶完全降解,而被 NLCs 包封后与胰酶共孵育 4 h,仍有 30%~ 50%的多肽未被降解。NLCs 表面含有对降解酶不敏感的亚结构,可为 PPDs 提供更好的胃肠道蛋白酶保护。
小肠是多肽和蛋白质消化的主要部位,因此肠黏膜及上皮是 PPDs 口服递送的障碍 [28]。LN 的亲水性和表面电荷是影响 LN 渗透小肠上皮细胞的关键因素。先前研究表明,带正电荷的 LN( 如壳聚糖修饰的 SLNs) 对黏液层具有更高的亲和力和更强的黏膜黏附特性,导致纳米粒的渗透效率低 ;而净中性表面电荷可避免黏液黏附 [22]。如用 PEG 对 LN进行表面功能化使其表面呈中性和亲水性,能克服疏水和静电相互作用而通过黏液扩散 [32]。LN 在到达小肠时脂质可被消化水解并形成次级囊泡,其脂解产物主要是 2- 甘油单酯和脂肪酸,然后会与内源性胆汁盐等相互作用,形成不同的胶束物质,形成的胶束被转移到未搅拌的水层和上皮,通过简单扩散到达肠细胞的吸收表面。在胶束结构中溶解的脂解产物和包裹的药物可大幅增强分子在未搅拌水层中的传递,从而增强药物吸收。在消化过程中,LN 脂解产物和药物可能通过肠淋巴系统或门静脉运输和吸收。
体内外试验表明,PEG 修饰的 SLNs(pSLNs)可迅速穿透黏液分泌物,而无任何修饰的 SLNs则易被黏液屏障捕获 [33]。以雄性 SD 大鼠为动物模型的多柔比星药动学研究表明,与 SLNs 相比,pSLNs 具有更高的吸收效率和更长的血液循环时间,相对生物利用度提高 1.99 倍。LN 可通过多种方式与细胞相互作用,包括内吞作用、跨细胞作用或与细胞膜融合等,此外还较易与渗透促进剂结合,如胆盐和脂肪酸这些递送系统甚至有可能高效地克服治疗性多肽和蛋白质的上皮屏障 [15]。
近年来,纳米载药系统在 PPDs 口服递送领域的应用前景逐渐开阔。首先,纳米载药系统粒径为10 ~ 200 nm,可将 PPDs 溶解、包裹或吸附其间以免受胃肠环境破坏 [34]。粒径大小对口服纳米系统在胃肠道的吸收有较大影响 :尺寸较小的颗粒比表面积较大,而纳米粒在上皮细胞表面的黏附性也随着颗粒比表面积的增加而增加 [21],有利于提高PPDs 的溶解度和溶出度。
其次,纳米载药系统和黏液之间存在多种相互作用力,影响着纳米载体在黏液层的扩散速率和滞留时间。黏液层的主要成分黏蛋白主要由糖蛋白构成 [3,35],黏蛋白骨架由丝氨酸、脯氨酸和苏氨酸的残基重复序列组成,由于氨基酸的高度糖基化使其增加了很多负电荷,肠道黏液层因此带负电 [36—37]。黏蛋白与载体的静电作用可导致粒子聚集,从而影响纳米载体渗透速率。多数 PPDs 无法主动转运,所以在纳米载体表面设计一层克服黏膜吸附的电中性或电负性亲水层,将有利于其渗透黏液层到达上皮细胞膜 [38]。一般来说,纳米载药系统的摄取途径主要是胞饮 [39],或 M 细胞吞噬作用。M 细胞对纳米载药系统的摄取和转运明显高于肠细胞,派尔斑中 M 细胞的摄取可使纳米载体系统通过淋巴吸收,进而绕过首过代谢的影响 [40—41]。
脂类又称脂质,是脂肪及类脂的总称,不溶于水而易溶于脂肪溶剂等非极性有机溶剂,并且是能为机体所利用的重要有机化合物 ;大致可分为单纯脂类 ( 甘油三酯 )、复合脂类 ( 磷脂 )、衍生脂类 ( 脂肪酸 )。脂类具有独特的性质,如生物相容性良好、能增强亲脂性分子的胃肠道吸收、化学结构广泛多样,使之成为优良的赋形剂。在肠道中,脂类受脂肪酶等影响,药物从制剂中释放出来后会与肠道中的甘油二酯等发生相互作用 [42],之后通过吸收胆汁盐形成稳定胶束来实现增溶,混合胶束与肠细胞膜上的脂类和蛋白质之间的相互作用,使得脂质膜更具流动性,增强了亲水性和亲脂性化合物的渗透能力,有利于进一步通过淋巴循环吸收 [43—44]。同时,肠道淋巴转运需要更多的时间,这意味着可获得药物持续释放的效果 [45]。此外,脂类的其他优势还包括增加肠细胞膜通透性、避免肠道酶降解及减少肝脏首过代谢。
脂类可促进活性化合物的吸收,在身体吸收脂肪的同时,药物也更易被摄取,这被认为是一种“特洛伊木马”效应 [46]。总之,脂类被肠道中的酶降解,在脂滴或固体脂粒表面形成表面活性的单甘酯和双甘油酯等 [32,42],使之在胆酸盐等内源性物质作用下聚集形成胶束,在此过程中,溶解在脂质中的药物被胶束摄取、包裹。由于脂类的组成和特性与细胞膜相似,易与肠黏膜细胞发生吸附、融合、扩散等作用,又因为 LN 的药物包封能力稳定,因而在加强药物的肠细胞摄取时还能使药物缓慢释放从而延长作用时间 [47]。因此,LN 的保护作用加上缓控释特性,可防止大分子药物过早降解,并提高其胃肠道稳定性 [26]。
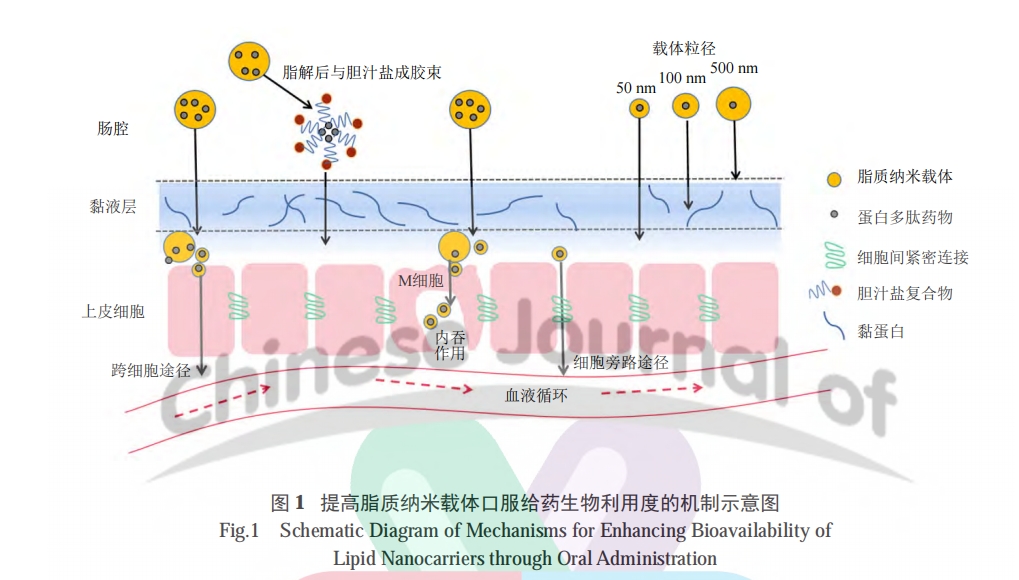
SLNs 表面可被修饰成带阴离子、阳离子或净中性表面电荷,有研究通过跟踪其在体内的转运,考察了表面电荷对口服吸收的影响 [48]。试验证明 3种类型的表面电荷修饰都能促进完整 SLNs 的口服吸收,其中净中性表面电荷 SLNs 的吸收最快和最多,这是因为表面带中性净电荷与未修饰的 SLNs都具较低的脂肪分解速率和较强的黏液渗透能力( 可能是由于其亲水性促进了黏液渗透 ) ;阴离子表面电荷虽能通过减缓脂解而增强口服吸收,但其与阴离子细胞膜的相互作用可引起静电排斥 ;阳离子虽更适合粒子内化入膜,但在胃肠道中会比中性电荷 SLN 更快地被脂肪酶分解。不同的表面电荷对脂解的影响并不符合对整体口服吸收的影响,可能原因是带电粒子会被阻止进入体循环。这种促进口服吸收的效应当归因于表面亲水性的增强,而非表面电荷。事实上,完整颗粒的口服吸收是基于几个因素的相互作用,在增强完整 SLN 的口服吸收方面,亲水性或许比表面电荷更重要。通过表面修饰还可控制 PPDs 释放的位置和速率,有助于避免发生不良反应 [12,49]。
4 PPDs 口服脂质纳米载体的主要类型及其应用
SLNs 是 20 世纪 90 年代初发展起来的第一代脂质纳米颗粒,是由固体脂质、药物和表面活性剂按一定比例组成的纳米胶体载体 (10 ~ 1 000 nm)[51]。固体骨架提供了高抗聚结稳定性的可能性,降低了药物分子的流动性,同时能保护它们免受化学降解。SLNs 结合了聚合物纳米粒和脂质体的优点,同时减少了稳定性及毒性相关问题,还可有效控制药物释放速率 [52]。脂质纳米制剂中的脂质还可能会影响它们通过肠上皮细胞吸收的途径 [38]。此外,PALIWAL 等制备了甲氨蝶呤 SLNs,并评价了脂类对制剂特性的影响,观察到不同链长的脂质可为药物分子提供的链间插入位置不同,从而影响包封率 [53]。不同性质的脂质对复乳法制备的 SLNs 的形成、体外释药和体内吸收存在影响 [54] :如脂质溶液的黏度可影响超声能量的传递,从而形成复乳液;脂类和溶剂之间的疏水性差异对初乳、复乳的形成和最终的挥发过程也有显著影响。
虽然 SLNs 对 PPDs 具有较强的稳定作用,但也很难突破肠道细胞黏液层的阻碍,需要经过适当的表面修饰才能发挥作用。壳聚糖是一种天然的阳离子多糖,因具有良好的生物相容性和生物降解性、低毒性、抗菌性、黏附性和增强吸收的特性而被用于药物传递系统的开发。经壳聚糖包被的脂质纳米粒与人结肠腺癌细胞 (CaCo-2 细胞 ) 培养模型的相互作用研究表明,改善 PPDs 口服吸收的原因很可能是该系统与肠黏膜发生了良好的黏附作用并增强了渗透性 [56]。FONTE 等采用 w/o/w 型复乳法制备了带负电荷的 SLNs,然后与带正电荷的低分子壳聚糖发生静电相互作用,得到壳聚糖包被的SLNs[57]。大鼠口服壳聚糖包被与未包被的 SLNs 后,可观察到前者降糖效果明显改善,同时可见定位于肠壁及内化到肠细胞内的荧光标记胰岛素,从而证明了该纳米载体促进胰岛素肠道吸收的有效性,以及包被壳聚糖的 SLNs 能增强肠道对胰岛素的摄取。此外,壳聚糖涂层似乎能进一步增强胰岛素负载SLNs 的肠道吸收特性,这可能有助于开发一种优化的口服胰岛素配方 [58]。
进一步研究表明,壳聚糖包被的 SLNs 具有“隐形”特性,可逃避巨噬细胞的吞噬。SARMENTO等以 Witepsol( 半合成椰油酯 / 棕榈油酯 ) 为脂核,泊洛沙姆或 Tween 为表面活性剂制备了平均粒径为200~400 nm的SLNs。巨噬细胞摄取试验结果表明,相对于未修饰 SLNs 表现出的内化现象,壳聚糖包裹的 SLNs 未见被内化,这些结果为延长脂质纳米粒的血液循环时间提供了新的研究思路 [13]。
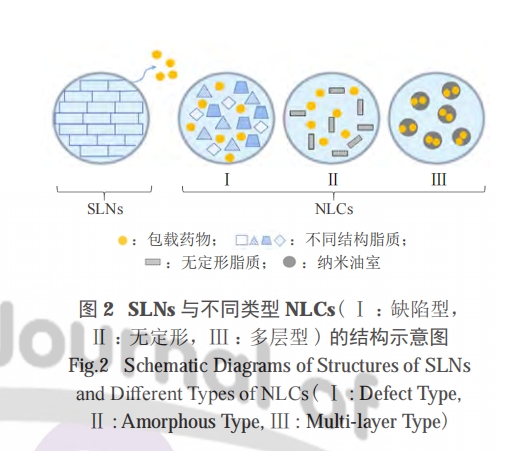
因此,尽管 SLNs 和 NLCs 都可作为 PPDs 的有效载体,但稳定性更好、释药行为更佳的 NLCs 可能是比 SLNs 更好的选择 [62]。DUMONT 等开发了一种高压均质技术将 2 种亲水性模型多肽 ( 去氨加压素和亮丙瑞林 ) 包裹在用于口服的 NLCs 中,2种模型肽通过与二十二碳磺酸钠的 HIP 作用形成复合物而增加其亲脂性,结果证明所制备的多肽复合物能被成功包埋在 NLCs 中,且贮存稳定性良好 [63]。
LC 作为胰岛素及其类似物口服给药载体的体内外研究得到不断推进。MUNTONI 等采用脂肪酸凝聚法制备了 SLNs 和 NLCs,胰岛素和胰岛素类似物甘精胰岛素通过疏水离子配对作用被包裹在脂质基质中 [26]。其中,负载甘精胰岛素的 NLCs 在体外和体内肠道表现出最佳的摄取效果,体内药动学研究中观察到血糖下降,这表明 NLCs 可一定程度上促进多肽类药物的口服吸收。此后又将甘精胰岛素 NLCs 转化为固体口服剂型,分别给予健康大鼠和糖尿病模型大鼠。随后测定了甘精胰岛素的摄取情况和葡萄糖反应性,观察到 NLCs 的混悬液和固体制剂对健康大鼠都有相应的降血糖作用,但只有胶囊剂对糖尿病大鼠有效,证明由 NLCs 转化成的固体制剂具有口服降糖剂的应用潜力,尤其是胶囊剂 [64]。此外,推测了胶囊剂对糖尿病大鼠有效的原因 :试验中所用的链脲佐菌素 (STZ) 诱导的糖尿病大鼠肠道黏膜发生改变,这种差异导致了甘精胰岛素的吸收差异,同时胶囊的体积较大,胃排空减慢,有助于甘精胰岛素在胃和十二指肠段的吸收。SHRESTHA 等评估了 NLCs 作为 GLP-1 类似物、艾塞那肽和利拉鲁肽的口服载体的潜力 [65]。结果显示,NLCs 展现出对多肽的高包封率,其中利拉鲁肽结构上存在一条脂肪酸链,亲脂性更强,有助于其固定在脂质基质上,因此包封率 (95.4% )略高于艾塞那肽 (87.5% )。与游离药物溶液相比,NLCs 还能增强艾塞那肽在 CaCo-2 肠道单层中的渗透性,然而在正常小鼠中没有观察到明显的降血糖效果。NLCs 的结构优势或许局限于肠道细胞的黏液层,需要利用改性剂或其他生物材料进一步优化。
5 结论与展望
蛋白多肽等生物大分子对靶点的选择性强、活性高、疗效显著,能在糖尿病、肿瘤等疾病治疗中发挥重要作用。然而,大多数生物大分子药物口服后被消化酶降解,且亲水性强、难以透膜,导致口服生物利用度低。虽然对 PPDs 进行化学修饰和加入改性剂可提高稳定性、增加膜通透性、促进小肠吸收,但也可能增强胃肠道毒性。黏膜黏附系统能延长 PPDs 在胃肠道的滞留时间,提高生物利用度,但却不能提高药物的口服渗透性,也不能避免小肠黏膜的清除作用。而脂质纳米递送载体 (SLNs和 NLCs 等 ) 具有其他方法无法比拟的优势,拥有良好的稳定性和生物相容性,可保护包载药物不受酶降解和 pH 条件的影响,利用黏附特性将纳米粒渗透至上皮细胞膜上,利用淋巴吸收途径有助于药物避免首过代谢,更重要的是已被成功地应用于PPDs 口服给药,如胰岛素和降钙素。
值得一提的是,SLNs 和 NLCs 对亲水性药物的载药量有限,研究发现可通过共价键或非共价键形式将 PPDs 与脂类化合物偶联,转化为更亲油、不溶于水的分子,以创造负载效率高的脂质纳米递送系统 [34]。同时脂质纳米粒表面还可修饰细胞穿透肽或亲水性聚合物等,发挥二者在口服给药方面的协同优势,为 PPDs 口服递送提供潜在策略。SLNs、NLCs 技术已在全球化妆品和药妆产品市场中得到应用,但到目前为止,用于 PPDs 治疗用途的 SLNs 制剂还处于临床试验阶段,NLCs 制剂也只处于实验室开发阶段。为充分发掘脂质纳米递送载体作为 PPDs 口服系统的潜力,需要加快临床前和临床上的验证研究,同时建立准确的体内外相关性模型也对促进其临床转化具有重要意义 [66]。此外,深入了解脂质纳米递送载体的体内吸收机制及分布将有助于设计更有效的递送系统,相信随着蛋白质化学、脂质纳米制剂和药物递送的技术迅速发展,基于脂质的纳米载体将进一步塑造 PPDs 口服递送的新格局。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。