
摘 要 由于在蛋白质分离、生物传感器、疾病诊断和治疗以及基础的生物医药研究等领域的潜在重要应用 ,合成受体与短肽(3 —20 氨基酸残基) 相互作用的研究已引起了人们的关注。本文综述了近年来合成受体与短肽相互作用的研究进展 ,介绍了小分子受体与个别氨基酸残基的相互作用 ,小分子受体对短肽的序列选择性识别 ,小分子受体对短肽二级结构的诱导与识别以及高分子受体与短肽的相互作用 ,并对短肽受体的设计进行了建议与展望。
在很长的一段时间里 ,人们对于蛋白质-蛋白质相互作用始终存在这样一种认识 ,即酶-底物及其抑制剂、抗原-抗体、激素-受体等蛋白质复合体的形成 ,是相互作用的两个分子间整个互补界面的相互作用 ,是整体空间构象的识别与契合。也就是说 ,两者的结合涉及较大的一个空间 ;参与结合的氨基酸残基不是线性肽段 ,而是在一级结构上相距较远 ,但又共同构成一个适合于结合的立体结构。这种观点在很多的蛋白质复合体中得到证实[1 —3 ] 。随着对蛋白质-蛋白质界面研究的深入 ,很多文献又报道了蛋白质相互作用中的结构[4 —8 ] 、能量[6 , 9 ] 、电性互补[10 ]及动力学等方面的研究结果 ,为深入研究蛋白质-蛋白质相互作用打下了基础。
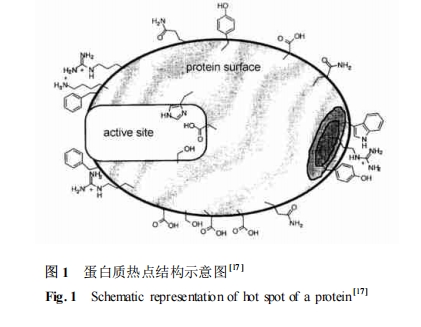
近年来蛋白质间相互作用研究的一个重要突破在于蛋白质表面“热点 ( hot spots) ”的确定 ,所谓的“热点”是位于或接近蛋白质-蛋白质界面几何中心的一个约 600A2 的区域 ,如图 1 所示。构成“热点”的残基对蛋白质-蛋白质复合物的稳定性起重要的作用[11 —14 ] 。Wells 等发现 ,改变热点区域内某些氨基酸残基对蛋白质的亲和行为影响较大 ,而热点周围的残基则对蛋白质复合物的稳定性贡献较小[15 ] 。研究还发现在热点区域内起作用的残基中 Trp (色氨酸) 、Phe (苯丙氨酸) 以及 Arg(精氨酸) 3 个氨基酸对于结合能的贡献最大 ,这与 Geysen 的研究结果[16 ] 一致。Geysen 认为 ,结合的两个分子间少数几个关键基团的弱相互作用提供了绝大部分的结合能 ;含有与结合有关的几个关键基团的线性短肽可模拟蛋白质折叠的抗原决定簇。
2 小分子受体与短肽相互作用
目前 ,在研究合成受体与短肽相互作用的分子设计中 ,主要包括几个方面 : (1) 针对特定的氨基酸残基 ,如 His(组氨酸) 、Arg、Trp 等 ; (2) 针对一类性质相近的氨基酸 ,如碱性氨基酸 :Lys(赖氨酸) ,Arg ;或酸性氨基酸 :Asp (天冬氨酸) 、Glu (谷氨酸) 等 ; (3) 针对氨基酸的端基 ,即 N 端阳离子或 C 端阴离子 ; (4)针对特定的多肽改性基团 ,如磷酸化基团 ; (5) 针对一个特定的序列 ,这也是目前研究的热点 ,但涉及的序列往往很短 ,很多研究都少于 3 个氨基酸残基的短肽 ,最为普遍的是两个氨基酸残基 ,或者多肽一头一尾的氨基酸残基 ; (6) 针对特定多肽构象的识别 ,即α螺旋和β折叠结构 ,这类研究往往集中于合成受体与肽的弱相互作用诱导二级结构的产生。
2. 1 小分子受体与个别氨基酸残基相互作用
针对多肽特定的氨基酸残基(端基、侧链和磷酸化残基) 设计相应的受体 ,使其与多肽发生选择性相互作用是多肽受体设计中一个重要方法。通过将某些能与特定氨基酸残基发生弱相互作用的小分子(环糊精、氨基三乙酸(NTA) 、卟啉等) 进行修饰和改性 ,目前已经发展了很多此类的受体。
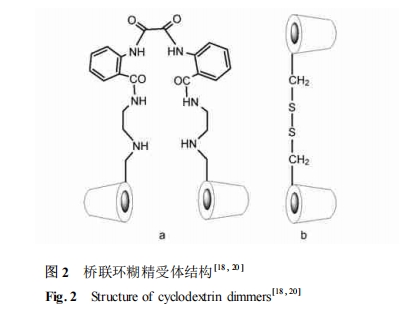
刘育等[18 ] 通过紫外、圆二色、荧光、二维核磁方法 ,在 Tris-HCl 缓冲液中研究了桥连双环糊精 (图2a) 在加入金属离子前后与系列脂肪族短肽 Leu-Gly ,Gly-Leu , Gly-Pro , Glu-Glu , Gly-Gly , Gly-Gly-Gly 以及 Glu-Cys-Gly 的包结行为 ,从主-客体间诱导契合和识别机理方面研究了选择性及键和能力。结果表明 ,桥联双环糊精受体对 Glu-Cys-Gly 具有明显的选择性 ,亲和常数是 Glu-Glu 的 51 倍 ,说明所合成的桥连双环糊精受体能有效识别短肽的尺寸和疏水性。而在络合 Ni2 + 之后 ,金属桥联双环糊精对 Glu-Glu具有最高的结合常数 ,达到 6182 ×104 M- 1,金属离子的参与有效地提高了桥联双环糊精的键和能力和选择性。
宋乐新等[19 ] 设计了荧光素标识的 (1 R ,3 R)-1-氨基-1 ,3-二羧基环戊烷衍生物桥联的双环糊精受体 ,利用荧光偏振方法 ,研究其与一系列短肽的相互作用。比较了主体分子与一对手性异构体相互作用的自由能变化增量以及它们之间的结合常数 ,证实环糊精二聚体对短肽具有手性识别能力 ,并探讨了环糊精二聚体与短肽之间相互作用的焓-熵补偿行为。
Breslow 等[20 ,21 ]合成了具有不同间隔臂的桥联环糊精 ,并分别研究了它们在水溶液中与几种短肽的结合能力。紫外滴定结果显示二硫键桥联环糊精(图 2b) 对 Trp-Trp 二肽表现出了极强的结合能力 ,而对 Phe-Phe 二肽则没有特异性结合。
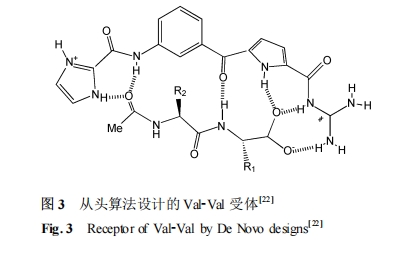
水溶液中肽的识别具有一定的难度 ,一个重要原因是氢键受溶剂干扰很难发挥作用 ,而利用离子相互作用稳定氢键是一种设计水相受体的有效方法。2004 年 Schmuck 等[22 ] 采用从头算法设计了一种新型的二肽受体(图 3) ,可在水溶液中有效识别 C端未保护的二肽 ,结合系数达到 10^4M- 1以上。通过在受体中引入胍羰基 ,与二肽的羧基形成氢键和离子对 ,同时二肽主链氨基与受体形成的其他氢键也起到增强复合物稳定性的作用。在此基础上 ,通过咪唑环的引入增加了普通胍基受体的选择性。紫外-可见滴定测定其在水中与不同底物的结合常数( K) ,结果显示 K 值 :Val-Val > Ala-Ala > Gly-Gly ,这一结果揭示氨基酸侧基的疏水基团与受体间的疏水作用可以进一步增强亲和性。该方法在理论计算的基础上合成出新的高效的二肽受体 ,优于当时报道的其他的二肽受体。Schmuck 课题组[23 —26 ]随后又研究了几种四肽与该类配体的相互作用 ,也得到了不错的结果。
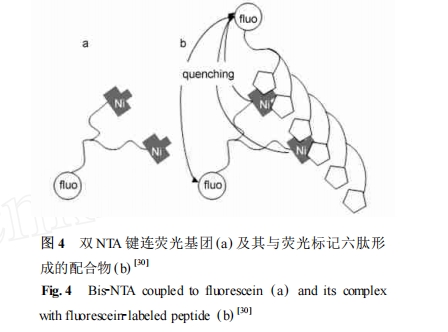
在受体上引入可形成配位键的过渡金属元素 ,与多肽序列中特定残基或磷酸化基团形成强的配位离子相互作用 ,也是实现受体在水相中对多肽识别有效的方法[27 —29 ] 。Piehler 等[30 ] 研究了含 2 —4 个NTA 的荧光探针化合物与含多个 His 残基的荧光六肽间的相互作用而引起荧光猝灭的现象 (图 4) ,证明该探针化合物对 His 标记的肽有较高的亲和性。在金属离子配位相互作用识别多肽方面 ,卟啉及其衍生物作为受体的报道很多[31 —34 ],这里不再详述。
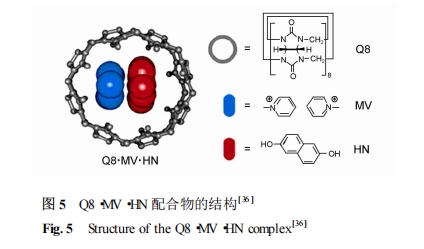
经典的已为人们所熟知的人工受体如冠醚、环番等如加以巧妙利用也可以设计出性能优良的受体[35 ],图 5 为 Urbach 等[36 ] 报道的合成受体葫芦脲(Q8) 对 N 端色氨酸的识别 ,Q8 可以与甲基紫罗碱MV 及一个芳环客体形成1∶1∶1型配合物。他们用等温滴定微量热、质谱、紫外-可见、荧光、1H NMR 研究了 Q8·MV 与 4 种包含色氨酸的三肽的相互作用 ,发现其对 Trp-Gly-Gly 的结合常数 (113 ×10^5) ,是 Gly-Trp-Gly 的 6 倍 ,是 Gly-Gly-Trp 的 40 倍。分析表明 ,这种差异是由吲哚的电荷相互作用产生 ,化合物形成伴随着电荷转移和吲哚荧光的变化 ,这些光学性质以及体系的稳定性和选择性在探测和分离特定的肽方面具有一定的应用前景。
蛋白质磷酸化是生物界最普遍 ,也是最重要的一种蛋白质翻译后修饰[37 ] 。可逆的磷酸化过程几乎涉及所有的生理及病理过程 ,如细胞信号传导、新陈代谢以及细胞的增殖、发育和分化等。例如 ,酪蛋白磷酸肽 (CPP) 是一类富含磷酸丝氨酸生物活性肽 ,分布于牛乳酪蛋白的不同区域 ,其活性中心是连续的磷酸化丝氨酸残基和谷氨酸残基 ,基本结构可表示为 :pSer-pSer-pSer-Glu-Glu。CPP 在中性和碱性状态下可作为无机离子载体 ,通过磷酸化丝氨酸与钙、锌、铁等离子结合 ,形成可溶性复合物 ,由小肠壁细胞吸收后再释放出来 ,从而有效避免了其在小肠中被沉淀 ,促进了这些离子的吸收[38 ] 。
由于针对磷酸化蛋白的分离和分析缺少廉价高效的识别材料 , 因此限制了该领域的发展。通过对磷酸化多肽的识别研究 ,可积累对含不同电荷残基识别的调控经验 ,有利于深入了解离子化基团对多肽识别的影响。对临床快速检测磷酸化蛋白具有指导意义。在氨基酸中 ,Ser (丝氨酸) 、Thr (苏氨酸) 和Tyr(酪氨酸) 上都含有羟基 ,是磷酸化的位点。因此 ,对于磷酸化肽的识别往往是通过合成或者生物受体与磷酸结构单元形成的离子键、络合配位等效果实现。
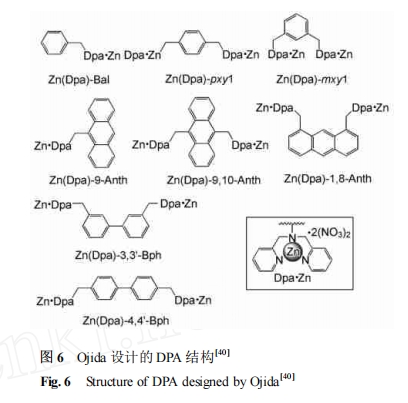
就目前对磷酸化肽的识别来说 ,合成的受体主要是利用磷酸结构的金属离子络合配位作用。Ojida等合成了金属离子锌配位的 DPA 结构 ,可以对磷酸化肽进行有效的识别。图 6 为他们设计的一系列的DPA 结构。在两个 DPA 结合臂之间由具有荧光效果的结构相连接 ,当它们与磷酸化肽进行结合的时候 ,荧光效果会随着结合程度的不同而不同程度地增强 ,据此获得主体客体之间相互作用的计量比以及结合常数 ,并对识别过程进行了分析。
Yamaguchi 等[41 ] 和 Yoshimura 等[42 ] 也合成了类似的结构 ,DPA 结构单元通过π2π堆积固定到凝胶结构上 ,对磷酸类结构以及含有磷酸结构的衍生物进行识别。他们还分析了这种水凝胶对不同磷酸衍生物 ,如 ATP、磷酸化的丝氨酸、磷酸根离子等的选择性。
虽然针对特定残基设计的受体对多肽有一定的选择性 ,但由于自然界中肽的种类无法估量 ,含有相同残基的肽的数量也很巨大 ,导致对多肽的选择性较差。肽序列选择性受体的设计和组合化学的发展为肽的专一性识别提供了一定的帮助。
2. 2 小分子受体对短肽的序列选择性识别
识别一个蛋白的表面需要在构型确定的环境内排列大量的功能基团[17 ] 。多肽的序列选择性识别是蛋白表面位点专一性识别的基础 ,对蛋白功能化控制、蛋白-蛋白及蛋白-寡肽相互作用的理解有重要帮助。Still 组是最早开始以多肽为目标物进行序列选择性识别的研究组之一 ,他们的主要目标是积累肽识别的理论知识 ,并将这些理论知识用于亲和性的确定和计算机预测。Still 等[43 —46 ] 已经给出一个包含很多识别元素的漂亮组合 ,这些信息在肽识别和肽库构建方面具有重要的意义。大部分序列选择性识别的报道都是通过单一氨基酸残基识别位点的简单连接构筑 ,如环糊精、冠醚或酰胺基团。
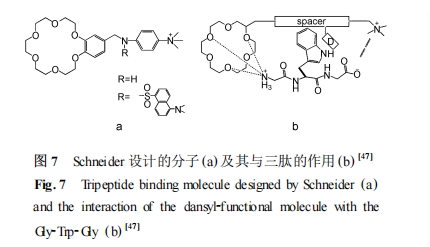
Schneider 等针对非保护肽端基和侧链引入多种识别基团 ,利用受体对双端基和侧链的共同作用识别多肽序列。如图 7 所示 ,水中和甲醇中的核磁滴定证明 ,18-冠-6 基团和多肽 N 端阳离子相互作用 ,受体氨基阳离子与多肽 C 端相互阴离子作用。单磺基团的引入有两个目的 ,一个是增加了受体分子与肽芳环侧链的相互作用 ,另一个则是可以用荧光光谱测定相互作用。这个工作最大的意义在于在同一体系中引入多种功能基团共同作用 ,具有很大的指导意义。后来他们又通过类似的方法引入卟啉基团作为氨基酸和三肽的紫外2可见传感器[48 ] 。
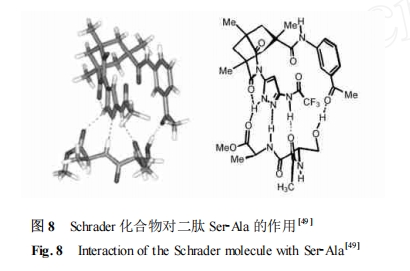
模拟自然界的肽受体是设计肽序列选择性受体的一个重要方法。Schrader 等[49 , 50 ] 发展了序列选择性肽受体的合理设计理论。他的理论认为很多生物体系都为肽序列的有效识别提供一个浅沟 ,并辅以一个对目标氨基酸残基的专一性键合的口袋。Schrader 课题组选用 kemp′s 酸作为受体骨架 ,为肽识别提供空间。Kemp′s 酸两个羧基一个连接单酰化的 3 ,5-二氨基吡唑 ,另一个接间位取代的苯胺衍生物作为识别位点 ,图 8 给出了该化合物对二肽Ser-Ala 的识别情况 ,Monte Carlo 结果显示其与 Ser-Ala 二肽的识别为三点协同作用。
然而 Fujita 等[51 ] 用过渡金属 Pd 制备了一种新型的 Pd 配位的三嗪笼形受体 (图 9) 。这种自组装配位笼受体通过π-π相互作用和 CH-π相互作用的协同作用对含有 Trp-Trp-Ala 链段的肽具有 10^6M- 1以上的作用常数 ,而对于含阳离子型 His 残基的 Ac-Trp-His-Ala-NH2 不存在结合能力 ,显示了其高度的序列选择性。受体与多肽的单晶结果证实了它们之间的作用模式是一种疏水作用。
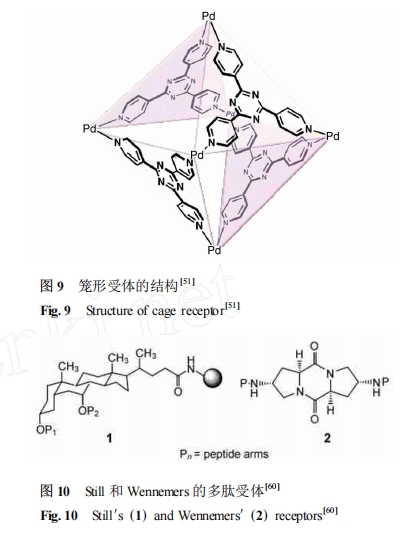
组合化学在多肽的序列选择性受体研究方面具有重要应用 ,通过肽库可以筛选出合适的序列选择性受体[52 , 53 ],目前这方面的研究报道很多 ,多数参与多肽序列选择性识别研究的课题组在组合化学方面都有不同程度的介入。通过组合化学优化 ,已经取得一些可观的成果[54 —57 ] 。组合化学技术也使大量有效受体的设计和合成成为可能。Still 的受体1[58 ]和 Wennemers 的刚性较强的受体 2[59 ] 就是较好的例子(图 10) 。
Anslyn 等[60 ]利用 Still 和 Wennemers 的思路设计了包含刚性骨架和可变三肽臂的受体识别三肽 ,研究表明该受体对 Xxx-Lys-Lys ( Xxx 为 His、Cys 或Met) 的三肽具有序列选择性 ,结合常数接近 10^6M- 1 。他们同时还证实三肽手臂的协同作用 (离子对) 能增加结合能力 ,如 His-Lys-Lys(110 ×10^6 M- 1)> His-Gly-Gly(115 ×10^4 M- 1) > Lys-Lys-His(0) , Gly-Gly-Gly(0) 。
2. 3 小分子受体对多肽二级结构的诱导与识别
多数少于或等于 30 个氨基酸残基的多肽在水溶液中并不以规整的构型存在 ,而是以许多自由能近似的构型群形式存在[61 ] 。因此 ,可以设计一定的受体 ,通过相互作用诱导并稳定多肽的某一构型 ,使其自由能降低并在构型群中占有多数 ,从而达到识别多肽的最终目的。当前研究中主要集中于α螺旋和β折叠的诱导识别。
α螺旋是一种重要的二级结构 ,在多种蛋白质-蛋白质表面相互作用中扮演着重要的角色。合理设计对α螺旋具有特定选择性识别的受体是一个挑战 ,这种挑战源于α螺旋较大的表面区域 ,以及疏水和静电互补在表面拓扑学上的匹配。
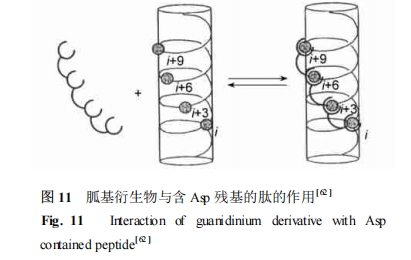
Hamilton 课题组[17 , 62 ] 利用胍基与肽上 Asp 残基的互补的特性 ,设计了一系列含有多个胍基结构的受体 ,这些受体可以在竞争性溶剂中对模型α螺旋肽进行识别。由于降低了去溶剂化能量和溶剂较低的介电常数 ,这种相互作用在有机溶剂里更为明显。如图 11 所示 ,胍基分子与 Asp 侧链相互作用 ,胍基间距离依赖于 Asp 残基间距离( i + 3 n) 。
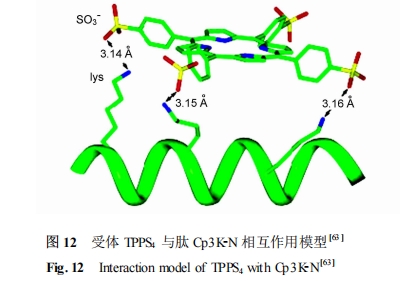
Fairman 等[63 ]利用 Lys 侧链氨基正离子能与阴离子相互作用的特点 ,设计了包含 3 个不连续 Lys残 基 的 肽 : Ile-Gln-Gln-Leu-Lys-Asn-Gln-Ile-Lys-Gln-Leu-Leu-Lys-Gln (Cp3K2N) 及其相应的阴离子卟啉受体(内消旋-四-(4-磺基苯)-卟啉 , TPPS4) 。紫外、圆二色及分析超速离心结果表明 ,受体 TPPS4 能通过多重静电相互作用与肽 Cp3K-N 发生特异性相互作用 ,并诱导其形成α螺旋结构 (图 12) 。TPPS4 的这种特异性和诱导α螺旋的能力在电子和光学活性的感应材料方面具有潜在的应用。
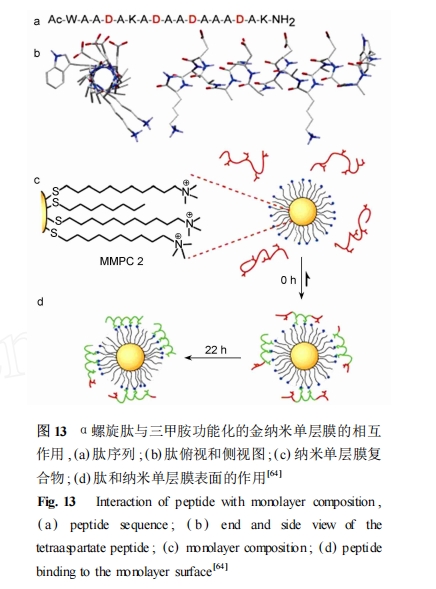
提高受体对生物分子亲和性的一个有效方法就是利用目标蛋白表面的模板受体进行识别 ,这已经通过分子表面印迹、树脂印迹以及金属印迹的模板聚合实现。纳米单层膜作为模板能为目标分子提供较大的表面 ,这使它们成为生物表面识别的工具 ,因此也成为目标α螺旋的潜在受体。Rotello 等[64 ]报道了在水溶液中三甲胺功能化的金纳米单层膜对含 4个天冬氨酸残基的α螺旋肽有显著识别和稳定作用 ,如图 13 所示。
β折叠的诱导识别主要有两种方式 ,即模拟成核链 ( nucleating strand mimics) 和 模 拟 成 核 转 角( nucleating turn mimics) , Nowick 等[65 ,66 ] 和 Kelly等[67 ,68 ]的分别建立过成功的模型体系。
3 高分子和短肽相互作用
3.1 线性高分子与短肽相互作用
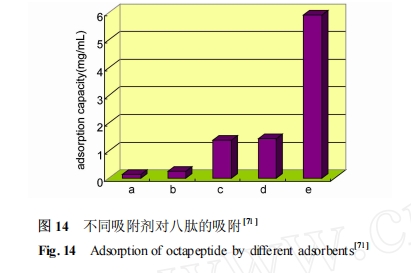
线性高分子与肽相互作用的报道在文献中出现较少[69 , 70 ],本研究组通过与亲水单体共聚的方法将功能单体引入高分子体系 ,制备了系列包含功能单体的水溶性共聚物 , 并将其用作吸附材料的模型[71 —75 ] 。通过等温滴定微量热、核磁、荧光和表面等离子体共振等现代分析测试手段研究模型聚合物与多肽在水中的作用机理 ,从而进一步指导吸附剂的结构设计 ,为高选择性多肽吸附材料的设计提供了一定的理论指导。图 14 给出了几种吸附剂对尿毒症中分子八肽(Val-Val-Arg-Gly-Cys-Thr-Trp-Trp) 的吸附能力 ,从图中可以看出 ,丁基修饰的聚乙烯胺(E) 吸附剂对八肽的吸附能力明显强于其他几种吸附剂。二维核磁对含有相同功能单体的水溶性聚合物模型与八肽相互作用的研究表明 ,模型聚合物与八肽的相互作用强弱趋势与吸附剂的吸附结果基本一致 ,证明了线性聚合物作为吸附剂模型筛选有效功能单体的有效性。同时 ,通过对吸附剂模型与八肽相互作用的研究 ,证明了吸附剂对八肽的吸附机理是疏水作用和静电作用的协同作用。
3. 2 肽吸附分离材料
随着生物技术的不断发展 ,在研究多肽和蛋白质的结构与功能时 ,一个必不可少的环节是要将其从成千上万种复杂的混合物中分离出来 ,并得到高纯度的样品。因此 ,近年来对于多肽的分离纯化技术已经发展成为生物技术的一个重要分支。在分子识别基础上进行多肽分离材料的设计将极大地提高分离效果。目前基于分子识别原理设计的多肽分离纯化材料主要分为亲和吸附剂、分子印迹聚合物等几类。
3. 2. 1 亲和吸附剂
亲和吸附剂可以应用于多种物质的分离 ,它的分离原理是基于分子间静电、氢键、疏水相互作用以及金属配位作用的分子识别。亲和配体包括生物特异性配体和仿生物特异配体。由于抗体十分昂贵且容易变性 ,因此生物特异性配体吸附剂的应用有很大的局限性。目前 ,应用该方法设计多肽亲和吸附剂主要是固定化金属离子亲和色谱 (immobilizedmetal ion affinity chromatography , IMAC) 的柱填充材料[76 —81 ]
IMAC 作为一种新型高效色谱分离模式 ,利用亲和吸附剂作为柱填充材料 ,已经被广泛应用于肽类物质的分离分析。IMAC 常作为捕获Π释放柱 ,富集某一类肽段(如表面含有裸露的组氨酸残基或磷酸化的肽段) ,以及含有组氨酸标签的重组多肽的分离纯化。邹汉法等[76 ] 通过直接聚合方法得到了含有磷酸酯基团的整体柱材料 ,利用磷酸酯基团与 Ti4 +的螯合配位作用固定化 Ti4 +,制备了 Ti4 +-IMAC(图15) 。再通过 Ti4 + 与磷酸化肽上磷酸基团的选择性作用达到富集的目标。实验结果表明 Ti4 + 固定化亲和色谱固定相对磷酸化肽段具有很高的选择性和明显的富集效果。分离和富集磷酸化肽的选择性和效率优于其他富集方法如 :Fe3 +-IMAC ,Zr4 +-IMAC[82 ],TiO2 以及 ZrO2 等。

3. 2. 2 分子印迹聚合物
将要分离的目标分子与交联剂在聚合物单体溶液中进行共聚制备得到颗粒介质 ,然后利用洗脱或萃取的方式除去包埋在介质中的目标分子 ,便得到分子印迹聚合物。此时的高分子介质中形成了在三维空间大小、形状以及功能配体都与模板分子互补的分子印迹微腔 ,可以将目标分子的空间结构保持“印迹”或留下“记忆”。这种分子印迹聚合物又被形象地称为“塑料抗体”或“人工抗体”,可实现对模板分子的特异性识别 ,这种特异性可以和多克隆抗体相媲美[83 , 84 ] 。
然而 ,由于多肽在溶液中构型自由度比较大 ,并不适合于分子印迹。除少数在水中结构很确定的多肽[85 ]外 ,针对多肽分子印迹的报道相对较少。一般对多肽的印迹都是基于三个方面 : (1) 蛋白质表面结构的印迹 ; (2) 蛋白质暴露域短肽序列的印迹 ; (3) 以识别蛋白质的生物分子作为功能单体制备印迹聚合物。
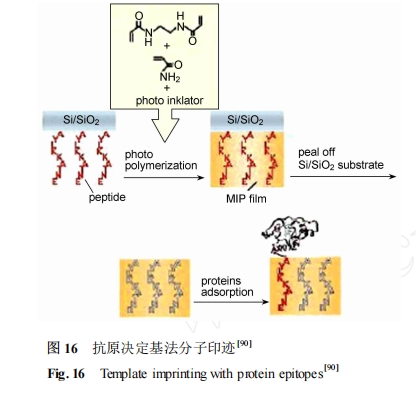
目前发展较为成熟的表面印迹技术是利用金属离子与组氨酸之间的螯合作用分离带有组氨酸片段的多肽。Shea 等[86 , 87 ]利用丙烯酰胺为功能单体 ,于富水相中制备分子印迹聚合物分离含有 N 端组氨酸的多肽 ,并对比了 Ni2 + 、Cu2 + 、Zn2 + 不同金属离子对印迹效果的影响。实验结果表明 Ni2 + 对肽的特异性识别作用最强。但遗憾的是 ,利用金属螯合作用的表面印迹技术只能应用于含有裸露组氨酸残基的蛋白质 ,并且金属螯合作用的特异性不强。近年来 ,新发展的抗原决定基法[88 , 89 ] 是基于使用多肽或蛋白质序列中裸露的一个特异短肽(抗原决定部位)片段作为模板分子(图 16) ,利用它所合成的分子印迹聚合物也能有效识别多肽和整个蛋白[90 ] 。
分子印迹聚合物可以高选择性地吸附混合物中的印迹分子 ,但制备分离材料之前必须获得待分离物质的纯品。如果纯品难于得到或价格昂贵 ,那么印迹方法将难于实现。另外 ,由于肽和蛋白由于其结构的复杂性及其与印迹常用的有机溶剂的不匹配性 ,导致蛋白质生物活性的丧失 ,如何能在水相进行分子印迹仍是一种挑战[91 ] 。
4 总结和展望
众多的文献报道对短肽识别的研究还主要限于小分子受体的设计及合成 ,短肽结构的柔顺性和多样性增加了其被识别的难度。特别是在极性溶剂(生物体系) 中 ,一些弱相互作用往往因受到溶剂分子的竞争 ,作用强度被大大削弱 ,导致识别的难度增大。而疏水性小分子受体的设计又受到水相溶解性的限制 ,发展并不顺利。对于高分子体系而言 ,尽管分子印迹技术用于多肽的识别得到了一定程度的研究 ,但分子印迹由于体系的限制难于有好的表现。
从目前发展的趋势来看 ,小分子受体应该以各种识别基团的优化和组合为基础 ,制备在水体系内具有序列选择性识别功能的受体。而实现肽吸附分离材料的高选择性首先要利用分子识别理论进行合理的设计并通过计算机模拟辅助筛选有效的配体 ,通过进一步优化配体后将优化得到的配体布局在吸附分离材料的表面 ,模仿蛋白质“利用弱相互作用进行组装和识别”的特点 ,实现配体的协同作用[92 ],有可能产生类似自然体系的响应性和和协同性 ,达到高选择性的识别效果。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。















