
摘要:常规化疗因特异性差、不良反应大,对肿瘤患者的治疗效果有限。前体药物是一类通过连接子将药物与靶向分子 (如抗体、多肽、核酸适体、聚合物等)连接成的药物偶联物,可提高药物向肿瘤部位递送的效率,提高化疗药物的疗效和安全性。本文介绍了几种可用于肿瘤靶向治疗的前体药物,如抗体-药物偶联物、多肽-药物偶联物、核酸适体-药物偶联物和聚合物-药物偶联物,包括其基本组成、靶向递药原理、临床研究进展和上市产品,并分析了前药策略在临床应用中存在的问题,以期为前体药物研发提供参考。
恶性肿瘤是一种慢性疾病,也是威胁人类生命健康的常见疾病。据报道,2018 年,全球恶性肿瘤的新发病例增加到 1 810 万例,死亡病例增加到960 万例 [1]。在恶性肿瘤的治疗中,化疗是除手术以外的重要治疗方法,使用小分子抗肿瘤药可有效阻止或减缓恶性肿瘤的生长。然而,很大一部分小分子抗肿瘤药并不具备识别肿瘤细胞的能力,会同时作用于正常细胞,从而导致较大的不良反应 [2]。基于现代精准医疗的需求,肿瘤靶向药物的开发引起了研究者的广泛关注。这一技术是降低小分子抗肿瘤药不良反应、提高整体疗效的有效方法。经过几十年的发展,除了借助纳米递药系统 ( 如胶束、脂质体、纳米粒等 ) 实现药物的靶向递送外,前体药物也是实现肿瘤靶向递药的一个重要策略 [3]。前体药物是将有生物活性的原型药与某种分子片段上的化学基团通过共价键结合得到的偶联物,这样形成的新化学实体本身无活性或活性低于原型药,但在体内经过酶作用或化学反应可使上述结合键裂解,释出原型药而发挥治疗作用 [4]。近年来,研究者又将可与肿瘤部位特异性表达的靶标高亲和力结合的分子与药物通过连接子连接形成小分子肿瘤靶向前体药物,用于肿瘤靶向递药。与小分子靶向药物相比,其原理简单,且靶向效率高、不易耐药 ;与纳米载药系统相比,其制备简单、无免疫原性,可穿透至肿瘤深处,更易于临床转化。目前,用于肿瘤靶向治疗的前体药物主要包括抗体 - 药物偶联物 (antibody-drug conjugate,ADC)、多肽 - 药物偶联物 (peptide-drug conjugate,PDC)、核酸适体 - 药物偶联物 (aptamer-drug conjugate,ApDC) 和聚合物 - 药物偶联物 (polymer-drug conjugate) 等。
1 抗体 - 药物偶联物 (ADC)
早在 20 世纪初,以“化疗之父”——保罗 · 埃利希 (Paul EHRLICH) 为代表的科学家们就提出了“魔术子弹”理论,旨在寻找一种化合物能选择性靶向病灶部位而不产生其他不良反应 [5]。20 世纪70 年代,基于单克隆抗体 (monoclonal antibodies,mAbs) 的免疫治疗开始出现 [6]。mAbs 可减少非特异性毒性,通过特异性结合肿瘤细胞上的抗原,作用于特定信号通路以达到治疗效果,或直接对肿瘤细胞产生免疫反应 [7]。迄今为止,约有 30 种 mAbs获得美国FDA批准用于肿瘤治疗。为提高治疗效果,研究者又将 mAbs 与各种抗肿瘤效应分子 ( 如细胞毒药物、放射性核素、免疫毒素等 ) 共价连接,创造出基于 mAbs 的靶向治疗和免疫治疗,其中 ADC受到广泛关注 [7]。
ADC 由重组 mAbs 通过连接子与细胞毒药物共价结合形成,其中 mAbs 可将药物靶向递送到目标细胞中发挥作用 [ 8]。这种结合了细胞毒小分子药物的免疫偶联物 [ 相对分子质量为 300 ~ 1 000,具有纳摩尔级的半数抑制浓度 (IC50) ] 具备高效抑制肿瘤细胞生长的能力,同时 mAbs 又赋予其高选择性、稳定性和有益药动学的特性,优势主要表现为:血循环时间长、因特异性高而具有的治疗效力强和对正常组织毒性低、不易耐药、免疫原性弱等 [9]。
ADC 的口服生物利用度较差,需要静脉注射以避免胃肠道消化酶对抗体的降解。ADC 入血后,其中的 mAbs 成分可与靶细胞上高表达的表面抗原识别并结合,通过网格蛋白介导的内吞作用内化,形成含有 ADC- 靶抗原复合物的早期核内体。在早期核内体中,腺苷三磷酸 (ATP) 依赖的质子泵产生酸性环境,触发一部分 ADC 中 mAbs 的 Fc 片段与核内体中表达的新生儿 Fc 受体 (FcRn) 结合,进而与细胞膜融合而被排出细胞外。随后晚期核内体与溶酶体融合,未被排出胞外的 ADC 在溶酶体水解酶的作用下,释出细胞毒药物到细胞质中。细胞毒药物与 DNA、微管蛋白等结合后,导致细胞 DNA复制或有丝分裂受阻,引发肿瘤细胞凋亡。目标细胞死亡时所释放的细胞毒药物还能通过旁观者效应 (bystander effect) 导致周围肿瘤细胞和周围基质组织死亡,但其效应取决于细胞毒药物的疏水性能 [10]。ADC 介导的效应还包括激活补体系统、通过各种机制触发免疫效应细胞浸润肿瘤部位等 [11]。
mAbs 有 2 个介导抗原识别的抗原结合片段 ( 也被称为 Fabs) 和 1 个介导抗体与免疫系统效应细胞相互作用的恒定片段 ( 即 Fc 片段 )。Fc 片段中包含与 FcRn 结合的结合域,用以调节抗体在血液中的半衰期 [12]。ADC 中的 mAbs 通常需具备以下特性 [13] :①较小的免疫原性,通常选择人源化或全人源化的抗体 ;②靶向特异性 ( 具有足够的抗原特异性和亲和力 ) 和高效的细胞内化能力 ;③循环半衰期长。
ADC 开发的主要问题是要确定和验证 mAbs 所对应的抗原靶标,在抗原选择中需要考虑以下几个因素 [14]。首先,目标抗原应表达于细胞表面,以便ADC-靶抗原复合物能顺利内化并在细胞内释药;其次,理想的目标抗原应在目标细胞表面均匀表达,但在健康组织中表达量较低 ;最后,目标抗原的脱落应尽量少,以防止游离抗原在血液循环中与mAbs 结合,导致 ADC 失效。目前国内外处于临床研究的 ADC 靶标很多,主要分为血液肿瘤靶标和实体瘤靶标。例如,已批准用于白血病的靶标有CD22、CD30、CD33 等,用于实体瘤的有人表皮生长因子受体 -2(HER2)、连接蛋白 -4(nectin-4)、前列腺特异性膜抗原 (PSMA)、表皮生长因子受体(EGFR) 等 [15]。
细胞毒药物是 ADC 的最终效应成分,适于制备 ADC 的药物通常须具备以下特征 [16] :①作用机制明确 ;②具有极强的细胞毒性 ( IC50 在纳摩尔级以下 ) ;③可被直接修饰,或结构改造后具有可连接基团且生物活性不受影响 ;④在 mAbs 溶液中能稳定存在并充分溶解。
目前临床应用最多的细胞毒药物根据其作用机制可分为三大类 [17]。① DNA 损伤剂 :卡奇霉素类(calicheamicins,CLM)、多柔比星 (doxorubicin,DOX)、倍癌霉素 (duocarmycins)、吡咯并苯二氮䓬类 (pyrrolobenzodiazepines,PBDs) 等,这些药物通过与 DNA 双螺旋小沟结合,导致 DNA 裂解和细胞凋亡。②微管蛋白抑制剂:美登素类 (maytansines)和澳瑞他汀 (auristatins) 等,通过与微管结合而阻止微管的聚合、阻滞细胞周期,继而诱导细胞凋亡。③拓扑异构酶抑制剂 :喜树碱 (camptothecin,CPT) 及其衍生物,通过调控 DNA 复制中所需的拓扑异构酶,使 DNA 链断裂。
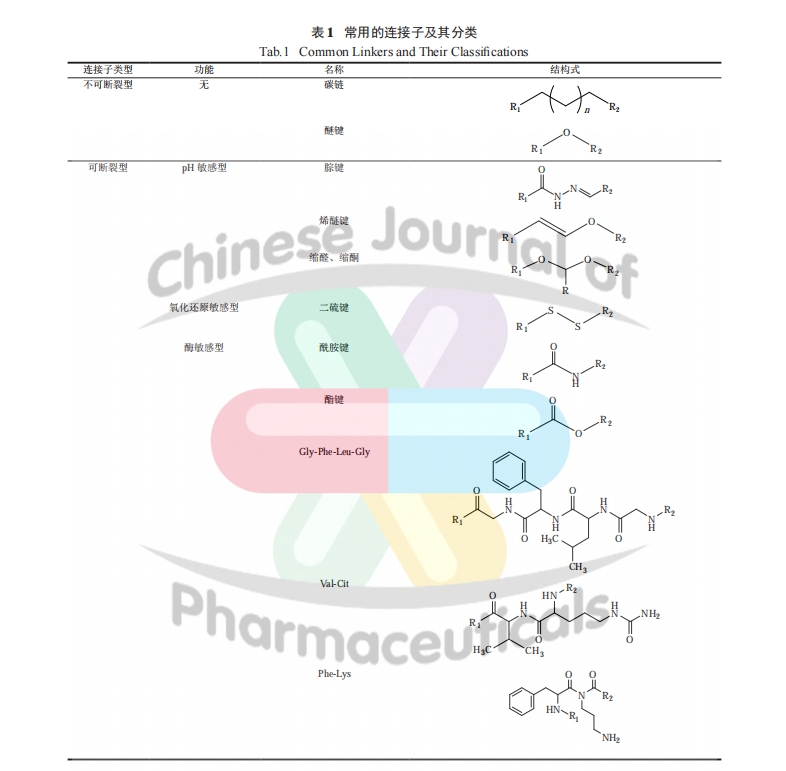
化学连接子的作用是将细胞毒药物与 mAbs 连接,并在体循环中维持 ADC 的稳定性。连接子的化学性质和偶联位点对于 ADC 的稳定性、药动学和药效学特性及治疗窗等方面具有至关重要的作用。连接子的特性应包括 [18] :①足够的稳定性,使 ADC 能在血流中循环并定位到靶部位,不会过早断裂而导致非特异性毒性 ;②能在内化过程中迅速断裂,释放细胞毒药物。

尽管 ADC 药物的研发已取得较大突破,但仍存在以下问题 :①抗体的载药率 (drug-to-antibody ratio,DAR) 问题,目前得到的均是含有不同 DAR值 ( 0 ~ 8) 的多种成分混合物,一般 DAR 为 3 ~4 较合适,DAR>4 会出现较低的耐受性、较高的血浆清除率和较低的体内功效 ;②目前得到的通常是偶联位置与数目不定的混合物,未能完全实现定点偶联,药物剂量的确定及体内药动学研究存在困难 ;③可断裂型连接子在血液中提前断开,而细胞毒药物没有选择性,故存在严重的肝毒性等不良反应,导致治疗窗较窄;④ ADC 的组织穿透能力有限,导致在实体瘤治疗中存在一定困难,要考虑抗体的小型化问题等。
2 多肽 - 药物偶联物 (PDC)
PDC 的设计原理与 ADC 类似,主要用于药物递送和肿瘤靶向,不同之处在于 ADC 中的抗体成分被可作为靶向配体的多肽分子所取代。与 ADC相比,PDC 具有诸多优势 :通常比生物药物制剂容易制备、成本较低且大多数无免疫原性,不易引起自身免疫反应 [27]。PDC 的合成、贮存和质控相对容易,体内外稳定性更好,且因 PDC 相对分子质量小,有更好的血管、组织和细胞的通透性,易渗透到肿瘤深处 [28]。值得注意的是,由于肾小球的滤过作用,PDC 从血中清除的速度快于 ADC,减少了 PDC 途径靶部位的循环频次,可能会影响其靶向效率 [29]。
2.1 基本组成
2.1.1 多肽近年来随着蛋白质组学、噬菌体展示和多肽固相合成等技术的快速发展,越来越多的新型多肽被发现或被合理设计,极大地促进了 PDC 的发展。PDC 中的靶向多肽分子需要与对应靶标具有纳摩尔级的亲和能力 (结合常数小于 10–9 mol/L)[30],从而获得良好的选择性,以减少全身给药时造成的非特异性分布与毒性 [31]。
用于 PDC 的多肽分子一般可分为细胞穿透肽 (cell penetrating peptides,CPPs) 和细胞靶向肽(cell targeting peptides,CTPs),前者能跨越细胞膜转运药物,后者能特异性地与靶细胞上的受体结合。PDC 的肽段易被消化道酶降解,故常用非胃肠道途径给药 ;PDC 经循环系统转运并透过毛细血管壁到达靶细胞。对于 CPP- 药物偶联物而言,跨膜转运是一个与能量无关的过程,它可直接穿过脂质双分子层 ;此外有文献报道,CPP- 药物偶联物可通过转运作用或受体介导的与能量无关的非内吞转运途径进入细胞 [32]。常用 CPPs 有 [33] :转录反式激活因子 (trans-activator of transcription,TAT)、transportan、penetratin 及其衍生物或其他具有穿膜能力的肽。CTP- 药物偶联物的跨膜转运依赖于肽与其受体结合介导的内吞作用,在此过程中偶联物通过早期和晚期核内体最终进入溶酶体,而受体再通过胞内循环回到细胞膜表面。常用 CTPs 包括精氨酸 - 甘氨酸 - 门冬氨酸 (RGD) 恒定系列肽、黄体生成素释放激素 (LHRH) 类似肽、通过噬菌体展示技术筛选出来的新型肿瘤靶向肽等 [34]。
用于 PDC 偶联的细胞毒药物通常是经典的化疗药物,如紫杉醇 (paclitaxel,PTX)、DOX、CTP 等,它们通过干扰或阻断细胞增殖过程而发挥抗肿瘤作用,但因选择性不高、对肿瘤靶向能力差,易导致正常细胞和组织的损伤。形成 PDC 后可提高这些药物对肿瘤组织的靶向性、减少在正常组织中的分布,从而减轻不良反应、抑制多重耐药 [35]。
连接子是连接多肽和药物的有效桥梁,一个好的连接子不会影响多肽或药物的功能,低分子、适当长度、合适的稳定性和极性是理想连接子的关键因素。与 ADC 类似,PDC 连接子分为不可断裂型和可断裂型 ( 见表 1),通过采用不同的连接子,可调节药物的释放,降低潜在不良反应的风险。

尽管 PDC 具有明显的临床应用优势,但目前仍无用于化疗的 PDC 获批上市。就现有数据而言,PDC 应用于临床可能存在的障碍包括 :① PDC 的相对分子质量较小,在体内易被清除,导致全身给药时疗效不理想 ;② PDC 分子中的肽序列由 L 型氨基酸构建,易被血中的酶降解而导致 PDC 的靶向性能被弱化 ;③ PDC 携带药物的容量和跨越多个生理屏障的有效性有待提高,肿瘤细胞对 PDC的应答率也有待深入研究。
3 核酸适体 - 药物偶联物 (ApDC)

DNA 是一种生物大分子,可通过碱基对自组装成双螺旋结构,通过氢键、π-π 堆积和疏水相互作用保持稳定 [69],故可通过简单的杂交和插层来实现药物的引入。cell-SELEX 的核心原理是在对靶分子特征未知的情况下,筛选得到可识别肿瘤细胞的核酸适体,直接用于肿瘤的诊断与治疗。YOON等利用这一特性,筛选得到一种可靶向胰腺导管腺癌的核酸适体 P19,并证明其靶向和递送吉西他滨、氟尿嘧啶 (FU) 和美登素衍生物 DM1 的能力。这些化疗药先与短寡核苷酸结合,然后通过杂交与核酸适体结合,生成的 ApDC 可将细胞毒药物特异性地递送至肿瘤细胞,减少非特异性不良反应 [70]。DOX 是一种常用的广谱抗肿瘤药,具有一个平面四环结构,可嵌入 DNA 中的碱基片段 ( 特别是 CG或 GC 碱基对 ) 中,抑制 DNA 的复制过程 [71]。根据 DOX 能嵌入核酸结构这一特性,可将 DOX 嵌入富含 CG、GC 序列的核酸适体中,用于 DOX 靶向递送。核酸适体 A10 是由 71 个核苷酸组成的单链 RNA,可与人前列腺癌细胞表面过表达的 PSMA蛋白特异性结合。BAGALKOT 等通过非共价相互作用将 DOX 嵌入 A10 的三维结构中得到了 A10-DOX 偶联物,可将 DOX 靶向输送到 PSMA 过表达的人前列腺癌细胞。鉴于 A10 与 DOX 通过非共价方式结合,A10 和 DOX 均可保持高生物活性,不影响各自功效的发挥 [72]。为了提高药物递送效率,ZHU 等通过杂交链式反应,在核酸适体分子的 5'端修饰了 1 个由几乎 100%药物插入位点组成的长双链 DNA,其工作原理类似于将核酸适体作为引导纳米列车驶向目标肿瘤细胞的火车头,同时串联“车箱”作为药物的高效载体,将药物源源不断地运送到靶细胞,发挥选择性细胞毒性效果 [73],显示出理想的抗肿瘤疗效,并减轻了不良反应,具有良好的应用前景。
虽然通过非共价结合形成 ApDC 的制备方法比较简单,但许多药物并不能有效嵌入核酸适体中,而且药物的嵌入可能会改变核酸适体的结构,从而影响核酸适体与靶标的特异性结合。因此,除了非共价结合外,共价结合也被广泛用于开发更稳定、更具位点特异性修饰潜力的 ApDC。在核酸适体与药物结合的过程中,通过设计不同的连接子可使药物在特定的组织或亚细胞器中释放。例如,将化疗药 DOX 与 DNA 核酸适体 sgc8( 可与急性淋巴细胞白血病 T 淋巴细胞表面过表达的 PTK7 特异性结合 ) 相连形成 ApDC,利用酸不稳定的腙键作为连接子,可在酸性肿瘤环境、酸性核内体或溶酶体中释放 DOX,抑制肿瘤生长 [74]。LI 等报道一种组织蛋白酶 B 敏感的核蛋白适体 (NucA) -PTX 偶联物可选择性地将 PTX 递送到肿瘤部位,显著提高了PTX 的抗肿瘤活性并降低其非特异性毒性 [75]。利用对组织蛋白酶 B 敏感的 VC 二肽键将 NucA 连接到 PTX 的 2' 位活性羟基上,得到的无活性 NucAPTX 偶联物在体循环中能保持稳定。该偶联物上的NucA 可促进其在肿瘤组织中的积累 ;进入肿瘤细胞后,NucA-PTX 偶联物的二肽连接子被酶解,释放出 PTX 并发挥作用。最近,HE 等将核仁素特异性核酸适体 AS1411 与雷公藤甲素进行偶联,所得偶联物能特异性识别肿瘤细胞,并在肿瘤细胞内GSH 的激活下触发一系列生物正交反应,原位、自循环产生碳中心自由基 [76]。同时,该偶联物的激活能显著降低肿瘤细胞内 GSH 的含量、同时增加游离二价铁的含量,产生协同的化学动力学疗法效应。该偶联物对人乳腺癌细胞 (MDA-MB-231) 具有强特异性和高细胞毒性,体内抗三阴性乳腺癌的效果好、对健康组织的不良反应小,为肿瘤靶向递药系统的设计和自由基相关分子机制的研究提供了新见解。
尽管核酸适体有诸多优良特性,研究也证明了 ApDC 在肿瘤治疗领域的应用潜力,然而针对靶向治疗的核酸适体或 ApDC 的开发仍较为滞后。迄今为止,只有一种以核酸适体为基础的药物pegaptanib[ 商品名 Macugen,一种聚乙二醇 (PEG)化抗 VEGF 核酸适体,用于治疗老年性黄斑变性 ]获得美国 FDA 批准上市 [ 77] ;用于肿瘤治疗的核酸适体 AS1411 目前处在Ⅱ期临床研究中 [78]。ApDC从实验室走向临床还需克服一系列难题,如核酸适体筛选过程较长,成功率还较低 ;核酸适体和ApDC 的稳定性较差,在体内易被普遍存在的核酸酶降解,体内半衰期较短,还须经一定的化学修饰才能用于临床 ;免疫系统对核酸的识别可能引发免疫反应等。
4 聚合物 - 药物偶联物
聚合物 - 药物偶联物是由一种或多种药物通过共价结合连接到聚合物上而构成的具有药理活性的大分子结构,其中的药物可以是小分子药物,也可以是多肽、蛋白质或核酸适体 [79]。药物与聚合物的结合有多种益处,包括增加药物的溶解度、控制释药速度、提高药效和改善药代动力学行为等 [80]。近年来,随着聚合物偶联技术的日渐成熟,越来越多的聚合物 - 药物偶联物进入了临床研究,显示出良好的发展前景。
聚合物 - 药物共价偶联物的概念最早由RINGSDORF 教授于 1975 年提出,他将其称为合成聚合物药物或药理活性聚合物 [81]。它是药物与聚合物主链通过不稳定键连接形成的,由 1 个聚合物主干和 3 个不同的单元组成:第一个是亲水区域,使整个大分子可溶和无毒 ;第二个是药物与聚合物链连接的区域,药物通常通过连接子 ( 如联氨、偶氮、肽、二硫键等 ) 结合到聚合物主链上,而连接子在特定条件下会断裂,使药物从聚合物载体中释放,所使用的连接子类型会影响药物偶联到载体上的比例、药物稳定性和药物释放机制 ;第三个是实现靶向运输的区域,其功能是将整个聚合物体系递送到目标细胞或发挥药理作用,与目前研究中广泛应用的靶向配体概念相似。通过对大分子聚合物链的不同区域进行不同的设计可实现不同的功能。
目前可用于药物递送的聚合物主要包括 [82] :①聚氨基酸衍生物,如聚 L- 赖氨酸 (PLL)、聚 L-谷氨酸 (PGA)、明胶、聚 [N-(2- 羟乙基 -L- 谷氨酰胺 )](PHEG) 和聚门冬氨酸 (PASP) 等 ;②多元酸,如聚 α 苹果酸 (poly-α-malic acid,PAMA)、聚 β苹果酸 (poly-β-malic acid,PBMA) ;③多糖,如葡聚糖、普鲁兰多糖、透明质酸、壳聚糖 ;④其他,如 N-(2- 羟丙基 ) 甲基丙烯酰胺 (HPMA) 共聚物和PEG 等。一些报道着重于将蒽环类、铂类和紫杉烷类等小分子化疗药偶联到聚合物上。广泛用于药物直接偶联或通过连接子与聚合物链偶联的官能团有氨基、羧基、羟基和巯基等 [83]。聚合物 - 药物偶联物可分为聚合物 - 大分子偶联物、聚合物 - 小分子偶联物、树枝状大分子和聚合物纳米粒 [84],本文主要关注可用于肿瘤治疗的聚合物 - 药物偶联物前药。

PGA-PTX(Opaxio,原名 Xyotax) 因其显著的抗肿瘤作用而被广泛研究。单次静脉注射给药后可完全消除小鼠乳腺癌,与未偶联的 PTX 相比,该偶联物的最大耐受量增加了 2 倍,肿瘤蓄积量增加了 12 倍。与单次静脉注射相比,多次注射该偶联物具有相似的疗效,表明长循环药物偶联物 ( 如PGA-PTX) 以最高剂量单次给药比多次给药效果更好 [102]。但是,在卵巢癌患者的Ⅱ期临床试验中,该偶联物的应答率仅为 10% (10/99),中位生存期为 2 个月 [103] ;在非小细胞肺癌患者的Ⅲ期临床研究中,该偶联物组患者的生存率与对照组相当,与晚期非小细胞肺癌一线治疗方案 PTX/ 卡铂相比,PGA-PTX/ 卡铂无法提供更佳的生存期 [104]。尽管PGA-PTX 改善了 PTX 的溶解度及安全性,但在临床抗肿瘤功效方面的改进仍然有限。
细胞毒药物伊立替康的四臂 PEG 偶联物(Onzeald) 已进入Ⅲ期临床试验。Onzeald 利用可裂解的酯键在每个 PEG 臂上结合 1 个伊立替康分子,相对分子质量为 20 000 ;在体内,酯键缓慢水解释放出伊立替康,随后代谢成活性抗肿瘤成分SN-38[105]。在动物模型中,与传统的伊立替康相比,Onzeald 表现出延长的循环半衰期、在血浆和肿瘤中稳定的浓度和高达 400 倍的血浆暴露 (AUC)。与伊立替康相比,使用 Onzeald 后肿瘤中的 cmax 增大了 10 倍,而血浆中的 cmax 却降低了,提示其治疗指数更具优势,故给予 Onzeald 可导致持续数周的肿瘤抑制和肿瘤消退。在Ⅰ期临床试验中,Onzeald证实了类似的药代动力学特征,SN38 表现出 50 d的消除半衰期,而伊立替康给药后半衰期只有 12 ~47 h[106]。Onzeald 已完成临床Ⅲ期试验并申请上市,用于治疗伴有脑转移的乳腺癌 [107]。
获批上市的聚合物 - 药物偶联物产品大多是PEG- 蛋白质偶联物,用于治疗丙型肝炎、急性淋巴细胞白血病和类风湿关节炎等 [80]。相比之下,小分子药物的聚合物偶联物的临床应用一直很有限,目前只有 PEG- 纳洛酮偶联物 ( 商品名Movantik) 成功进入市场,用于治疗慢性疼痛患者阿片类药物引起的便秘 [ 108]。尽管一些聚合物偶联物已证明可延长半衰期和降低毒性,但在抗肿瘤功效方面的改进仍然有限。抗肿瘤聚合物疗法的临床前疗效在很大程度上归因于 EPR 效应介导的肿瘤积累,但人类肿瘤中的被动积累目前是一个颇受争议的话题。例如,37 例接受 PK1 治疗并进行Ⅰ期和Ⅱ期临床试验评估的患者中,只有 8 例通过放射性核素成像显示出肿瘤摄取 [ 109]。临床前研究和患者数据之间出现差距的原因可能是小鼠模型不能准确地反映人类肿瘤的特点,小鼠肿瘤的快速生长导致不规则的血管形成和血管渗漏,但并不是所有人类肿瘤血管都有渗漏。近期一项研究结果表明,通过 EPR 效应介导的肿瘤药物载体蓄积试验中,只有 0.7%静脉注射剂量的药物到达肿瘤 [110],这提示 :即使在临床前模型中表现出被动积累效果的药物载体,其向肿瘤部位递送的药量也是不足的。然而研究者并没有对类似小分子药物的肿瘤定位进行分析,从而混淆了药物载体和小分子药物在肿瘤部位的蓄积效果。因此,未来需要仔细选取患者,以便确认哪些患者能受益于所设定的疗法 [111],或者开发增加聚合物载体肿瘤蓄积的方法 ( 如引入靶向配体等 )[112],同时必须对药代动力学和生物分布进行完整的临床前评估,以确保所选择的连接子在体内具有足够的稳定性,保证药物的有效递送。
5 总结与展望
本文主要介绍了抗体、多肽、核酸适体和聚合物与药物的偶联物在介导药物靶向递送中的应用,就目前研究及临床试验结果而言,它们均有良好的应用前景,部分产品已在临床应用中取得了良好的治疗效果,为患者带来了较大益处,但同时也存在着一些棘手的问题,诸如不良反应、耐药性、费用昂贵及缺少较好的肿瘤标记物等。首先,靶向治疗虽然能提高药物在肿瘤部位的蓄积,但在正常组织中的分布仍不可避免,导致产生不良反应。例如,Kadcyla 的不良反应虽然比化疗显著减轻,但仍存在恶心、呕吐、血小板减少、肌肉骨骼疼痛以及肝毒性等不良反应,导致患者用药顺应性较差。其次,与传统化疗药物一样,靶向治疗也存在耐药问题,肿瘤细胞表面高表达的药物外排蛋白,可促进药物外排,且在肿瘤发生发展过程中可能出现复杂的突变来促进肿瘤的生长,使靶向药物失去作用。第三,肿瘤靶向治疗的花费较昂贵,尤其是抗体类药物,且在治疗过程中还包括一些其他费用,在很大程度上增加了政府及患者的经济负担。最后,由于肿瘤的复杂性及异质性,导致不同肿瘤患者的疗效存在差异,需要进一步寻找可能预测患者疗效的肿瘤标记物,进而筛选出最适合靶向治疗的患者,实现精准治疗。相信随着生物医药科技的进步和靶向递药理论的完善,将会促进更为合理有效的靶向药物的临床转化,为广大肿瘤患者的治疗带来福音。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。