
[摘 要] 目的:探讨靶向融合肽IL-4Rα-lytic对卡波西肉瘤相关疱疹病毒(KSHV)阳性原发性渗出性淋巴瘤(PEL)细胞的体内外杀伤作用及其安全性。方法:应用 MTT 法检测 IL-4Rα -lytic 对 KSHV 阳性PEL细胞BCBL-1和BCP-1的杀伤能力。通过FCM检测IL-4Rα-lytic 诱导 KSHV 阳性 PEL 细胞凋亡的情况。建立 BCBL-1 细胞小鼠移植瘤模型,连续3周(3次/周)腹腔注射IL-4Rα-lytic后,通过活体生物发光成像技术评估IL-4Rα-lytic对小鼠体内BCBL-1细胞移植瘤的抑制效果,并通过H-E染色和全血分析法检测其毒副作用。结果:靶向融合肽IL-4Rα-lytic在体外对两种KSHV阳性PEL细胞BCBL-1和BCP-1均有选择性杀伤作用(均 P<0.01),并且可以在短时间内发挥杀伤作用(均 P<0.01)。靶向融合肽 IL-4Rα-lytic 可诱导 KSHV 阳性 PEL 细胞BCBL-1和BCP-1凋亡(均P<0.05)。靶向融合肽IL-4Rα-lytic显著抑制BCBL-1细胞小鼠移植瘤的生长,与对照组比较差异具有统计学意义(P<0.05),并且无明显的器官毒性(均P>0.05),同时不会造成体质量异常(P>0.05)。结论:靶向融合肽IL-4Rα-lytic在体内外均显著抑制KSHV阳性PEL细胞的生长,且无明显毒副作用,有望为PEL的治疗提供一种新的治疗方案。
原发性渗出性淋巴瘤(primary effusion lymphoma,PEL)是一种罕见的霍奇金淋巴瘤,主要表现为腹水、胸腔积液和心包积液等[1-2]。PEL的恶性程度高,常规化疗药物治疗效果不佳,预后极差,患者中位生存期少于6个月[3-4],因此亟待研发安全有效的治疗手段。PEL通常与卡波西肉 瘤 相 关 疱 疹 病 毒(Kaposisarcoma-associated herpesvirus,KSHV)感染相关[5-9]。本课题组前期的研究结果[10-11]显示,处于KSHV感染潜伏期的 PEL 细胞均不同程度地过表达 IL-4Rα,而KSHV 阴性细胞则不表达或低表达 IL-4Rα;过表达IL-4Rα引起JAK1-PI3K-Akt信号通路的组成型激活,从而促进潜伏期肿瘤的生长。研究结果[12-13]发现,IL-4R高表达与多种类型恶性肿瘤相关,并在以其为治疗靶点的研究中观察到药物对肿瘤长期、持续的疗效。上述研究结果均提示,IL-4Rα可能是KSHV阳性PEL的潜在治疗靶点。利用带负电的膜磷脂酰丝氨酸在多数肿瘤与正常细胞细胞膜上表达水平的差异,PAPO等[14]合成非对映体裂解肽(包含D-和L-形式的亮氨酸和赖氨酸等15个氨基酸),并发现此裂解肽能够因癌细胞表面酸性成分的静电吸引而具有一定的细胞选择性,随后通过类似阳离子抗菌肽的工作原理裂解细胞膜。KOHNO等[15]在此基础上,通过优化氨基酸序列设计了裂解肽 Lytic,减少了对正常细胞的杀 伤 。之 后 ,YANG 等[16]设 计 的靶向融合肽IL-4Rα-lytic 含 有 靶 向 IL-4Rα 的 靶 向 肽和裂解肽Lytic 两个片段,可特异地靶向多种类型表达IL-4Rα受体的肿瘤细胞(如胰腺癌、乳腺癌等细胞)。本研究旨在检测靶向融合肽IL-4Rα-lytic对KSHV阳性PEL细胞的体内外杀伤效果,并分析其安全性,为PEL的治疗提供新的思路和理论基础。
1 材料与方法
人B细胞淋巴瘤细胞系BCBL-1、BCP-1和BJAB由本室保存,荧光素酶标记的BCBL-1细胞为本实验室前期构建[17]。所有细胞均采用含10%胎牛血清的RPMI 1640 培养基,于 37 ℃、5%CO2的培养箱中培养。6周龄、体质量20 g左右的雌性NOD/SCID小鼠购自维通达生物技术有限公司(实验动物合格证号:20210402Abzz0619000685)。CCK-8 试剂盒购自上海碧云天生物技术有限公司,AnnexinⅤ-APC/PI试剂盒购自 BD Biosciences 公司。IVIS Spectrum 活体光学成像系统购自美国珀金埃尔默公司,荧光素底物购自翌圣生物科技股份有限公司,正倒置一体荧光显微镜购自美国ECHO公司,pocH-100i全自动血液分析仪购自日本希森美康公司。组织切片和H-E染色由武汉赛维尔生物科技有限公司完成。
IL-4Rα-lytic 和 Lytic多肽均用固态合成法合成(纯度>95%),并经过质谱分析验证。多肽溶解在 PBS(pH=7.4)中。IL-4Rα-lytic: KQLIRFLKRLDRNGGGKL-l-LK-l-L-kk-LLK-l-LKKK(小写的氨基酸为D型氨基酸);Lytic:KL-l-LK-l-L-kk-LLK-l-LKKK(小写的氨基酸为D型氨基酸)。
将密度为 5×105个/mL 的 KSHV 相关细胞(包括KSHV阳性PEL细胞BCBL-1、BCP-1和KSHV 阴性细胞BJAB)悬液接种于96孔板(50 µL/孔),然后加入2.5、5、10或20µmol/L的IL-4Rα-lytic或Lytic溶液(50 µL/孔),于 37 ℃、5%CO2条件下培养2 h后,每孔加入CCK-8试剂10 µL,通过酶标仪检测450 nm波长处各孔细胞的光密度(D)值,并计算细胞存活率(细胞存活率=实验组D450/对照组D450×100%)。实验重复3次。
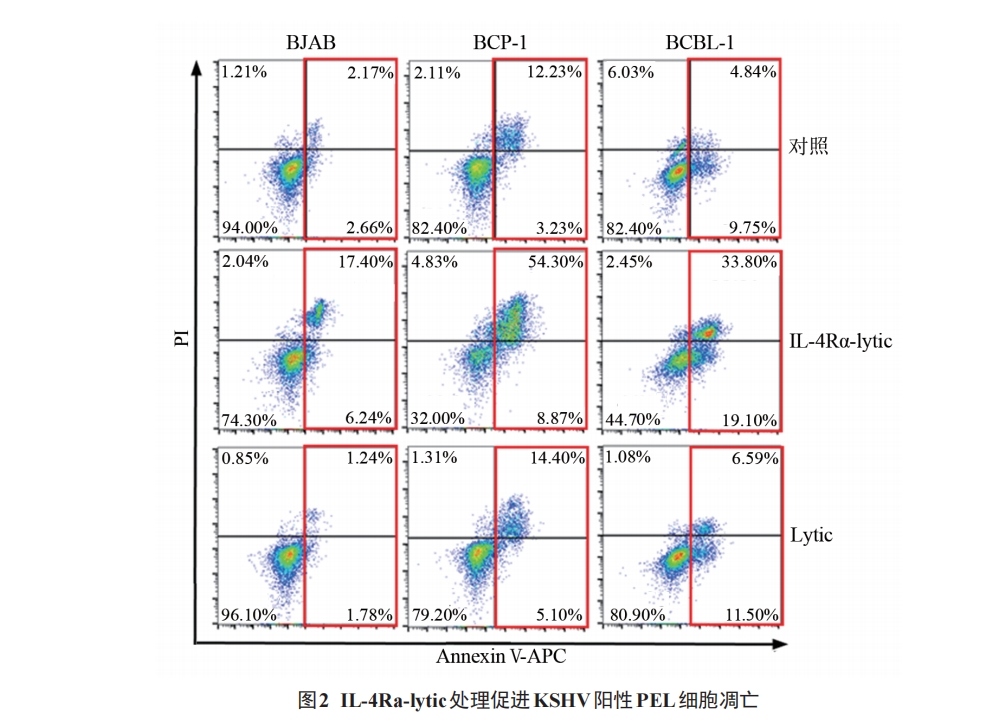
将 密 度 为 1×106 个/mL 的 BCBL-1、BCP-1 和BJAB 细胞置于 12 孔板中,分别加入 IL-4Rα-lytic 和Lytic 溶液(终浓度均为 5 µmol/L),同时对照组加入等体积培养基,37 ℃下处理2 h。离心、冷染色缓冲液洗涤后,用 100 µL 结合缓冲液重悬细胞。每管依次加入 0.5 µL Annexin Ⅴ-APC 和 1 µL PI,室温下避光 15 min,加 400 µL 结合缓冲液,混匀,上机检测细胞的凋亡情况。实验重复3次。
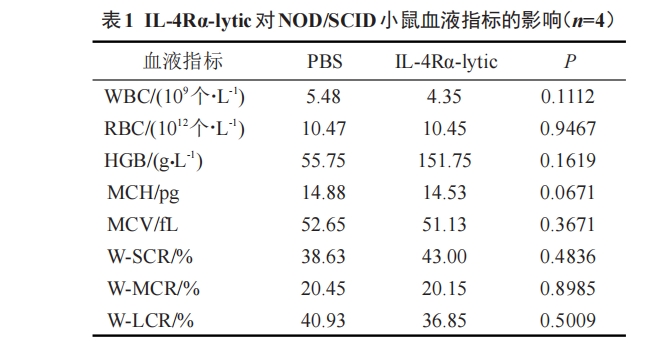
将荧光素酶标记的 BCBL-1 细胞经腹腔注射至NOD/SCID小鼠体内(注射剂量为1×107个细胞/只),建立小鼠异种移植模型。细胞植入后第9天,小鼠腹腔注射荧光素底物(150 mg/kg),利用活体生物发光成像技术检测小鼠体内肿瘤的生长情况。随后,将具有相似信号强度的荷瘤小鼠随机分成 PBS 组(对照组)和 IL-4Rα-lytic 组(4 只/组),经腹腔分别注射PBS 和 IL-4Rα-lytic(5 mg/kg),每周 3 次,连续 3 周。在药物治疗过程中,每 2~3 d 称量一次小鼠体质量。3周后,再次进行活体光学成像检测移植瘤的大小,然后经尾静脉取血,用全自动血液分析仪进行血液分析。第 23 天时处死小鼠,切取肺、肝和肾组织标本,经固定、石蜡包埋、H-E染色后,在正倒置一体荧光显微镜下观察并拍照。
采用 GraphPad Prism 6 软件对实验数据进行统计分析,符合正态分布的计量数据以xˉ±s 表示,组间差异比较采用t检验,以P<0.05或P<0.01表示差异有统计学意义。
2 结果
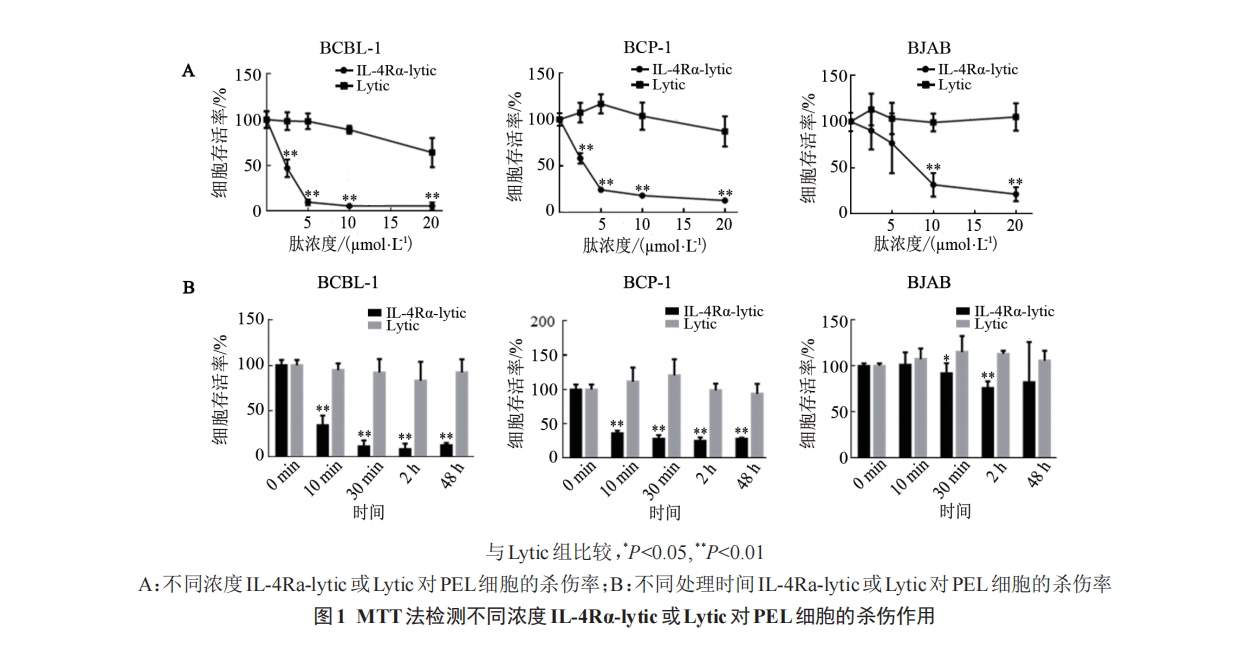
随后,检测了IL-4Rα-lytic不同处理时间的杀伤效果,结果(图 1B)显示,5 µmol/L 的 IL-4Rα-lytic 可在 10 min 内诱导 60% 以上的 KSHV 阳性 PEL 细胞BCBL-1 和 BCP-1 死亡(均 P<0.01),而 5 µmol/L 的Lytic处理相同时间未造成明显的细胞死亡。这一杀伤水平未随着时间增加而增强,提示IL-4Rα-lytic对KSHV阳性PEL细胞的杀伤主要是通过IL-4Rα-lytic穿膜而导致的快速杀伤。
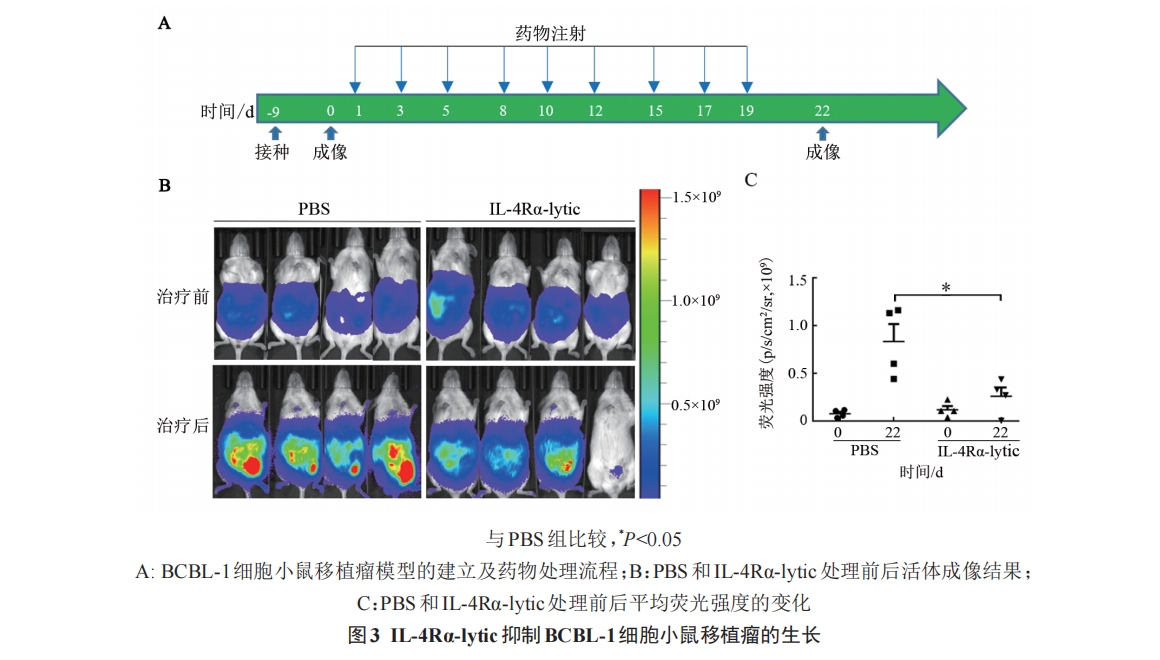
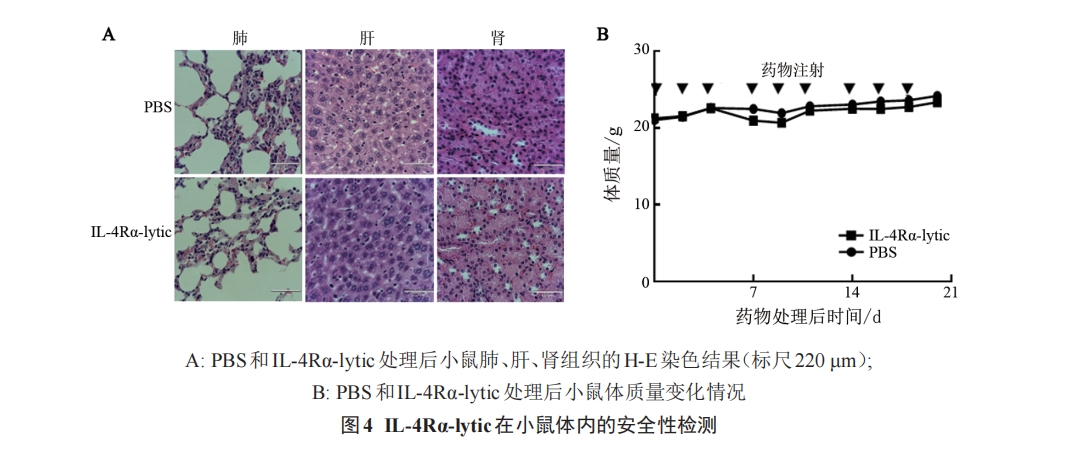
实验结果表明,IL-4Rα-lytic可显著抑制BCBL-1细胞小鼠移植瘤的生长,且无明显的毒副作用。
3 讨 论
PEL恶性程度高、预后较差、长期生存者少,目前主要采用CHOP方案化疗和逆转录病毒治疗法联用进行治疗。但是,常规治疗所用药物在杀伤肿瘤细胞的同时也会对正常细胞产生杀伤,同时肿瘤细胞的耐药性也影响着治疗效果。此外,PEL不常见,临床研究多局限于个案报道,可用的特效药物少,因此研发新型的毒副作用小的靶向治疗药物并探究其作用机制对于治疗PEL意义重大。
总之,本研究提供了一种针对PEL的特异性强、安全性高的靶向融合肽 IL-4Rα-lytic,为进一步的动物实验和PEL的治疗提供了新的思路和实验基础。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。