
摘 要 由于具有与大块固体相迥异的性能 ,贵金属纳米粒子的制备与应用已经成为当前纳米、材料技术领域研究的热点。由于组成成分较多、包含各种活性基团、序列可调 , 并且很多多肽可生物降解、生物兼容、具有生物活性和特异性识别性能 , 多肽在贵金属纳米粒子制备中的应用也越来越受到人们的重视。本文从多肽作为还原剂还原贵金属盐;多肽作为保护剂/调控剂制备不同尺寸/ 形貌的贵金属纳米粒子;多肽作为引导剂规则排列贵金属纳米粒子;多肽作为贵金属纳米粒子组装的模板以及多肽在贵金属表面的吸附、 多肽的自组装和如何获取所需要的多肽序列等几个方面综述了近年来多肽在贵金属纳米粒子制备中的应用。最后简述了利用多肽制备的贵金属纳米粒子在纳米、材料技术领域中的应用 ,并提出了当前该领域中存 在的一些不足及研究展望。
金、银、铂、钯等贵金属纳米粒子( noble metal nanoparticles, NMNPs)由于具有量子限制效应、表面效应和宏观量子隧道效应等特性 ,在光、热、电、 磁、力以及化学方面显示出与大块金属固体显著不同的特性 [1] ,如局部表面等离子共振(LSPR)、表面强化拉曼散射( SERS)和荧光等 ,使其不仅在传统的催化、电子、光学和信息储存领域大有作为 ,还可以用于许多新型的材料领域 ,如传感、图像、光子学和生物医学等 。因此近年来对 NMNPs 制备及应用的研究日益增多 [2—6] 。
NMNPs 的性能受尺寸、形貌和组成的影响很大 [3, 4, 7] , 因此从这三个方面考察对 NMNPs 制备及应用的研究已成为当前纳米、材料技术领域研究的热点 。通过加入能吸附于 NMNPs 表面从而抑制其生长的物质( 保护剂),可以获得尺寸均一、可调的NMNPs [8, 9] ,甚至还能修饰 NMNPs 的表面性能 [10] 。
目前 , 已经实现对 NMNPs 由刚成核不久的几个纳米到上百纳米尺寸范围内的粒径大小控制 [8, 11] 。通过加入能控制 NMNPs 不同晶面相对生长速度的物质(调控剂), 可以调控 NMNPs 的晶体形貌 。从 1996 年 El-Sayed 提出利用聚丙烯酸钠调控Pt NPs 形貌以来 ,从简单的立方体等单晶到二十面体等复杂孪晶 , 有不下十几种形 貌的 NMNPs 见诸报道[2—5, 12—26] 。而对NMNPs 组成的调控通常借助于合金来实现 。此外,NMNPs 的组装也已经引起人们 的重视 [3, 4, 11, 14, 16, 24, 27—32] ,此过程需要能够对其进行精确调控。
常见的 NMNPs 制备方法有物理法( top-down) 和化学法( bottom-up)两种[30] ,前者如蒸发、电弧放电和激光切除等;后者则是采用化学反应的方法 ,利用原子、离子等从头排列进行制备 。化学法通常包 括 :溶液中还原剂还原金属盐、电化学还原、光化学还原、声化学还原和( 水)热分解等 。相比于物理法和其他化学法 , 由于所需条件相对温和 ,无需特制的 实验设备 ,易于操作和便于工业化生产等优点 ,溶液 中还原剂还原金属盐已经成为最被看好的 NMNPs 制备方法 [3] 。常规的制备 NMNPs 用到的还原剂、保护剂和调控剂等化学试剂如 NaBH4 、维生素 C、柠檬 酸、表面活性剂( 如 CTAB、SDS)、各种无机离子( 如 重金属离子、卤素离子)和大分子聚合物( 如聚乙烯 吡咯烷酮)等或具有毒性、环境友好性较差 ,或因活性过强/过弱导致反应不便于调控 ,所以一定程度上 限制了对 NMNPs 的研究和应用 。相比之下 , 由于组成成分较多( 常见的氨基酸就有 20 种)、包含各种活性基团、序列可调、生物兼容 ,而且很多多肽可生 物降解 ,具有生物活性和特异性识别性能 ,利用多肽 制备 NMNPs 就具有非常显著的优势[33] 。因此 ,本文只讨论溶液中还原剂还原金属盐方法制备NMNPs 中多肽所起的作用。
2 多肽在 NMNPs 制备中的应用


由于在 NMNPs 制备过程中 ,多肽还可以起保护剂、调控剂、引导剂或模板等作用 ,所以利用多肽单独做还原剂的情况很少 ,通常情况下是协同其他作用一步反应制备 NMNPs。
要了解多肽在制备 NMNPs 中起保护剂/调控剂 的作用 ,首先要了解多肽与 NMNPs 之间的吸附、结合作用。
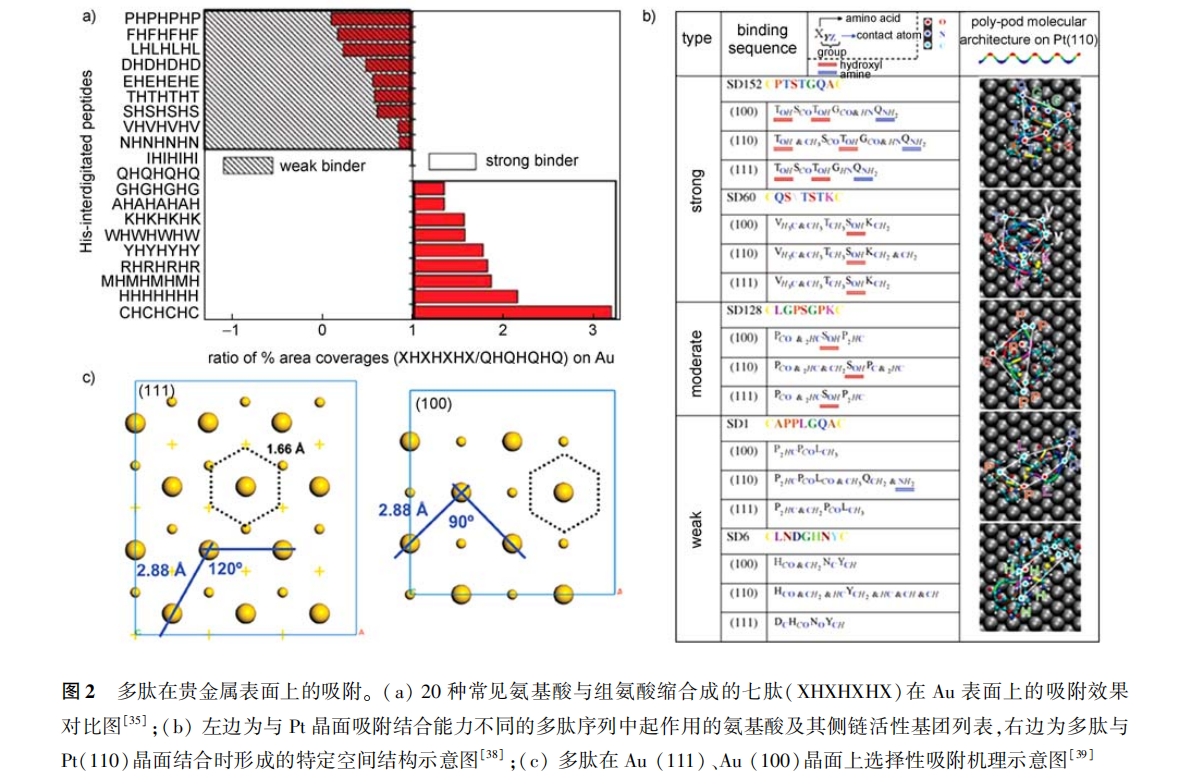
在对多肽在贵金属表面吸附机理考察的过程 中 , 由于相互作用的位点( 如氨基酸侧链的羟基、氨基等与晶面之间的点对点作用)非常小 ,用实验手 段很难检测 , 因此常借助于模拟的 方法进行考 察[38, 39] 。sarikaya 课题组长期致力于研究多肽与 NMNps 之间的相互作用和应用 ,并提出了一个新的 研 究 方 向:分 子 生 物 模 拟( molecular biomime- tics)[38, 40—46] 。借助于分子动力学模 拟( molecular dynamics stimulation),sarikaya 等详细研究了大量七 肽序列与 pt(111)、pt(100)面之间的吸附结合作 用 ,发现:(1)多肽能在 pt 晶面上吸附是由于多肽特 定的空间构象( polypod)能与 pt 晶面结构之间形成 空间匹配 ,而多肽选择性吸附结合于某一晶面是由 于其特定的空间构象能恰好与该晶面空间结构相匹 配的空间特异性;(2)多肽在 pt 晶面吸附能力的强 弱取决于多肽与晶面作用的活性基团数量的多少 , 如羟基、氨基和羧基等极性基团和带电荷基团 [38] ,如图 2b 所示 。借 助于表面等离子共振(SPR), Sarikaya 等考察了多肽在贵金属表面的吸附动力学 [46] , 发 现 多肽在贵金属表面上的吸附遵循 Langmuir 吸附模型 ,并计算出吸附常数、脱附常数、 吸附平衡常数和吸附吉布斯自由能等动力学和热力学参 数;再借助于原子 力显微镜(atomic force microscopy, AFM), Sarikaya 等观 察到 多肽在 Au (111)晶面上的吸附可分为两步 ,第一步是吸附于 Au 表面的多肽分子聚集成核 ,核相互融合形成滤网 状结构;第二步是滤网状结构陈化(ripening)并不断填充空隙 ,铺满整个晶面 [41] 。此外,Naik 等[39] 利用 分子动力学模拟考察了多肽在 Au、Pd 表面上的吸 附 , 同样发现空间匹配在多肽与晶面之间的特异性 吸附结合中起着很重要的作用:由于 Au 属于面心 立方晶体(face-centered cubic, fcc),其(111)晶面上 形成六边形凹槽结构 , 凹槽边长 1. 66括 接近于C—C 和 C C 的键长(分别为 1. 52 和 1. 39括),凹槽角 度 120o接近于 sp2 、sp3 杂化的键角(分别为 120o和 109. 5o)[47] ,而(100)晶面上形成四边形凹槽结构 , 凹槽边长为 2. 88括,角度为 90o。因此相比于(100) 晶面 ,侧链中含有芳香环(如苯环 , 酚环)、sp2 杂化 (如羧基)和 sp3 杂化(如羟基、氨基)结构基团的氨 基酸更容易与(111)晶面形成空间匹配 ,故更容易 吸附于(111)晶面 ,如图 2c 所示 。多肽的这种吸附 相当于晶面的 “ 生长”,故可称之为软外延性生长 (soft epitaxial growth)。
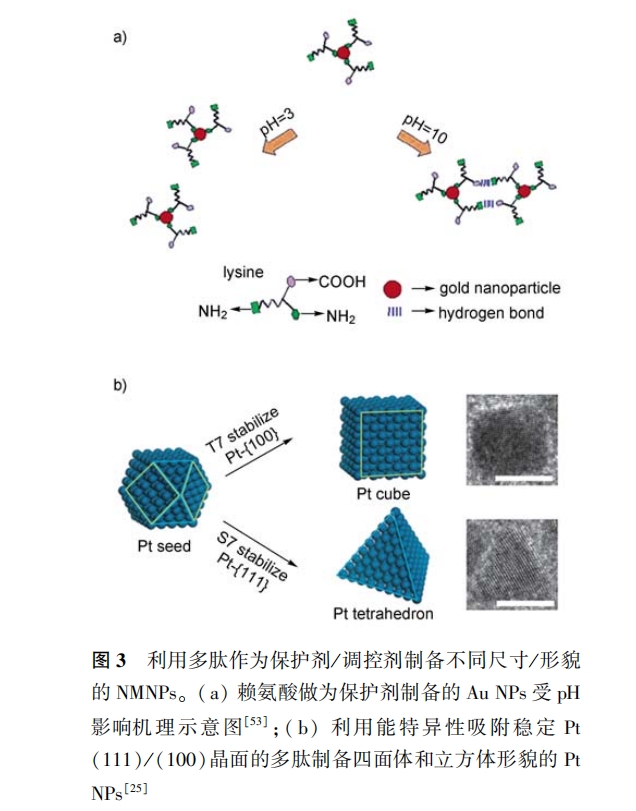
在 2. 2. 1 节中已叙述多肽能够选择性吸附和稳定不同的晶面 。因此 ,可以利用多肽的这一特性调控不同晶面的相对生长速度 ,从而制备出不同形貌 的 NMNPs,这样的多肽称之为调控剂 ,其作用区域 如图 1 中Ⅲ所示。Huang 等[25] 利用能特异性吸附 稳定 Pt(111)、Pt(100)晶 面 的两个 多肽序 列 S7 (SSFPOPN)、T7(TLTTLTN)作为调控剂制备出四面 体(tetrahedron)和立方体(cube) Pt NPs,如图 3b 所 示 。并且通过控制两种调控剂加入的先后顺序 ,可 以实现 Pt NPs 形貌间的相互转化:如先加入 T7 再 加入 S7,可以将 Pt NPs 由原来的立方体结构逐渐生 长为四面体结构 。同时 ,借助于多肽保护剂 P7A 制 备出的 Pt 单孪晶作为晶种,Huang 等[26] 利用 S7 和 T7 制备出(111)-双棱锥(111-bipyramid)和正交双 棱锥(right-bipyramid) Pt NPs。此外,Cha 等[58] 利用 能特异性吸附、稳定 Pt(100) 晶 面的多肽序列 (PWXXQRELSV,X 代表任意氨基酸残基)制备出立 方体 Pt NPs。
值得一提的是 ,通过调整实验条件 ,多肽起保护 剂和调控剂的作用是可以互换的 。在较低浓度时 , 有些对晶面具有选择性吸附的多肽会优先吸附于这 些晶面上 ,从而抑制这些晶面的生长 ,起到调控剂的 作用;但当浓度增大到一定程度时 ,过量的多肽也可 以吸附于其他晶面上 ,抑制所有晶面的生长并稳定NMNPs, 从 而 起 到 保 护 剂 的 作 用 。如 Huang 等 [8, 12, 26] 发现七肽序列 P7A 在较低浓度时(1μg/ ml)能优先吸附并稳定 Pt(111)晶面 ,并在(111)面 上形成 孪晶 , 从而制 备出 三脚 架形貌(tripod ) Pt NPs;而当浓度较高时(50μg/ml),多余的 P7A 就会 吸附于其他晶面上并抑制其生长 , 最终生成只有 1—4 nm 大小、球型形貌的 Pt NPs。另外 ,当 NMNPs 生长速率大于成核速率时 ,较大的晶体尺寸保证各 个晶面能充分表达 ,对某些晶面具有选择性吸附的 多肽会优先吸 附于这些晶面上 , 从而起到调控 NMNPs 形貌的作用;但当 NMNPs 成核速率大于生 长速率时 ,小晶核的各个晶面表达不充分 , 多肽在 NMNPs 上的吸附则不具有特异性 ,从而起到保护剂的作用 。如 cha 等[58] 在考察多肽( PWXXQRELSV) 制备 Pt NPs 中的作用时 ,采用络合常数较高的前驱体(Pt( NH3 )4(NO3 )2 )或弱还原剂(H2 ),就可以得到较大尺寸(7—8 nm)的立方体 Pt NPs;当采用络 合常 数 较 小 的 前 驱 体( K2 Ptcl4 )或 强 还 原 剂 (NaBH4 )时就能得到较小尺寸(1—2 nm)、球型形貌的 Pt NPs。因此在考察多肽作为保护剂/调控剂的作用时 ,对实验条件的控制( 如多肽浓度 ,试剂种 类和配比等)必须要考虑充分。
在对NMNPs 尺寸、形貌和性能研究的同时 ,越来越多的研究重点开始转向对 NMNPs 组装体的研 究上 [3, 4] 。NMNPs 的组装方式通常可分为两种:一 种是单个 NMNPs 规则排列( regular array)成超晶体 结构 [11, 14, 16, 27, 28] ;另一种是 NMNPs 利用模板组装 成特定形貌的低维纳米结构[17, 29—31, 59, 60] 。
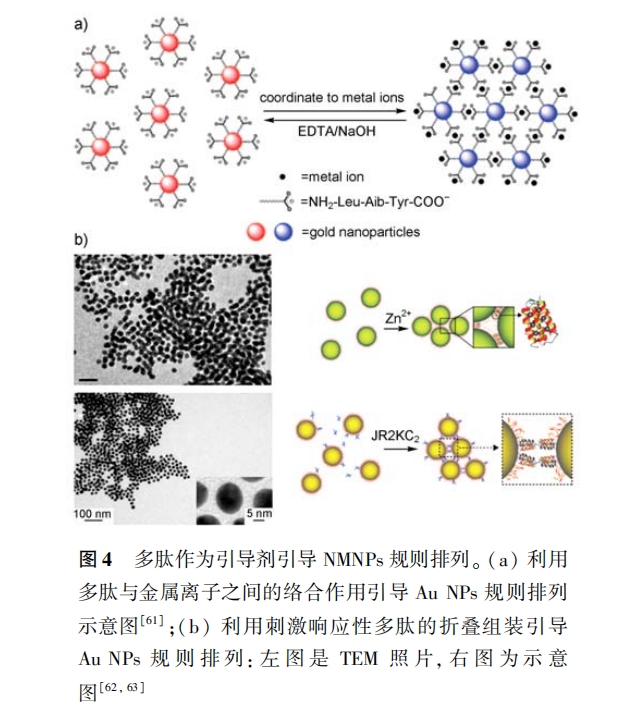
(2)多肽折叠组装:利用刺激响应性多肽作为 引导剂 ,通过引入刺激调控多肽的折叠组装 ,从而引 导 NMNPs 规则排列 。如 Liedberg 等[62] 巧妙地设计 了一含有 42 个氨基酸的多肽序列 JR2Ec,该序列在 酸性或某些金属离子的存在下可以通过二聚作用折 叠为球型四螺旋簇 。利用该序列作为保护剂 ,在中 性条件下可以制备出在 520nm 处存在很强表面等 离子共振( surface plasmon resonance, SPR)峰的 Au NPs;当溶液 pH 降到酸性( < 5 )时, SPR 峰出现红 移 ,表明 Au NPs 发生了聚集;而当 pH 继续降到 3. 5 时 ,多肽的电荷性质由负变为正 ,相互间的静电排斥 作用反而抑制了 Au NPs 的聚集 ,导致 Au NPs 聚集 体解组装, SPR 峰又蓝移回初始波长 。此外 , 引入zn2 + 或 含 有 二硫键的多肽 JR2kC2 , 也能够促使 JR2EC 保护的 Au NPs 聚集;而且这种聚集同样也是 可逆的 ,当加入强络合剂(EDTA)或二硫键裂解剂 (TCEP)时又会解组装成单个的 Au NPs[62, 63] ,如图 4b 所示。
(3)静电吸引作用:knecht 等[64] 利用精氨酸吸 附于柠檬酸稳定的 Au NPs 表面 ,导致 Au NPs 变成 电偶极子 ,从而制备出 Au NPs 线性链 。通过考察温 度、溶剂介电常数和离子强度对制备 Au NPs 线性链 的影响,knecht 等人发现 Au NPs 线性链的制备分 为两步:第一步是 Au NPs 二聚体的形成 ,这一步遵 循二级反应动力学且反应活化能较低;第二步是二 聚体聚集成线性链 , 也是整个制备过程的控制步骤 [65] 。
NMNPs 组装的模板种类有很多 ,但大致可分为 两类:一类是软模板 ,如 CTAB、生物质( 如蛋白质、 细胞骨架、多肽、病毒和 DNA) 等自组装形成的纳米结构 [31, 32] ;另一类是硬模板 ,如碳纳米管等 。由 于具有形貌可调、灵活性较好 ,而且易于在水溶液中 进行等优势 ,软模板已成为更被看好的 NMNPs 组装 模板 , 其中 , 多肽更 以其自身特有的优势而备受瞩目。
利用基因工程技术可以在病毒衣壳上大量表达 能吸附结合 NMNPs 的多肽序列 ,借助于这些多肽序 列可以诱导 NMNPs 以病毒载体为模板组装成低维 规则的纳米结构 [32, 66—68] 。如 Mann 等 [66] 利用烟草 花叶病毒(tobacco mosaic virus)为模板 ,成功地制备 出 Au、Pt 纳米管和离散、线性排列的 Ag NPs。实验 发现 ,烟草花叶病毒管状内壁上谷氨酸、天冬氨酸侧 链的羧基 ,外壁赖氨酸侧链的氨基对组装 NMNPs 的 作用非常关键:在酸性条件下 , 内壁上呈电中性而外 壁上带正电荷 ,所以 Au、Pt 前驱体离子[AuCl4 ] - 和 [PtCl6 ]2 - 会吸附于管外壁 ,经还原成核结晶生长形 成纳米管;而在中性条件下 , 内壁上呈电负性,Ag 前 驱体离子 Ag + 会静电吸附于管内壁并受内壁空间的 限制 ,经光 化学 还原 生长 成离散、线性 排列 的 Ag NPs。
利用基因工程技术改造病毒作为 NMNPs 组装 的模板存在很多缺点:如病毒具有危害性和传染性 , 不适宜大规模利用且生物兼容性差;受病毒形貌和 尺寸的限制 ,组装体调控空间太小;操作复杂等 。相 比之下 ,除了前面已经提到的优势外 , 由于多肽能够 自组装 ,且自组装形貌多样和便于调控等 ,利用多肽 自组 装 体 为 模 板 组 装 NMNPs 就 具 有 很 大 优 势[69, 70] 。

通常 ,利用多肽自组装体为模板组装 NMNPs 有 两种方法:一种是原位组装( in situ),即前驱体离子 先与模板吸附结合 ,然后再以模板为反应位点还原。这种 方 法 是 利 用 多 肽 自 组 装 体 作 为 反 应 器 ( reactor),借助于 NMNPs 在多肽上成核结晶生长从 而达到组装的目的 [91] 。第二种方法是还原后组装 ( post conjugation ), 即 前 驱 体 离 子 先 还 原 生 成 NMNPs,再吸附于模板上聚集组装[68] 。
(1) 静电吸引作用:如果多肽自组装体表面电 荷性质与前驱体离子电荷性质相反 ,则可以通过静 电吸引作用将前驱体离子与多肽自组装体结合 。如 Gazit 等[92] 在利用淀粉样蛋白短肽( NsGAITIG)自 组装纤维为模板制备 NMNPs 纳米纤维时 ,带负电的 Au、Pt 前驱体离子[ Aucl4 ] - 和[Ptcl6 ]2 - 与多肽 N 端带正电荷的氨基之间存在静电吸引作用 ,故能制 备出效果较好的 Au、Pt 纳米纤维;而 Ag 前驱体离子 Ag + 与模板之间存在静电排斥作用 ,故制备出的 Ag 纳米纤维效果较差。
(3) 化学键合作用:前驱体离子可以借助能与 金属形成化学键的基团( 如半胱氨酸侧链上的巯 基)与多肽自组装体结合 。如 Gazit 等[92] 利用半胱 氨酸修饰的淀粉样蛋白短肽自组装纤维为模板成功 地制备出 Au、Pt 纳米纤维 ,并且发现丝氨酸残基对 制备 Au、Pt 纳米纤维也有贡献 , 因此将丝氨酸和半 胱氨酸并列时 , 由于“桥接”( bridge)的作用 ,可以制 备出组装致密的 Au、Pt 纳米纤维 ,而将丝氨酸和半 胱氨酸分开时 ,可以制备出组装相对疏松的 Au、Pt 纳米纤维。
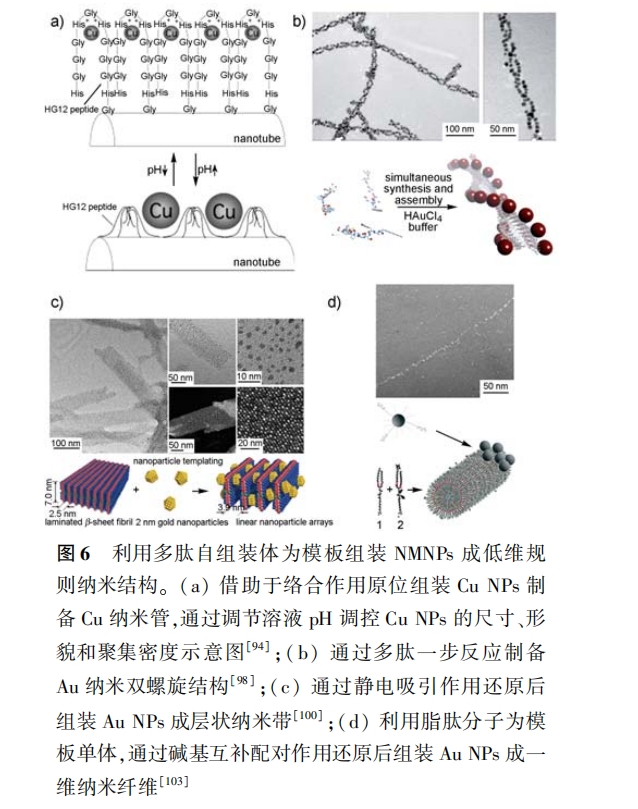
(4)利用多肽一步反应制备 NMNPs 组装体:在 不外加还原剂的情况下 ,利用多肽既能做还原剂又 能自组装的特点 ,一步反应制备 NMNPs 组装纳米体 。这种制备方法的优点在于:反应过程中无需加 入其他试剂 , 简单、高效且影响因素较少 。如 Rosi 等 [98] 借助 HEPEs 缓冲溶液的辅助还原作用 ,利用 脂肽(C 12 -AYssGAPPMPPF)同时做为还原剂、保护 剂和模板单体制备出尺寸、形貌均一的 Au NPs 纳米 双螺旋 ,如图 6b 所示。
在前驱体离子与多肽自组装体之间还存在其他 结合作用可以利用 。如 Gazit 等[29] 利用二肽 FF( F 代表苯丙氨酸)组装纳米管为模板 ,成功地制备出 Ag/肽核 壳 结构的纳 米纤维 , 再利 用 K 蛋白 酶 (proteinase K)降解掉多肽 ,就可以得到无模板的纯 Ag 纳米线;若改用 D 型 FF 自组装体做模板 , 又可 以制备出能抵抗 K 蛋白酶降解的 Ag/肽核壳结构的 纳米纤维 。此外,shelnutt 等[99] 利用 D 型 FF 自组装 纳米管为模板制备出 Pt NPs 镶嵌于管壁的 Pt-肽纳 米管 。但 Ag/肽核壳纳米纤维与 Pt-肽纳米管两种 截然不同组装体的形成机理目前尚不清楚 ,可能与 实验方法、F 中侧链苯环、前驱体离子的电荷性质以 及 FF 自组装成纳米管的机理有关。
(1) 静电吸引作用:NMNPs 通常带负电荷 , 因 此可以利用带正电荷的多肽自组装体为模板 ,通过 静 电 吸 引作用实 现 NMNPs 的还原 后组装 。如 Pochan 等[100] 利用发卡肽(( VK)4 -VPPT-( KV)4 )自 组装层状纳米带为模板 ,借助 Au NPs 与肽链中赖氨 酸侧链氨基之间的静电吸引作用 ,将 Au NPs 组装成 层状纳米带结构;而且夹杂的 Au NPs 将多肽纳米带 的层间距由原来的 2. 5nm 扩撑到 3. 9nm,反过来调 控模板的形貌 ,如图 6c 所示 。此外,Pochan 等[101] 还巧妙地设计了一多肽序列 ,使带正电荷的组氨酸 在其自组装纳米纤维表面能以 5. 47nm 间距均匀分 布 ,利用静电吸引作用将 Au NPs 在纤维表面定向排 列成均匀分散的一维纳米纤维;并且 Au NPs 相互之 间的静电排斥作用保证了纳米纤维都是由单个 Au NPs 排 列 组 成。Tang 等 [86] 以 多 肽( RGYFW AGDYNYF)自组装体为模板 ,利用还原后组装的方 法制备出 Au NPs 双螺旋 ,并且通过调整溶液 pH 可 以将双螺旋变为单螺旋;同时他们还比较了原位组 装和还原后组装制备 Pd NPs 双螺旋的效果 ,发现还 原后组装制得的 Pd NPs 尺寸均一性较差 ,原因可能 是在本体溶液中无法有效避免二次成核的发生。
啶与脂肽自组装纤维表面的胸腺嘧啶之间的碱基配 对作用 ,在有机溶剂( CCl4 )中制备出 Au 纳米纤维 , 如图 6d 所示。
需要指出的是 ,用多肽自组装体为模板制备的 NMNPs 低维规则纳米结构与 NMNPs 定向生长形成 的一维纳米线/纳米棒之间是有本质区别的 :前者是 由单个 NMNPs 聚集而成;而后者是在调控剂的作用 下 ,晶种沿着特定晶面生长形成的具有较大长径比 ( aspect ratio)的单晶( 若晶种是孪晶 , 则一维纳米 线/纳米棒也可能是多晶),如图 1 右端所示。
3 获取制备 NMNPs 所需要的多肽
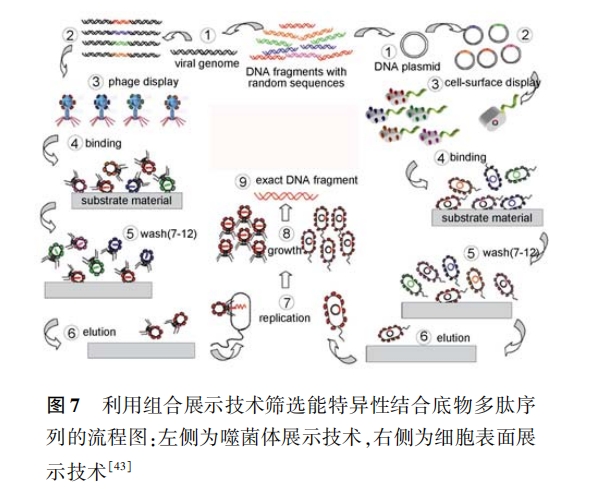
综上所述 ,在 NMNPs 的制备过程中 ,多肽可以 担任很多角色 。因此如何获取所需要的多肽序列就 成为问题的关键。
生物体中存在许多能生物矿化的蛋白质和多 肽 [30, 104] 。将这些蛋白质、多肽提取出来 ,就可以用 于 NMNPs 的制备 。如 Lee 等 [105] 从单细胞绿色普通 小球藻( unicellular green alga chlorella oulgaris)中提 取出能制备 Ag 纳米板的蛋白质 ,详细考察了其中 酪氨酸的还原作用和谷氨酸、天冬氨酸的形貌调控 作用 ,并在此基础上设计合成了可以一步反应制备 Ag 纳米板的三肽( DDY-oMe)。
sio2 表面的多肽序列里富含疏水性( 如色氨酸、苯 丙氨酸和甲硫氨酸)和较大空间位阻的氨基酸( 如 脯氨酸),而较少含有带电荷( 如酸性、碱性氨基酸) 和疏水性较弱的氨基酸( 如甘氨酸)以及半胱氨酸;同时圆二色光谱( circular dichroism, CD)实验证实 高效 的 sio2 结 合 肽 主 要 采 取 聚 脯 氨 酸 Ⅱ 型 (polyproline type Ⅱ) 二级结构 ,而低效的结合肽主 要采取无规卷曲( random coil)结构 。因此,sarikaya 等认为高效的 sio2 结合肽在吸附过程中骨架主要 采取伸展方式紧贴于 sio2 表面 ,从而降低与溶剂水 的接触 ,并且其氨基酸组成和空间结构对其在 sio2 表面的吸附能力影响很大。
由于从生物体和多肽库中获取多肽过程繁琐 , 而且多肽种类繁多 ,对考察结构-性能之间的关系贡 献有限;同时受数据库准确性的限制 ,利用生物信息 学技术所设计多肽的预期性能与实际可能还会存在 偏差 。因此 ,如果清楚多肽组成、结构和性能之间的 关系 , 则可以从头设计所需要的多肽序列 。如在 2. 2. 1 节中已经提到了 willett 等[37] 曾系统考察了 20 种常见氨基酸在几种无机表面的吸附情况 。因 此对于某一 NMNPs,可以依据每个氨基酸在其上的 吸附能力合理的设计所需要的多肽序列 。再如在 2. 1 和 2. 2. 1 节中所述 ,通过详细的考察氨基酸组 成、序列 结构对 多肽还 原、吸附 能力的 影 响, Lee 等 [35] 从头设计了一系列多肽序列 ,可以一步反应制 备出不同尺寸、形貌的 Au NPs。
4 利用多肽制备 NMNPs 在纳米、材料技术中的应用
在引言中 已经提到 , 由于具有特殊的性能 , NMNPs 在很多领域都具有巨大的应用前景 ,而多肽 的引入又让 NMNPs 的应用领域大大拓展。
Naik 等[56] 考察了不同多肽作为保护剂制备的 Pd NPs 对 stille 加成反应( stille coupling)的催化性 能 ,发现不同多肽保护的 Pd NPs 对 stille 加成反应 的催化性能效果迥异 。此外 ,该课题组还利用这些 多肽杂化成一条既做还原剂又做保护剂的杂化肽 FlgA3,可以一步反应制备出 Au/Pd 核壳结构 NPs;与 Pd NPs 相比 ,这些 Au/Pd 核壳结构 NPs 对不饱 和醇加氢反应具有非常高的催化活性 [55, 57] 。因此 可以通过调控多肽保护剂的序列来调控 NMNPs 的 的催化性能。
Matsui 等 [97] 利用多肽自组装纳米管为模板 ,通 过调控溶液 pH,制备出由不同尺寸 Ni NPs 组装成 的纳米线并考察了其磁性性能 。实验发现:Ni NPs 尺寸不同 ,其组装成的纳米线的磁性也有所差异 , 因 此可以有的放矢的用于各种磁性纳米材料领域。
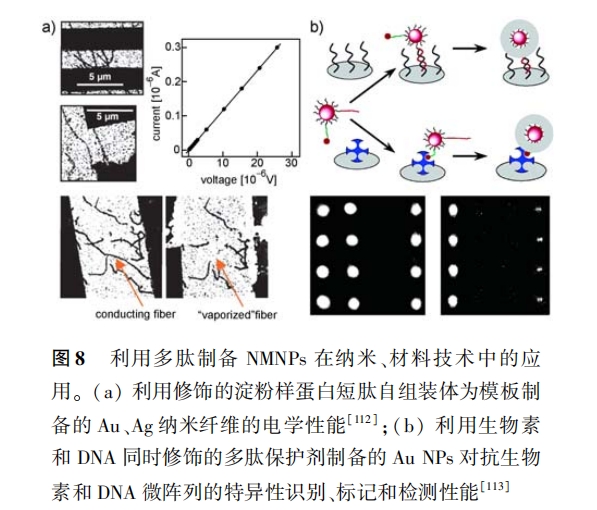
利用 NMNPs 的 sPR、LsPR 等性 能, sarikaya 等[40, 42, 46] 详细考察了各种多肽在 Au、Pt 表面的吸 附行为 ,并计算出相关的动力学和热力学参数 。此 外,Fernig 等[10] 利用摩尔吸光系数计算出单位面积 Au NPs 上吸附的多肽保护剂的分子数目 。这些数 据为定量分析多肽与 NMNPs 之间的吸附结合作用 提供了依据。
生物体内的特异性结合已为人所众知 ,如酶/作 用底物、抗原/抗体、RGD 短肽/细胞、生物素/抗生 物素以及核酸适体/配体等 ,将其应用于多肽保护剂 方面 ,就可以使 NMNPs 具有与荧光标记方法灵敏度 相近的特异性识别和检测性能 [10, 113—115] 。如 Fernig 等 [113] 将生物素 和 DNA 同时 结合在多 肽保护 剂 ( cALNN)上 ,制备出了肉眼可观测信号的能特异性 识别、标 记 和 检 测 抗 生 物 素 和 DNA 微 阵 列 ( microarrays)的 Au NPs,如图 8b 所示 。此外 ,将能 特异性吸附于细胞表面的 RGD 序列修饰在多肽保 护剂 上 , 可以利 用 NMNPs 的 光学性能 实现细 胞 成像。
5 存在的问题与展望
尽管利用多肽制备 NMNPs 的研究方兴未艾 ,但 目前仍有很多问题没有解决 ,如对多肽在 NMNPs 成 核阶段所起的作用和在其表面吸附机理的研究实验 结论相对较少 ,主要还依赖于分子模拟 ,导致诸多理 论证据不足;多肽作为保护剂/调控剂制备不同尺 寸/形貌 NMNPs 的确切机理仍不太清楚;多肽作为 引导剂还没有完全实现 NMNPs 的长程有序规则排 列;从生物体和多肽库中获取多肽序列工程量较大 且具有一定的盲目性 ,而利用生物信息库和从头设 计多肽序列又因对多肽与 NMNPs 相互作用理解的 不全面而进展缓慢等 。很多情况下对多肽作用的认 识甚至相互之间出现矛盾:如有些研究认为多肽在 与 NMNPs 作用时对构象的依赖性较强 ,而有些研究 认为多肽对氨基酸组成的依赖性较强;对各种氨基 酸在多肽结合 NMNPs 中的作用认识也不尽相同 ,甚 至相反 。此外 ,很多外在因素 ,如温度、压力、投料 比、试剂种 类、甚至微 量杂质 的存 在也会 影 响 NMNPs 的制备 , 给分析研究带来了不少麻烦 [4, 11] 。而且利用多肽制备 NMNPs 的应用还刚起步 ,在很多 领域还处于探索阶段 。上述的种种问题在制约了对 利用多肽制备 NMNPs 研究的同时 ,也给出了解决问 题的突破口 。随着研究工作的不断深入 ,预计以下 几个方面将会成为该领域研究的热点:
(1) 对多肽与 NMNPs 相互作用机理的研究。利用模拟和实验手段考察 NMNPs 从开始成核到晶 体生长的每一个阶段 ,多肽所起作用的分子机制 ,从 而实现从头设计所需功能的多肽分子。
关 ,对 NMNPs 尺寸、形貌和组成的研究一直是化学、 材料等领域研究的热点 。多肽不仅可以提供一条能 环保、低耗的实现这一目标的途径 ,而且由于其丰富 的组成和灵活的骨架 ,还可以实现对 NMNPs 尺寸、 形貌和组成的同时调控。
(3) 利用多肽制备基于 NMNPs 的可调控规则 形貌、长程范围内有序的组装体 。尽管利用多肽在 短程范围内对 NMNPs 的有序组装体在光学、电学等 领域已经显示出巨大的应用前景 ,但对 NMNPs 长程 范围的组装和其组装体形貌的可预测和可调控性还 没有实现。
(4)利用多肽制备 NMNPs 在各学科领域中的 应用 。将多肽和 NMNPs 两者的优势结合起来 ,可以 实现很多以往 NMNPs 很少涉猎的领域 。如通过对 多肽保护剂的生物学修饰 ,可以将 NMNPs 的应用领 域拓展至生物医学范围 。此外 ,将特异性识别性能 和其他性能结合使用可以使多肽制备的 NMNPs 在 纳米生物传感器、纳米编码、分子印迹、癌症的早期 诊断和食源性致病菌的快速检测等新兴纳米、材料 技术领域也大有作为。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。