
摘要 自从20年余前第一次发现细胞穿透肽(cell-penetrating peptides, CPPs)以来, 细胞穿透肽新家族成员的发掘和应用研究发展迅速。这些短肽可以通过共价或非共价连接形式穿过细胞膜, 并且可以携带多种没有能力克服细胞膜通透性障碍的分子进入细胞。作为纳米级转运载体, 大多数CPPs是无毒的, 并已成为药物治疗、诊断以及蛋白质、核酸功能等方面研究的新型潜在工具。该文重点从CPPs的分类、结构与功能关系、跨膜机制、细胞器定位、细胞毒性、与外源物质连接方式以及应用等方面介绍了国际上有关CPPs的研究进展及其存在的挑战和未来前景。
细胞膜对外源分子的进入具有选择性。许多生物活性分子不能克服细胞膜的通透性障碍, 是基因和药物靶向诊断和治疗的主要限制因素。而细胞穿透肽(cell-penetrating peptides, CPPs)是一系列能够快速穿透细胞质膜的短肽[1-2](如I型人类免疫缺陷病毒的反转录激活因子HIV-1 Tat的基本域长度只有9个氨基酸), 它们能传递比自己分子量高100倍的大分子, 例如蛋白质、质粒、siRNA、纳米粒子、核酸和脂质体等, 它们通过与CPPs形成复合物从而进入细胞[3]。与病毒载体相比, CPPs具有生物安全性高、细胞毒性低、可设计性强等优点。同时, 细胞穿透肽的发现, 在诊断和治疗研究领域极其重要, 极大地推动了细胞摄取和大分子功能研究。
1 细胞穿透肽的种类
根据细胞穿透肽在序列、疏水性和极性等方面的差异, CPPs可以分为5类: 阳离子多肽(cationicpeptides)、疏水性多肽(hydrophobic sequences)、两性分子肽(amphipathic peptides)、富含脯氨酸的多肽和抗菌肽(proline-rich and antimicrobial sequences)、嵌合肽(chimeric peptides)[4]。
阳离子的细胞穿透肽主要由多个精氨酸残基和赖氨酸残基组成。最初研究者们认为它是携带外源物质进入细胞的传递工具, 而且不引起细胞反应[5]。通过比较由精氨酸、组氨酸、赖氨酸或鸟氨酸组成的短聚合物, 发现精氨酸残基在穿透细胞质膜的过程中是最有效的[6]。因此, 精氨酸残基被认为是阳离子CPPs的一个关键结构特征。氨基酸序列中精氨酸和赖氨酸残基的数量和位置同样也是转导效率的关键。研究表明, 分别有7、8、9个残基的低聚精氨酸会有最高的转导效率[7]。
已知的蛋白质、多聚精氨酸和缩氨酸中有很多富含精氨酸多肽的例子, 例如: HIV-1 Tat的49-57截序列(RKKRRQRRR)[6]、Tat(transactivator of transcription)的 二 聚 体 分 子Tat2(RKKRRQRRRRKKRRQRRR)[6,8]、果蝇ATF转录因子的同源结构域N-端截序列(RQIKIWFQNRRMKWKK)[9]等。
信号肽总体来说由三个区域组成: 带正电荷的N-端、疏水的H区域和带负电的C-端, 其中疏水的H区域是疏水性多肽的重要标志。对于相关生物活性的蛋白质片段, H区域担任着信号肽的“搬运工”角色[10]。例如, 肉瘤成纤维细胞生长因子(FGF)信号肽序列, 由16个氨基酸(AAVALLPAVLLALLAP)组成[10];整合素(integrin) β3信号肽序列由15个氨基酸(VTVLALGALAGVGVG)成。
两性的CPPs中亲水部分大多是由赖氨酸残基组成[11]。pH中性时, 具有亲水和疏水两面特性的两性螺旋是多肽穿过质膜的必要结构[12]。两性模型肽(model amphipathic peptide, MAP)是由18个氨基酸组成的多肽(KLALKLALKALKAALKLA), 有一个α螺旋结构[13]。CADY(GLWRALWRLLRSLWRLLWRA)是含20个氨基酸的CPP多肽, 它可以靶向siRNA[14]。Pep-1(KETWWETWWTEWSQPKKKRKV)是第一个商业化的两性分子肽类型的CPP(Chariot kit, ActiveMotif, USA), 可用于蛋白质的非共价键转导, 它有三个区域: 一个疏水域、一个亲水域和一个间隔域, 它能提高疏水域和亲水域的灵活性和完整性[15]。
富含脯氨酸序列或多聚脯氨酸序列在水中能形成螺旋状结构。例如, SAP(sweet arrow peptide,SAP)(VRLPPP)来自于玉米贮存蛋白, 是γ-zein中富含脯氨酸的N-端重复区域, SAP包含50%的脯氨酸残基。
抗菌肽(antimicrobial peptides, AMPs)是生物体防御外界病原体侵袭时产生的由基因编码、核糖体合成的一类小分子活性多肽, 是生物体内先天性防御系统的重要组成成分[16]。在体外, 往往在几分钟之内, 它就可杀伤革兰氏阳性菌、革兰氏阴性菌、真菌、寄生虫、病毒及肿瘤细胞[17]。例如, S413-PV(ALWKTLLKKVLKAPKKKRKVC)是 一 个 由13个氨基酸组成的多聚阳离子抗菌肽, 来源于抗菌肽S4和猿病毒40(SV40)大T抗原NLS(nuclear localization sequence)[18]。
嵌合肽可能包含两个或更多的模体。例如,转 运 素(transportan)是 由27个 氨 基 酸(GWTLNSAGYLLGKINLKALAALAKKIL)组成的嵌合肽, 前12个残基来源于神经肽甘丙肽(galanin)的N-端, 而C-端14个残基来自于黄蜂毒素的mastroparan多肽;pVEC(peptide vascular endothelial-cadherin, pVEC)是由18个氨基酸组成的来源于鼠类的多肽(LLIILRRRIRKQAHASK)。值得注意的是, pVEC和转运素都可以被小黑麦幼苗的各种组织内化[19]。
2 CPPs结构与功能的关系
传递高分子的CPPs序列所共有的特征是具有正电荷, CPPs能与核酸和一些蛋白质的负电荷相互作用, 因此为CPP功能的预测提供了参考。然而, 并不是所有带正电荷的序列都是细胞穿透肽, 不同序列CPPs的功能与其氨基酸构成关系不大[20]。例如,pVEC(LLIILRRRIRKQAHASK)和pVEC-scrambled(IAARIKLRSRQHIKLRHL)虽具有相同的氨基酸组成, 但后者氨基酸的排列是随机的, 在植物和哺乳动物细胞中, pVEC-scrambled比pVEC的内化能力明显降低[19]。单一氨基酸的替换甚至就可能导致细胞转运或者核定位能力的完全丧失, 例如突变的Tat(MTat), 它的第一个精氨酸残基被丙氨酸代替[6], 就基本丧失了细胞跨膜转运能力[8]。在相同的组织中,CPPs的细胞内化能力受其氨基酸序列和长度的影响[8]。对于Tat的有效转运, 至少需要6个精氨酸残基,而且研究结果显示, 伴随着精氨酸残基数的提高, 其转运能力也提高[6,21]。研究结果表明, 氨基酸序列和结构在决定CPPs的细胞穿透特性方面是很重要的因素。
3 CPPs的跨膜机制
CPP的跨膜机制至今仍不十分明确。初始阶段(1988~2003年)的研究认为, CPPs穿膜是非内吞、非能量依赖的直接穿膜过程, 目前这些实验结果的准确性已备受质疑[22]。2003年, 有研究者提出用流式细胞仪无法区分CPPs在细胞内还是细胞外, 不能对细胞摄取的有荧光标记的CPPs进行定位; 另一质疑是细胞固定技术对CPPs观察的影响, 因固定剂乙醇和醋酸可以增加核膜的通透性, 有研究指出, 荧光标记的细胞蛋白在使用上述固定剂固定后可以定位在不当位置。
随着更多有类似细胞穿透性质蛋白的发现以及对它们跨膜机制的研究, 发现它们是通过形成某种跨膜转导结构域来完成转导的[23]。现在已经提出的CPPs可能的转导模式有三种[24-25], 即倒置微团模式(inverted cell model)、地毯模式(carpet model)和打孔模式(barrel stave pore formation model)。倒置微团模式由Prochiantz研究小组[26]提出, 他们利用核磁共振技术研究CPP与磷脂膜的相互作用。他们认为, 首先CPP带正电的基团与带负电的磷脂分子相互作用, 随后CPP的疏水性氨基酸与细胞膜相互作用从而使细胞膜发生反转和重排, 形成微团结构将CPP包围其中, 然后将CPP释放入细胞内。虽然这一假说能够解释一些CPP的穿膜机制, 但对于不含有疏水性氨基酸的Tat和富含精氨酸的多肽来说却无能为力。地毯模式首次被提出来是为了解释一些抗菌肽的穿膜机制, 但它同样可以用来解释在高浓度时会出现细胞毒性的CPP的内化, 主要包括三个步骤: 首先, CPP依靠其阳性电荷与磷脂膜的负电荷产生相互作用, 引起CPP二级结构发生改变, 使得CPP就像地毯一样将整个细胞表面覆盖; 然后, CPP方向发生倒转, 插入磷脂膜中, 引起膜张力的改变; 最后,膜的稳定性被破坏, 出现瞬时的通透性增高, CPP得以内化。这一机制能够更好地解释一些抗菌肽的毒性作用[27]。打孔模式是指兼性α螺旋结构的CPP内化时, CPP成束聚集排列于细胞表面, 并平行排列插入细胞膜中, 形成像棍子箍成的桶样结构的孔型通道——疏水性氨基酸与膜疏水核心相互形成外表面, 亲水氨基酸形成孔的内表面, 然后CPP发生跨膜转位, 实现内化。这种模式也是抗微生物肽进入细胞的一种内化机制[28]。
进一步的研究表明, 内吞才是细胞穿透肽内化的主要机制[29-30], 目前这一观点已被认可和证明。内吞通路主要包括网格蛋白介导、胞膜窖介导、巨吞饮介导的内吞。有研究小组提出CPPs的巨胞饮机制[31]。2004年, 有报道Tat转导小鼠活细胞的巨胞饮机制, 表明Tat与内涵体标记的共区域化, 说明CPPs定位于内涵体中[32]。有研究称, 巨胞饮作用是细胞内化的主要途径, 它能在不同程度上发生于所有的细胞内, 而且可以从膜的边缘扰动和形成囊泡的大小两个方面区分巨胞饮与其他形式的内吞作用。
4 CPPs进入细胞以后的细胞器定位
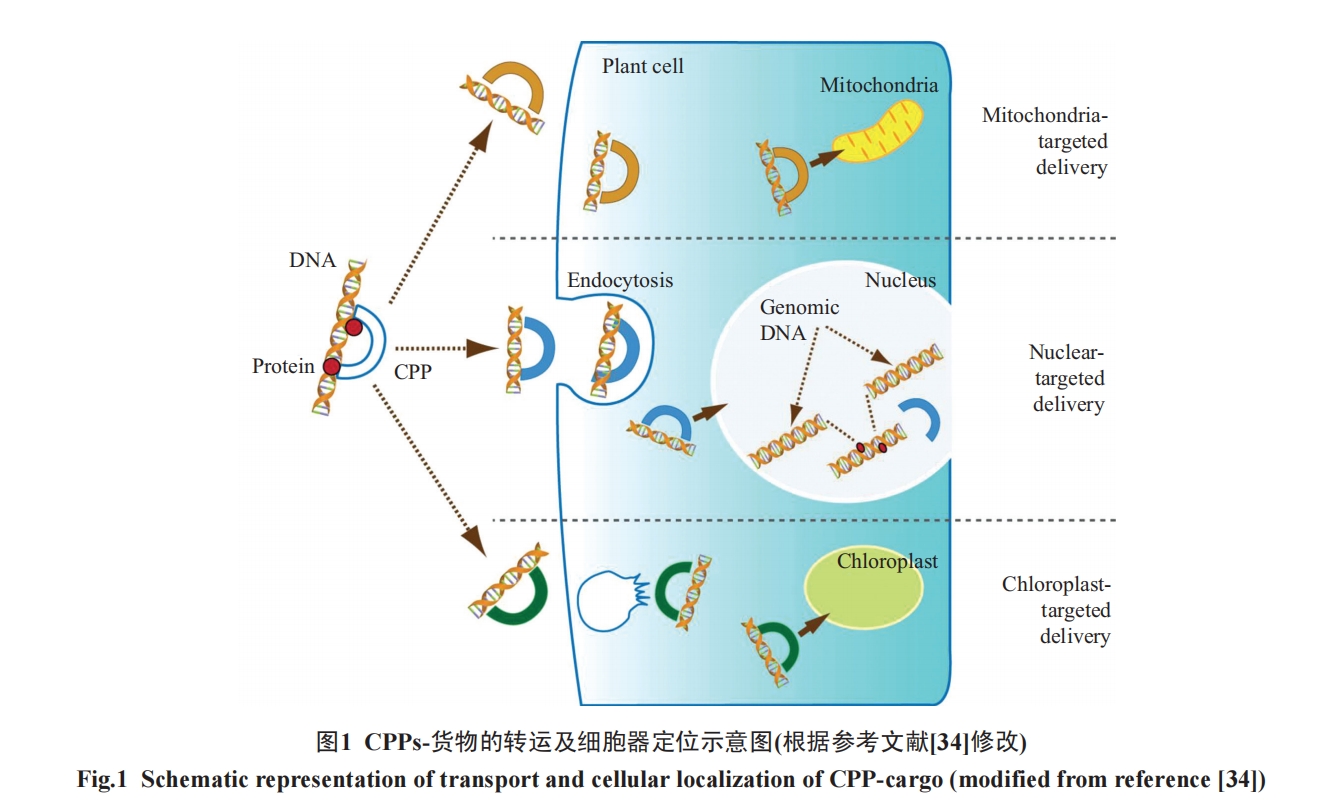
多数CPP因序列上带有核定位序列(nuclear lo-calization sequence, NLS), 在进入细胞并从内含体释放出来后, 都能通过核孔复合物(nuclear pore complexs, NPCs)穿过核膜, 进入细胞核。直径小于9 nm或者60 kDa的高分子可通过NPC被动地扩散。此外,NPC可以促进直径10~20 nm高分子的主动转运。在NPC里, 核蛋白需要NLS作为核输入蛋白α/β介导的核进口路径的靶点[35]。因此, 推测CPPs可利用已知的核进入机制轻易地进入细胞核。
线粒体是治疗多种疾病和紊乱的重要靶点。线粒体定位序列效率相对较低。由阳离子和亲脂性残基组成的线粒体定位肽已被用于研究细胞的氧化胁迫反应[36]。脂质体粒子MITO-porter是基于STR-R8MEND(stearyl-octaarginine, multifunctional envelopetype nanodevices)概念的传递治疗药物到线粒体的分子, 它是一种脂质体为基础的纳米载体, 可以通过膜融合将货物转运到线粒体中[37]。
叶绿体基因工程是一项充满希望又富有挑战的植物基因工程遗传操作技术, 研发能将DNA等大分子运送到叶绿体内的CPPs无疑将会极有利于植物叶绿体基因工程的发展。加拿大研究人员Eudes等[38]构建了带荧光标记的叶绿体定位CPP肽, 并在受试叶肉细胞的叶绿体中检测到大量的标记荧光,证明了该CPP的叶绿体定位转运能力。他们将开发的几种细胞器定位转运CPPs一起申请了国际专利[34]。
5 细胞毒性和细胞功能
在植物中, 以体细胞胚胎或小孢子为试材的研究显示, 独自的CPP或者与携带货物形成的复合物在实验浓度下, 没有观察到细胞毒性[41]。小孢子与CPPs或CPP-货物复合物共育后的活性与对照小孢子活性相似(约65%~70%活性细胞); CPPs在小黑麦叶肉原生质体的活性方面没有负面影响[8,19]。CPP处理不同植物的根细胞也没有发现细胞毒性效应[7]。
6 CPPs与外源物质的连接方式
CPP能够输送种类繁多的物质进入细胞, 所转运的物质在物理和化学性质上不尽相同。因此, 需要不同的连接方法, 通过共价、非共价偶联或者二者联合使用, 将CPP与外源物质连接[42]。其中, 连接的方式对CPPs在摄取水平和方式上有深远影响[1]。
共价连接是CPP与外源物质结合常见的方法。蛋白质和CPP往往通过化学偶联或者使用重组DNA技术进行连接, 形成含有细胞穿透序列的融合蛋白。与外源物质共价连接进行细胞转运的CPP有Tat、多聚Arg、转运素以及单纯疱疹病毒的VP22蛋白和降钙素等。然而, 从化学观点来看, CPP共价连接技术在方法学上对连接物质有严格的限制, 并且可能改变连接物的生物活性, 尤其是带电荷的寡核苷酸或siRNA。
基于该方法与载物结合的大多数是两亲性型的CPP, 如MPG多肽与siRNA、寡核酸, Pep-1肽与核酸、蛋白等, 其他还有阳离子型的Tat和寡聚精氨酸[43]。非共价结合相对比较简单, 包括静电作用和疏水作用, 运用非共价结合方法可以实现核酸和蛋白等生物活性大分子的胞内传递并保留其生物活性[44]。因此, 对一些连接物而言, 非共价连接显得更为合适。
7 细胞穿透肽的应用
在过去的数十年里, 人们一直致力于将肽段、蛋白质和寡核苷酸等用于疾病的治疗, 但是由于细胞膜的生物屏障作用, 这些大分子物质的跨膜转导一直是困扰医学界的难题。自1999年首次报导了Tat可携带活性蛋白β半乳糖苷酶进入活体小鼠包括脑组织在内的所有细胞后[45], CPPs开始作为转导工具应用于实验研究中, 使蛋白质等大分子能够穿过细胞膜发挥作用, 其在肿瘤显像与治疗、心血管疾病、神经系统疾病、炎症及免疫治疗、疫苗研究等领域展现出很大的研究价值, 并且已经取得了不少新的进展, 具有广泛的用前景。
Tat与 一 种 多 肽 模 拟 物(anti-Her-2/neu peptidemimetic, AHNP), 共轭连接(Tat-AHNP)之后, AHNP就可以选择性地吸附一种表皮生长因子受体ErbB2,并在乳腺癌细胞中过量表达。这种设计新颖的对癌细胞有特异性的运输多肽Tat-AHNP将可以用于乳腺癌的治疗[47]。
7.1.2 CPPs在脑疾病治疗中的应用 在脑肿瘤的治疗中, 由于存在血脑屏障, 大多数抗癌药物必须以侵入性、高毒性的方式进入大脑, 大大限制了有效治疗。有关研究证明, CPPs能以一种无毒方式穿越血脑屏障, 可运载抗癌药物进入脑内, 并且可以保留其药理作用[48]。也有研究报道, 将狂犬病毒的糖蛋白(rabies virus glycoprotein, RVG)和含9个精氨酸残基的小肽交联在一起组成一个新的细胞穿透肽RVG-9R, 不仅能特异性地将siRNA递送进神经细胞中, 并且能穿越血脑屏障, 这为难以治疗的脑部疾病带来了曙光[43]。
7.1.3 CPPs在生物影像学中的应用 利用CPPs可以提高造影剂和生物传感器在生物体内的穿透能力以及实时观测病毒感染细胞等。有研究者利用Tat将纳米半导体递送到兔子脑组织中[49]。Tat能快速完成这一功能, 而且利用低能量的手控紫外灯就能立刻观测到兔子脑组织中的荧光显影, 这一研究成果可以应用于肿瘤患者手术中的肿瘤显影。
7.1.4 其他 除以上的应用外, 也有研究报道, 将转录因子STAT-6抑制肽与HIV-Tat来源的PTD4(proteintransduction domain 4)交联后可以降低小鼠体内卵白蛋白引起的炎症反应, 而STAT-6的功能与过敏性疾病有关, 提示其抑制肽可以用来治疗过敏性鼻炎和过敏性哮喘[50]。由于CPPs能够通过血脑屏障, 可携带胆碱乙酰化转移酶、脑源性神经生长因子治疗老年性痴呆; 携带酪氨酸羟化酶、胶质细胞神经营养因子治疗帕金森病[51]。研究者们利用Tat的穿膜能力成功地将各种多克隆抗体递送进细胞内部, 近期也有关于递送单克隆抗体的报道, 而且这一技术能够被广泛地用于辐射免疫治疗及辐射免疫检测[52]。
植物转基因的方法很多, 1991年Potrykus[53]将其归结为17种。后来, 又出现了超声波法、离子束法等。在报道的众多转基因方法中, 有不少是大同小异的。大致可划分为两类: 一种是载体介导法, 如农杆菌介导法、病毒介导法等; 另一种是DNA直接摄取法, 如基因枪法、聚乙二醇(PEG)介导法、电击法、显微注射法和超声波导入法等。CPP纳米载体的出现为植物基因工程操作展现了新的曙光。
在植物中, CPP介导高分子的传递是一个较新的领域。Chang等[7]报道了在绿豆、大豆、玉米和洋葱根尖细胞中, 24 kDa的荧光蛋白被Tat蛋白的转导结构域(Tat-PTD)和精氨酸丰富的细胞内传递多肽(AID)以共价和非共价的方式转导。最近的研究显示, 悬浮的烟草细胞原生质体和黑小麦叶肉细胞原生质体都可以摄取CPPs, 例如: Tat、Tat2、AID、pVEC、转运素和穿透素[8,19]。在原生质体、烟草悬浮细胞、绿豆、大豆根尖和未成熟的小麦胚中都有成功的核酸(DNA和dsRNA)转染报道[8,54]。Chugh等[55]借助Tat2将携带gus基因的质粒DNA进入小麦胚胎细胞, 实现了gus基因的瞬时表达。以上都说明, CPP克服了细胞壁作为大分子蛋白转导的主要障碍。
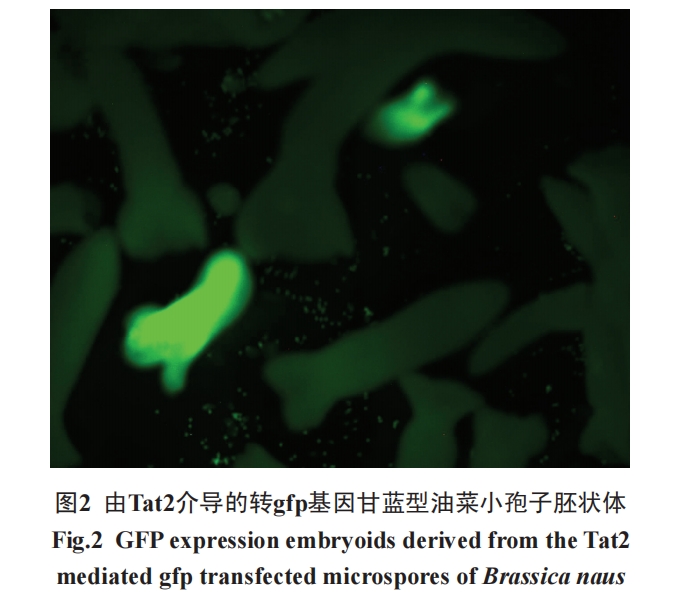
由于植物细胞比动物细胞具有更强的全能性,特别是小孢子细胞还具有群体大、单倍性、可培养性等特点, 因此, CPPs介导植物细胞转染技术的建立, 在植物基因功能研究及基因工程遗传改良上具有巨大潜力。
CPPs的研究已经取得了不少新进展, 但还存在一些缺陷, 如内含体释放率低、细胞定位不精确以及稳定性差等。尤其是内含体问题, 即进入细胞后,细胞穿透肽及其负荷的“货物”立即被细胞内的内体(endosome)包裹, 与细胞浆分隔开, 本质上, 这与处在细胞外的状态没有区别。如何突破内体包膜释放进细胞浆, 成为细胞穿透肽及其负荷的“货物”能否发挥功能的关键。近年来, 这方面也已经取得重要进展。
7.3.1 化学物质辅助解决 Wattiaux等[58]证明, 氯喹可促进TAT多肽从内含体中逃逸至胞浆并进入胞核。另外, Ca2+和蔗糖也都能促进内涵体的释放。
7.3.2 光敏物质辅助解决 光敏物质能在可见光的激发下产生活性氧簇, 而活性氧簇能破坏内含体膜, 促进内含体内物质释放进入胞浆。Maiolo等[59]将CPPs-多肽标记上光敏物质, 作用于细胞的同时给予激光照射, 结果显示, 多数CPPs偶联多肽均从内含体逃逸进入胞浆或胞核, 发挥相应的生物学活性。
7.3.4 病毒微生物辅助解决 为逃避宿主细胞的杀伤机制, 一些病毒等微生物在进化过程中获得了从内含体逃逸的本领。Wadia等[32]研究发现, 流感病毒血凝素2蛋白(hemagglutinin 2, HA2)与TAT的融合多肽能显著增强融合蛋白从内含体中释放。此外,人乳头瘤病毒(human papilloma virus, HPV)衣壳蛋白L2 C-端的23个氨基酸残基短肽也具有与HA2类似的内含体逃逸功能。
7.3.5 CPP自身改造辅助解决 目前已提出很多关于CPP改造的方案, 也已对很多方案进行试验验证,虽有进展, 但缺少实质性的突破。对现有CPPs进行改造是更简便、更安全的方法来促进CPP的内体逃逸。
8 存在的挑战与前景
CPP能以共价或非共价键连接的方式传递比自己大很多的“货物”(蛋白质、药物或核酸等)穿过质膜, 并具有细胞器定位能力, 这两个特性, 展示了它在细胞生物技术操作上的巨大潜力。对CPPs和高分子“货物”的研究已经打开了药理学、疾病诊断和治疗方法研究的新视野, 为生物药物载体的发展带来了很多机会, 也给生物大分子治疗疾病带来了曙光。CPPs在植物上的应用研究虽然起步较晚, 但其可能性已得到证实, CPPs能够携带基因和蛋白以一种简单且低成本的方式转运进植物细胞中, 让我们看到了CPPs在植物基因或蛋白研究中的巨大潜力。然而,实现CPP-“货物”成功传递的步骤、方法尚需完善,其细胞内化的机制也存在争论。CPPs在哺乳动物细胞中作为传递工具的一个重要不足是没有细胞特异性, 这可能是CPPs用于药物治疗和其他药理学应用的主要缺点。
对CPP多肽序列的特征、重要的结构特点与其功能的关系还需要进一步解析, 其中包括CPP大小和序列对细胞内化和亚细胞定位的影响, 以及继续发现新的CPPs, 继续扩大、优化CPPs在植物与哺乳动物中的各种应用, 等等。近年来, 研究者们对CPPs的巨大兴趣无疑强化了CPPs在纳米生物新兴领域的巨大潜力。随着CPPs内化机制的进一步解析、明确以及CPP-“货物”运送技术的进一步完善, CPPs的应用会越来越广泛。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。