
过去的二十年,肿瘤治疗已经从非特异性的化疗向具有选择性的基于发病机制的疗法转变[1]。分子靶向治疗作为肿瘤治疗的新手段,正以其疗效高、不良反应少且轻等特点而备受瞩目,现已成为肿瘤治疗领域的研究热点。它以肿瘤微环境、肿瘤细胞细胞膜或细胞内特异性表达或高表达的分子为作用靶点,能够更加特异地作用于肿瘤细胞,阻断其恶性增殖、转移或诱导其凋亡,同时降低了对正常细胞的杀伤作用,因此是十分有前途的肿瘤治疗方法之一[2]。
治疗肿瘤的生物制剂主要包括单克隆抗体、蛋白质和肽。对于“小型化”的肽类而言,其合成工艺成熟稳定、不易在体内诱发免疫应答、具有良好的肿瘤穿透能力以及生物兼容性,显示了良好的研究价值和应用前景[3-5]。目前已上市的肽类药物有60个左右,其中销售额超过10亿美元的4个肽类药物中有3个(亮丙瑞林、戈舍瑞林和奥曲肽)用于肿瘤的治疗或肿瘤并发症的辅助治疗。2000–2010年,进入临床试验的以多种形式用于肿瘤诊断和治疗的肽类药物占整个肽类药物的18%,其在抗肿瘤药物中发挥着越来越重要的作用[3]。靶向肽不但可以作为激动剂或拮抗剂用于肿瘤的治疗,还可以作为细胞毒药物、放射性核素、显像试剂以及新型制剂(纳米、脂质体、胶束等制剂)等的靶向传输载体,为肿瘤的诊断和治疗开辟了新的途径(图1)。本文就基于抗体及配体的肿瘤靶向肽药物研究进展作简要综述。
1 基于抗体的肿瘤靶向肽药物
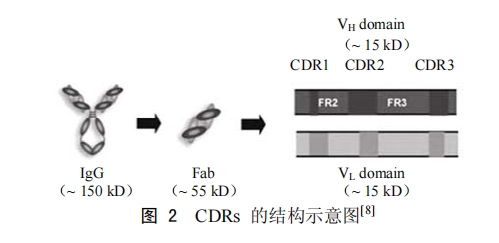
来源于抗体CDRs的CDR-H3序列也称“微(小)抗体(micro/miniantibody)”,它和完整抗体具有类似的特异性。CDR-H3位于抗原识别位点的中心位置,在免疫反应中发挥着重要作用,剩下的CDRs则围绕其周围以进一步增加其亲和力。最近研究表明,除了CDR-H3以外,其他单独的CDRs也可能通过先天免疫反应分子来发挥生物活性[7]。C7L1、C7L2、C7L3、C7H1、C7H2和C7H3是衍生于单克隆抗体C7(抗白色念珠菌细胞壁甘露糖蛋白抗体)CDRs6个区域的6种肽段,Blast比对结果表明它们和生物体分泌的天然肽类的氨基酸序列存在很大差异。这些肽段经过一系列体外体内测试后,发现基于CDR-H2的C7H2肽(YISCYNGATSYNQKFK)具有最佳的抗肿瘤效果。它能显著抑制鼠黑色素瘤细胞B16F10的生长(IC50值为50μmol/L)、引起DNA的降解,此外还可导致黑色素瘤细胞以及白血病细胞的凋亡(caspase依赖型),其凋亡活性与肽的受体结合活性有关[7]。后续研究表明,C7H2的分子靶点为β-肌动蛋白,它可诱导β-肌动蛋白的聚合、F-肌动蛋白的稳定以及肿瘤细胞的死亡,而且可以抑制肿瘤的转移,但对正常细胞以及小鼠无明显的毒性[9]。
同时来自于CDRs的肽段,其体内生物活性的有无可能与CDR的选择以及有无间隔区有关。为了确定最佳的配对方式,有人将抗EB病毒包膜抗原的HB-168抗体CDR1或CDR2与CDR3通过CDR以外区域的骨架区2(frameworkregion,FR2)连接起来,形成不同组合的拟肽,其中以CDRH1-FRH2-CDRL3(含28个氨基酸)形式组合的拟肽的抗原结合活性最高,且其穿透并富集于实体瘤的能力比完整抗体强;而无间隔区的拟肽,如CDR H1-CDRL3、6个CDRs形成的环肽等,由于缺乏“准生理学”间隔区,它们与抗原表位界面的结合有所减弱。由此可见通过间隔区连接的CDRs更加接近天然抗体CDR的构型,而且处于对角线位置的CDR1和CDR3对抗原的识别起着重要的作用[10-11]。
1.2 模拟抗体和受体相互作用的肿瘤靶向肽药物
表皮生长因子受体2(humanepithelialgrowthfactorreceptor2,HER2/ErbB2)是表皮生长因子家族成员之一,与其他3个家族成员不同,HER2没有与之对应的配体,且以同源或异源二聚体形式发挥作用。HER2的表达水平与乳腺癌的生长、转移及预后呈现明显的正相关性。帕妥珠单抗(用于治疗HER2阳性转移性乳腺癌的人源化单克隆抗体)拟肽HRAP(Ac-PHAHF-NH2)是首次利用基于结构的药物设计(structure-baseddrugdesign,SBDD)软件模拟帕妥珠单抗和HER2的结合位点,并通过优化得到的一条可以特异性地与HER2二聚体功能域结合的短肽。该肽可通过抑制PTEN和Akt的磷酸化来抑制HER2过度表达的乳腺癌细胞的增殖,此外它还可以增强紫杉醇的细胞凋亡诱导活性[8,12]。肽疫苗是肽类药物研究的热点之一,最新临床数据表明目前进入临床试验的肽类药物大部分为肽疫苗[13]。MVF266 Cyc是基于帕妥珠单抗结合HER2胞外域的单晶结构模拟设计的一种帕妥珠单抗样肽疫苗,其动物体内疗效与帕妥珠单抗相差无几,但无抗体常见的副反应。MVF597Cyc是利用同样的方法设计的肽疫苗,其生物活性与曲妥珠单抗类似。另外一种已进入临床I期试验,用于免疫疗法的肽疫苗14633则是由帕妥珠单抗样肽段MVFHER-2[597-626] 和帕妥珠单抗样肽段MVFHER-2[266-296]两部分组成,可以靶向HER-2胞外域的两个不同表位[14]。
AHNP(anti-HER2/neupeptidomimetic)是以抗HER2单克隆抗体4D5(Herceptin,赫塞汀,用于治疗HER2过度表达的转移性乳腺癌)和HER2复合物的三维结构为基础设计出的一段环外小肽(FCDGFYACYKDV,分子量为1.5kD)。AHNP二级结构与抗体的CDR3类似(同为β-转角结构),向外延伸的疏水性尾巴则与抗体的FR类似(呈现β-折叠样的扩展结构)。体外结果表明AHNP和HER2具有很高的结合能力,其亲和力常数KD值高达300nmol/L,体内结果则表明AHNP可以模拟抗体4D5 的功能,从而发挥抗肿瘤疗效。此外,AHNP与其他化疗药物联用可以增加它们的疗效。目前,AHNP作为一种新颖的小分子探针已广泛用于临床前研究[15-16]。
AERP(anti-EGFreceptorpeptidomimetic)则是基于相同原理,以抗体C225的CDR-H3为模板设计的一段抗EGFR十六肽(YCASRDYDYDGRCYFD)。AERP和EGFR的结合呈现浓度依赖性,其KD为400nmol/L,经99mTc 标记的AERP可在肿瘤部位特异性富集,其肿瘤与血液的浓度比是单链抗体(single-chainantibodyfragment,scFv)的3.2倍,但不足的是它在肝脏和肾脏也有大量分布,其药代动力学有待进一步提高[16-17]。
2 基于配体的肿瘤靶向肽药物
自从发现特异性受体以来,配体的肽类似物就因为具有良好的受体结合活性、低免疫原性以及独特的生物动力学行为而广泛用于癌症的诊断和治疗[18-21]。本部分以目前常见的受体来对基于配体的肿瘤靶向肽药物进行分类。
促黄体激素释放激素(luteinizinghormone-releasinghormone,LHRH)肽类激动剂是治疗前列腺癌的最经典的例子。目前,已上市的激动剂有:布舍瑞林、戈舍瑞林、组氨瑞林、亮丙瑞林和曲普瑞林。这些激动剂是LHRH的类似物,可以下调垂体的促黄体激素释放激素受体,从而抑制促卵泡激素、促黄体激素以及睾丸酮的释放。随后发现的肽类拮抗剂如阿巴瑞克、西曲瑞克、地加瑞克等进一步提高了激素阻断疗法的疗效[3]。
自20世纪80年代以来,大量数据表明多数肿瘤细胞胰岛素样生长因子受体(insulin-likegrowthfactor-1receptors,IGF-1R)呈现高表达。流行病学研究也显示血清IGF-1水平和患乳腺癌及前列腺癌的风险相关。IGF信号系统在肿瘤发生发展中起着至关重要的作用,IGF-1R作为靶向治疗的靶点被广泛研究[22-23]。JB3(D-CSKAPKLPAAYC)作为IGF-1最有效的类似物,可以和内源性配体竞争性结合IGF-1R,从而抑制某些肿瘤的生长。JB3通过二硫键形成12肽,其中包含一个D型氨基酸,可有效对抗酶的水解。简化JB3后得到的环4肽JB9(D-CSKC)也可有效地富集于IGF-1R阳性肿瘤部位[24]。
另外,与肿瘤有关的激素受体还包括生长抑素受体(somatostatinreceptors,SSTRs)、血管活性肠肽受体(vasoactiveintestinalpeptidereceptors,VIPRs)等[19]。
表皮生长因子受体(epidermalgrowthfactorreceptor,EGFR)在许多肿瘤细胞中过量表达,与肿瘤细胞的增殖、分化和转移等关系密切[25]。
EGFR的天然配体EGF具有很强的生物活性,可能引起免疫原性等问题,因此必须寻找新的靶向分子。EGF含3个由二硫键形成的环状结构,其中B环与EGFR结合有关,活性区序列为CMYIEALDKYAC。人工合成的环肽可以靶向EGFR过表达肿瘤细胞,并可作为药物的载体以提高化疗药物的抗肿瘤疗效、降低全身性毒性[26]。
另外,也有研究表明EGF的C-端在配体-受体结合过程中发挥着重要作用[27]。通过基因工程技术将EGF的C环22个氨基酸(简写成Ec)与力达霉素的辅基蛋白(lidamycinapoprotein,LDP)融合形成的融合蛋白Ec-LDP 便是一个很好的例证。ELISA和细胞流式检测结果均显示Ec-LDP蛋白对EGFR高表达的肿瘤细胞系A431和MCF-7都有很强的免疫结合活性,而对不表达EGFR的NIH3T3细胞则无结合活性,免疫荧光实验也证实Ec-LDP 蛋白可与A431细胞膜受体结合。在此基础上构建的双靶向融合蛋白Ec-LDP-Hr可同时靶向EGFR和HER2,进一步证实了Ec寡肽的靶向性[28-29]。
整合素(integrin)是由α亚基和β亚基组成的异源二聚体,它是一类细胞表面受体,其配体是细胞外基质蛋白,如胶原蛋白、纤黏连蛋白、层黏连蛋白、细胞间黏附分子、血管细胞黏附分子等[30]。影响肿瘤血管生成的整合素主要包括4种:αvβ3、αvβ5、α5β1和α2β1。其中αvβ3是最引人关注的肿瘤血管新靶标[31]。
整合素和配体的识别过程与配体的特定氨基酸序列有关。1997年,Pasqualini等[32]注意到大多数整合素与细胞外基质的识别位点都含有一个共同的Arg-Gly-Asp(RGD)三肽模体,并首次证明包含RGD序列的短肽可与整合素αv(αvβ3以及αvβ5)特异性结合。西仑吉肽(EMD121974,cilengitide)为环状RGD肽c(RGDfV)的N-甲基化衍生物,是第一个以αvβ3为靶点进入III期临床的抗肿瘤药物,II期临床结果表明对多种肿瘤有效。另外一个靶向整合素αvβ3、αvβ5和α5β1的药物ATN-161(Ac-PHSCN),已经进入II期临床,用于治疗头颈部肿瘤[33]。
包含RGD序列的短肽不仅可以单独发挥作用,还可以和其他生物活性蛋白融合在一起,协同发挥抗肿瘤作用。含有4个半胱氨酸的短肽ACDCRGDCFCG(RGD-4C)和比内皮抑素活性强20倍的含192个氨基酸的血管内皮生长抑制剂VEGI-192的N-端融合形成的双功能融合蛋白RGD-rhVEGI-192,不仅可以抑制鸡胚绒毛尿囊膜新生血管的形成,而且可以强效抑制内皮细胞的生长,从而在移植乳腺癌模型中显示了较好的抗肿瘤疗效[34]。
2000年,意大利研究人员采用基因工程技术将含NGR的序列(CNGRC)与人TNF-α的N-端连接制备了融合蛋白NGR-TNF[37]。I期和II期临床试验表明NGR-TNF单独使用或与化疗药物联合治疗复发性乳腺癌以及亚种群胸膜间皮瘤和肝细胞癌时,不仅可以达到较好的抗肿瘤效果,同时患者可以耐受。目前,该蛋白(NGR015)正处于III期临床试验,用于治疗恶性胸膜间皮瘤[38-40]。
NGR-LDP则是将CNGRC和力达霉素辅基蛋白(LDP)通过GCG连接形成的融合蛋白。结合实验证实该蛋白可特异性地和高表达CD13的HT-1080细胞结合。NGR-LDP和力达霉素烯二炔发色团(AE)组装后得到的强化融合蛋白NGR-LDP-AE可以显著地抑制鼠H22肝癌和人HT-1080纤维肉瘤的生长,其抑瘤率分别达到了95%和87%;免疫组化结构表明NGR-LDP可以结合肿瘤血管[45]。
除上述研究结果外,目前正处于研究阶段的肿瘤靶向肽药物相关受体还有血管内皮生长因子受体[46]、转铁蛋白受体[47]、白介素受体[48]、B细胞受体[49]等。
3 靶向肽-药物偶联物
抗体-药物偶联物(antibody-drugconjugate,ADC)是一类将抗癌制剂偶联于抗体的药物,主要用于肿瘤的治疗。最近来,随着“小型化”概念的提出,肽-药物偶联物也不断涌现。
部分肿瘤靶向肽可以直接发挥抗肿瘤作用,还有部分可以作为药物的靶向输送载体。KCCYSL肽是可以特异性和ErbB2结合、可用于肿瘤显像的六肽序列,将该序列和裂解肽通过连接形成的杂合肽,对所有测试的卵巢癌和乳腺癌细胞,甚至对曲妥珠单抗和拉帕替尼耐药的细胞均显示出较高的细胞毒活性,在5min内即可裂解ErbB2高表达的SK-BR-3细胞的细胞膜。另外,该杂合肽还可以显著地抑制荷瘤BT-474和MDA-MB-453裸鼠肿瘤的生长[50-51]。KCCYSL肽和高效酸肌醇激酶抑制剂TGX-D1通过PSA 可裂解肽SSKYQ偶联形成的偶联物(KCC-TGX)可以被前列腺癌表达的PSA断裂而释放母体药物TGX-D1。体外实验表明,高表达ErbB2的前列腺癌LNCaP细胞对KCC-TGX的摄取量明显高于TGX-D1,且KCC-TGX的活性得到了保留[52]。
低密度脂蛋白受体相关蛋白(low-densitylipoproteinreceptor-relatedprotein,LRP)可透过血脑屏障将配体转运进入内皮细胞。LRP受体不仅表达于脑毛细血管内皮细胞而且在多种恶性胶质瘤中有表达。抑肽酶(aprotinin)是低密度脂蛋白受体相关蛋白配体的抑制剂,在牛脑毛细血管内皮细胞的转胞吞作用比转铁蛋白至少高10倍[53-54]。肽家族angiopeps是基于抑肽酶氨基酸序列和人Kunitz型结构域设计出的一类肽类化合物,体外血脑屏障模型和原位脑灌注模型证明该家族成员特别是angiopep-2(TFFYGGSRGKRN NFKTEEY)具有比抑肽酶更强的转胞吞能力[53]。Angiopep-2 和紫杉醇、阿霉素、依托泊苷偶联形成的偶联物ANG1005、ANG1007、ANG1009均能很好地通过血脑屏障进入脑部位。临床前研究表明,ANG1005进入脑实质部位的浓度是紫杉醇的100倍左右,并且可以绕过p-糖蛋白。2007年,Angiochem公司以惊人的速度将其推入I期临床试验,主要针对恶性胶质瘤和脑转移瘤患者,2008年的评估结果显示ANG1005安全且耐受性良好[55]。
RGD和NGR三肽由于作用靶点明确,特异性高,常被用作靶向载体。为了提高喜树碱类化疗药物的治疗指数,意大利技术人员合成了一系列RGD肽-喜树碱偶联物,其中有2个偶联物(两个RGD肽和喜树碱衍生物通过溶酶体可断裂的丙氨酸-瓜氨酸二肽序列和多个分支乙二醇链连接而成)具有高受体亲和力、高肿瘤细胞黏附力、高细胞毒性以及良好的稳定性,现正处于临床前的体内疗效和急性毒性评价中[56]。另外有研究表明将RGD三肽和抗肿瘤抗生素云南霉素制成偶联物后,其细胞毒活性较RGD肽强,且具有与RGD肽相当的抗肿瘤细胞侵袭能力[57]。早在NGR序列发现之初,有学者就尝试将NGR和阿霉素偶联,并取得了较为满意的结果[58]。NGR-LDP-PYM则是利用NGR-LDP融合蛋白作为支架,将抗肿瘤抗生素平阳霉素(pingyangmycin,PYM)偶联于其上形成的蛋白-药物偶联物。该偶联物不仅保留了PYM的部分细胞毒活性和DNA切割活性,而且可以特异地与CD13/APN高表达的肿瘤细胞结合,此外偶联作用还可显著增强PYM抵抗博来霉素水解酶水解的能力[59]。
有些药物与靶向肽偶联以后并没有达到预想的抗肿瘤效果,可能原因是其内化效率低。细胞穿透肽(cell-penetratingpeptide,CPP)是一种富含碱性氨基酸的短肽,可以轻易穿透细胞膜。为了克服上述偶联物的不足,有研究者将肿瘤靶向肽和穿透肽通过柔性氨基酸相连,形成靶向-穿透双功能肽如GRD-Tat、PEGA-pVEC、gHo-pVEC 等。以这些肽作为载体形成的偶联物可以特异性地将DNA、基因、化疗药物带入肿瘤细胞内,从而达到消灭肿瘤细胞的目的[60-63]。
最近,科学家们还把焦点放在了一种同时具有靶向和穿膜功能的细胞穿透归巢肽(cellpenetratinghoming peptides,CPHPs)上[64]。2009年,伯纳姆医学研究所癌症研究中心首次报道了内化RGD(internalizing-RGD,iRGD,CRGDKGPDC),该序列既包含RGD基序又包含在血管生成、心血管发育和感应血管渗透性方面发挥着重要作用的靶向神经纤毛蛋白(neuropilin-1,NRP-1)的R(K)XXR(K)基序。该基序为VEGF-A165的一部分,只有处于C-端,即符合“C端规则”时才能显示出穿透能力[65]。iRGD通过三步进入肿瘤细胞,首先iRGD的RGD基序和肿瘤血管整合素αvβ3、αvβ5结合;然后在蛋白酶的作用下,暴露出RGDK基序;最后和神经纤毛蛋白结合,穿透细胞膜进入细胞。iRGD和其他药物联合使用,可以提高多种药物如小分子化合物、纳米药物和单克隆抗体的疗效指数,用IRDye 800CW、DOTA标记的iRGD可以靶向肿瘤显像。另外,iRGD和其他试剂偶联,可明显提高肿瘤显像敏感性,增强抗肿瘤药物的疗效[66-67]。
2013年,该研究中心又根据iRGD序列,重新设计了内化NGR(internalizing-NGR,iNGR,CRNGRGPDC),其靶向肿瘤血管和渗透肿瘤组织的能力比NGR肽更加有效,另外它还可将偶联的纳米粒带入肿瘤内部,从而更好地发挥纳米药物的疗效[68]。
4 结语
肽是蛋白质-蛋白质相互作用的基础,对特定分子靶点有高度特异性;同时,组成肽链的氨基酸可随意组合,易于设计针对不同靶点的靶向肽;此外,肽还可以进行拼接和组装,可作为药物的靶向载体。这些优点使得肽在肿瘤诊断和靶向治疗方面有着无可比拟的优势。然而,肽类药物也有一定的局限性,如半衰期相对较短、靶向性不如抗体及配体等,这些不足限制了肽类药物的临床应用。但化学家也有相应的应对办法,比如可以通过化学方法(如将L型氨基酸置换成D型氨基酸、引入新的官能团、与放射性核素及细胞毒药物偶联)来优化它们的生物活性、酶稳定性以及药代动力学等性质,从而提高它们疗效[16,69-70]。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。