
谷胱甘肽(GSH)是一种具有重要生理功能的活性三肽,结构中的巯基(—SH)易被氧化脱氢。因此,GSH不仅可以清除体内氧自由基及其他自由基,还能与重金属离子、多种化学物质及其代谢物结合,并促进其排出体外,帮助体内保持正常免疫系统的功能[1⇓~3]。GSH在人体血液中的含量为26~34 mg/100 g,过量会引起如阿尔茨海默症、沃纳综合症、帕金森症、癌症及心脏疾病等疾病;缺乏则会造成发育缓慢、脱发、嗜睡、牛皮癣、肝损害、肌肉和脂肪减少等问题[4,5]。因此,实时、精准地检测细胞内GSH的含量对于临床诊断、疾病治疗、病原体检测意义重大。
目前,检测GSH的方法[6⇓⇓⇓~10]有高效液相色谱法、电化学法、比色法、荧光分析法等,其中基于荧光探针的荧光分析法[11]灵敏度高、响应速度快、选择性好且可实时监测,成为检测GSH领域的研究热点,并广泛用于生物体内定性或定量检测。
基于GSH上—SH的强亲核性、还原性以及对金属离子高亲和力的独特性质,运用[12⇓⇓~15]迈克尔加成反应、亲核取代、还原反应以及硫醇诱导的2,4-二硝基苯磺酰基(DNBS)的断裂反应与络合反应对GSH进行检测。检测机理[16]主要基于荧光共振能量转移(FRET)、电子传递(ET)、分子内电荷转移(ICT)、光诱导电子转移(PET)、激发态分子内质子转移(ESIPT)及内滤荧光效应(IFE)。为进一步从分子结构上认识、了解GSH荧光探针,从有机小分子荧光探针和无机纳米荧光探针的角度对GSH荧光探针进行概括和总结。重点讨论了12种荧光团[16⇓~18]对探针的荧光性能和生物应用的影响,并分析了GSH响应机制。
2 检测GSH的有机小分子荧光探针
可用于检测GSH的有机小分子荧光探针可分为香豆素类、BODIPY类、罗丹明类、花菁类、苯并噻唑类、萘酰亚胺类、金属有机骨架类以及其他有机荧光探针。
2.1 用于GSH检测的香豆素类荧光探针
作为一种内酯化合物,香豆素具有荧光量子产率高、Stokes位移大、光学性能好、结构易修饰等优点,是设计合成特异性检测GSH荧光探针的理想底物,相比于传统荧光探针基于非共价键的超分子相互作用,香豆素类荧光探针多属于反应型探针,其识别过程主要是与GSH发生不同类型的反应,生成具有荧光性质的化合物,进而使荧光探针的光学信号发生改变,最终实现对GSH的灵敏检测[19]。
2.1.1 基于迈克尔加成的香豆素类荧光探针
香豆素类探针具有吸电子基团,易被GSH中亲核的硫阴离子(GS-)攻击。最终,α和β碳原子之间的双键被打破,完成迈克尔加成。基于上述机理,设计了许多基于迈克尔加成的香豆素类荧光探针(图1)。
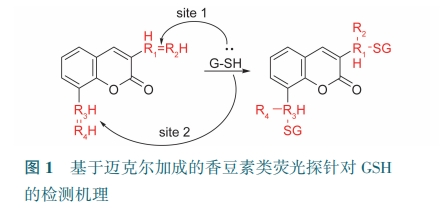
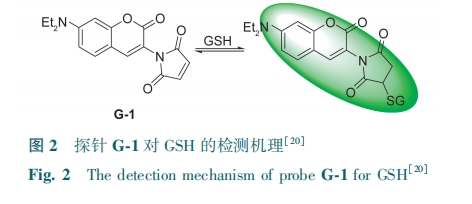
可逆荧光探针有利于定量、实时监测活细胞中GSH的变化。Chen等[20]设计出一种可逆的香豆素类探针G-1。GSH的—SH与探针的马来酰亚胺进行迈克尔加成(图2),从而使489 nm处荧光增强。G-1检测限为760 nmol·L-1,成功应用于L929细胞和HeLa细胞内GSH成像。
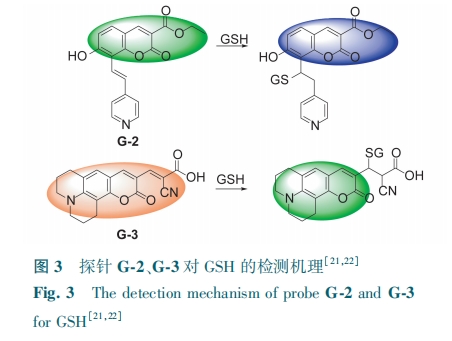
比率探针通过内置校正可提高检测GSH的精度。Khatun等[21]合成了一种以香豆素为主体的比率荧光探针G-2。G-2与GSH发生迈克尔加成反应,阻断了与吡啶部分π共轭的扩展,使得荧光颜色由绿变蓝(图3)。随着GSH浓度的增加,F460/F510的荧光强度比值呈线性上升趋势,检测限为245 nmol·L-1。G-2可定位进入GSH缺失的细胞器(如核仁、线粒体和溶酶体),应用于追踪细胞周期过程中GSH。Tian等[22]则合成了比率荧光探针G-3。G-3与GSH发生迈克尔加成反应,使GSH的共轭降低,导致吸收峰蓝移,发出绿色荧光(图3)。随着GSH的增加,G-3荧光强度比值F488/F405 呈上升趋势,对GSH的检测限为50 mmol·L-1。G-3成功应用于不同的活细胞中GSH水平的比率成像。
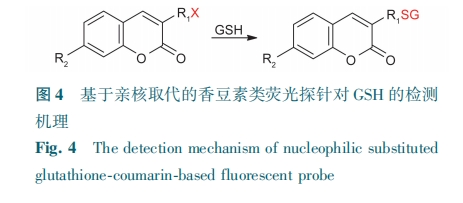
2.1.2 基于亲核取代的香豆素类荧光探针
GSH分子中—SH易与吸电子基团卤素发生亲核取代反应。许多研究者利用这一反应在香豆素荧光团上引入卤素原子,通过GSH与卤素原子之间的取代反应,达到荧光转换效果(图4)。
增加探针与GSH中—SH和—NH2的反应位点可以提高检测GSH的灵敏度。Li等[23]首先在香豆素的3位引入α,β-不饱和丙二腈,4位引入一个氯原子,制得探针G-4,由于分子内存在吸电子基团导致探针荧光猝灭。GSH的—SH取代探针G-4的氯原子,—NH2与丙二腈发生环化反应,ICT过程受到抑制,G-4荧光恢复,发射黄色荧光(图5),对GSH检测限为0.43 μmol·L-1。该探针可用于人宫颈癌细胞水平GSH成像。基于同样的设计策略,通过将氯化香豆素和苯并噻唑乙腈结合,Yin等[24]开发了新型荧光探针G-5。探针的香豆素部分中4位的氯原子与—SH进行卤素取代。在氰基的影响下,具有不饱和键的苯并噻唑部分可作为另一个反应位点与—NH2发生分子环合(图5)。G-5的检测限为6.9 nmol·L-1。G-5成功应用于外源性活细胞GSH的荧光成像。
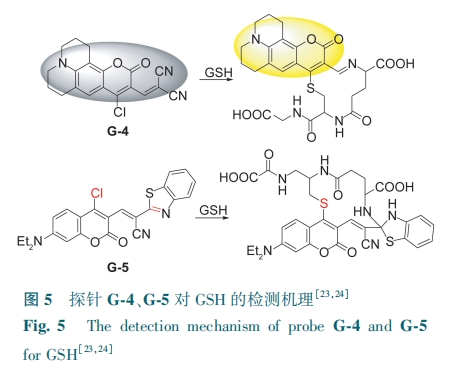
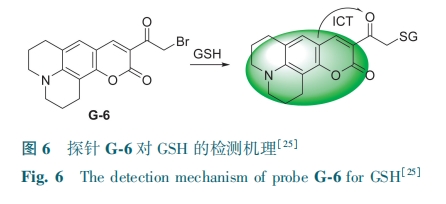
临床研究表明,喉癌肿瘤细胞中GSH水平明显高于正常或瘤周组织,但目前荧光探针在临床标本上的应用仍然很少。基于此,Zou等[25]设计了一种基于香豆素衍生物的双光子荧光探针G-6。由于溴原子的重原子效应,探针G-6是无荧光的。在GSH存在下,溴化的部分可以被—SH亲核取代,并伴有强的荧光发射现象(图6)。该探针的荧光强度与GSH浓度(0~15 mmol·L-1)呈良好的线性关系,检测限为90 μmol·L-1。G-6成功地区分了喉癌组织和正常组织,可用于检测活细胞、小鼠模型和人类临床癌症组织中的GSH。
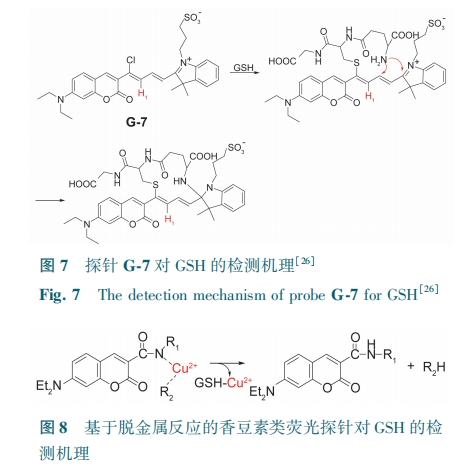
Yang等[26]以香豆素和半氰胺为原料合成了一种近红外荧光探针G-7。该探针与GSH在反应过程中发生了亲核取代和分子内环化两个过程(图7)。随着GSH的加入,G-7通过红光发射在A375细胞中对内源性GSH进行生物成像。
2.1.3 基于脱金属反应的香豆素类荧光探针
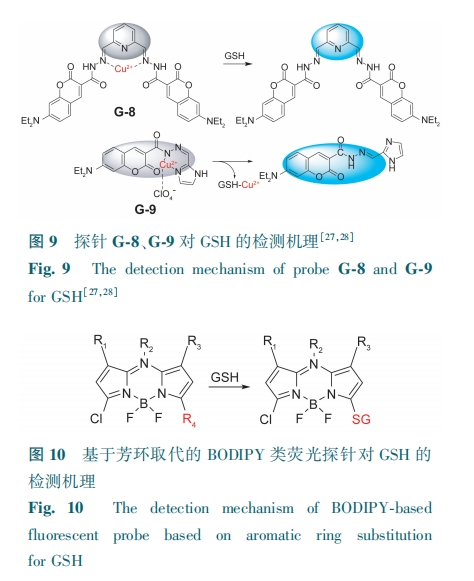
该类香豆素荧光探针因与金属离子配位,发生PET或者配体-金属电荷转移(LMCT)导致荧光猝灭。而GSH分子中—SH与金属离子有更强的络合能力,可与该络合物发生脱金属反应,形成GSH-金属络合物,使得荧光恢复(图8)。
席夫碱制备简便,其结构上的亚氨/烷亚氨基使得探针与金属离子的配位能力增强。He等[27]基于席夫碱易配位特性,选取香豆素酰肼和2, 6-吡啶二甲醛为原料合成双席夫碱香豆素探针G-8。G-8本身具有较强的荧光,与Cu2+配位后,由于顺磁性和光诱导电子转移,探针荧光猝灭。加入GSH后,发生脱金属反应(图9),从而使485 nm处的荧光恢复。该探针可应用于荧光成像并特异性检测人宫颈癌细胞中的GSH。He等[28]以香豆素酰肼和咪唑-2-甲醛为原料设计并制备了一种新型荧光探针G-9。Cu2+与G-9络合,使得G-9的吸电子能力增强。两者相互作用提供了一个额外的荧光猝灭通路。激子能量从配体转移到金属d轨道或者发生了LMCT,从而导致G-9的荧光猝灭。由于GSH从G-9-Cu2+中捕获铜金属离子的能力较强,G-9-Cu2+去蚀,释放G-9,荧光恢复(图9)。G-9-Cu2+对GSH的检测限为0.12 μmol·L-1。该探针可用于生理条件下内源性GSH的检测,为GSH的生物分子检测提供了一种新方法。
2.2 用于检测GSH的BODIPY类荧光探针
BODIPY是一类重要的有机荧光染料,其分子结构易于改性便于修饰,并具有量子产率高、稳定性高等特点。修饰后的BODIPY类荧光探针利用自身复杂的分子结构,可达到检测GSH的目的。
2.2.1 基于芳环取代的BODIPY类荧光探针
含不稳定取代基的荧光团易与GSH发生亲核取代反应生成硫醚(图10)。
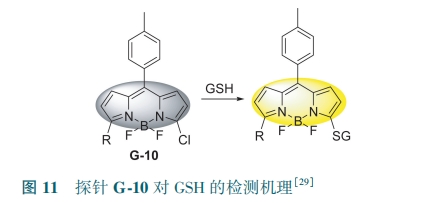
Liu等[29]在BODIPY上引入氯原子,设计了荧光探针G-10。氯原子可与GSH上的—SH发生芳环亲核取代反应得到硫醚(图11),使得557 nm处荧光强度降低,588 nm处荧光强度增加,对GSH的检测限为1.1 μmol·L-1。通过在探针5位上引入带正电荷的三苯基膦官能团,可作为线粒体递送载体,利用静电引力将探针传送到线粒体。除此之外,该探针可用于人宫颈癌细胞外源性GSH成像。
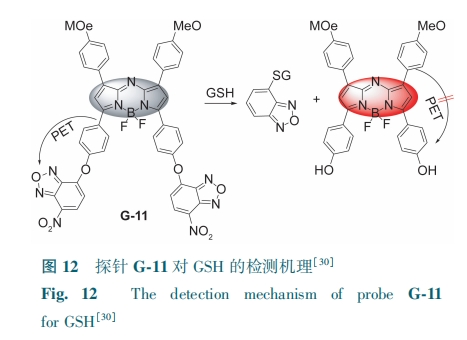
氮杂-BODIPY的发射波长较长,有利于深入体内,在分子成像过程中对生物样品的损伤较小。Xiang等[30]报道了一种含有两个7-硝基苯并-2-氧杂-1, 3-二唑(NBD)基团的BODIPY近红外探针G-11。NBD不仅是GSH诱导的亲核取代反应的离去基团,还可通过PET过程促使荧光探针猝灭。G-11中的NBD被GSH的-SG取代,产生硫-NBD和氮杂-BODIPY,并在730 nm处释放红色荧光(图12)。G-11可用于检测人宫颈癌细胞中的GSH。
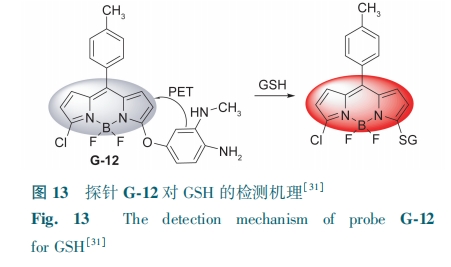
BODIPY 3号位上取代基的推拉电子能力会影响亲核芳香取代反应的活性。Chen等[31]将3,4-氨基苯酚引入氯化的BODIPY中,开发了荧光探针G-12。附着在BODIPY核上的苯酚衍生物通过芳香亲核取代与GSH发生反应,产生红色荧光(图13)。探针的荧光强度与GSH(0~100 μmol·L-1)浓度存在良好的线性关系,检测限为56 nmol·L-1。该探针可在RAW 264.7细胞中诱导的炎症介质中明显观察到GSH升高,成功检测了巨噬细胞中外源性和内源性的GSH。
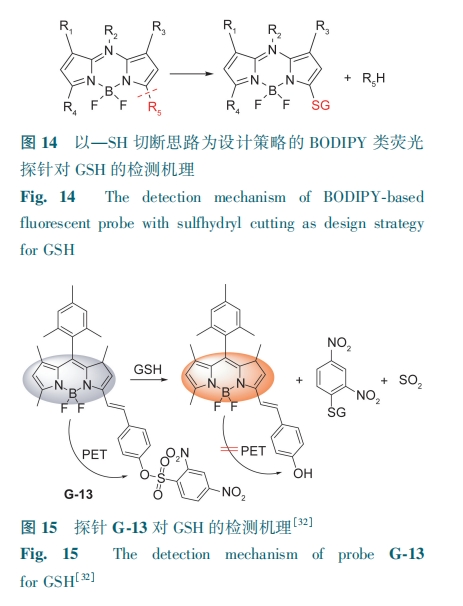
2.2.2 以—SH切断思路为设计策略的BODIPY类荧光探针
通过—SH消除探针分子中的共价连接,达到荧光信号转换的效果,也是设计GSH探针的好策略 (图14)。
基于荧光猝灭基团DNBS被—SH切断后探针荧光恢复的研究思路,Wang等[32]设计合成了一种含有DNBS且以BODIPY为母核的探针G-13。探针中的DNBS被GSH的—SH切断,在582 nm处产生橙色荧光(图15)。探针能够快速进入人宫颈癌细胞,高度选择性检测出细胞内GSH。
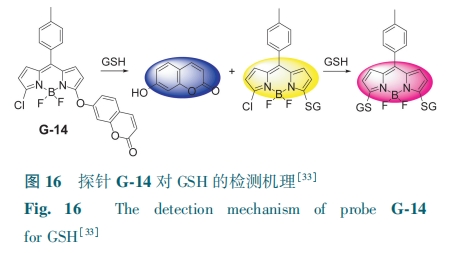
Liu等[33]将香豆素作为一种内标荧光团,利用芳环上的亲核取代反应,通过共价连接氯代BODIPY和香豆素,合成了荧光探针G-14。G-14具有绿色荧光,GSH上的—SH切断香豆素与BODIPY的共价连接后得到香豆素及对应的BODIPY衍生物。香豆素部分在453 nm处产生蓝色荧光,GSH取代的BODIPY衍生物在558 nm处产生黄色荧光。加入过量的GSH则形成二取代BODIPY衍生物,在588 nm处发出粉色荧光(图16)。该探针对GSH的检测限为1.07 μmol·L-1,可用于人宫颈癌细胞中外源性GSH的成像研究。
2.3 可用于检测GSH的罗丹明类荧光探针
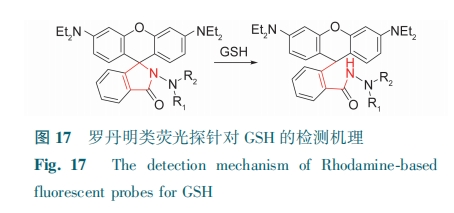
罗丹明是一种呫吨类荧光染料,其衍生物螺环打开会引起荧光“开关”现象,同时伴随荧光颜色变化(图17)。用于特异性检测GSH一直是罗丹明类探针研究的热点。
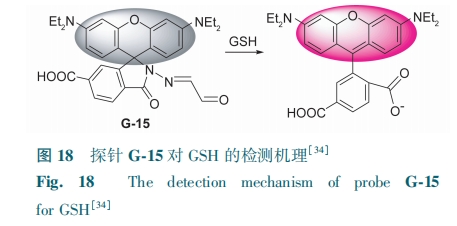
在底环上引入亲水基团可以改善罗丹明类荧光探针水溶性差的特点,Ouyang等[34]以偏苯三酸酐为原料合成了含羧基的罗丹明探针G-15。当GSH中的—SH与罗丹明醛基加成时,开环水解成具有荧光的罗丹明衍生物,576 nm处荧光强度显著增加,裸眼观察溶液颜色由无色变成粉色(图18),对GSH的检测限为27 nmol·L-1。探针G-15可用于检测人宫颈癌细胞水平上的GSH。
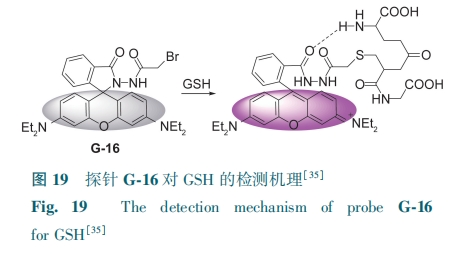
Chen等[35]研制了一种基于罗丹明的荧光探针G-16。结构中螺旋体的内酰胺环破坏了罗丹明荧光团的共轭,使得G-16没有荧光。GSH与环溴酰胺基团发生亲核取代,促进螺旋体内酯开环,释放出罗丹明发色团,荧光颜色从无色变为粉色(图19)。G-16的荧光强度与GSH浓度(5~50 μmol·L-1)呈良好的线性关系,检测限为0.17 μmol·L-1。G-16可用来监测氧化剂引起的GSH的细胞氧化还原状态。
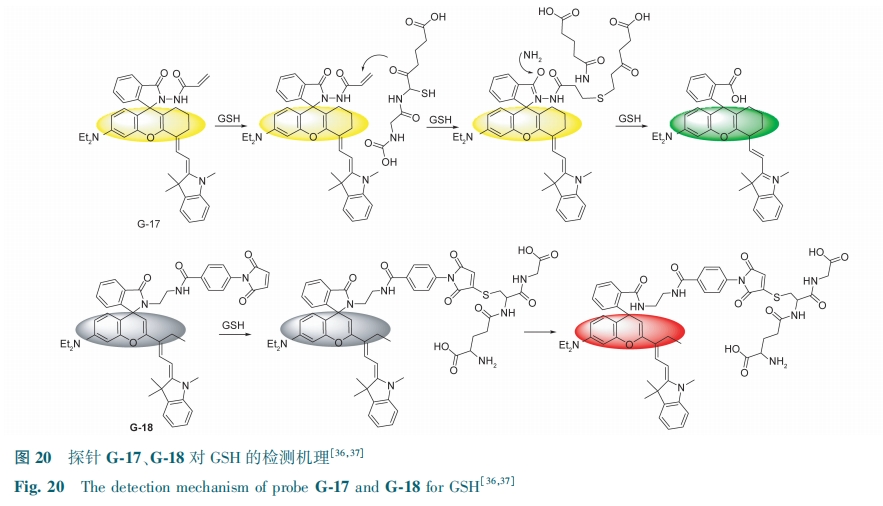
近红外荧光发射探针具有强组织穿透性、低自发荧光干扰等优点,近年来越来越受到关注。Tong等[36]设计并合成了一种基于共轭加成和分子内氨基诱导螺旋体内酰胺开环的新型GSH近红外探针G-17。GSH中的-SH与G-17中的醛基发生加成反应,生成不稳定的中间体。然后,罗丹明的羰基与GSH的—NH2基团发生反应,诱导罗丹明内酰胺开环,荧光颜色由黄色变为绿色(图20),检测限为0.1 μmol·L-1。G-17可应用于MCF-7细胞内源性和外源性GSH成像,是一种快速有效的检测活细胞中过量GSH的方法。Yang等[37]也设计并合成了一种近红外荧光探针G-18。G-18由于罗丹明部分的螺旋体内酰胺环而没有荧光。加入GSH后,氢离子与GSH的羧基相互作用,形成不稳定的中间体。由于罗丹明部分与带负电荷的羧酸基团之间的距离减小,产生一个高酸性的微环境,从而使得罗丹明的螺旋环部分打开,荧光开启,发出明亮的红色荧光(图20)。在GSH浓度1~3 μmol·L-1的范围内,探针与其有良好的线性关系,检测限为70 nmol·L-1。该探针已成功地应用于血清中GSH的测定和低细胞毒性活细胞中GSH的生物成像。
2.4 用于检测GSH的花菁类荧光探针
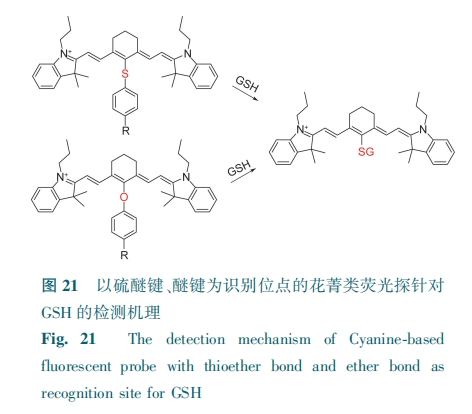
花菁类荧光探针的荧光母核为花菁染料(花菁染料、半花菁染料、Oxonol染料)。这类探针含有季铵盐阳离子,具有很好的亲和力并能够有效富集于线粒体中。此外,合成步骤简便、背景干扰小、量子产率高。因此,研究与拓展该类探针具有现实意义。探针的硫醚键是GSH识别位点,发生亲核反应,生成硫醚化合物,并伴随荧光变化(图21)。
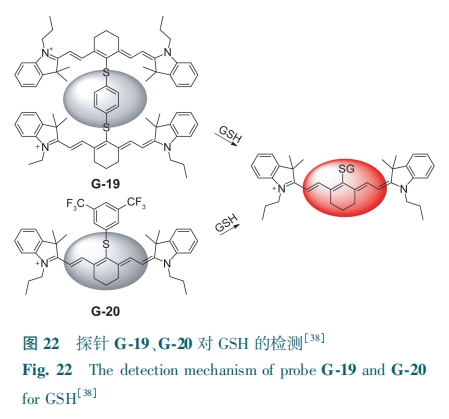
Lee等[38]以花菁为母体,开发了两例荧光增强型探针G-19、G-20。探针G-19通过苯硫醚键连接两个花菁单元,导致探针自猝灭。探针G-20含有3,5-二(三氟甲基)苯硫醚基团,花菁部分与3,5-二(三氟甲基)苯硫醚发生PET而使探针无荧光。GSH切断G-19和G-20的硫醚键,导致两个近红外探针在805 nm处荧光显著增强(图22)。探针G-19、G-20对GSH的检测限分别为0.63 和0.33 μmol·L-1。它们可用于SCC7荷瘤小鼠内GSH的荧光检测与成像。
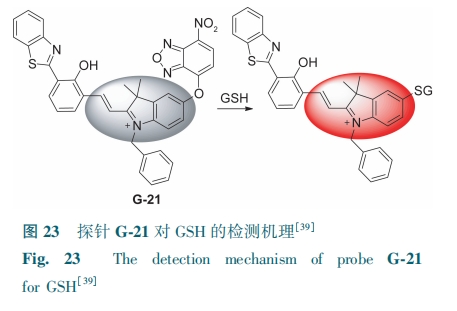
Lin等[39]通过醚键将羟基苯并噻唑茂菁(HBTMC)和NBD连接,制成了荧光探针G-21。G-21自身无荧光。GSH与探针发生亲核取代反应,609 nm处红色荧光增强(图23)。该探针可用于在细胞水平上GSH的荧光检测。
2.5 用于检测GSH的苯并噻唑类荧光探针
与经典的荧光机制(PET、ICT和FRET)相比,ESIPT有大Stokes位移和高环境敏感性,更具吸引力。而2-(苯并噻唑-2-基)苯酚衍生物具有光稳定性优异、荧光量子产率高、细胞膜通透性好等优点,因此可将其从苯酚形式转化为酮式的ESIPT过程作为设计策略,开发检测GSH的荧光探针(图24)。
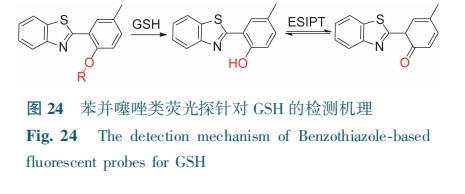
Chen等[40]合成了一例大Stokes位移(202 nm)的联苯基苯并噻唑衍生物探针G-22。将DNBS作为识别基团及电子受体,其与羟基苯并噻唑(HBT)部分的PET抑制了HBT分子内部ESIPT,致使探针荧光猝灭。当GSH与探针反应时,DNBS与苯并噻唑衍生物间的PET被阻断,生成的4-羟基-3-(苯并噻唑-2-基)-4-联苯基腈产生分子内ESIPT,荧光开启发出强烈的青色荧光(图25),对GSH的检测限为0.17 μmol·L-1。Zheng等[41]开发了荧光探针G-23用于跟踪GSH。G-23没有荧光。加入GSH后,形成了G-23-OH,发生ESIPT,显示了一个大的Stokes位移,探针发出绿色荧光(图25)。探针对GSH(0~1 mmol·L-1)检测限为330 nmol·L-1。G-23可应用于活细胞和斑马鱼内源性GSH的成像。

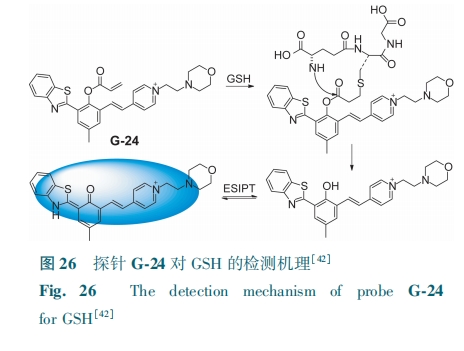
Zhang等[42]基于HBT合成了一种新颖的单激发双发射荧光探针G-24。GSH与探针先发生迈克尔加成和酯裂解反应,后发生ESIPT,探针的颜色从无色变为浅蓝色(图26)。该探针对GSH的检测限为0.24 μmol·L-1。G-24为利用化学反应和分子间弱相互作用制备多选择性探针提供了新的途径。
2.6 用于检测GSH的萘酰亚胺类荧光探针
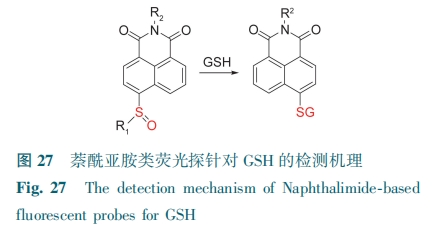
萘酰亚胺衍生物具有共轭体系较大、含强给电子基团等特点。在萘酰亚胺4位引入给电子基团,它的共轭体系改变,形成分子内具有供-吸电子电荷转移的化合物,这种化合物往往能产生很强的荧光。该类探针具有亚砜基团,GSH常以其为识别位点,发生芳香亲核反应,生成硫醚化合物(图27)。
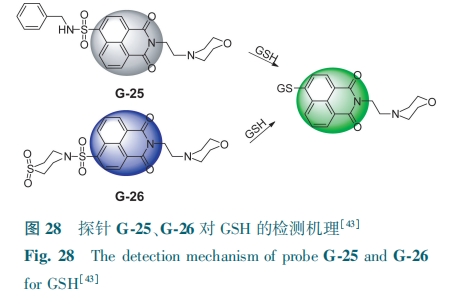
Liu等[43]先后开发了两例GSH荧光探针G-25、G-26。G-25荧光团上接有非氧化态的吗啉基,是一种开关型荧光探针,初始态无荧光。G-26则是以两个氧化吗啉(硫代吗啉-S-二氧化物和吗啉-N-氧化物)为功能基团,探针呈蓝色荧光。GSH与两例探针的磺酰胺发生取代反应后得到相同产物,在495 nm处发出绿色荧光(图28)。探针可用于检测溶酶体中的GSH。
双光子探针通常采用双荧光团和识别基团结合来设计探针结构,利用这类探针进行细胞成像具有更低的光毒性、更好的三维空间定位、更深的穿透深度和更低的自身吸收的优点。Xu等[44]设计了荧光探针G-27。GSH通过芳香亲核取代机制攻击G-27,亲核取代产物产生绿色发射,裂解产物产生橙色发射(图29)。在加入GSH(2~150 μmol·L-1)后,探针在495 nm处的荧光强度逐渐增大,呈良好的线性关系,检测限为0.10 μmol·L-1。该探针成功地应用于双色荧光成像,检测活细胞中的GSH。
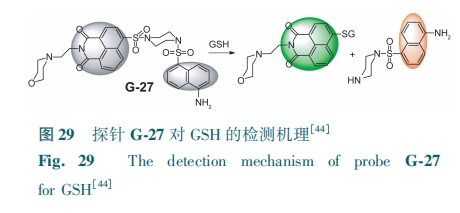
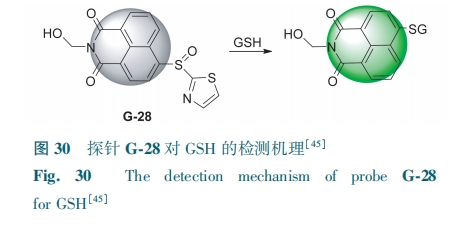
为探索活细胞中决定探针灵敏度的关键结构因素,Zong等[45]合成了以亚砜基为识别基团的GSH超灵敏探针G-28。加入GSH后,—SH攻击探针中的亚硫酰基,发生亲核取代(图30)。G-28的荧光强度对GSH的响应呈单指数增长,对GSH(0~500 mmol·L-1)的检测限为0.11 mmol·L-1。G-28可追踪发育神经元中GSH水平的细微波动,对发育中神经元的GSH通量进行生物成像。
2.7 用于检测GSH的金属有机骨架荧光类探针
金属有机骨架材料(MOFs)通常是一系列由金属离子或金属团簇与有机配体(通常含有羧酸、氮、硫)有序排列并通过配位键连接的多孔骨架结构材料。与有机分子不同,MOFs中由金属离子或金属团簇和有机配体形成的刚性框架可以将配体与金属中心节点分离,增强荧光,减少自猝灭。此外,由于其可调的多孔结构,基于MOFs的传感器比其他荧光传感器更灵敏。目前,MOFs已被深入开发用于构建荧光化学传感器,将该新型材料用于GSH检测也有一定优势。
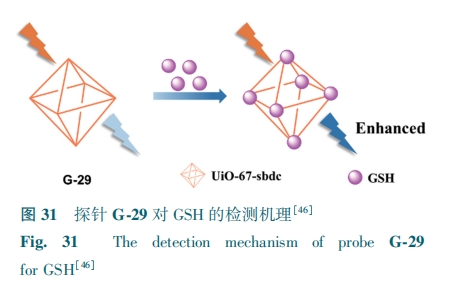
UiO-67具有优异的光学性能,GSH可以通过与配体之间的电子效应有效增强UiO-67的荧光,从而实现GSH识别。基于上述原理,Zhu等[46]制备了以UiO-67为骨架的荧光探针G-29,因为配体(4,4'-二苯乙烯甲酸)具有共轭结构导致G-29具有荧光。
当GSH接近配体时,GSH的供电子基团(肽键和—SH)会增加共轭结构的电子密度,从而增强配体的共轭度,增强溶液荧光(图31)。G-29的荧光强度与GSH浓度(0.5~10 mmol·L-1)有良好的线性关系,检测限为97.5 μmol·L-1。G-29有望作为临床医学的诊断工具。
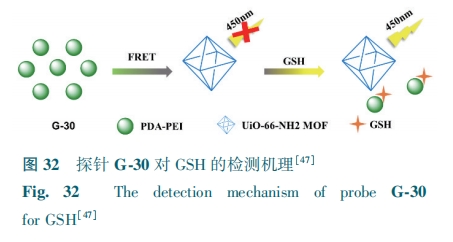
Wang等[47]利用UiO-66-NH2,建立了比率荧光探针G-30。多巴胺在聚乙烯亚胺(PEI)溶液中自氧化形成共聚物(PDA-PEI)。PDA-PEI通过FRET使G-30的荧光猝灭。由于GSH的还原性,阻止了PDA-PEI的形成,并且可以恢复G-30的荧光(图32)。探针对GSH(1~70 μmol·L-1)的检测限为0.57 μmol·L-1。该探针应用于人血清样品中的GSH检测。
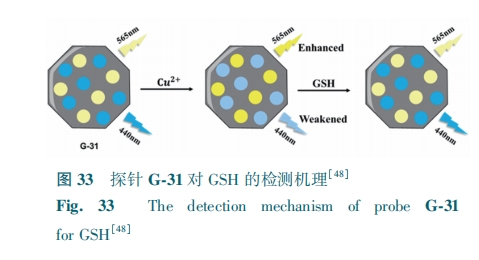
Jalili等[48]利用咪唑沸石框架(ZIF-8)将黄色和蓝色碳点封装在内,制备了一种双发射金属有机框架G-31。在Cu2+的存在下,G-31中黄色碳点的荧光增强,而蓝色碳点的荧光猝灭。在Cu2+-G-31体系中加入GSH后,由于GSH与Cu2+的强烈相互作用,两个碳点的荧光逐渐恢复 (图33)。在紫外线照射下,可以通过荧光强度变化达到检测目的。G-31对GSH的检测范围为3~25 nmol·L-1,检测限为0.90 nmol·L-1。
2.8 用于检测GSH的其他有机荧光类探针
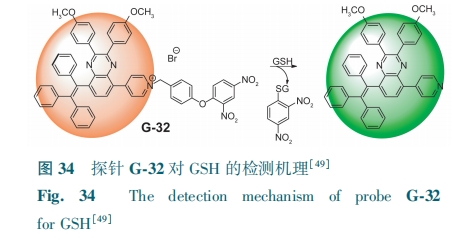
由聚集引起的猝灭效应(ACQ)会限制探针在体内的使用,所以开发抗ACQ效应的GSH型荧光探针具有很大的意义。Cui等[49]设计了一种具有扭曲分子内电荷转移(TICT)和聚集增强发射特性(AIE),含三苯基乙烷的喹口恶啉吡啶化合物G-32。GSH将G-32结构中的二硝基苯基醚裂解,产物具有AIE活性且水溶性较低,从而在516 nm左右开启了荧光,颜色由橙色变为绿色(图34)。探针的荧光强度与GSH浓度(0~10 μmol·L-1)呈良好的线性关系,检测限为434 nmol·L-1。G-32成功地检测了牛血清样品中的GSH。此外,还可以通过共聚焦激光扫描显微镜检测HeLa细胞中的GSH。
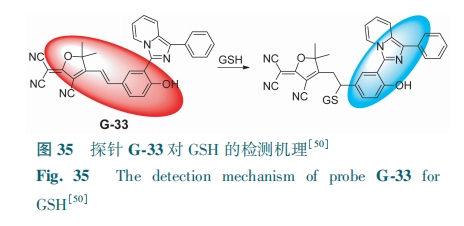
咪唑[1,5-α]吡啶具有出色的光学特性,如强光稳定性、高量子产率和大Stokes位移。Hou等[50]扩展了咪唑[1,5]吡啶的共轭体系,合成了一种新的荧光探针G-33。由于ICT,电荷从咪唑[1,5]吡啶部分转移到呋喃部分,G-33产生红色荧光。GSH与G-33中碳碳双键部分发生迈克尔加成,抑制ICT,G-33的荧光颜色从红色变为青色(图35)。G-33对GSH(0~30 μmol·L-1)的检测限为97 nmol·L-1。该探针成功地用于MCF-7细胞和斑马鱼内源性GSH的成像,是研究内源性GSH的强有力的分子工具。
卟啉是一类天然存在的大环化合物,在活生物体代谢中起重要作用。由于特殊的光电特性,如强吸光度、高发射率和丰富的化学性质,卟啉已广泛应用于UV-vis传感器、光电化学传感器(PEC)和电化学发光。Chen等[51]制备了一例基于5,10,15,20-(4-磺基苯基)卟啉(TPPS4)-Hg2+的裸眼可视“开关”型荧光探针G-34。在Hg2+存在下,电子给体氮原子的孤对电子转移到Hg2+的空轨道上,形成复合物,从而导致G-34的荧光猝灭。加入GSH后,GSH对Hg2+的亲和力比卟啉环的N原子强,使得探针转为“开”状态,荧光颜色变为粉色。在640 nm和700 nm处,探针对GSH(0~28.5 μmol·L-1、38.15~61.87 μmol·L-1)的裸眼检测限为0.43 nmol·L-1。
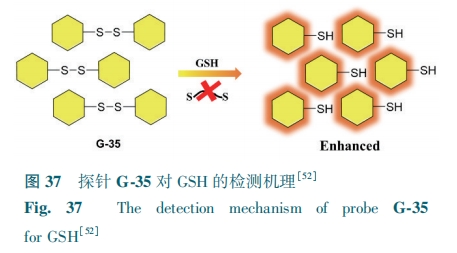
GSH中的—SH具有还原性,可使探针分子中的二硫键断裂,从而荧光恢复/增强(图36)。基于二硫键-硫醇交换反应,设计了下列两种探针(图37、38)。

Hu等[52]合成了基于AMC的席夫碱荧光探针G-35。探针的自身荧光来自n-π*诱导的席夫碱中两个碳氮键的传递。GSH对二硫键响应,通过硫醇-二硫键交换反应裂解成—SH,从而导致荧光强度的增加(图37)。该探针对GSH的检测限为36 μmol·L-1。G-35可在HeLa细胞中进行GSH成像。
方形素(SQ)是典型的近红外染料,Zheng等[53]建立了一种基于方形素的新型近红外自猝灭探针G-36。G-36由两个SQ荧光团通过二硫键连接而成,由于ACQ增强和FRET介导的自猝灭效应,背景荧光强度很弱。GSH通过分子间氢键和特定的静电相互作用选择性裂解G-36的二硫键连接物,中断两个SQ荧光团之间的荧光自猝灭效应(图38)。该探针检测限为0.15 μmol·L-1。G-36可以监测肿瘤或正常细胞内的内源性和外源性GSH。
3 检测GSH的无机纳米荧光探针
目前用于检测GSH的有机荧光探针普遍具有水溶性较差的缺点,而设计的无机荧光探针,如半导体量子点(QDs)、碳点(CDs)、金属纳米簇(NCs)等则具有较好的水溶性。该类荧光探针大多基于荧光的猝灭与恢复的原理来检测GSH。
3.1 用于检测GSH的半导体量子点
QDs是指由半导体材料合成的尺寸在0~100 nm的微小颗粒,主要由Ⅱ-Ⅵ族或Ⅲ-Ⅴ族元素组成。由于其优良的光学性能,可用于对GSH的特异性检测。
基于晶体紫(CV)功能化QDs可以方便、快速、低成本地检测GSH。Sheng等[54]制备了一例水溶性巯基丙酸(MPA)封端的QDs与CV混合的纳米荧光探针G-37,CV的N+和MPA的—COO-之间因静电相互作用产生FRET使探针发生荧光猝灭。由于GSH与Cd2+结合能力比MPA强,使MPA携带CV从QDs的表面解离下来,QDs的荧光恢复(图39)。在550 nm处,G-37的荧光强度与GSH浓度(0.02~50 μmol·L-1)呈良好线性关系,对GSH的检测限为8.2 nmol·L-1。探针G-37为快速测定水样和尿样中GSH提供了新思路。
在含金属的QDs中,ZnS的化学毒性相对较小。ZnS QDs作为一种生态友好型荧光探针,化学稳定性高,在荧光化学领域具有巨大的应用潜力。Amouzegar等[55]以此为设计策略合成了一种MPA包封的探针G-38。加入Zn2+后,生成Zn(OH ,并在量子点表面形成了钝化层,导致量子点的荧光增强。在Zn2+-G-38中加入GSH后,GSH能与Zn2+形成配合物,导致Zn(OH 裂解,量子点钝化层被破坏,从而荧光强度降低(图40)。GSH检测范围为1.95~104.0 μmol·L-1,检测限为0.92 μmol·L-1。
对QDs表面进行改性可开发出敏感和生物相容性良好的荧光探针,可用于细胞中GSH的检测。Sun等[56]在二氧化硅包覆的半导体量子点(QD-SiO2)上增加MnO2纳米片,制备稳定的生物相容性荧光纳米探针G-39。MnO2通过FRET猝灭QD-SiO2的荧光。加入GSH使MnO2纳米片被还原降解,G-39的荧光恢复。探针荧光强度随着GSH浓度增加而逐渐增大,在0.01~120 μmol·L-1范围内呈良好线性关系。G-39具有生物相容性好和细胞摄取能力强的特点,已成功用于细胞内GSH的实时成像。
3.2 用于检测GSH的碳点
CDs是近年来出现的一种新型的荧光碳纳米粒子,分为石墨烯量子点、碳量子点、碳纳米点和碳化聚合物点。由于其具有优良的光学特性、良好的生物相容性、低毒性等优点,在物质检测和细胞成像等方面发挥着重要作用。CDs检测GSH的原理一般都为间接检测,首先,CDs与物质结合导致荧光猝灭;加入GSH后可以恢复CDs的荧光,从而达到检测GSH的目的。
由于—SH对Cu2+具有很强的络合能力,基于金属离子置换法能够实现GSH的检测。Yang等[57]用三乙基四胺对CDs表面改性得到探针G-40。由于Cu2+易被G-40表面上的氨基和酰胺基选择性捕获,形成G-40/Cu2+的聚集体,荧光猝灭。当GSH加入到G-40/Cu2+聚集体系中,GSH和Cu2+之间的强相互作用使聚集体结构被破坏,在470 nm处释放蓝色荧光(图41)。探针的荧光强度与GSH浓度(0.2~175 μmol·L-1)线性关系良好,检测限为0.11 μmol·L-1。G-40可用于活体酵母细胞中Cu2+和GSH的检测。
直接热解柠檬酸获得的CDs经1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)进行表面钝化后,荧光有较大改善。Pan等[58]通过这种方法设计了荧光探针G-41。GSH和过量的EDC溶液混合,部分EDC与GSH形成稳定的复合物,把CDs加入上述混合溶液中,CDs表面被剩余的EDC钝化,相当于GSH间接控制CDs的表面钝化程度(图42)。G-41对GSH(1~50 μmol·L-1)的检测限为0.943 μmol·L-1。探针G-41可用于人血清中的GSH监测。
当卤原子引入荧光探针的共轭体系时,系间窜越速度增加,探针的荧光减弱,形成“重原子效应”[59],而—SH化合物可以取代卤原子使探针荧光恢复。基于该思路,本课题组[60]设计合成了一种以CDs为母体、溴乙酰溴为功能化基团的荧光探针G-42。由于重原子效应,G-42自身荧光猝灭。当溴原子被GSH的—SH取代后,荧光恢复。在470 nm处G-42的荧光强度与GSH(0~36 μmol·L-1)呈线性关系,检测限为140 nmol·L-1。由于G-42具有低毒性和良好的细胞渗透性,可用于在人脐静脉血管内皮细胞水平上检测GSH。
为避免荧光团或受体和荧光团之间用共价键连接的复杂过程,Wu等[61]研制了一例基于IFE的荧光纳米探针G-43,氮掺杂CDs作为荧光团,DTNB作为识别分子。GSH与探针中的DTNB生成5-硫代-2-硝基苯甲酸(TNB),TNB具有较高的摩尔消光系数,且与氮掺杂CDs的激发光谱重叠,产生IFE,导致510 nm处G-43的荧光强度逐渐降低。G-43对GSH的检测限为30 nmol·L-1。该探针可用于小鼠氧化应激模型研究以及人肝癌细胞成像。
Jia等[62]设计了一种吡啶N含量高的红色碳点G-44,可以比色和荧光双模式检测GSH。加入GSH后,G-44的颜色从红色变为紫色。G-44在576~486 nm的吸光度比与GSH(12.5~800 μmol·L-1)的对数浓度线性成正比,检测限为0.7 μmol·L-1。此外,他们还制备了以该探针为基础的纤维素复合水凝胶和试纸条,为便携、准确、灵敏地检测GSH提供了很大的机会。
在柠檬酸(CA)和聚醚酰亚胺(PEI)合成的CDs的基础上,Wang等[63]以CA、PEI和罗丹明B为前驱体,开发了双波长发射的探针G-45。在360 nm激发时,荧光光谱显示出CDs (447 nm)和罗丹明B(581 nm)两个发射带,分别为蓝色和橙色。加入Hg2+后,G-45在447 nm处的荧光被猝灭。而GSH可以恢复Hg2+猝灭的荧光(图43)。该探针荧光强度比值(F447/F581)与GSH浓度(1~10 μmol·L-1)呈正比,检测限为0.27 μmol·L-1。G-45可实现水、人血、尿等水溶液中GSH的测定。
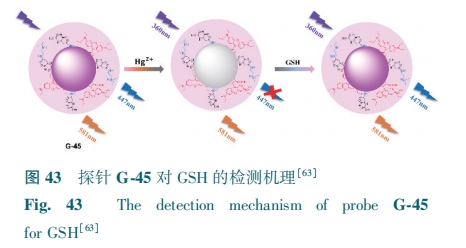
Li等[64]制备了双发射碳点G-46。GSH与G-46表面的含氧官能团易形成分子间氢键,诱导探针有序聚集,形成形状不均匀的大纳米颗粒,从而导致G-46在430 nm处的荧光峰呈现上升趋势,在642 nm处的荧光峰则呈比例下降(图44)。探针对GSH的检测限为0.26 μmol·L-1。G-46可以作为一种有效的工具,应用于比率GSH传感和分化癌细胞与正常细胞方面。
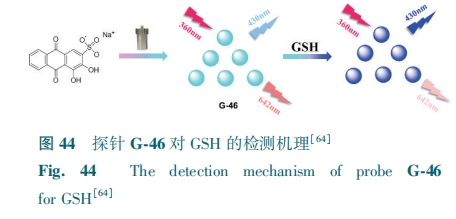
大多长波长发射CDs不受生物基质的蓝色自发荧光影响、对生物组织的光损伤较小,但存在量子产率低、Stokes位移小等缺点。针对此问题,本课题组[65]设计出了具有较大Stokes位移的黄色碳点G-47。Ag+与G-47的羧基结合,静态猝灭机制导致荧光猝灭。而GSH又对Ag+有高亲和力,可以恢复G-47的荧光。通过这一荧光“关-开”过程实现对GSH的检测,检测限为76 nmol·L-1。G-47能够用于番茄、紫葡萄和H1299细胞中GSH的检测。
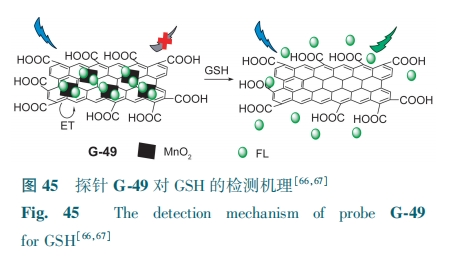
石墨烯量子点(GQDs)可作为有毒过渡金属量子点的绿色替代品,同时也可以很好地应用于GSH的检测。Wang等[66]合成了GQDs包裹的方形MnO2纳米复合材料G-48。通过有效的FRET和IFE,GQDs荧光被抑制。GSH可将MnO2分解,恢复GQDs荧光。G-48在456 nm处的荧光强度与GSH浓度(0.07~70 μmol·L-1)呈线性关系,检测限为48 nmol·L-1。基于同样的设计策略,Guo等[67]合成了氧化石墨烯-MnO2-荧光素(GO-MnO2-FL)纳米复合材料G-49。FL与GO-MnO2纳米复合材料之间发生ET,导致荧光猝灭。GSH将MnO2还原为Mn2+,阻断了FL与GO-MnO2之间的能量传递,从而使得复合材料的荧光显著增强(图45),对GSH(10 μmol·L-1~2 mmol·L-1)的检测限为1.53 μmol·L-1。G-49具有优异的肿瘤靶向能力,在GSH介导的癌症诊断方面具有巨大的潜力。
3.3 用于检测GSH的金属纳米荧光探针
NCs由几个到几十个原子组成,并由硫磺酸保护,有时甚至含有数百个金属原子。其大小(<2 nm)介于原子和纳米粒子之间。NCs的直径与金属中电子的费米波长相当,导致连续的态密度分裂成离散的能级,从而具有独特的光学、电学和化学特性。近年来,关于NCs的研究呈爆炸式增长,可作为荧光探针应用于生物传感、生物成像。
Li等[68]以多糖(藻酸盐二醛,ADA)、二苯丙氨酸(FF)、Au纳米颗粒(AuNPs)和5-氨基荧光素(FI-NH2)为原料,制备得到荧光探针G-50。由于FI-NH2和AuNPs之间的纳米金属能量转移(NSET),FI-NH2的荧光被猝灭。引入GSH后,形成稳定的Au—S键,同时阻断了NSET过程,518 nm处FI-NH2的荧光恢复,468 nm处Au纳米球的荧光保持不变,可用作内置参比信号。在正常细胞(0~200 μmol·L-1)和人体宫颈癌细胞(1~15 mmol·L-1)内,荧光比率信号与GSH浓度呈正相关。G-50为诊断和治疗癌症提供了重要思路。
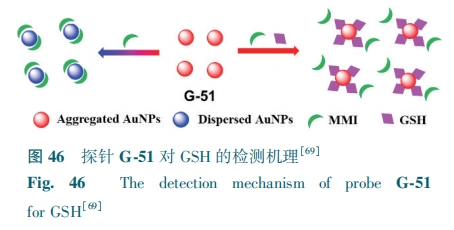
Li等[69]基于金纳米晶簇(AuNCs)聚集态与分散态之间的转化策略设计了探针G-51。通过加入聚集剂2-SH-1-甲基咪唑(MMI),调节AuNCs状态,使AuNCs处于分散态和聚集态时荧光颜色分别表达为蓝色和红色。在PBS溶液中,若同时加入GSH和MII,AuNCs为分散态,探针荧光颜色无变化(图46),对GSH检测限为12 nmol·L-1。
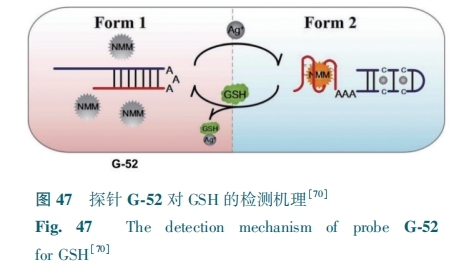
G-四链体是一种特殊形式的核酸,易于合成和修饰,可以与金属离子和卟啉特异性结合。将N-甲基卟啉IX(NMM)与G-四链体结合作为GSH检测的信号单元,Ji等[70]开发了一例基于Ag+和NMM介导的G-四链体结构的荧光探针G-52。以富含G序列的DNA链为原料,初始的链内分子杂化形成“发夹”结构,富含G序列部分被封闭。在添加Ag+后,通过形成C-Ag+-C碱基对,“发夹”结构被破坏,富集G序列被释放进而形成G-四链体结构,其能够结合NMM并在612 nm处产生强荧光。然而,在GSH的存在下,由于GSH对Ag+的强结合能力,无法形成C-Ag+-C碱基对,G-52恢复到其原始结构(图47),荧光猝灭,对GSH的检测限为3.5 nmol·L1-。
3.4 用于检测GSH的基于二氧化锰纳米片的荧光探针
二氧化锰(MnO2)纳米材料摩尔消光系数大、生物相容性好,在体内可分解为无毒的Mn2+由肾脏排出,因此,被广泛应用于荧光传感器中。MnO2纳米材料可通过诱导荧光猝灭或独特的氧化还原反应实现GSH的检测。目前,研究人员已经开发出多种基于MnO2纳米片荧光探针用于GSH检测。
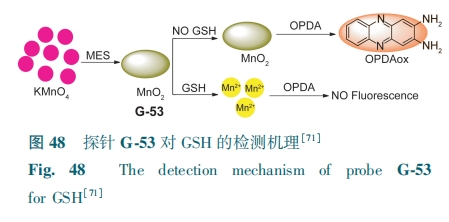
基于MnO2纳米片氧化还原反应,Yao等[71]报道了一例荧光探针G-53。MnO2纳米片可将OPDA氧化成2,3-二氨基吩嗪(OPDAox),最佳发射在568 nm。加入GSH可使MnO2纳米片还原为Mn2+,降低了纳米片的有效氧化活性,抑制OPDAox的形成(图48)。同时,导致568 nm处荧光猝灭。G-53检测限为10 nmol·L-1。
Zhang等[72]通过静电作用将AIE分子SiO2-NPs吸附在MnO2纳米片上,制成探针G-54。由于带负电荷的MnO2纳米片与阴离子四苯基乙烯衍生物(TPE3)之间存在空间位阻,使得TPE3在SiO2纳米粒子表面无法聚集,G-54无荧光产生。随着GSH的加入,MnO2还原为Mn2+导致纳米片分解,释放氨基官能化的SiO2-NPs,TPE3聚集在带正电荷的SiO2-NP表面,形成TPE3-SiO2-NPs。TPE3分子内旋转受限,在490 nm处发出强烈荧光,荧光强度与GSH浓度(0.5~100 μmol·L-1)正相关,检测限为200 nmol·L-1。G-54可应用于复杂的探针荧光标记过程。
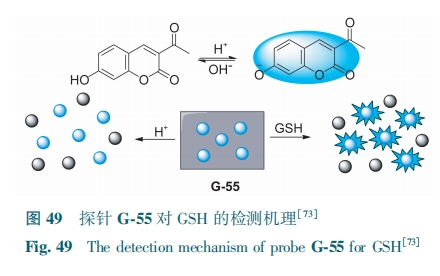
MnO2在酸性条件下易被还原,溶液颜色褪为无色。Fu等[73]通过结合pH响应型荧光染料AHC(3-乙酰基-7-羟基-2H-铬-2-基团)和MnO2纳米片,合成了一种多功能纳米探针G-55。由于IFE,AHC被MnO2纳米片高效猝灭。加入GSH后,MnO2纳米片被还原分解,AHC的蓝色荧光恢复。同时,随着酸性pH的增强,不仅MnO2纳米片被分解,AHC中苯酚基团也发生去质子化,增强了ICT,从而导致AHC蓝色荧光增强(图49)。随着GSH (0.5~20 μmol·L-1)的加入,G-55在456 nm处的荧光逐渐增强,检测限为0.22 μmol·L-1。
4 结论与展望
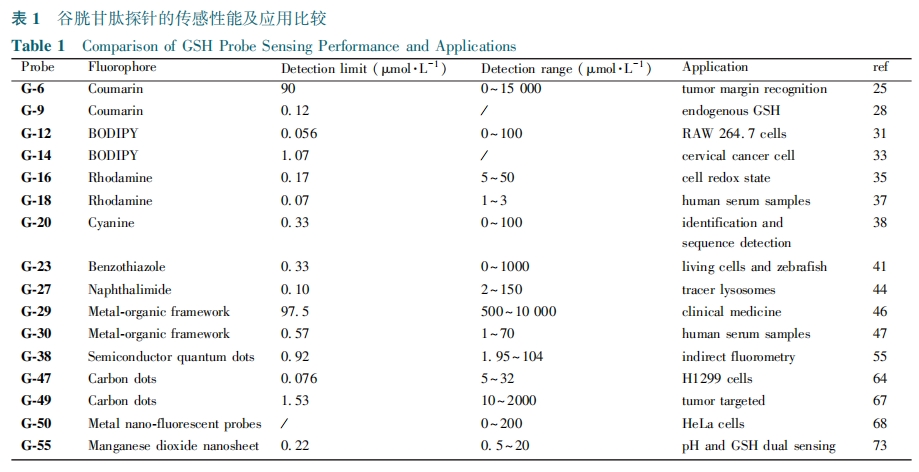
本文从有机小分子和无机纳米探针两个角度,以荧光团为分类依据,综述了近五年报道的GSH荧光探针。重点介绍了GSH对于不同荧光团的响应模式,同时讨论了探针的设计策略、荧光变化和实际应用。基于不同荧光团的谷胱甘肽探针的传感性能及应用的比较总结于表1中。
目前来看,GSH荧光探针在选择性、灵敏度、生物相容性、细胞内分布能力等方面都得到了提高。其中:(1)比率探针和双发射探针可以进行有效的自校准,提高GSH检测的精度和准确性;(2)近红外和双光子荧光团的设计降低了生物系统荧光背景干扰和组织损伤能力并提高了穿透深度,有利于在生物医学方面的应用;(3)将AIE分子与探针相结合,不仅避免了传统荧光探针的ACQ效应,还使探针的荧光标记过程得到有效改善。以上三点均为GSH荧光探针的开发提供了新的思路。
此外,人体细胞内GSH含量变化能够间接反映某些疾病,但目前能实时跟踪细胞内GSH并精确量化的探针较少。因此将来的研究应更多地集中在探针的临床应用上,需要不同领域科学家之间的跨学科合作,希望相关研究的综述能够为研究人员提供参考和信息。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。














































