
摘要:抗菌肽 (antimicrobial peptides, AMPs) 是一种新型抗生素,对多种细菌,多重耐药细菌均具有抗菌活性。然而,其副作用也是制约抗菌肽研发的主要障碍。研究者使用模式细胞膜,揭示抗菌肽与细胞膜之间的作用方式,开展抗菌肽开发和筛选研究。另外,研究者还将抗菌肽与常规抗生素联合使用,可以协同提高抗菌效果。研究初步揭示了 AMPs 和常规抗生素之间协同作用的机制。本综述探讨了模式细胞膜在 AMPs 发现筛选中的应用,及 AMPs 和常规抗生素之间联合用药的研发现状。
抗生素的发现和使用,使得大多数传染病得到了有效控制,但几十年来抗生素的过度使用,导致病原微生物对常用抗生素产生了耐药性。如果这种情况继续恶化,将会对人类健康特别是手术和癌症的治疗等产生重大影响,此外,耐药性问题也将使对抗艾滋病毒和疟疾的斗争复杂化。多重耐药细菌的出现,新抗菌素研发减缓,抗生素的有效性下降,这就极需新型抗感染药物的研发。
使用抗菌肽 (antimicrobial peptides, AMPs) 是抗感染的一种新策略。从低级单核微生物到人类免疫系统中都发现了这类分子。一些天然 AMPs 是高等生物与细菌共同进化数百万年的产物,它们是免疫防御的第一道防线。AMPs 不如常规抗生素药效高,但可以抑制多重耐药菌的繁殖,并且起效快 [1]。
如同新型抗菌治疗药物的研发一样,药物的耐药性无疑是核心问题,因为抗菌肽作用机制研究发现这些分子主要作用靶点是细菌的细胞膜,因此发生药物耐药性的概率要小于常用抗生素。细菌抵抗天然 AMPs 的机制有,外排泵功能上调,细胞膜和细胞包膜的生理改变,被蛋白酶降解,生物膜脂多糖修饰等。研发人员同时发现,将 AMPs 和抗生素联合使用,可以抑制多重耐药细菌繁殖 [2-3]。AMPs作为新型抗生素备选药物,研究者正在努力发现其抗菌作用机制,降低细胞毒性,降低蛋白酶降解,使其更稳定并可以实现大规模生产。
现在认为抗菌肽作用机制是 AMPs 靶向阴离子细菌细胞膜,并且驱动它们之间的初始接触,第一作用力是带正电氨基酸和带负电细胞膜之间的静电相互作用。第二作用力是肽的双亲性结构域与膜磷脂之间的疏水相互作用。如果达到AMPs的阈值浓度,上述的这些作用力是剧烈的,进而达到对细菌细胞膜的破坏。AMPs 对细菌细胞膜的破坏作用,取决于抗菌肽和脂质膜的组成 [4],因为 AMPs 靶向阴离子细菌细胞膜,因此 AMPs 产生耐药性可能性较低。
另一个越来越受关注的研究领域是 AMPs 与常规抗生素的联合用药。由于常规抗生素和 AMPs 抗菌的作用机制不同,这些联合疗法似乎是一种有前景的方法。在这方面,人们相信通过 AMPs 对细菌膜的透化作用使得抗生素能够更容易进入细菌细胞。新型协同疗法的发展,需要深入地对“抗菌肽 - 细胞膜”的生物物理相互作用,以及抗生素生化活性进行研究。
1 抗菌肽的结构
根据 AMPs 的结构,可以将其分为 5 大类:AMPs 拓展型、β- 折叠型、β- 发夹型、α- 螺旋型和环型 AMPs( 图 1)。
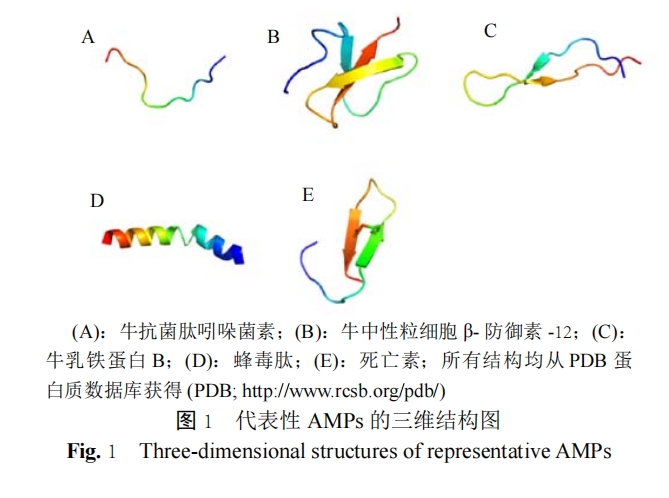
AMPs 拓展型是不含二级结构的富含甘氨酸、精氨酸或硫胺素的多肽,如吲哚菌素,富组蛋白和果蝇菌素等。β- 折叠型 AMPs 的特征是,存在两个或多个由二硫键稳定的 β- 链,包括 α-,β- 和 θ- 防御素。β- 发夹型 AMPs 具有一个发夹结构,通过 II 型旋转,并通过 β- 链之间形成的二硫键来稳定,如乳铁蛋白肽 B 是一种带有单一二硫键的阳离子肽,在2 位和 20 位半胱氨酸残基之间形成一个 18 元环。此类型其他肽还有,中国鲎肽和多孢菌素等。α- 螺旋型 AMPs 具有两亲性特征,这些 AMPs 在水性溶剂中无固定结构,在人工细胞膜或天然细胞膜存在时形成 α- 螺旋。环型 AMPs 通过一个单键维持其环形结构,同时它可能具有 α- 螺旋结构、β- 折叠结构,通常在 C 末端通过一个分子内二硫键,形成环形结构,而其 N 末端多为线状结构,如牛的环状十二肽(dodecapeptide)、青蛙皮肤产生的 brevinins 等。
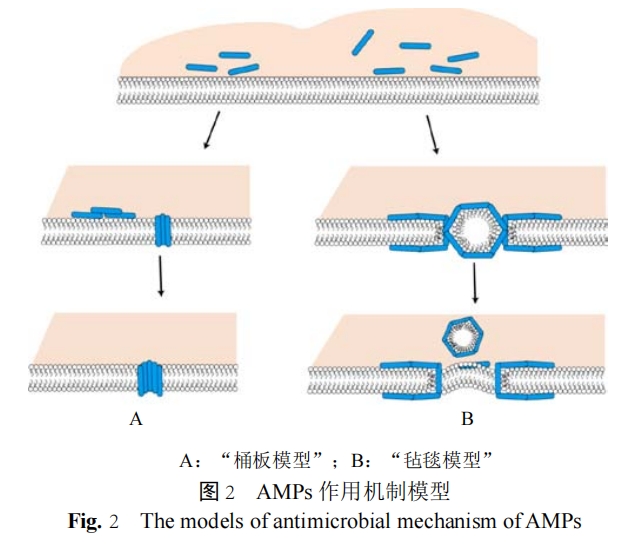
当抗菌肽与细胞膜接触,并超出肽脂临界比后,AMPs 插入细胞膜中并形成跨膜孔,引起膜的不稳定导致膜的去极化及最终细胞死亡。虽然 AMPs 可以扰动细胞膜的正常结构,但是膜破裂还需要 AMPs要达到一定的浓度阈值。研究发现,N- 末端的带电残基对于环形孔的形成至关重要,并且在与膜结合前后,AMPs 聚集是跨膜孔形成的先决条件,而并非多肽的螺旋结构。扫描电镜研究显示,观察发现两栖动物 AMPs 孵育的铜绿假单胞菌,几乎所有细菌表面都被突出的囊泡覆盖。这可能是 AMPs 导致细菌外膜结构的不稳定,并破坏了革兰阴性细菌内膜,细胞质填充在周质空间中由外膜包裹形成囊泡。
2 磷脂脂膜模型
模型膜系统为膜 - 肽相互作用研究提供了帮助,其优点是测试条件易于控制。细胞膜主要结构是脂质双分子层,磷脂作为细胞膜的主要成分之一,具有良好的生物相容性,还具有自组装、乳化和润湿等特性。目前已经开发的几种模型系统用于模拟脂质双层特征。模型膜系统有,囊泡脂质体、langmuir单层膜和固体支撑双层脂质膜模型。这些系统对于研究肽膜相互作用均存在优缺点。
囊泡脂质体是一种封闭磷脂双层,根据制备方式不同,脂质囊泡的直径大小有 10nm,如小单层囊泡 (small unilamellar vesicles, SUV),1000nm;而 大型单层囊泡 (large unilamellar vesicles, Luvs) 或巨型单层囊泡 (giant unilamellar vesicles, Guvs),其范围直径可达几十微米。脂质体也可由多层囊泡组成,称为多层囊泡(multilamellar vesicle, MLV)。单层脂质体,也称“langmuir 单层”,是空气和液体界面处表面活性分子形成脂质体单层。这种单层脂质体模型形成较为简单,将有机溶剂中脂类沉积到液体表面,溶剂蒸发后,脂质极性头部保持与液相接触,而非极性链指向外侧。该模型可用于脂质膜的相变进行研究,为肽引发的脂质堆积变化提供信息。单层脂质体模型具有独特优势,即可以方便地测定和调节脂质分子的排列和堆积,也可以控制脂质层组成和密度 [5]。
固 体 支 撑 双 层 脂 质 膜 (supported lipid bilayers,SLB) 模型,是将脂质双层固定在固体基质 ( 如二氧化硅、玻璃或云母 ) 上,脂质的亲水性基团面向固体基质。由于它们的脂质排列整齐并极易形成,SLB 成为最常用有价值的研究模型。此外,研究对象被限制于二维空间中,可以使用多种固相表面定量研究技术,如原子力显微镜 (atomic force microscope, AFM),石英晶体微量天平 (quartz crystal microbalance, QCM),红外反射吸收光谱法等进行研究。固体支撑双层脂质膜可以用于研究模型平面结构的变化,也可以研究 AMPs 在细胞膜上的扩散。
使用磷脂脂膜模型研究的另一个优点是可以过调整脂质组分来模拟不同种类细胞膜。研究者利用负电荷囊泡模拟细菌膜,中性 ( 或两性 ) 囊泡模拟真核细胞膜,进行了许多抗菌肽的筛选研究。例如,磷脂酰胆碱 (phosphatidyl choline, PC) 通常用于模拟哺乳动物细胞的膜,因为 PC 是其细胞质膜的主要成分之一,而磷脂酰甘油 (phosphatidyl glycerol, PG) 通常添加在细菌模型膜上,因为真核生物的细胞质膜不含PG,而在细菌的细胞膜中广泛存在。过去的几十年,许多物理化学技术和膜模型技术被应用于 AMPs 表征研究。应该注意,使用不同磷脂脂膜模型对同一个AMPs 进行研究时,得到的数据和结论可能不尽相同 [6]。
3 肽 - 膜的相互作用研究
细胞膜模型的研究发现,细胞膜上的 AMPs 达到阈值浓度之后才会出现膜破裂。为了研究 AMPs 的作用机制,需要首先研究 AMPs 与细胞膜结合位点的结合。如,触发细胞膜破裂时,细胞膜上 AMPs 的阈值浓度,导致细胞膜破裂的分子作用力等基础科学问题。
Bouchet 等 [8] 研 究 结 果 显 示,AMP([K108W111]107~115hLz), 对 于 纯 二肉 豆 蔻 酰 磷 脂 酰 胆 碱 的Kp 为 3.2×103,而在含 PG 的细胞膜上该值上升到17.3×103。由此,在 3mmol/L AMP 下,纯二肉豆蔻酰磷脂酰胆碱过量条件时的膜上多肽的摩尔分数(molarfraction of the peptideon the membrane, XL) 为 0.88,当将 AMP 转移到带负电荷的细胞膜上时,该值增加到0.97,说明这时候几乎所有多肽都与细胞膜相结合。AMPs 在细菌模型膜的分配常数显著高于哺乳动物模型膜的这一事实,解释了 AMPs 的特异性和安全性,并且也为新抗菌肽的设计提供了依据 [9]。
AMPs 和质膜结合反应方程为:P+nL PLn.其 中 P 为 peptide, 多 肽;L 为 脂 质;n 为 等 效 的独立结合点数量。当可结合的脂质过量时,反应方 程 可 转 化 为:kon[L][P]=koff [PLn]。其 中 kon和 koff 分 别 为 结 合 和 解 离 速 率 常 数。通 过 测 试不同的质膜模型,可以获得抗菌肽对于不同质膜的筛选信息。研究肽 - 膜亲和力可以使用光谱方法,如红外 (infrared, IR)、紫外 - 可见光、荧光、旋 光 色 散 (opticalrotatorydispersion, ORD) 核 磁 共 振(nuclear magnetic resonance, NMR),等离子体波导共振 (plasmon waveguide resonance, PWR), 圆 二 色 性(circular dichroism, CD) 和动态光散射 (dynamic lightscattering, DLS) 等。这些方法的最大优点,即可实现亲和力的溶液检测 [10]。
分配系数和解离常数常用于 AMPs 与不同膜模型相互作用的描述,预测AMPs抗菌活性或细胞毒性。研究者还通过使用不同脂质膜模型,对抗菌肽对于两性离子质膜或负电荷质膜的选择进行研究,抗菌肽的这种对膜性质的选择性决定了其生物学活性。
分配系数和解离常数,不能描述抗菌肽吸附或是镶嵌到细胞膜上的位置信息。该结构信息可以通过使用光谱方法,如差示荧光猝灭 (differentialfluorescence quenching) 技术获得,细胞膜不同区域放置猝灭剂分子,如碳酰亚胺基团修饰的硬脂酸分子 5NS 和 16NS。16NS 对于埋细胞膜中的分子有很好淬灭效应,而5NS对于接近细胞膜浅层、靠近脂质-水界面的分子的淬灭效应较好 [11]。当猝灭剂 (5NS 或16NS) 和荧光基团 (AMPs 的 Trp 残基 ) 之间发生接触时,即发生猝灭效应,猝灭效率与两个基团之间距离有关,由此可以计算出它们在细胞膜中的最终位置。荧光猝灭实验还可以确定来源不同 AMPs 的最终位置,有助于揭示这些抗菌肽的作用模式 [12]。
3.4 细胞膜的破裂
AMPs 是通过改变细菌细胞膜通透性,导致细胞膜最终渗漏破裂,杀伤细菌,发挥宿主防御或细胞毒性的作用。因此,细菌细胞膜通透性是研究 AMPs作用双层脂膜的关键内容 [13]。
囊泡内染料渗漏的荧光检测,被广泛用于抗菌肽活性的量化分析。使用增加荧光强度检测技术,可以对囊泡中释放的荧光染料进行检测。常用的荧光染料和猝灭剂有,8- 氨基萘 -1,3,6- 三磺酸(8-aminonapthalene-1,3,6trisulfonicacid, ANTS) 和 对 -二 甲 苯 - 双 吡 啶 溴 (p-xylene-bispyridiniumbromide,DPX) 等。当细胞膜渗漏后,渗漏染料荧光和猝灭剂结合会改变溶液的荧光强度。钙黄绿素和羧基荧光素,广泛应用于由 AMPs 引起的脂质体渗漏。膜渗漏的难易程度取决于脂质双层膜的物理性质 [14]。
大 型 单 层 囊 泡 (large unilamellar vesicles, LUV)悬浮法的研究仅能提供细胞膜破裂反应不同阶段的荧光强度平均值,很难得到有关细胞膜破裂机制的更多信息,如染料 50% 渗漏,不能确定是 50% 囊泡释放还是所有囊泡释放 50%,在这两种情况,检测数值都是 50%。因此,LUV 悬浮法提供了一些AMPs 诱导渗漏的信息,但渗漏的基本过程和相互作用的机理细节仍不清楚。
因 此, 研 究 者 使 用 荧 光 共 聚 焦 荧 光 显 微 镜(confocal fluorescence microscop) 研 究 巨 大 单 层 囊泡 (giant unilamellar vesicles, GUV) 的破裂过程,以及针对单个 GUV 破裂,进行荧光探针渗漏的过程观察。Tamba 等 [15] 使用染料 8- 羟基芘 -1,3,6- 三磺酸(8-hydroxypyrene-1,3,6-trisulfonicacid, HPTS) 包 裹 磷 脂酰甘油形成单层囊泡,当将加入低聚 α-Synuclein 时,囊泡内部HPTS荧光外流。他们使用同样的GUV方法,发现 AMP 爪蟾抗菌肽 -2 可以诱导细胞穿膜孔的形成,于细胞膜表面电荷密度和缓冲液盐浓度有关。
4 抗菌肽与细胞膜相互作用的计算机模拟
研究者建立计算机模拟模型,用于抗菌肽和脂类相互作用的研究,每种模型系统建模的方式不同,适用的范围也不同。分子动力学 (molecular dynamics,MD) 是计算机建模的基础原理之一,可用于研究抗菌肽进入脂质双层的动力学及对周围脂质的影响。MD 建模的主要优点是能够描述药物进入膜的可能位置和方向。MD 建模系统用于多种药物预测,预测参数和实验数据吻合。最近,Brgund 等 [16] 利用 MD 研究了已知抗菌脂肽多黏菌素 B1(polymyxinB1, PMB1)与大肠埃希菌细菌外膜异质模型的相互作用,揭示了不同细菌膜模型下 PMB1 的行为差异 [17]。这种脂肽聚集在细菌外膜脂多糖的头部区域,很少插入质膜 [18];另一方面,它更容易插入细菌内膜,造成脂双层不稳定,最终导致细胞膜破裂 [19]。
Sudheendra 等 [20] 对 人 β- 防 御 素 -3(humanβ-defensin-3, HβD-3) 不同类似物进行了研究,使用POPC 双层膜 MD 模型,将抗菌肽放入到双层质膜中,他们发现,模拟过程中抗菌肽末端残基突出双层质膜之外。他们认为,静电相互作用决定了细胞膜的破裂,静电作用下,抗菌肽末端残基的正电荷破坏磷酸盐头部基团,相应的多肽延伸出双层质膜。
另一种计算机建模的基础是分子对接,可以用于配体与靶蛋白的可能位点的定位研究。分子对接是通过特定评分函数循环评估配体构象,直到溶液能量最低。Trott[21] 使用 Auto Dock Vina,计算比较不同构象和配体产生的结合亲和力。对接方法多用于筛选具有不同抗菌肽特异性,用于了解抗菌肽对细胞膜的生物学活性和特异性。例如,Fantini 等[22] 研究 α-synuclein 的和胆固醇的潜在结合位点。Nsimba 等 [23] 通过应用分块矩阵方法,比较磷脂酰胆碱十六烷基甜菜碱氯化物 (hexadecyl betainatechloride, C16BC)、鞘磷脂和胆固醇的亲和力。Deleu等 [24] 改进了 HM 对接方法,计算作为表面蛋白的抗菌肽与不同脂质之间的相互作用 [25],如 DPPC、DOPC 和它们的二元混合物,可用于观察分子之间优先相互作用和相位差。
5 抗菌肽与生物膜的相互作用
我们对抗菌肽和细胞膜作用机制的认识,都来自对上述细胞膜模型的研究。至今,我们尚不能确认这种模拟情况,和真实细菌中的 AMPs 的作用机制是否一致。近年来,一些模型膜技术开始应用于细菌研究,如 Zeta 电位和一些荧光方法作为偶极电位扰动。
Alves 等 [26] 用抗菌肽 BP100 或 PEPR 进行大肠埃希菌 zeta 电位评测,发现了抗菌药物敏感性与细菌表面电荷中和有关。此外,通过全细胞 AFM 成像,实现上 AMPs 对大肠埃希菌的原子水平作用模式的研究。Malgieri 等 [27] 研究革兰阴性菌细胞与抗菌肽的相互作用,抗菌肽遇到细菌细胞膜后 CD 检测获得抗菌肽的二级结构信息,并证明 CD 适合抗菌肽与大肠埃希菌细胞相互作用研究。Roversi[28] 在PAMAP-23 类似物与大肠埃希菌细胞的研究中发现,只有当结合的抗菌肽完全饱和细菌细胞膜 ( 每个细胞结合 106~107 肽 ) 时才会发生抗菌作用 [29]。上述这些研究发现,基于细胞膜模型和基于细菌的实验结果是相似的,这些支持了模型膜的正确性。也就是说,其一定合理范围内,细胞膜模型对于 AMPs 的作用机制研究是可靠的。
但有些研究结果显示,AMPs 对于模拟细菌细胞膜和真核细胞膜的亲和性不同,但这可能只是实验假象,因为测定抗菌肽的抗菌和溶血活性所需要条件差异非常大,实验研究还很薄弱。但最近,利用偶极子电位法直接用于红细胞的研究,为抗菌肽与细胞膜的亲和力研究提供了有力支持,结果显示和溶血实验结果完全吻合。这种单独检测方法是基于假设 AMPs 与特定细胞类型亲和力不受不同细胞影响。抗菌肽 HDP PMAP-2315 在红细胞存在时具有抗菌活性,抗菌活性不受红细胞存在的影响。此外,当细菌和红细胞存在下,或只有一种细胞存在下,ESCultin 1A(1-21)NH2 仅在大量过剩红细胞存在下,才会引起对抗菌活性的轻微抑制。ESCultin 1A(1-21)NH2 是一种来自 EsCultin 1A 的 AMP,该抗菌肽的抗菌活性很高。
6 抗菌肽的细胞毒性与抗菌活性
AMPs 活性取决于靶细胞膜磷脂组成和净电荷。实际上,AMPs 对于哺乳动物细胞膜的作用是一种细胞毒,特别是针对红细胞,因此在设计新 AMPs 时需要注重考虑。AMPs 对真核细胞膜或原核细胞膜的选择性,通常使用治疗指数表示,治疗指数是指最小溶血浓度 (minimum hemolytic, MHC) 和最小抑菌浓度 (minimum inhibitory concentrations, MIC) 的比值表示。治疗指标反映了 AMPs 的抗菌性能,指标越高,抗菌性能越好。
研究人员试图开发低毒新型 AMPs 并提高其抗菌活性。因此,进行了很多尝试去发现控制 AMPs选择性的参数。抗菌肽两亲性在抗菌或溶血中作用一直没有定论。有研究指出,净电荷是 AMPs 选择性关键参数,而不是增加两亲性;然而,Takahashi等 [30] 证实,当抗菌肽具有 α- 螺旋时,两亲性是AMPs 具有抗菌活性的必要条件。在任何情况下,抗菌肽两亲性的增加会引起溶血性和抗菌活性同时增加 [31]。
除了抗菌活性外,Dathe 等 [32] 还证明了抗菌肽的疏水性与膜选择性和插入细胞膜方式有关。人们推测,疏水性增强 AMPs 穿透两性离子膜,引发溶血。抗菌肽相关研究,确定高疏水性 α- 螺旋抗菌肽与真核生物的膜亲和力高,从而引发溶血。
7 抗菌肽与抗生素的协同作用
协同作用是指两种药物联合所产生的药效大于其单独使用。AMPs抗菌作用方式与常规抗生素不同,AMPs 靶向细菌膜,产生膜不稳定或形成穿膜孔,最后导致细胞破裂。当 AMPs 与常规抗生素药物联合使用时,AMPs 的这种特性可能会促进常规抗生素进入细菌细胞,作用于细胞内靶点,产生药物协同活性 [35]。
常规抗生素抗菌活性表现在抑制 DNA 复制、DNA 转录、细胞壁合成,或是靶向拓扑异构酶和青霉素结合蛋白 (penicillin-binding proteins, PBPs)。多重耐药细菌的耐药性机制,是抑制常规抗生素分子进入细菌细胞,从而导致抗菌失败。而 AMPs 可以增加细胞质膜的渗透性,抗生素可以渗透进入细菌,发挥抗菌功能。联合使用抗生素时必须考虑药物的拮抗作用、重复感染、增加不良反应和增加成本等问题。在临床实践中,抗生素联合使用被广泛应用于危及生命的感染,或是为了避免耐药性的出现。一些 AMPs 与常规抗生素的联合使用,抑制人类病原体的协同作用已并被证实。
黏菌素是一种阳离子抗菌肽,与阿奇霉素、红霉素和克拉霉素协同作用于,可用于多耐药性肺炎克雷伯菌、铜绿假单胞菌和鲍曼不动杆菌的感染。这种 AMPs 能增加细菌膜渗透,促进抗生素进入,从而抑制核糖体蛋白的合成活性,阿奇霉素和 LL-37( 一种阳离子 AMP) 之间的协同作用,抑制多重耐药的革兰阴性杆菌 [36]。
达托霉素是环状脂肽类抗生素,可与钙结合形阳离子复合物抑制革兰阳性菌。Nsimba 等 [23] 报道了一例万古霉素和氨苄西林耐药的肠球菌 (vancomycinand ampicillin-resistant E. faecium, VRE) 引起的主动脉瓣心内膜炎病例,使用达托霉素和氨苄西林联合使用进行治疗。他们研究了氨苄西林对VRE菌株的影响,证实氨苄西林引起细胞表面净正电荷的减少,增大达托霉素与细胞表面的结合。
有研究显示:人 β- 防御素 3(human β-defensin3,HBD3) 和 cathelicidinLL-37 联合替加环素,莫西沙星、哌拉西林 / 三唑巴坦和美罗培南使用,对于难辨梭状芽孢杆菌的治疗具有协同作用 [37]。
另有研究证明,弱阳离子抗菌肽与常规抗生素联合使用对革兰阴性菌 ( 大肠埃希菌,肺炎克雷伯菌和铜绿假单胞菌 ),革兰阳性菌 ( 表皮葡萄球菌,肺炎链球菌和金黄色葡萄球菌 ) 具有协同作用。几乎所有抗菌他肽与头孢吡肟,亚胺培南,万古霉素和盐酸左氧氟沙星联合使用均具有协同作用。利用小鼠伤口感染模型,用 PL-5 和盐酸左氧氟沙星联合治疗可显著降低金黄色葡萄球菌的 CFU,进一步证明了联合用药的协同作用 [39]。
阳离子肽 nicin 是由乳酸乳球菌产生的一种3.5kDa 羊毛硫氨酸抗生素。Lewies 等 [42] 研究了乳链菌 nicin-Z 与常规抗生素对金黄色葡萄球菌、表皮葡萄球菌和大肠埃希菌上的协同作用。他们发现,nicin-Z 与常规抗生素具有相加作用,尤其于新生霉素的协同作用更为显著。
虽然在上述的实验表明了 AMPs 和常规抗生素的协同作用,但并非每一种 AMP 和常规抗生素联合使用都能产生协同作用。有些可能表现为不相关,甚至为拮抗关系。有研究显示,家蝇幼虫抗菌肽亚型 MDL-3 与青霉素或链霉素联用时均产生对鼠伤寒沙门菌 50013 的拮抗作用,抗菌肽在 N 端亲水和 C端疏水结构使功能具有一定相似性,但是对具体抗菌肽其高级结构的不同表现出功能的差异。发生对抗关系的原因可能为:(1) 抗菌肽与抗生素之间对病原菌的结合位点具有竞争关系;(2) 抗生素影响病原菌的生理性质可能改变了抗菌肽的结合位点;(3) 抗菌肽与抗生素可能导致了对方的失活。每种抗菌肽与抗生素作用机制不尽相同,加之与细菌的 3 者之间关系复杂,需要进一步深入探究。
8 结论
抗菌肽是一种很有前景的抗生素,可以从头设计,并可应对多重耐药细菌的挑战,副作用小。深入了解这些分子与原核或哺乳动物膜相互作用的选择性机制,为降低细胞毒性和增加抗菌活性提供依据。AMPs 独特的膜破坏活性,使其可以于常规抗生素联合治疗,产生药物协同作用。研究显示出 AMPs作为多重耐药细菌疗法中,抗菌活性增强剂具有广阔应用前景。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。