
摘 要:肿瘤微环境在肿瘤的发生、发展和转移过程中起着至关重要的作用,因此靶向调控微环境为发展肿瘤精准治疗的新策略提供了机遇。纳米技术的快速发展为传统药物的增效减毒提供了契机,已有一系列纳米药物用于肿瘤临床治疗。近年来,分子自组装领域的快速发展为智能纳米药物的研发提供了新机遇。多肽作为生物相容性高、序列可设计、易修饰、功能多样化的生物分子,可组装构建结构多样和功能集成的纳米药物系统。本文综述了利用多肽自组装超分子体系实现药物对肿瘤微环境的响应释放和高效递送,并对其通过调控微环境中的血管、成纤维细胞和胞外基质等组分,改变肿瘤赖以生存的“土壤”,并与抗肿瘤细胞治疗有机结合的最新进展进行了介绍。针对肿瘤异质性和复杂性的难题,构建表/界面性质可控的纳米药物系统,发展基于肿瘤微环境调控与联合治疗的肿瘤综合治疗方案,将是未来重要的发展方向之一。
恶性肿瘤的发病率和死亡率高、诊疗难度大、易复发和转移[1],现有的放化疗、靶向治疗、免疫治疗及纳米药物均无法有效降低恶性肿瘤的死亡率,研发新型治疗药物迫在眉睫。肿瘤组织包括肿瘤细胞及其周围的间质细胞和细胞外基质,共同构成了肿瘤微环境[2]。肿瘤细胞与微环境的关系犹如“种子”和“土壤”,被肿瘤细胞驯化的间质细胞协同细胞外基质为肿瘤细胞提供适宜生存、转移和耐药的微环境,不仅加速了肿瘤的恶性进展,还构成阻碍药物输运的重要屏障,严重影响抗肿瘤药物的疗效[3, 4]。与肿瘤细胞相比,肿瘤组织的间质细胞与基质所占比例高、遗传背景相对稳定、与药物接触机率高[5],因此,靶向肿瘤微环境的治疗成为遏制肿瘤的新策略。
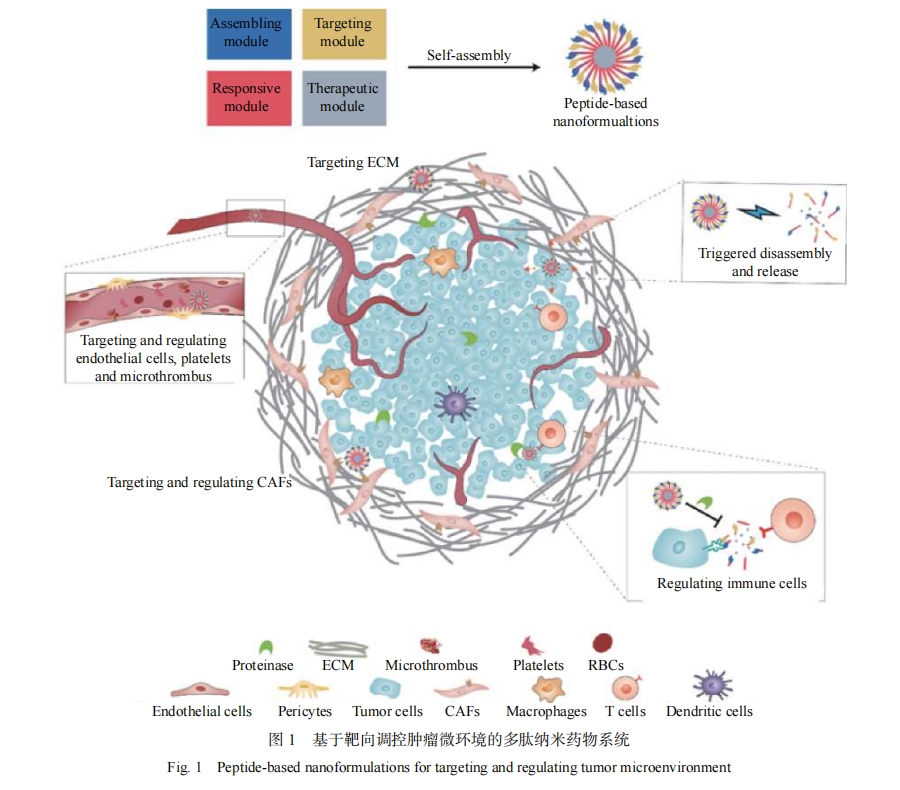
纳米技术的发展为传统药物的增效减毒提供了契机,一系列纳米药物已用于肿瘤临床治疗[6]。基于新型载体的抗肿瘤药物研发是目前的热点之一[7]。近年来,分子自组装领域的快速发展为智能纳米药物研发提供了新的机遇,该技术将不同功能的分子以非共价键组装成高度有序的纳米体系,是构建结构多样、功能集成的纳米药物的有效策略[8]。生物分子多肽序列中氨基酸残基具有不同的化学结构,其可以利用肽链间氢键作用以及氨基酸残基之间的各种非共价键的作用有效实现分子自组装[9]。基于多肽及其衍生物在结构设计上精确可控的特性,可将具有不同生物功能的多肽分子通过可控组装进行模块化功能集成,构建多肽纳米药物[10]。基于多肽自组装构建的抗肿瘤纳米药物包含两个层次的内容:一是以多肽自组装体作为载体输运和递送药物分子;二是以抗肿瘤活性短肽为组装基元构建多肽药物的纳米剂型[5, 11-13]。
当前肿瘤微环境调控型纳米药物的研发仍处于起始阶段[14]。基于肿瘤微环境调控的药物研究在全球范围内不断升温的现状,将纳米药物和肿瘤微环境调控相结合,在抗肿瘤治疗方面孕育着重大机遇。本课题组前期利用多肽自组装技术,发展了一系列精确响应和调控肿瘤微环境的新型纳米药物,实现了药物对肿瘤微环境的响应释放和高效递送(图1)。本文将综述利用纳米药物系统调控微环境中的成纤维细胞、血管和细胞外基质等组分,改变肿瘤赖以生存的“土壤”,并与抗肿瘤细胞治疗有机结合,增效恶性肿瘤治疗的一系列最新进展。
1 靶向调控肿瘤血管系统相关成分
1.1 靶向调控肿瘤血管系统相关细胞组分的多肽纳米药物
为了运输营养和排出代谢废物,肿瘤微环境中含有大量血管。肿瘤血管主要由内皮细胞及附近的周细胞和基底膜构成[15]。内皮细胞为血管管腔的主体;周细胞包裹在血管外,为内皮细胞提供结构支持和促进血管成熟[16]。肿瘤血管新生是指肿瘤组织为了在快速增殖过程中获得足够的氧气供给和营养物质,肿瘤细胞通过释放多种促血管生长因子,进而过表达相应受体的内皮细胞发生增殖和迁移,在已有血管的基础上新生出更多的毛细血管,从而满足能量需求[17]。和正常组织血管不同的是肿瘤血管生长迅速,导致其具有形态学上的不规则性[15];同时由于内皮细胞和周细胞的连接不紧密,增加了血管渗透性—即实体瘤的高渗透长滞留效应(EPR效应)[18],但这也在一定程度上为肿瘤转移创造了条件[19]。
靶向调控肿瘤新生血管生成和肿瘤细胞迁移侵袭能力的治疗具有抗肿瘤疗效。目前已发现大量能够抑制肿瘤新生血管生成和肿瘤细胞迁移侵袭的短肽类小分子药物[20-23],它们在前期实验中都显示出了优越的抗肿瘤活性,但其体内半衰期短或被蛋白酶水解或被肝肾清除等弊端严重制约了其治疗效率及在临床转化中的应用,因此提高短肽小分子药物的体内稳定性至关重要[24]。纳米结构能够有效提高短肽小分子药物的稳定性及生物利用度,可实现联合治疗。大量多肽自组装体作为药物载体已经用于递送抗肿瘤小分子药物[25, 26]。本课题组基于模块化设计的概念,提出将不同生物功能的分子通过可控组装进行功能集成,构建了一系列原创性多肽纳米材料。特别是通过改造抗肿瘤活性短肽分子,自组装构建的多肽纳米药物,既能有效延长短肽分子的体内半衰期,较好地解决了目前多肽类药物普遍存在的体内稳定性差的瓶颈问题,同时又能有效提高生物活性肽的抗肿瘤疗效,为多肽类药物的开发及应用拓宽了前景。
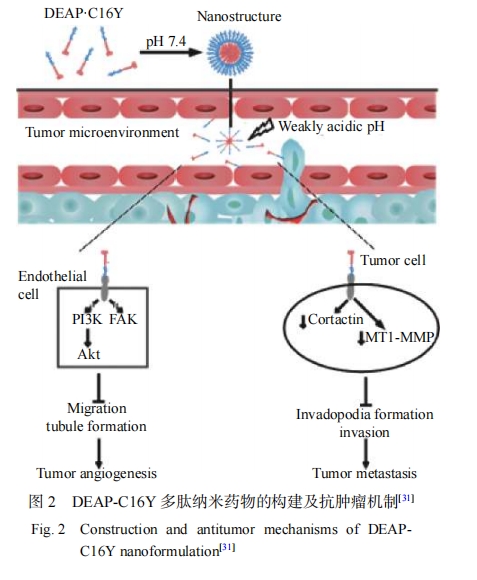
酸中毒是肿瘤微环境的显著特点之一,Warburg发现由于肿瘤细胞内葡萄糖-6-磷酸脱氢酶活性显著被抑制,使其大量消耗葡萄糖却无法高效产能,最终导致了细胞外乳酸和H+的蓄积[27]。与正常组织pH约7.4的环境相比,肿瘤组织的细胞外微环境pH(pHex)低至6.7~7.1[28, 29]。我们在之前肿瘤微酸性环境响应的多肽自组装纳米探针的工作基础上[30],通过对抗肿瘤短肽C16Y(DFKLFAVYIKYR,靶向整合素受体)的分子进行改造,自组装构建了一种双靶点多肽纳米药物[31]。具体来讲,以C16Y为构筑单元,在其N末端偶联了pKb约为6.8的3-(二乙基氨基)丙基硫代异氰酸酯(DEAP)功能分子,构建了两亲性多肽分子DEAP-C16Y。DEAP-C16Y分子在生理条件下自组装成球形纳米胶束,位于多肽疏水内部的DEAP分子质子化,降低其疏水性,改变两亲性平衡,同时由于电荷相斥导致体系不稳定,多肽自组装体随之解聚,促使抗肿瘤短肽C16Y以单分子形式靶向其作用位点,整个过程实现了“单分子-组装体-单分子”的可控组装和解聚。解聚产生的DEAP-C16Y分子无明显细胞毒性,却能够通过抑制黏着斑激酶(focal adhesion kinase,FAK)以及PI3K-Akt信号通路从而有效抑制血管内皮细胞的迁移及微管生成;同时通过降低侵袭性伪足(invadopodia)的形成[32]抑制肿瘤细胞侵袭,降低肿瘤远端转移率(图2)。我们原创性地改造了抗肿瘤短肽作为组装基元构建多肽纳米药物,有效增强小分子多肽药物的体内稳定性,同时实现多肽药物与化疗药物的联用,协同增效肿瘤治疗。
化疗是抗肿瘤治疗的主要手段之一,然而化疗药物触发的血管重建与破裂是导致肿瘤复发和转移的关键原因[33]。大量研究表明,3种细胞(包括肿瘤细胞、血管周围的巨噬细胞和内皮细胞)的密度和乳腺癌转移的风险挂钩。化疗药物明显影响了肿瘤组织中血管周围的巨噬细胞密度,在新增的巨噬细胞中,受体酪氨酸激酶Tie2相关巨噬细胞(Tie2 associated macrophages, TAMs)的比例尤其多。敲除巨噬细胞上Tie2受体后血管重建和肿瘤复发的概率大幅度减少[34]。因此,抑制Tie2的功能是减少肿瘤复发和转移风险的重要策略。在众多具有Tie2抑制功能的小分子抑制剂中,短肽NLLMAAS具有强大的抗肿瘤活性。然而,短肽NLLMAAS是疏水性多肽,生物利用度差;此多肽序列对抗肿瘤活性有着高度保守性,改变其氨基酸顺序和对其侧链和两端进行任何修饰都将使其失去抗肿瘤活性[35]。以上特性都严重增加了对其改造并提高成药性的难度,因此我们考虑基于自组装技术构建多肽纳米药物,提高其未来临床应用的可能性。
我们将抗肿瘤活性疏水肽NLLMAAS改造成两亲性分子[36],自组装构建具有肿瘤微酸性环境和酶双重响应的多肽纳米药物。两亲性组装基元为PEG1000-K(DEAP)-AAN-NLLMAAS,其亲水部分为PEG1000,用于增加纳米体系的体内半衰期。疏水部分包括3个功能模块:(1)肿瘤微环境特异性高表达的豆荚蛋白酶(legumain)的特异性底物片段AAN-X作为酶响应模块;(2)功能分子DEAP在生理环境中呈现疏水性,在pH约6.8的微酸性环境中质子化带正电荷,作为肿瘤微酸性pH响应模块;(3)疏水性抗肿瘤活性肽NLLMAAS作为效应模块。此多肽纳米药物一方面可提高疏水性抗肿瘤活性肽在血液循环中的稳定性和生物利用度;另一方面,将NLLMAAS序列隐藏在其疏水核区域,从而避免暴露在纳米结构表面以减少机体血管功能异常的副作用;通过对肿瘤微酸性环境和酶的双重响应性,产生特异性解聚变构释放抗肿瘤活性肽NLLMAAS,且不改变氨基酸序列,以确保其抗肿瘤活性。在乳腺癌肿瘤模型中,我们发现此多肽纳米药物通过肿瘤原位抑制Tie2功能,减少了化疗后血管重建和破裂等异常现象,与对照组相比,降低约97%的化疗后肺部转移,并减小副作用,最终有效控制肿瘤的恶性发展,实现更加高效、长效、安全的肿瘤治疗。
1.2 靶向调控肿瘤相关血小板的纳米药物系统
在肿瘤内大量中性粒细胞的浸润会破坏内皮细胞之间的连接进而诱发血管损伤[37],文献[38]证实血小板除了参与血栓形成过程外,还可以通过分泌趋化因子和血清素等在保护血管完整性方面发挥关键性作用,这进一步妨碍了药物在肿瘤部位的有效渗透[39]。以往研究表明基于此的血小板清除策略可以显著促进药物渗透,然而完全清除血小板会导致病人机体出现全身性不可逆出血症状[40]。为了实现特异性清除肿瘤相关血小板,增强肿瘤血管EPR效应和化疗药物靶向富集,同时降低出血风险,本课题组[41]设计了一种具有核壳结构的共聚物-脂质体-多肽杂化纳米药物载体(PLP),壳心部分由具有生物相容性和可降解性的聚合物PEI-(PLGA)2组成,装载有抗血小板单克隆抗体R300和化疗药物阿霉素(Dox),制备的核壳球型结构粒径约为105 nm。R300能够通过诱导微聚集来消耗血小板,随后通过吞噬作用快速清除血小板而不激活凝血系统[42];壳层由一段MMP-2底物多肽、卵磷脂及PEG化的磷脂杂化组成,此外壳层可以有效防止R300和Dox的非特异性释放,PEG化增加体系亲水性,从而防止被网状内皮系统快速清除[43]。基质金属蛋白酶家族(MMPs)是一类依赖锌离子的蛋白水解酶家族,通常由血管内皮细胞和肿瘤相关成纤维细胞分泌,在肿瘤微环境中多以细胞外基质成分为水解底物[44, 45]。该纳米药物系统对肿瘤组织中高表达的MMP-2具有酶响应特性,在多肽被特异性剪切后磷脂结构发生扰动,在肿瘤部位定点释放R300,从而原位清除肿瘤部位血小板,进而增加内核载有Dox的聚合物纳米载体在肿瘤组织中的富集。在炎性组织和器官中血小板缺失会减少中性粒细胞的招募,而在肿瘤部位原位清除血小板不会影响中性粒细胞的渗透,从而造成中性粒细胞介导的血管破损。我们原创性地通过系统给药的方式增加了肿瘤血管的通透性,同时增强了纳米药物的富集,最终有效抑制肿瘤组织恶性生长以及远端转移(图3),此联合递送抗血小板药物和化疗药物的治疗策略展现出巨大的临床应用潜力。
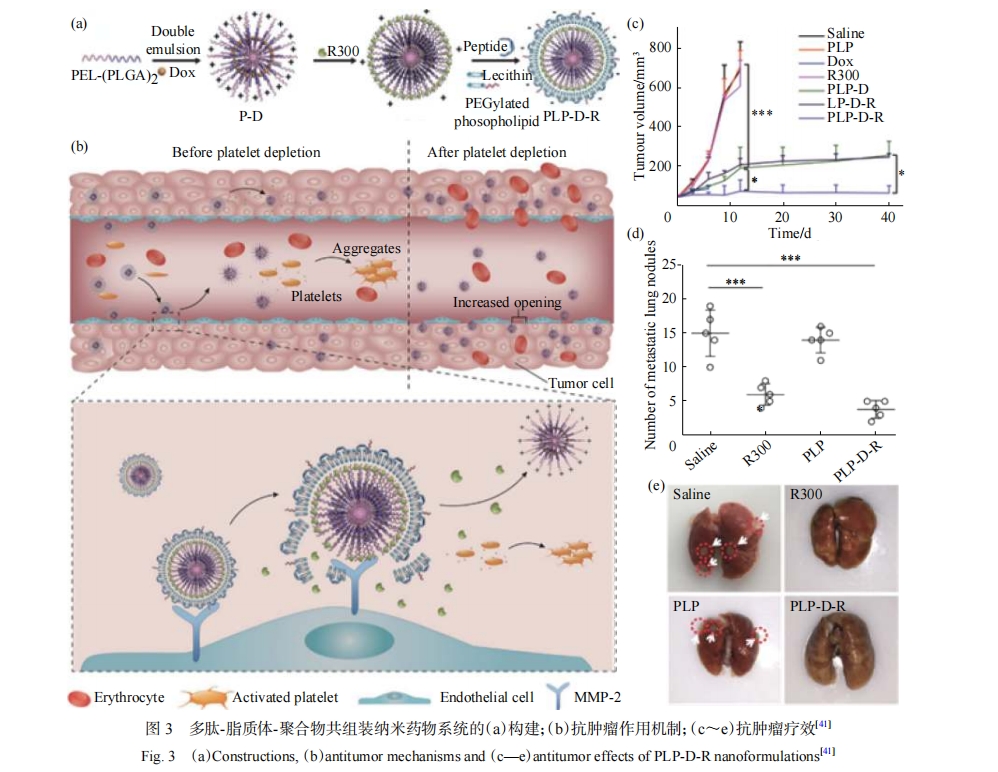
此外,肿瘤相关血小板已经被证实在肿瘤转移过程中发挥关键作用,它们可以刺激肿瘤细胞获得侵袭特性,释放转化生长因子(TGF-β)[46],在转移至远处病灶过程中结合至循环肿瘤细胞表位,避免被免疫系统中的自然杀伤细胞(NK细胞)清除[47],或将主要组织相容性复合体(MHC)Ⅰ类蛋白转移至肿瘤细胞表面。与肿瘤细胞的异质性不同,血小板性质相对稳定,因此展示出作为诊疗靶点的优良特性。Zhang等[48]利用多肽序列CREKA(Cys-Arg-Glu-Lys-Ala)能够特异性与肿瘤血管壁上的纤维蛋白-纤连蛋白复合物(微血栓)结合的特点,通过薄膜法制备表面修饰CREKA的卵磷脂/DSPE杂合脂质体包载替卡格雷,竞争性抑制肿瘤相关血小板上P2Y12受体[49],并抑制TGF-β释放。与生理盐水组相比,实现了75%的肺部转移抑制率。
2 靶向调控免疫细胞
2.1 靶向调控肿瘤相关巨噬细胞(TAM)的纳米药物系统
肿瘤相关巨噬细胞是肿瘤微环境中免疫细胞的主要和主导性成分[50, 51]。微环境中的巨噬细胞会根据环境刺激选择性分化为M1型或者M2型巨噬细胞,这两种表型的生物标记分子不尽相同[52]。M1型细胞为免疫激活型细胞,通过释放γ-干扰素(IFN-γ)和Notch信号通路介导抗肿瘤免疫活性[53]。在缺氧的肿瘤微环境中,巨噬细胞会倾向于分化为M2型,其高表达抗炎性细胞因子如TGF-β和IL-10,M2型巨噬细胞和肿瘤细胞间的相互作用还会激活STAT3信号通路,促进形成免疫抑制性肿瘤微环境,使肿瘤细胞逃脱免疫系统的监视和清除[54]。在大多数癌症中,较低的M1与M2型巨噬细胞比例与预后呈负相关[55]。此外,还有报道表明TAM是化疗和放疗过程中产生耐受性的关键因素[56]。针对肿瘤相关巨噬细胞的治疗策略以抑制巨噬细胞募集,降低TAM存活率,增强TAM向M1型细胞分化,或者抑制M2型细胞的促肿瘤活性为主[57]。Conde等[58]设计了以金纳米粒为核体,表面修饰小干扰RNA(siRNA)和多肽的杂合纳米体系,利用M2pep(YEQDPWGVKWW)特异性靶向至肺癌相关巨噬细胞,同时结合小干扰RNA降低M2 TAM中VEGF的表达,抑制肿瘤血管新生和侵袭。在作者构建的小鼠肺癌原位模型中,长期给以低剂量制剂显著降低TAM在肺部肿瘤组织的募集,肿瘤抑制率约为95%,生存期延长约75%,展示出良好的治疗效果。
2.2 多肽组装激活自然杀伤细胞(NK Cells)介导的肿瘤免疫治疗
抗体依赖细胞介导的细胞毒性作用(antibody-dependent cell mediated cytotoxicity,ADCC)被证明是单克隆抗体临床治疗肿瘤的重要机制和手段[59, 60]。在抗体介导的ADCC发生过程中,抗体依赖的细胞介导的细胞毒性作用是指抗体的Fab段结合病毒感染的细胞或肿瘤细胞的抗原表位,抗体Fc段与杀伤细胞(NK细胞)表面的CD16膜蛋白结合,介导NK细胞直接杀伤靶细胞[61]。激活的NK细胞主要释放两种分子—穿孔素(perforin)和粒酶B(granzyme B)来直接杀伤靶细胞,同时会释放炎性细胞因子和趋化因子来产生间接抗肿瘤作用[62]。因此,抗体与靶细胞上的抗原结合是特异性的,NK细胞等对靶细胞的杀伤作用是非特异性的;然而由于肿瘤细胞的异质性和高变异率,很难找到多种肿瘤细胞共表达的抗原乃至同一种肿瘤内不同细胞的抗原也会有区别,这限制了ADCC效应在临床上的应用[63]。本课题组[64]原创性地构建了一种多肽-抗体免疫偶联物平台,将抗体或者它们的Fc片段与pHLIP(Ac-ACEQNPIYWARYADWLFTTPLLLLDLALLVDADEGT)的N端通过水溶性的氨基-巯基交联剂(Sulfo-SMCC)共价偶联。利用pHLIP多肽在肿瘤微酸性环境中二级结构产生特异性变化的特性,通过浓度依赖和时间依赖的模式,将效应分子Fc或抗体特异性组装在肿瘤细胞表面,进而激活NK细胞介导的ADCC效应,有效杀伤包括三阴性乳腺癌细胞在内的多种肿瘤细胞(图4),体内实验证实该体系对于早期肿瘤及其转移均有显著作用。这种在肿瘤微酸性环境中由多肽组装介导的效应分子高效结合靶细胞的策略,由于完全不依赖于抗体与抗原结合的高效性和特异性,有望在一定程度上解决肿瘤异质性的难题。

2.3 靶向阻断免疫检查点的多肽纳米药物
在肿瘤微环境中存在多种T细胞亚群,它们分别具有抑制和促进肿瘤生长的作用[3]。CD8+ T细胞(CTL)通过促进肿瘤细胞凋亡具有强大的肿瘤杀伤能力,因此肿瘤组织的CTL细胞比例和预后呈正相关[54];CD4+ T细胞(Th)通过释放促炎细胞因子如白细胞介素-2和IFN-γ增强其他细胞的免疫活性[65];肿瘤微环境中CD4+CD25+FOXP3+ T细胞(Treg)种群比例的增加表明肿瘤免疫抑制微环境的产生,同时Treg能够诱导单核粒细胞向M2型分化[66]。然而,肿瘤在恶性增生过程中进化出多种机制逃脱机体的免疫反应,细胞程序性死亡受体-1(PD-1)是在T细胞表面表达的免疫检查点受体,许多实体瘤通过过表达细胞程序性死亡受体-1的配体(PD-L1),抑制激酶信号通路,从而降低T细胞的增殖与活力,逃脱免疫系统的攻击[67]。
阻断免疫检查点的免疫疗法为治愈肿瘤患者提供了希望,PD-L1和吲哚胺-(2, 3)-双加氧酶(IDO)是肿瘤免疫治疗的重要靶点[68, 69]。免疫检查点抗体药物疗效显著,但它们同时给患者带来了严重甚至持续性的不良反应,尤其是多药联合应用导致的不良反应率更高。其中一个重要原因是抗体类药物的免疫原性很高,同时抗体药物还存在研发周期长、制备成本高和组织渗透率低等问题[70]。与抗体药物相比,多肽药物的组织渗透率高、免疫原性低、受体结合率高,但体内半衰期很短,严重制约了其临床应用。
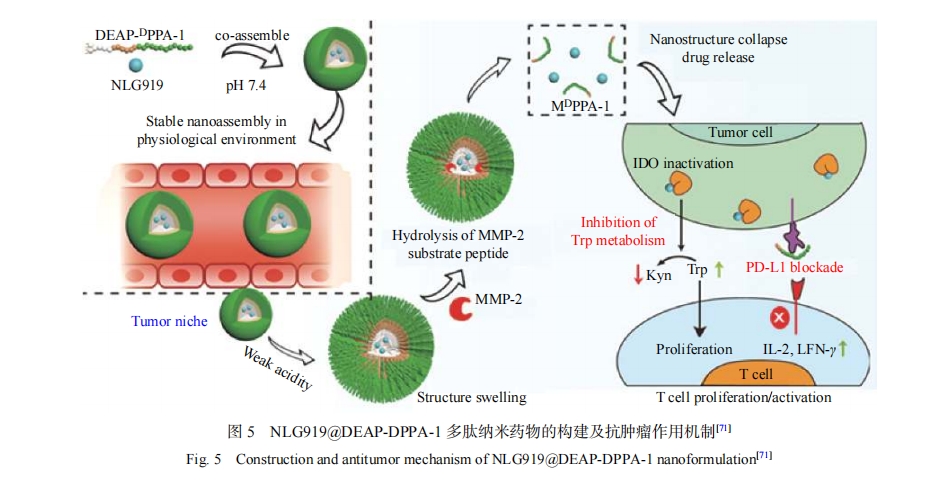
本课题组[71]基于多肽分子模块化设计的策略,通过改造用于阻断PD-L1与其受体结合的短肽DPPA-1分子,构建了一种肿瘤微酸环境和酶双响应的多肽纳米药物。其疏水内核区域由微酸响应性功能分子DEAP和MMP底物肽PLGLAG组成,彼此通过K-L2-G2连接,其中赖氨酸(K)用于偶联DEAP,亮氨酸的掺杂增加了此区域的疏水性。此多肽纳米药物的表面暴露大量亲水性短肽DPPA-1(nyskptdrqyhf)用于阻断免疫检查点[72]。在微酸性条件下,由于DEAP质子化使组装体稳定性变差,非致密体系为MMP剪切释放功能性DPPA-1肽段提供空间。同时联合IDO抑制剂NLG919,通过竞争性拮抗PD-L1和PD-1结合和抑制色氨酸代谢途径[73],使肿瘤组织中CD8+ T细胞和CD4+ T细胞占比明显增加,对黑色素瘤起到了很好的治疗效果(图5)。此多肽纳米药物在肿瘤免疫治疗领域为抗体的替代奠定了基础。
3 靶向调控肿瘤相关成纤维细胞(CAFs)
成纤维细胞是间质来源的纺锤状细胞,在正常组织中一般处于静息状态,主要参与创伤后修复[74]。在肿瘤发生过程中,新生肿瘤细胞通过释放多种生长因子(如TGF-β)激活周边正常组织成纤维细胞和骨髓间充质干细胞(Bone Marrow-Derived Mesenchymal Stem Cells),最终这些细胞获得了以成纤维细胞激活蛋白-α(FAP-α)为表面标志物的CAFs表型[75]。CAFs通过释放血管内皮生长因子和白介素-6等促进肿瘤血管新生和肿瘤细胞增殖[76]。
此外,肿瘤相关成纤维细胞的一些特性也决定了它非常适合作为纳米药物调控的靶点[77]。首先,它广泛存在于大部分实体瘤中,构成了50%~95%肿瘤基质,靶位十分丰富;其次,与肿瘤细胞相比,间质成纤维细胞的基因组较稳定,不易抗原丢失和治疗耐受;另外,肿瘤相关成纤维细胞主要分布于肿瘤血管附近,因此易与纳米药物相互作用。
FAP-α是CAFs细胞膜上特异性表达的一种蛋白水解酶[78],能在多肽链N端倒数第二位特异性剪切含脯氨酸或丙氨酸的二肽片段,同时具有降解明胶和I型胶原的能力,因此FAP-α在细胞外基质重构方面发挥关键作用[79-81],正是因为FAP-α的水解酶活性,使其底物多肽序列用于肿瘤靶向诊断和治疗具有实际意义[82, 83]。我们[82]将FAP-α的底物多肽设计成为具有π形结构的两亲性分子(AcATK(C18)EATGPAK(C18)TA),构建肿瘤微环境酶响应性多肽纳米载体,实现药物的包载和响应释放。亲水区Gly-Pro-Ala-X序列可被FAP-α特异性剪切,苏氨酸的加入增加体系亲水性,天冬氨酸由于具有羧基,可以增加体系的负电荷,避免在体内被网状内皮系统清除,同时氨基端加以乙酰化保护,避免被淋巴管中表达的二肽水解酶降解[84],而油酸在体系中则构成疏水性基团。该多肽纳米药物系统存在3种可能的自组装机制(图6):(1)多肽分子的自组装;(2)多肽与药物的共组装;(3)药物分子诱导的重新组装。在已经自组装形成多肽纳米纤维的溶液体系中,在超声的作用下加入疏水药物Dox,在不同时间点取样观察,疏水Dox可以在超声条件下诱导纤维状多肽自组装体进行载药重组的变构过程,最终形成球形纳米颗粒。当肽段被FAP-α酶切后,纳米药物在肿瘤微环境中迅速解聚,随之释放药物分子。基于尺寸效应,药物渗透深度可提高5倍,肿瘤抑制率大于75%。
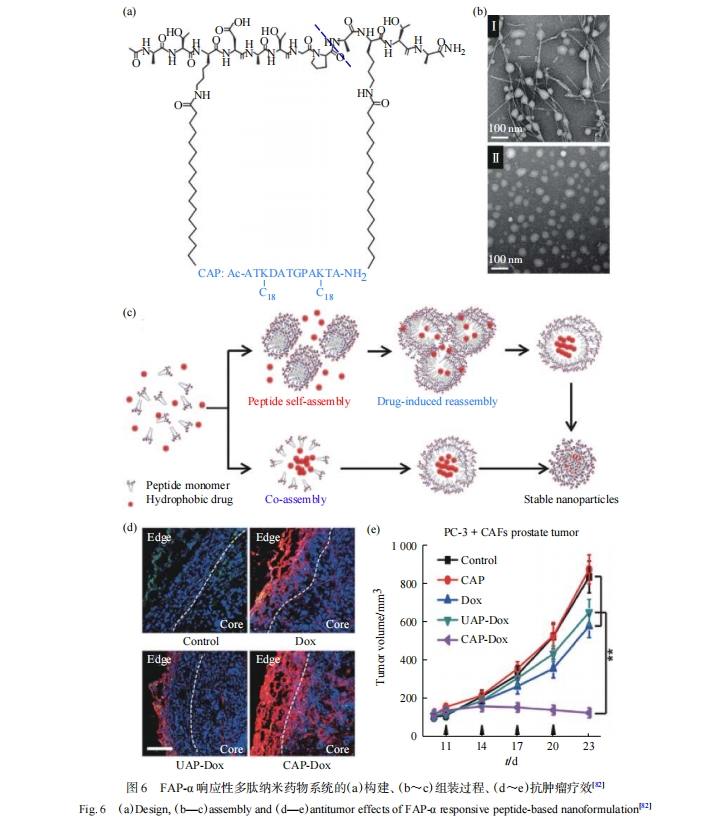
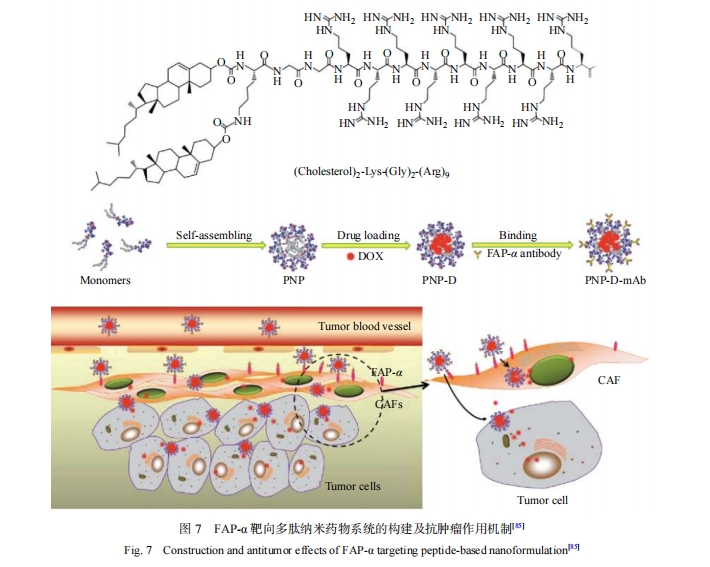
FAP-α除了具有蛋白水解酶的性质外,其本质也是一种膜蛋白,可视为是CAFs的表面抗原。本课题组利用细胞穿膜肽R9和胆固醇分子的模块搭配设计两亲性分子,构建多肽纳米载体,利用FAP-α抗体对其进行表面修饰。在血液循环中,纳米药物表面的FAP-α抗体屏蔽细胞穿膜肽的穿膜功能。当进入肿瘤微环境后,FAP-α抗体首先结合CAFs的表面抗原,随后从载体表面脱落,暴露出大量细胞穿膜肽,从而载带化疗药物Dox高效进入CAFs以及肿瘤细胞,实现高效的穿透能力和双重靶向效果(图7)。此多肽纳米药物在肿瘤组织中的渗透深度可提高6倍,肿瘤抑制率大于85%。
4 靶向调控细胞外基质的纳米药物系统
细胞外基质(ECM)是一种包含胶原、弹性蛋白、纤连蛋白、透明质酸、糖蛋白以及蛋白聚糖的三维结构[86],用以支撑细胞和维护体系水分及pH的动态平衡[87]。由于肿瘤细胞的异质性、组织乏氧以及炎性反应,导致了以胶原交联沉积为代表的细胞外基质重构现象,表现为基质的密度和刚性增加[88]。重构的细胞外基质一方面促进血管新生、肿瘤增殖和迁移,另一方面致密的细胞外基质和肿瘤细胞的堆叠增大了组织间质压,极大限制了药物渗透进入深层组织和穿透血管的能力,增加了肿瘤组织的耐药性[89]。CAFs在肿瘤微环境中合成并分泌大量细胞外基质的主要成分,因此主导塑造高度纤维化的致密生物屏障,在基质丰富的实体瘤中严重限制着纳米药物的瘤内递送。
传统的基于细胞靶点的分子药物递送系统设计可能会因为病人机体内细胞的异质性或者病人间的种群差异,从而限制其临床应用。最近,研究者们开始探索大量非细胞靶点,例如凝血级联[90]和细胞外基质[91, 92]等。
Ⅳ型胶原(Collagen IV)在血管基底膜成分中占50%左右[93]。Langer等[94]通过噬菌体筛选技术设计出多肽序列(HWGSLRA),体外实验展示出对Collagen IV的特殊亲和力,并构建了基于FDA批准的生物安全性材料的胶束型紫杉醇药物递送系统,表面修饰多肽特异性结合组织中Ⅳ型胶原。体内实验证明,该载药系统对于创伤后血管具有良好的靶向性并可实现长达12 d的缓控释效果。Langer等表示该体系日后可以应用于包括心脑血管疾病和癌症在内的一系列血管类疾病进行药物递送和治疗。
透明质酸作为凝胶状细胞外基质的主要成分之一,可被透明质酸酶(hyaluronidase, HAase)特异性降解。Wang等[95] 以天然大分子葡聚糖(dextran, DEX)为载体,经过化学改性后在温和的反应条件下即可通过酸性可裂解的基团与HAase键合,制备了在生理环境中保持稳定而在肿瘤偏酸性的微环境中快速释放HAase的刺激响应性纳米颗粒DEX-HAase,该体系可以有效抵御蛋白水解酶对于透明质酸酶的降解,使肿瘤细胞外机制变得疏松,从而实现药物的有效富集、改善乏氧和促进细胞毒性T淋巴细胞(cytotoxic lymphocyte,CTL)在肿瘤组织的浸润。
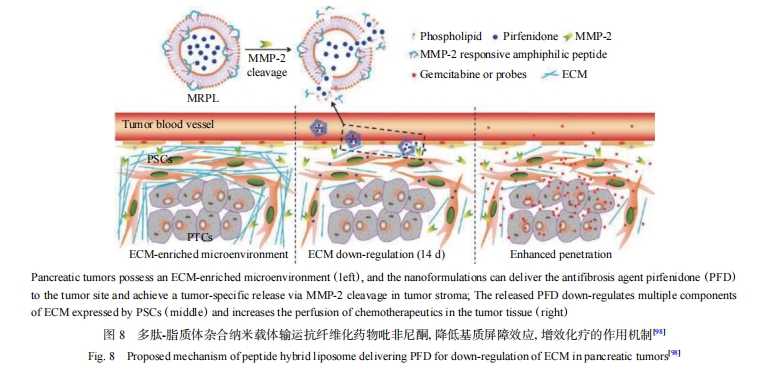
被称为“癌症之王”的胰腺癌是一种恶性程度很高、诊断和治疗困难的消化道恶性肿瘤,其5年生存率小于5%[96]。在胰腺癌的微环境中,间质细胞和细胞外基质成分约占整个肿瘤组织的90%,呈现高度纤维化和乏血供的特征[97]。本课题组[98]针对胰腺癌基质微环境的病理、生理特点,基于重塑基质微环境的策略,构建纳米载体载带抗纤维化药物吡非尼酮(PFD)。由于PFD是亲水性小分子药物,我们将MMP-2底物多肽改造成具有π形结构的两亲性分子(SDK(C18)SGPLG-IAGQSK(C18)DS),构建肿瘤微环境酶响应性多肽-脂质体杂化纳米载体。当多肽与磷脂的质量比超过1∶5时可以共组装形成稳定的杂合纳米载体,将亲水性PFD包载于内腔中。当此纳米药物被递送到肿瘤微环境中,多肽序列被MMP-2特异性剪切,磷脂双分子层发生扰动,从而释放出药物PFD,调控肿瘤相关成纤维细胞,特异性降低基质的屏障效应(图8),使化疗药吉西他滨的渗透深度提高8倍以上,肿瘤抑制率大于70%,显著提高了吉西他滨的抗肿瘤疗效。
5 总结与展望
针对恶性肿瘤治疗难度大、易复发和转移等临床挑战,发展基于自组装生物纳米材料靶向调控肿瘤微环境的创新策略,为实现肿瘤的综合性精准治疗提供了科学依据,将是未来重要的发展方向之一。通过纳米技术改善和重塑肿瘤微环境,可实现抑制肿瘤恶性表型,提高肿瘤治疗效果。基于多肽和高生物相容性分子精准自组装技术,构建表/界面性质可控的纳米药物系统,可实现药物在体内多靶点、多层次、多模式的肿瘤靶向递送和可控响应释放;揭示生物纳米材料组装调控规律,及其影响肿瘤微环境病理效应的关键纳米参数;发展基于肿瘤微环境调控的纳米抗肿瘤综合治疗策略。
聚焦人类健康与疾病,智能诊疗技术已逐渐成为快速捕获各类疾病的分子表型,认识其在疾病发生、发展过程中的动态演化规律,实现对疾病的早期预防、诊断和治疗的关键技术。充分利用多肽分子的结构特性和生物功能特性等优势,基于模块化设计的概念,可以通过对多肽单体的设计、修饰和组装实现不同功能多肽分子的模块化生物功能性集成,构筑具有系列生物功能的多肽纳米药物系统。它一方面可以兼顾多肽的生物相容、生物可降解等特性;另一方面,多肽超分子组装体能够在不同的生物环境中进行可控组装和解聚的变构过程,因此,多肽纳米药物系统具有生物功能多样化和利于变构的明显优势。综合利用疾病微环境的病理、生理特点,精准构筑多肽纳米药物系统,使其在肿瘤微环境中实现可控变构和功能性,将有助于我们更好地认识生命体的生理与病理过程等,研究诸多与人类健康和疾病相关的科学问题,有望成为实现对疾病精准诊断和治疗的一个重要突破口。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志








