
摘要 备受关注的肿瘤免疫治疗其核心在于能够激发免疫应答的抗原表位。该文以纳米金颗粒作为筛选载体, 偶联肿瘤抗原, 体外与人外周血单个核细胞相互作用, 以酶联免疫斑点法精确检测免疫原性来筛选具有免疫原性的抗原多肽。光谱分析证明了纳米金颗粒与合成多肽的偶联,荧光显微镜和电子显微镜直接证明细胞摄取偶联复合物, 通过检测T细胞γ-干扰素分泌水平证实了不同多肽的免疫原性。该文优化了实验参数(如pH、缓冲液体系以及孵育时间等), 显著地减少了从多肽合成到免疫原性分析的实验过程所需的时间, 同时, 实验规模也成功地缩小到了96孔板, 达到简单快速筛选免疫原性多肽的最终目的。
肿瘤的免疫疗法利用T细胞对肿瘤特异性抗原的应答反应诱导免疫系统对肿瘤造成杀伤作用, 避免药物带来的常见不良反应, 改善患者的生活品质[1], 给肿瘤治疗带来了希望, 成为肿瘤治疗研究的热点。免疫治疗药物, 尤其是免疫检查点抑制抗体[如细胞毒T淋巴细胞相关抗原-4(cytotoxic Tlymphocyte-associated antigen-4, CTLA-4)和 程 序 性死亡受体-1[2](programmed death receptor-1, PD-1)已在某些肿瘤中具有显著疗效。由于其高度特异性、显著的有效性以及相对可控的副作用[3], 肿瘤免疫治疗已成为越来越多肿瘤的标准治疗方式[4], 对延长存活率有很大的帮助[5]。肿瘤的免疫治疗包括多细胞免疫疗法[6]和特异性抗肿瘤疗法[7]。杀伤性T淋巴细胞(cytotoxic T lymphocyte, CTL), 是T细胞的其中一小类, 在肿瘤细胞识别和杀伤过程中起重要作用[8]。总体而言, 特异性免疫治疗的基础在于肿瘤特异性抗原的识别与处理[9], 无论采用肿瘤抗原疫苗和嵌合抗原受体(chimeric antigen receptor, CAR)方法,其核心都是要支持免疫系统正确识别肿瘤细胞[10]。然而, 很多情况下, 能引起免疫的抗原性质是不明确的[11]。抗原特异性T细胞群在体外培养后也可能发生显著改变, 比如刺激后体外优势克隆型及次优势克隆型的减少[12]。因此, 确立一定数量的抗原表位(epitope)不仅是免疫治疗的基础, 也是持续疗效的保障。
虽然T细胞抗原在临床药物应用和研究中非常有应用前景, 但是一方面由于效应T细胞和抗原递呈细胞之间相互作用的复杂性, 另一方面是由于庞大的T细胞群和大量潜在T细胞表位的存在[13], 使得其发现和鉴定速度过慢, 导致无法满足高效筛选的要求。在免疫干预实验中, 免疫原性的综合研究或者T细胞表位的整体性研究非常困难, 因此通常利用混合多肽来监测T细胞的应答[14]。相比过程复杂的表达克隆[14-18]和高度仪器依赖的肽洗脱[19-22]方法,肽疫苗(peptide vaccine)能更大程度地缩短筛选潜在表位所需要的时间[23]及对大型仪器的依赖性, 提高效率及拓宽应用广度。此外, 新兴的基于分子模型计算的T细胞表位预测已取得部分成果但仍需改进[24]。多肽结合主要组织相容性复合体分子(majorhistocompatibility complex, MHC)的计算机预测在基于表位的疫苗发展中具有重要的实际意义, 然而该预测方法基于具免疫原性的多肽, 现有的大部分MHC等位基因对应的抗原表位之间存在明显的差异[25]。因此, 可能需要较长时期的算法改进和实验数据支持。
在发现抗原表位的实验方法中, 除了前述较为直接的肽洗脱法, 其他方法均采用间接的T细胞应答观察, 如荧光信号[26]、四聚体流式检测[27]及细胞因子分泌检测[28]等, 抗原信息导入也同样有着各类方法[13]。纳米金颗粒(gold nanoparticle, AuNP)能有效传递免疫原性物质并且具有低生物毒性[29-30], 是一种潜在的肿瘤免疫治疗的优良载体。目前, TNF-α(tumor necrosis factor-α)偶联的纳米金颗粒(CYT-6091)在I期临床实验阶段中发现, 其可以通过肝脏缓慢清除[31]。纳米金颗粒被细胞摄取与清除的机制取决于尺寸,形状和表面修饰特性。纳米金颗粒大小在13 nm到100 nm之间, 能被淋巴引流及细胞摄取, 其中, 直径在50 nm左右的颗粒显示了最高的细胞摄取率, 小于15 nm的颗粒能通过核孔[32-34]。通过核定位信号肽(nuclear localization signal peptides, NLSs)、 细 胞 穿膜肽(cell penetrating peptides, CPPs)或者受体靶向型多肽的作用, 纳米金颗粒可以进入细胞或细胞核。在实际应用中还发现, 经过紫杉醇修饰的纳米金颗粒在肿瘤治疗中显示对正常细胞无细胞毒性[35]。这种稳定安全的特性也使纳米金颗粒能够成为表位筛选的理想载体。以纳米金颗粒为载体的转导方法与传统的电穿孔法、脂质体转染法[36-37]、腺病毒转染法等相比, 在安全和稳定方面均拥有更大的优势。
1 材料与方法
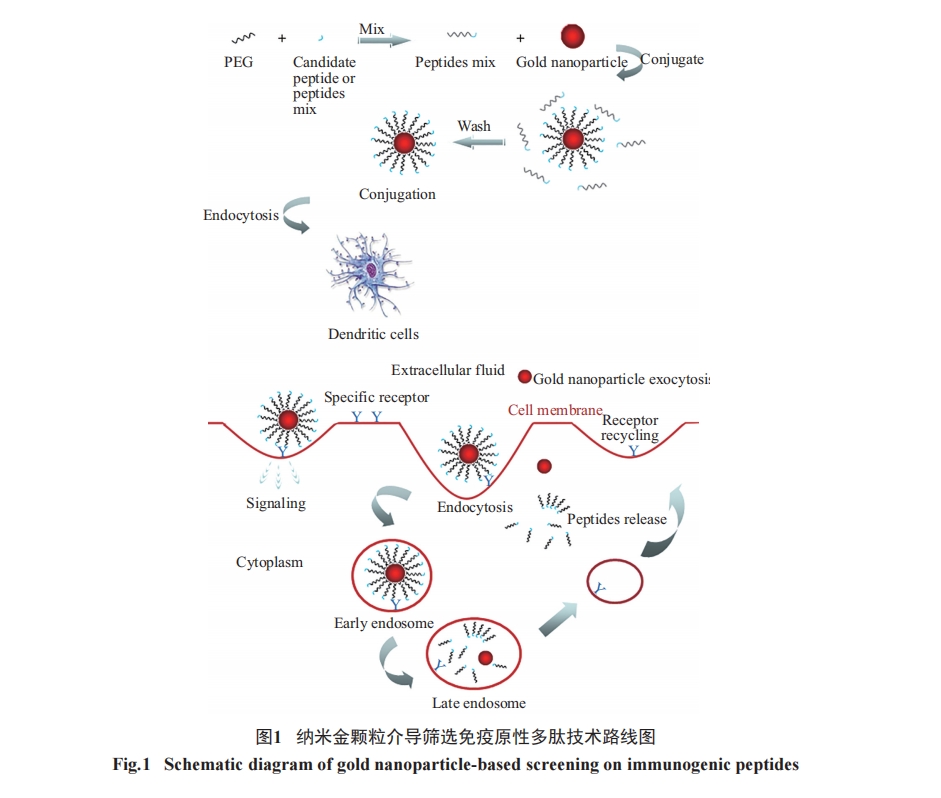
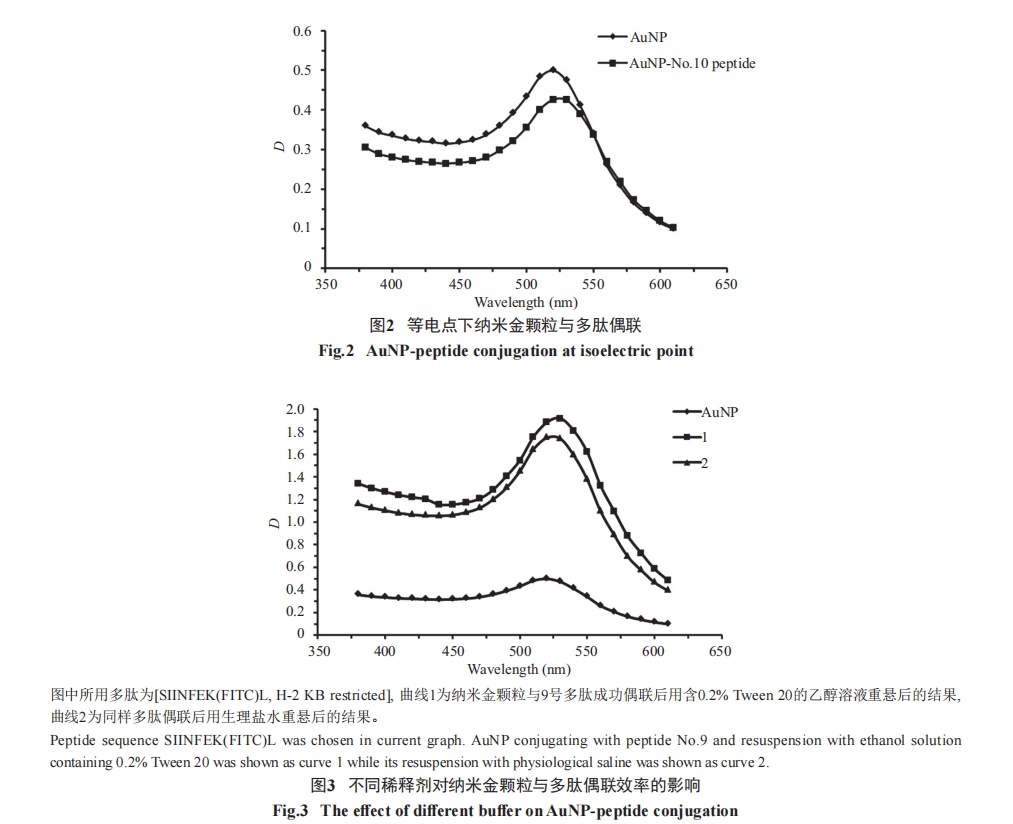
室温下, 硫醇可以与纳米金颗粒在溶液环境中形成共价键[27]。首先, 将20 μmol/L的PEG(methoxy PEGThiol, 5 kDa)和20 μmol/L的多肽在离心管中等体积混合, 形成多肽与含巯基聚乙二醇(PEG)摩尔比为1׃1。然后, 将混合物加入到15 nm柠檬酸盐包被的纳米金(1.16 nmol/L)胶体中, 形成巯基与纳米金颗粒的摩尔比(以下简称为硫金摩尔比)为2 500׃1。室温搅拌金/PEG/多肽混合物1 h, 使硫醇与柠檬酸在纳米金颗粒中完全置换。然后, 12 000 r/min离心30 min富集偶联复合物。弃上清, 并用合适体积的缓冲液重悬偶联复合物。为了提高偶联效率, 需调整实验过程中的pH及缓冲液, 偶联结果通过纳米金颗粒与偶联复合物在380~610 nm波长之间吸收峰检测得到。
用血细胞分离机 (Fresenius Kabi公司 )分离收集病人外周血单个核细胞(pe riphe r a l bloodmononuclear cell, PBMC)。每个病人收集约2×109个PBMC, 用AIM-V培养基(Gibco公司)洗2遍后, 稀释至4×106/mL。然后, 将PBMC按每孔约1×106/mL接种到96孔板中培养2 h。贴壁细胞加入树突状细胞(dendritic cell, DC)培 养 基(含100 ng/mL GM-CSF、1 000 U/mL IL-4和50 ng/mL FLT3-L)诱导培养未成熟DC细胞。所有细胞因子均购买自Novoprotein公司。
除DC细胞外, 本研究中还应用到了293A细胞和巨噬细胞。用DMEM培养基(Dulbecco’s ModifiedEagle Medium)培养293A细胞, 1.0 mmol/L丙酮酸钠,100 U/mL青霉素和100 μg/mL链霉素, 加10%胎牛血清(fetal bovine serum, FBS), 在37 °C、5% CO2及饱和湿度条件下培养, 每3 d传代, 取对数生长期细胞用于实验。小鼠腹腔注射500 μL液体石蜡, 饥饿处理72 h刺激巨噬细胞生成, 收集腹腔液, 于1 000 r/min离心3 min, PBS洗3次, 加RPMI 1640, 在37 °C、5%CO2及饱和湿度培养, 每3d更换培养基。
如前所述, 通过荧光显微镜检测DC细胞摄取FITC标记的纳米金颗粒–多肽复合物情况。简单地说, 将50 μL(多肽含量为60 nmol)按上述方法配制的纳米金颗粒–多肽复合物加入到150 μL含有5×105个未成熟DC细胞的培养体系中, 培养2 h(37 °C、5%CO2及饱和湿度)。处理后细胞用生理盐水洗2次, 保存在生理盐水溶液中用于荧光显微镜检测。用透射电子显微镜(transmission electron microscopy, TEM)直接观察细胞摄取纳米金颗粒能力时, 由于DC细胞样本量的限制, 无法满足切片要求以完成TEM观察,因此改用293A细胞检测细胞摄取纳米金颗粒的情况。方法如下, 培养约1×108个293A细胞, 用15 mL纳米金颗粒处理。处理后细胞收集并用多聚甲醛固定。使用HITACHI H-7650透射电子显微镜完成电镜实验。
抗原特异性T细胞应答反应是通过酶联免疫斑点 试 验(enzyme-linked immunospot, ELISPOT)检 测IFN-γ的释放水平来实现的, 实验设置3个对照组(分别为空白对照组、阴性对照组和阳性对照组)及不同浓度的实验组, 使用人IFN-γ预包被ELISPOT试剂盒(达科为生物技术股份有限公司)进行检测。首先用200 μL培养基预包被每孔, 然后将100 μL含1×105个细胞的液体加入到除空白对照组外的各实验孔,空白对照组加对应体积培养基。实验所用细胞为PBMC, 在阳性对照组孔加入阳性刺激剂10 μL/孔,等体积培养基加入到阴性对照组孔, 浓度梯度的纳米金颗粒–多肽复合物加入到各实验孔。37 °C、5%CO2孵育20 h后, 在4 °C用去离子水裂解10 min。用试剂盒提供的洗液洗5遍后, 每孔加100 μL生物素偶联的IFN-γ单抗孵育1 h。重复上述清洗步骤后, 每孔加100 μL的链霉亲和素-HRP后孵育1 h。再重复清洗步骤后, 每孔加100 μL新鲜配置AEC显色液, 并将实验板避光20 min显色。显色完成后弃溶液, 用去离子水洗若干遍后, 自然晾干实验板, 用Bioreader4000-PRO-X(Bio-Sys, Germany)读板仪进行斑点读取, 单次实验设置3个复孔进行均值统计, 3次独立重复实验后, 采用Origin 8.0软件进行统计学分析。
2 结果
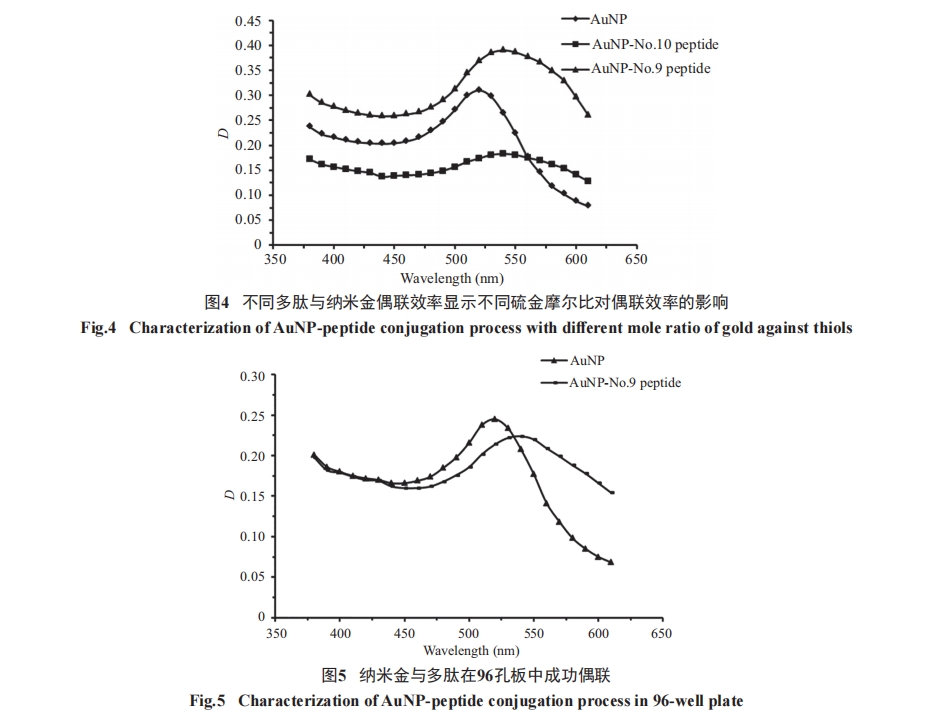
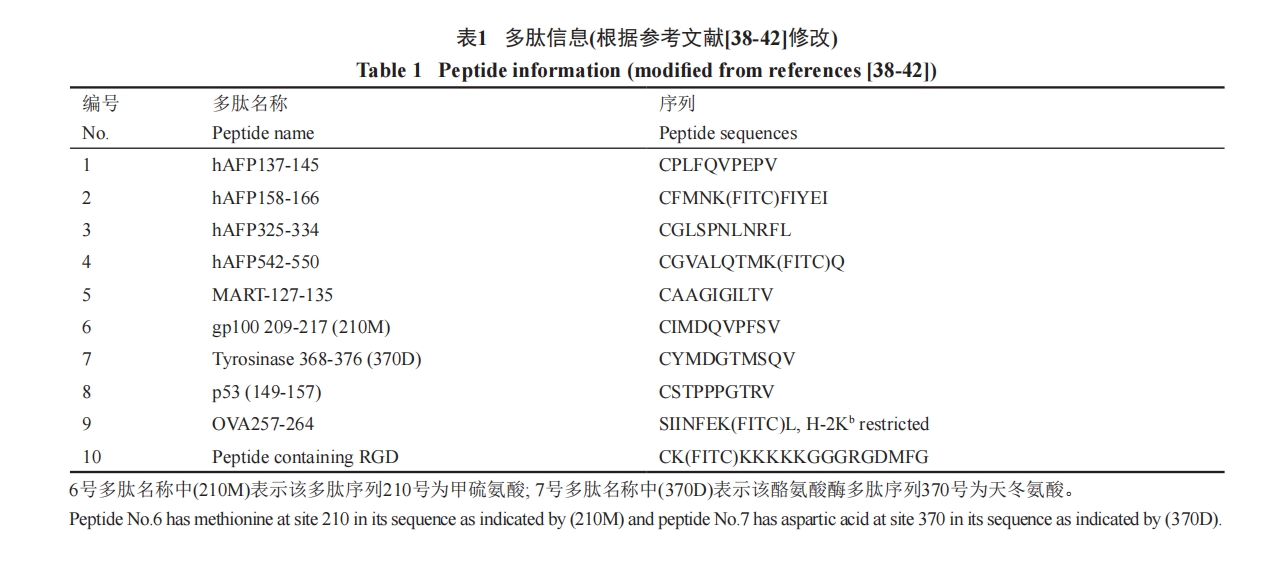
为 了 减 小 偶 联 体 系 的 规 模, 使 用9号 多 肽[SIINFEK(FITC)L, H-2 KB restricted]在最佳pH5.8时, 与纳米金颗粒偶联。在同一离心管中, 混合20 μmol/L等体积7.2 μL多肽和PEG, 形成摩尔比为1׃1。将混合物加到粒径为15 nm的柠檬酸盐包被的100 μL纳米金颗粒中, 室温搅拌金/PEG/多肽混合物1 h, 使硫醇和柠檬酸在纳米金颗粒表面完全交换。混合完全后, 将偶联复合物转移到1.5 mL离心管中, 12 000 r/min离心30 min纯化偶联复合物并去除上清。用100 μL含0.2% Tween 20的乙醇溶液重悬偶联复合物。图5显示了380~610 nm的光谱吸收以证实偶联成功。
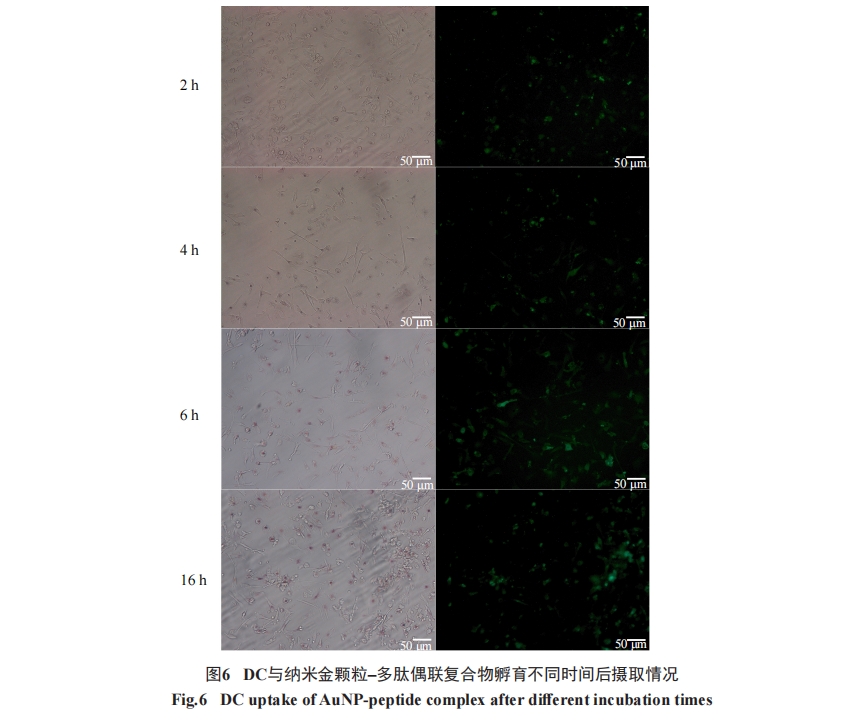
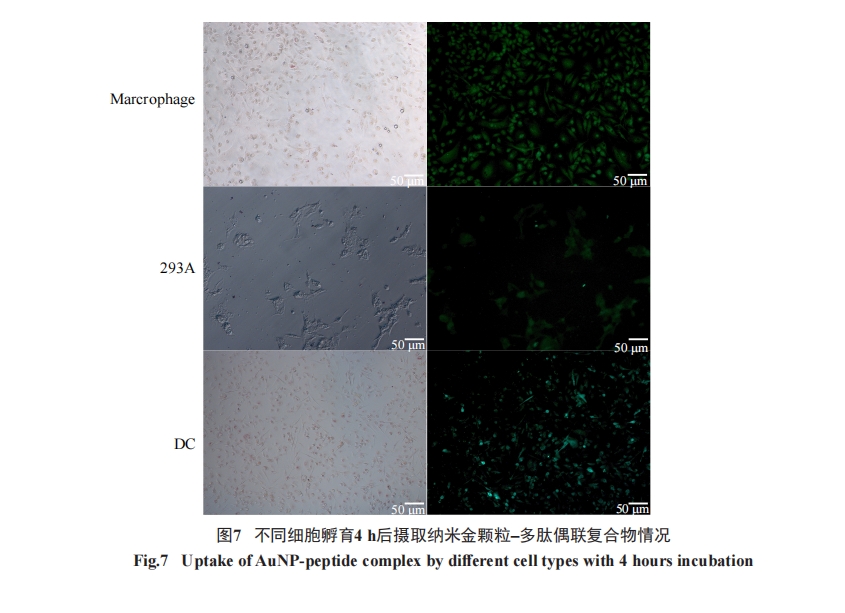
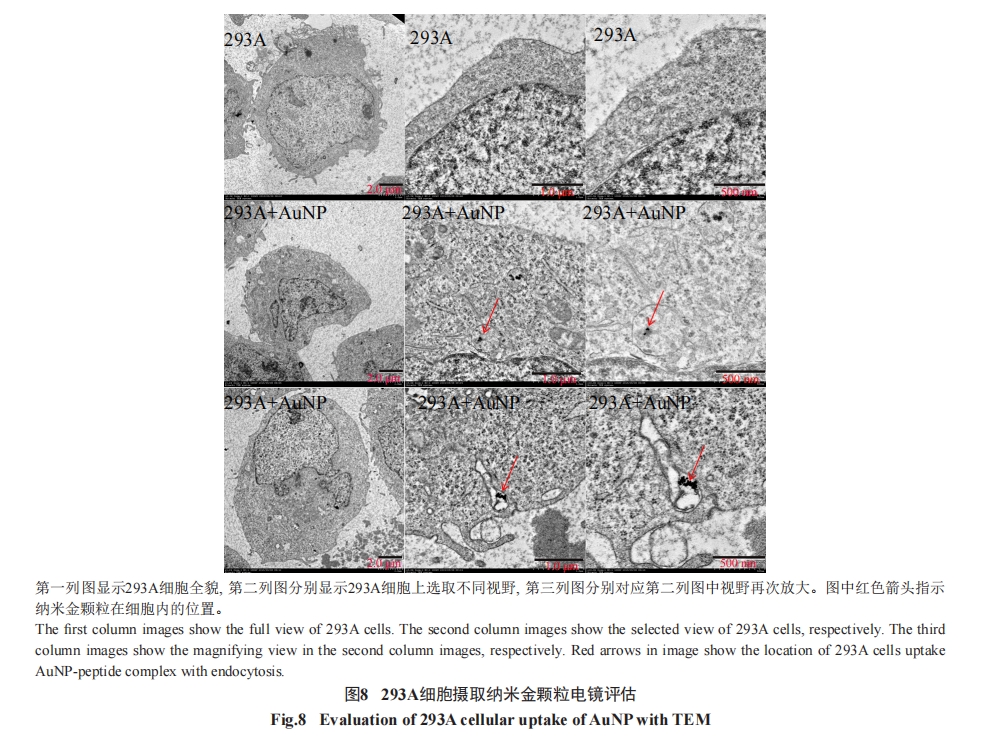

3 讨论
随着基因测序的应用推广, 针对肿瘤的治疗势必将趋于精准化和个性化, 其应用主要包括两个方面, 即精准诊断和精准治疗。其中, 精准诊断深入基因水平对肿瘤发生原因进行定位; 治疗上的精准化则指的是针对病因的靶向用药。精准医疗作为一种新型的医学概念及医疗模式, 目前正受到国家的大力支持, 基因测序政策的放开也打开了精准医疗产业化的大门。免疫治疗作为继手术、放疗和化疗之后的第四大肿瘤治疗技术, 其核心要素抗原表位的筛选必将成为肿瘤免疫疗法中的重要一环和常规技术。肿瘤相关免疫原性多肽来源于肿瘤, 作为识别肿瘤抗击肿瘤最直接的武器, 其免疫原性强弱直接关系到肿瘤治疗的效果。
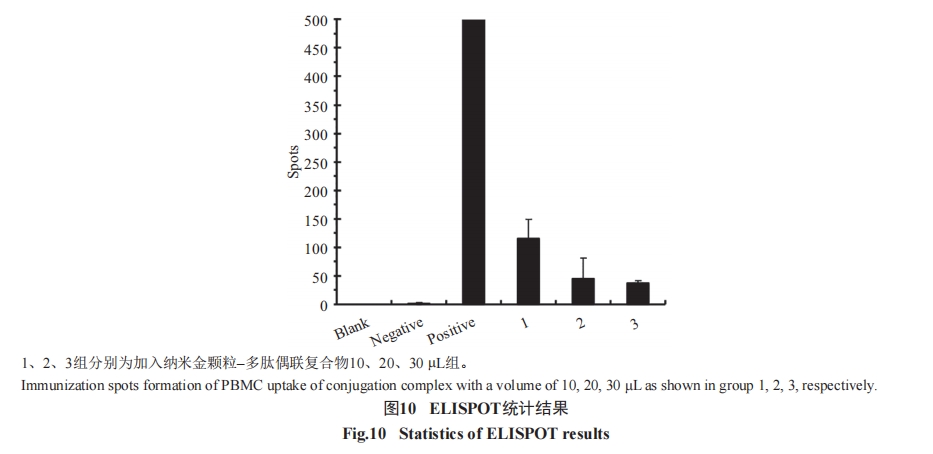
本研究从纳米金颗粒良好的理化性质及广泛的生物学应用入手, 将其与抗原多肽进行偶联实现快速且简便的筛选。在实验过程中, 不断优化各种参数, 如纳米金颗粒与多肽偶联时的pH、缓冲液体系、稀释剂成分、硫金摩尔比、细胞摄取偶联复合物的时间等参数, 实现最优的偶联条件、最少的偶联损耗以及最短的实验时间。在多肽免疫原性实验中成功验证不同多肽的免疫原性。此外, 研究还成功实现了反应体系的缩小, 以适应高通量筛选的需求。现今, 纳米科技在生物学、医学等领域发挥着越来越重要的作用, 纳米材料的优良特性使其拥有广泛的应用前景。生化药品的研发如抗癌药、抗心血管病药、抗艾滋病和糖尿病药, 特别是DNA药物都可引入纳米材料。因此, 本研究所涉及的实验成果在抗病毒感染、肿瘤治疗、疫苗开发等方面都具有重要的理论和实际意义。已有研究表明, 粒径小于50 nm的微粒, 能穿过肝脏内皮或通过淋巴传递到达脾和骨髓, 或者携带小分子多肽或药物跨越血–脑屏障。因此, 针对纳米金颗粒的研究必将极大地推动肿瘤的免疫治疗。此外, 本研究后期可致力于寻找和设计DC细胞靶向型多肽, 可以直接利用人外周血单核细胞, 无需分离DC及T细胞, 减少细胞分离与共培养步骤。
抗原表位筛选结果最终可通过合适的方式, 转换为医疗数据呈现给研究人员、医务工作者及患者。随着数据量的逐渐丰富, 肿瘤的新的基因标志或特异/共有的分子特征可能被发现, 其治疗方法也将随着现有经验的积累而得到简化与快速采用。本研究所涉及的实验方法可与计算机模拟及预测相结合,利用现有的MHC分子三维结构与实验筛选出的免疫原性差异明显的几种多肽进行演算, 从抗原亲和力微观角度解释其免疫原性的区别。随着MHC分子的空间结构越来越清晰化和准确化, 多种MHC分子–抗原复合物的数学模型已被建立, 通过计算机模拟运算能预估出每种抗原与MHC分子的亲和力数值。但鉴于MHC分子亚型的多样性, 新抗原前后氨基酸序列以不同组合、不同长度形成表位的多样性,数据庞大。目前, 该预测方法仍不够成熟, 假阳性或假阴性仍普遍存在, 需要后续耗时耗力的验证工作。因而, MHC分子与抗原的亲和力的准确预估, 仍有待于通过数据的不断积累、预测模型的不断优化来完成。此外, 研究也可覆盖MHC-I类分子及MHC-II类分子对抗原多肽的递呈能力, 这两类分子均可在免疫应答过程中受细胞因子的诱导而表达, 在肿瘤治疗中可通过提高抗原递呈细胞表面表达量达到更好的治疗效果。当多肽能稳定均匀的分散在纳米金颗粒上的时候, 进行多肽与MHC-I类及II类分子的亲和力模拟及预测, 通过计算机模拟找到这两类分子中起结合作用的关键氨基酸, 可为预测抗原递呈能力提供理论基础。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志