
摘要:植物利用包括激素和短肽在内的各种内源信号分子,调节自身生长发育和对各种环境胁迫的抗性反应。Pep是植物细胞产生的一类由二十多个氨基酸构成的短肽分子,在被子植物中普遍存在。Pep能够被植物细胞膜上的受体蛋白PEPR识别,进而发挥多种生物学功能。目前的研究表明,Pep既在植物抵抗原菌侵染、昆虫噬咬等生物胁迫以及高盐等非生物胁迫中发挥重要作用,也调控着根生长、叶片衰老等植物生长发育过程。综述了近年来关于Pep的产生、受体识别、信号转导及其生物学功能等方面的研究进展,并对该领域尚待解决的一些科学问题和可能的实际应用方向进行了讨论和展望,以期为相关研究者提供参考。
在自然界中,病原菌侵染、昆虫啃食、机械损伤等各种不利环境因素时刻威胁着植物的生存,而植物往往能够利用一些外源或内源信号分子,识别并有效应对这些生物或非生物胁迫[1,2,3]。这些信号分子包括来源于病原菌的病原菌相关分子模式PAMP(pathogen-associated molecular patterns,PAMP)[4,5]和来源于植物自身的损伤相关分子模式(danger-associated molecular patterns,DAMP)[4]。PAMP和DAMP可以被定位于质膜的模式识别受体(pattern recognition receptors,PRRs)识别[6],进而触发植物抗性反应。近年来,在植物中发现一类新型短肽Pep,可以作为一种DAMP分子,调控植物免疫。Pep在大多数被子植物中广泛存在,包括一些重要的农作物中,如玉米、水稻、番茄等[7,8,9]。一些研究表明,Pep可以正调控植物对细菌、真菌以及食草动物等的抗性[7,10-13]。此外也有研究发现,Pep在植物生长发育[14,15]和非生物胁迫响应[16,17]中也发挥重要的调控功能。本文将对近年来Pep相关的一些研究进展进行综述,并对该领域尚待解决的一些科学问题和可能的应用方向进行展望,以期对相关研究者有所启发。
1 Pep的产生
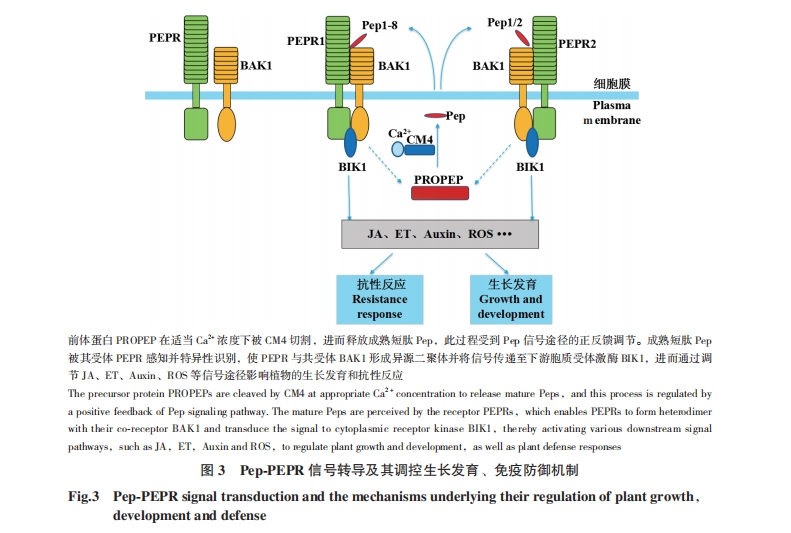
拟南芥8个AtPROPEP基因在不同组织中的表达模式大致可分为两类:AtPROPEP1/2/3/5/8主要在根中表达,在叶脉管系统中少量表达;而AtPROPEP4和AtPROPEP7仅在根尖中表达[19]。正常条件下,AtPROPEP基因的启动子几乎是不活跃的[21],但植物在受到外界刺激时,这些前体蛋白编码基因会被显著诱导。例如,损伤可以诱导AtPROPEPR1/2/3/5/8的表达;flg22、MeJA(methy jasmonate)和NaCl诱导能够诱导AtPROPEP1和AtPROPEP3的表达。此外,AtPep1也可以诱导AtPROPEP1和AtPROPEP3的表达[22],说明Pep信号途径可能存在一定的正反馈调节。除了组织表达特异性之外,不同的AtPROPEP蛋白的亚细胞定位也存在一定差异,例如AtPROPEP1和AtPROPEP6定位于液泡膜上,而AtPROPEPR3定位在胞浆中[19]。

植物细胞中Pep如何由其前体蛋白加工而来,目前还不是十分清楚。现有的研究提示,植物损伤后胞内钙离子浓度上升,激活相关蛋白酶,导致前体蛋白被蛋白酶切割,从而释放成熟短肽。在拟南芥中,当幼苗受到机械损伤后,产生的AtPep1可以在30 s内被检测到,并在5 min内达到峰值,说明损伤诱导的Pep的产生是十分迅速的。蛋白酶抑制剂筛选实验表明,前体蛋白的切割可能是由半胱氨酸蛋白酶Metacaspase介导的[23]。在拟南芥中,Metacaspase蛋白家族包括9个成员,根据所含结构域的不同可分为两种类型:Ⅰ型Metacaspase包括MC1-MC3,它们同时含有N端的pro-domain和C端的caspase-like domain,其中MC1与MC2可以相互拮抗的调控细胞程序性死亡[24];Ⅱ型Metacaspase包括MC4-MC9,它们含有caspase-like domain,但缺失pro-domain。在拟南芥原生质体中共表达Ⅱ型Metacaspase(MC4-MC9)能够促进PROPEP1的切割,说明Ⅱ型Metacaspase在由Pep的成熟过程中发挥重要作用[25]。Ⅱ型Metacaspase能够在精氨酸残基和赖氨酸残基后切割底物蛋白,其蛋白酶活性大多数依赖于适当的Ca2+浓度[26]。当植物处于静息状态时,胞质中的Ca2+浓度较低,半胱氨酸蛋白酶 MC4处于无活性或低活性状态;而当植物受到损伤后,胞质中的Ca2+浓度上升,MC4被激活,从而切割PROPEP形成成熟短肽Pep[23]。

2 Pep的信号转导
在植物中,质膜定位的模式识别受体PRR负责识别感知DAMP和PAMP,触发植物免疫。PRRs由许多类受体激酶(receptor-like kinase,RLK)和类受体蛋白(receptor-like proteins,RLP)组成[6]。
2006年,Yamaguchi等[20]鉴定到AtPep1的受体AtPEPR1。AtPEPR1是一个富含亮氨酸重复序列的受体激酶(LRR-RLK)。2010年,Yamaguchi等[13]进一步鉴定到AtPep的另一个受体AtPEPR2。AtPEPR2也属于LRR-RLK,与AtPEPR1共同介导拟南芥对Pep的感知。AtPEPR1和AtPEPR2的组织表达模式相似,均主要在根(除了根尖)中表达,同时在其他组织中也有较低水平的表达[19,27]。AtPEPR1和AtPEPR2的表达受损伤、MeJA和多种PAMP分子的诱导,同时也可受Pep诱导,但不同的Pep对这2个受体基因的诱导强度不同。例如AtPep1-AtPep3是PEPR1的强诱导子,而AtPep4和AtPep5对AtPEPR1、AtPEPR2的诱导作用较弱;AtPep6对AtPEPR1有较弱的诱导,但是对AtPEPR2无影响[13]。不同的AtPep对AtPEPR1和AtPEPR2的诱导程度不同暗示着,AtPEPR1和AtPEPR2可能在介导不同Pep的信号转导中存在一定的分工。确实,在拟南芥中AtPEPR对Pep的识别具有一定的特异性。AtPEPR1能够识别所有的AtPep,而AtPEPR2则主要识别AtPep1和AtPep2[13,19,21]。此外,也有研究表明AtPEPR1和AtPEPR2介导的Pep信号转导需要具有胞外结构域的受体激酶BAK1和一些没有胞外结构域的类受体胞质激酶(如BIK1和PBL1)的参与[28]。
Pep-PEPR信号转导体系在不同植物中显示出一定的不相容性,AtPep1只能被拟南芥及其近缘的植物识别,不能被亲缘关系较远的植物所识别。但Pep-PEPR信号转导体系在不同植物中也具有一定的保守性:用拟南芥AtPep1、番茄SlPep6和玉米ZmPep1分别处理瞬时表达AtPEPR1、SlPEPR1和ZmPEPR1a的烟草叶片,都能够激活下游信号通路,说明受体PEPR下游的激酶信号转导模块具有较强的保守性[8]。
受体复合体的内吞在植物信号转导发挥重要作用[30]。有研究表明,Pep与受体PEPR结合之后也会发生内吞,且这种内吞对Pep的信号转导有重要作用。Ortiz-Morea等[31]利用荧光标记的Pep(TAMRA-pep)证实了Pep的内吞依赖于PEPR:AtPep1可以被野生型拟南芥的根细胞内吞,但不能被pepr1pepr2突变体的根细胞内吞。进一步研究发现,AtPep1-AtPEPR1复合体的内吞依赖于网格蛋白(clathrin)。在网格蛋白突变体chc2(clathrin heavy chain 2)中,AtPep1的内吞作用受到抑制,且对AtPep1的响应程度减弱。2020年Collins等[32]发现,网格蛋白衔接子EPSIN1(EPS1)可以调节AtPEPR1等模式识别受体和共受体BAK1在细胞膜上的积累,从而影响Pep等免疫信号的转导。
3 Pep的生物学功能
3.1.1 抑制植物生长 外源施加AtPep1能够明显抑制植物生长。在拟南芥Pep的两个受体中AtPEPR2在介导AtPep1的根系生长抑制起主导作用[15,33-34]。Col-0和pepr1对AtPep1的根生长抑制效应具有相似的敏感性,但pepr2单突变体和pepr1pepr2双突变体的根则对AtPep1几乎完全不敏感。转录组分析也发现,根中AtPep1调控的基因中有75%基因表达完全依赖于AtPEPR2[8,27]。
除与植物激素途径互作外,Pep对植物根生长的抑制作用也可能与ROS及氨基酸的合成相关。Kadota等[36]发现,AtPEPR2结合AtPep1后,能够磷酸化BIK1(botrytis-induced kinase 1),BIK1能够进一步磷酸化并激活ROS合成途径中两个关键酶RBOHD和RBOHDF,从而促进ROS生成,抑制根系生长[37]。2014年Ma等[27]发现,AtPep1能够抑制谷氨酰胺转运蛋白(glutamine dumpers genes,GDU)介导的氨基酸外排,导致氨基酸在根细胞中过度积累,从而抑制根生长;过表达GDU3的拟南芥表现出短根的表型,并对AtPep1介导的根生长抑制效应不敏感。
3.1.2 调控衰老 Pep可以通过诱导叶绿素降解和自噬,加速黑暗或者饥饿诱导的叶片衰老。外源Pep处理能够加速野生型拟南芥叶片黄化,而对pepr1pepr2双突变体植株则没有效果。黑暗或饥饿处理可以诱导AtPep3的前体蛋白编码基因AtPROPEP3的表达,而AtPep3能够快速诱导叶绿素降解基因PAO以及自噬基因APG7和APG8a的表达,激活叶绿素降解和自噬途径[14]。
3.2.1 非生物胁迫 AtPep3正调控植物耐盐反应。在盐胁迫处理下,AtPROPEP3基因的表达显著上调。外源施加AtPep3可以抑制盐胁迫下的幼苗叶片白化,提高拟南芥的耐盐性,而AtPROPEP3基因的敲除突变体则对盐胁迫超敏。进一步研究表明,AtPep3对植物耐盐性的促进作用主要由AtPEPR1介导。AtPep3处理能够提高野生型拟南芥或pepr2单突变体的耐盐性,但对pepr1和pepr1pepr2双突变体却没有效果[17]。此外,盐胁迫能够强烈诱导叶片中AtPROPEP3和AtPEPR1的表达,这也佐证了AtPep3与AtPEPR1在调控植物耐盐性中的作用[21]。然而,AtPep3/AtPEPR1如何调控植物耐盐性还有待进一步研究。
3.2.2 生物胁迫 Pep能够正调控植物对多种细菌和真菌的抗性。拟南芥pepr1和pepr2单突变体以及pepr1pepr2双突变体对丁香假单胞菌Pst DC3000的抗性明显弱于野生型植物[13]。有研究表明,Pep可以通过调节气孔开闭状态,影响植物对丁香假单胞菌的抗性。当野生型拟南芥中受到Pst DC3000侵染时,AtPEPR1或AtPEPR2识别Pep并招募共受体BAK1,然后磷酸化并激活下游BIK1。活化的BIK1从受体复合物中释放,激活保卫细胞S型阴离子通道SLAC1(SLOW ANION CHANNEL1)和SLAH3(SLAC1 HOMOLOG3),导致气孔关闭。而pepr1pepr2突变体受到Pst DC3000侵染时,其叶片上的气孔不能及时关闭,导致其更加感病[38]。此外,AtPep1也可以增强植物对腐生型病原菌灰霉菌(Botrytis cinerea)的抗性[28]。
Pep调控植物免疫的功能在双子叶和单子叶植物中似乎是保守的。玉米Pep分子ZmPep1与AtPep1存在很多功能上的相似性。ZmPep1处理可以诱导茉莉素和乙烯的合成,促进相关防御基因的表达,提高玉米对南方叶枯病(southern leaf blight)以及炭疽病(anthracnose stalk rot)的抗性[7]。此外,昆虫口腔分泌物处理能够诱导ZmPROPEP1和ZmPROPEP3的表达,且外源施加ZmPep3能够提高植物对食草动物的抗性。
4 总结与展望
植物在自然环境中的生长往往会受到各种生物或非生物胁迫的影响。植物为适应环境,进化出一系列的防御机制以应对这些胁迫[39,40,41]。Pep作为新近鉴定到的一类在被子植物中普遍存在内源短肽分子,在植物的生长发育和抗性反应中都表现出重要的调节作用。本文综述了Pep的产生和信号转导过程,介绍了Pep对根的生长、叶片衰老等植物生长发育过程的调控,并阐述了Pep在植物应对病原菌、昆虫、高盐等生物和非生物胁迫中的作用。
尽管我们对Pep的信号转导机制和生物学功能已有不少了解,但目前仍有许多问题有待进一步探究。比如,(1)Pep作为植物细胞内产生的一种内源短肽,是如何释放到胞外空间的;(2)在拟南芥中,不同Pep与受体PEPR之间的结合表现出了一定的特异性,这种特异性的生化基础和生物学意义是什么;(3)Pep-PEPR受体复合物的内吞是如何影响下游信号转导的;(4)Pep在植物中能否长距离移动,是否可作为一种系统性防御信号;(5)在机械损伤或昆虫噬咬过程中,Pep信号与JA、ROS、钙离子等信号的时序关系是怎样的,又是如何相互作用的;(6)Pep短肽的代谢或降解机制;(7)在拟南芥中,干扰ROS或Auxin信号途径不能完全模拟Pep对根生长的抑制作用[15,37],那么还有哪些其他的信号途径参与Pep介导的植物生长抑制;(8)Pep-PEPR在调节植物生长发育和抗性反应中都发挥着重要作用,这两方面的作用是如何平衡的。
近年来,除Pep外,有越来越多的短肽类植物内源信号分子被发现,它们分别在植物生长发育或抗性等方面发挥着不同的调节作用。如:CLV2短肽能够调控不同温度下拟南芥花的发育[42],而RALF短肽则可以调控植物根的生长[43]和抗性[44]等。对Pep的系统研究,不仅能够拓展和深入人们对Pep系列短肽分子功能和作用机制的认识,也将为其他类型植物短肽的研究提供范例。此外,外源施加Pep在提高植物耐盐性和病原菌及昆虫抗性等方面展现出了较显著的效果,且这种作用在不同种类的植物中可能相对保守,在农作物中具有潜在的应用价值。因此,随着多肽商业合成成本的下降,Pep等短肽类分子有望作为一种新型植物生长调节剂或生物农药,应用于农业生产。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志