
摘要: 目的 基于斑马鱼帕金森症(Parkinson’s disease,PD)模型,研究一种抗氧化活性十肽YSQLENEFDR (Tyr-Ser-Gln-Leu-Glu-Asn-Glu-Phe-Asp-Arg)的抗帕金森症活性。方法 实验分为空白对照组,50 μmol·L-11-甲基-4-苯基-1, 2, 3, 6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-terahydropyridine,MPTP)诱导组以及50 μmol·L-1 MPTP和不同浓度(2、10、50 mg·L-1)的十肽共处理组。受精后4d(day post fertilization,dpf),用荧光显微镜观察并记录各实验组转基因斑马鱼多巴胺神经元和脑部血管的发育情况; 5dpf时,用Zebrabox斑马鱼行为分析仪分析野生型斑马鱼行为并通过qRT-PCR检测帕金森相关基因的表达变化。结果 与空白对照组相比,MPTP处理组斑马鱼出现多巴胺神经元缺失、脑部血管损伤、帕金森状行为和帕金森相关基因表达异常。与MPTP处理组比较,共处理组斑马鱼表现出多巴胺神经元缺失减少、脑部血管损伤降低、帕金森状行为缓解的表征,相关基因表达趋于正常。结论 抗氧化活性十肽YSQLENEFDR具有抗帕金森症活性。
帕金森症(Parkinson’s disease,PD)是中老年人常见的第二大神经系统退行性疾病,65岁以上人群中患病率高达1.7%,仅次于阿尔兹海默症[1]。该病临床症状主要为震颤、动作迟缓、肌强直等行为性障碍,还会伴随有睡眠障碍、认知功能下降、自主神经功能紊乱等一系列非行为性障碍[1-2]。PD主要病理特征为黑质多巴胺(dopamine,DA)神经元的减少和形成以α-syn为主要成分的路易小体(Lewy-body,LB)[3]。PD的发病机制复杂多变,目前尚未明确。但有研究发现,PD与自噬系统有关,自噬系统的损伤会导致蛋白的积累和聚集,产生细胞毒性和神经退行性病变。也有研究表明,氧化应激、蛋白酶体损伤以及线粒体功能紊乱等是PD潜在的发病机制。近年来已经发现的与PD相关的基因包括α-syn、parkin、dj1等[4-5]。α-syn和parkin基因的突变使泛素蛋白酶体降解,从而导致毒性蛋白聚集沉积[3, 6]; parkin的基因突变会造成线粒体功能紊乱[7]; dj1具有抗氧化应激的作用[8]等。
海洋生物体内富含多种生物活性化合物,具有抗氧化的生物活性,因此在预防和治疗慢性非传染性疾病(如PD、阿尔兹海默症等)具有潜在的价值[9]。诸多实验证实,抗氧化剂或具有抗氧化活性的物质能够有效清除活性自由基,具有神经保护作用[10]。在人体内,线粒体呼吸通常会产生一些强氧化剂,Complex I的抑制作用会增加活性氧(reactive oxygen species,ROS)超氧化物的产生,ROS超氧化物可形成有毒的羟自由基,或者形成过氧亚硝基,这些分子作用于核酸、蛋白质和脂类等物质而引起细胞损伤[7]。课题组前期研究发现,来源于海螺肉提取物中的一种十肽YSQLENEFDR具有较强的抗氧化能力,可清除体外自由基及抑制斑马鱼体内氧化损伤[11],但海螺源抗氧化活性十肽YSQLENEFDR是否具有抗PD活性仍未可知。目前常见的PD治疗药物对于人体都有或多或少的副作用,如服用左旋多巴极易引发胃部不良反应[12]; 多巴胺受体激动剂可有效改善患者的临床症状,但会造成患者恶心、失眠等不良反应[13]。并且这些药物只能改善症状,并不能延缓PD进程。天然来源的食源性十肽YSQLENEFDR除其自身所具有高抗氧化活性外[11],相对更加安全,更适用于长期服用。
斑马鱼体型小且透明、发育繁殖快、饲养经济且具有无需解剖便可观察各器官发育情况的优势[16]。最重要的是,斑马鱼的基因序列与人类的基因序列有着极高的相似度,所以被认为是优良的建立神经退行性疾病模型的动物资源[14]。Vmat、Fli1分别特异性表达于斑马鱼DA神经元与血管中,因此转基因斑马鱼Vmat:GFP、Fli1:GFP分别用于评价DA神经元、脑部血管的发育状况。1-甲基-4-苯基-1, 2, 3, 6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-terahydropyridine,MPTP)是一种神经毒性物质,在斑马鱼中常被用来诱导PD模型。
1 材料与方法
斑马鱼培养及胚胎的准备:成年雌雄斑马鱼分开培养于水温26 ℃斑马鱼养殖系统中,照明黑暗14 h :10 h交替进行,每日定时喂食。实验前一晚,选择成熟斑马鱼按雌雄比例2 :2,放入产卵缸中。次日早上8:30抽取隔板,2 h后收取鱼卵,将死卵剔除,养殖水反复冲洗3次,移入含2 mg·L-1亚甲基蓝的养殖水中,置于26 ℃恒温培养箱中控光培养,以备后续实验使用。
斑马鱼养殖饲养系统(北京爱生科技公司)、体视荧光显微镜(德国蔡司公司)、实时荧光定量PCR仪(罗氏诊断产品有限公司)、超微量分光光度计(基因有限公司)、C1000 Touch梯度PCR仪(Bio-Rad公司)、Zebrabox斑马鱼行为分析仪(Viewpoint公司)等。
1.2 方法
基于课题组已建立的酸醇浸提法结合活性导向分离纯化法[10],制备海螺活性十肽,即取香螺组织,磨碎,匀浆,加入10倍量的酸性稀乙醇溶液(冰醋酸调整溶液pH值至5),30 ℃搅拌提取6 h,离心,取上层清液,减压浓缩至无醇味,正己烷萃取脱除脂溶性部分,下层溶液冷冻保存,即得粗多肽提取物。随后,通过体外活性导向分离法,分离纯化富集得到海螺十肽样品,经蛋白定性确定其氨基酸组成,采用固相合成技术,制备YSQLENEFDR (Tyr-Ser-Gln-Leu-Glu-Asn-Glu-Phe-Asp-Arg)样品。
将受精后1 d的胚胎进行脱膜处理,放于6孔板中,每孔放入20条斑马鱼,分为以下5组:空白对照组、50 μmol·L-1 MPTP处理组、50 μmol·L-1 MPTP与不同浓度(2、10、50 mg·L-1)抗氧化活性十肽YSQLENEFDR共处理组。另外需以0.003%(W/V)PTU处理转基因斑马鱼Vmat :GFP、Fli1 :GFP,目的在于抑制黑色素的形成,便于后期在显微镜下观察记录。加完药后,将其放入培养箱内培养,每日换药。
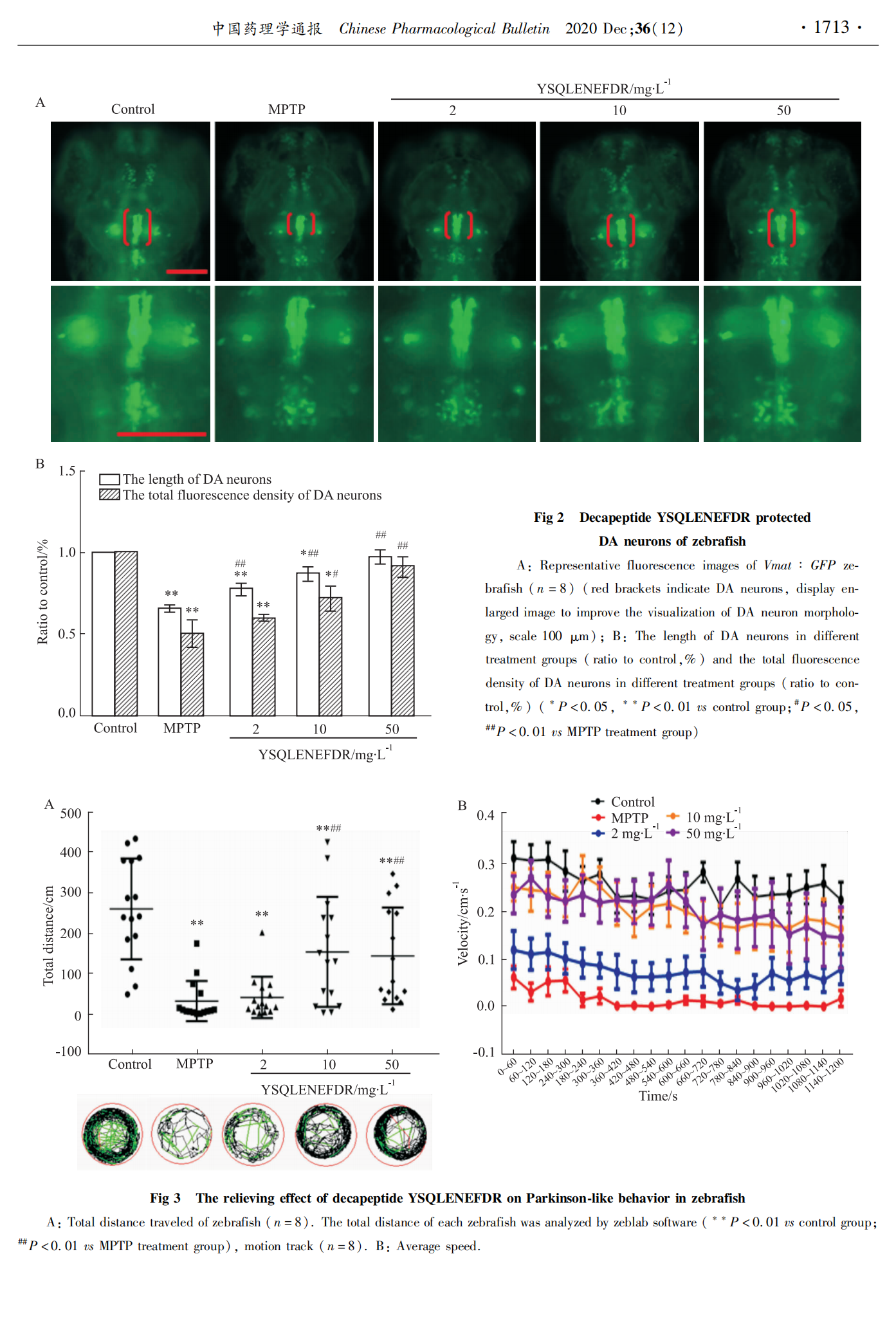
4 dpf时,在蔡司体视荧光显微镜下,选取不同实验组的转基因斑马鱼Vmat :GFP、Fli1 :GFP分别观察DA神经元与脑部血管发育情况。
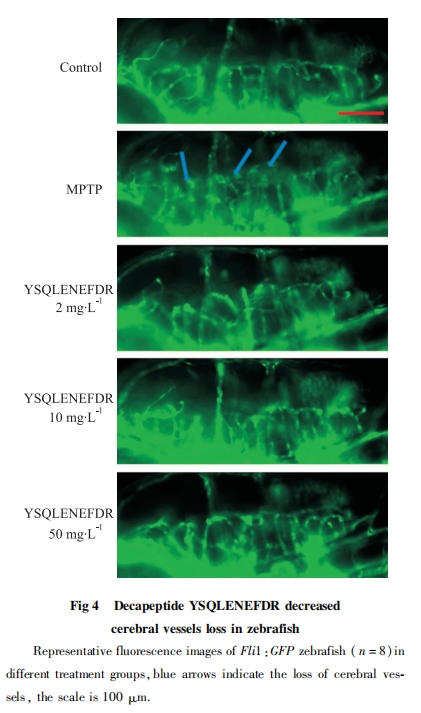
5 dpf时,将野生型斑马鱼AB的不同组别放入48孔板中,1条/孔,加养鱼水1 mL/孔,将48孔板放入Zebrabox斑马鱼行为分析仪暗箱中,先使其适应环境。15 min后开始进行行为学检测,检测时间设置为20 min。运用Zeblab软件进行数据处理,计算每条鱼游动总距离和平均速度。
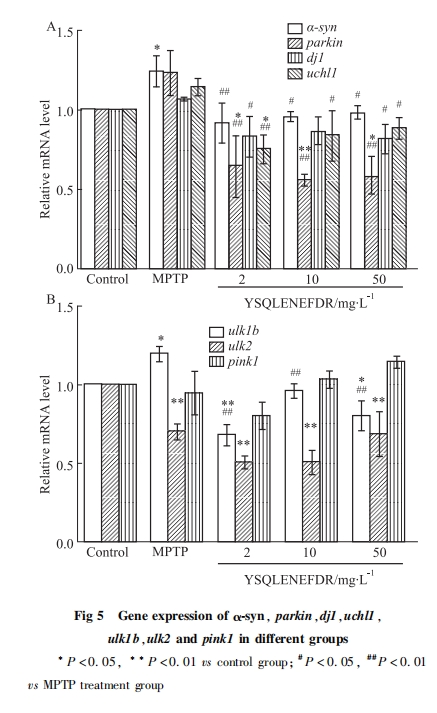
每组取5 dpf的野生型斑马鱼AB幼鱼(n=20)进行qRT-PCR检测。RNA的提取参照试剂盒说明书,利用超微量分光光度计测定提取的RNA的浓度,A260/A280应在2.0~2.5之间; RNA反转为cDNA参照反转录试剂盒说明书; Real-time PCR参照实时荧光定量PCR说明书。Real-time PCR扩增结束后输出对照组和待测组目的基因CT及内参基因rpl13a的CT值,以相对定量法用2-ΔΔCT计算各组基因的相对表达量。
用Graphpad prism 7.0软件对实验结果进行One-way ANOVA检验,并以x±s表示。
2 结果
3 讨论
PD是仅次于阿尔兹海默症的第二大神经退行性疾病,严重影响患者的生活质量,特别是老年人,所以研究如何治疗和缓解PD势在必行。
本实验旨在探究海螺源的具有抗氧化活性十肽YSQLENEFDR的抗PD活性。实验中用MPTP诱导的斑马鱼PD模型,出现了多巴胺神经元及脑部血管缺失明显,行为异常和PD相关基因表达异常等现象,说明斑马鱼PD模型建立成功。与MPTP处理的斑马鱼相比,MPTP与十肽YSQLENEFDR共处理组的斑马鱼多巴胺神经元的缺失随着十肽YSQLENEFDR浓度的增加有明显的改善。十肽YSQLENEFDR对于斑马鱼PD模型脑部血管损伤也表现出一定的拯救作用。MPTP与十肽YSQLENEFDR共处理组的斑马鱼游动能力明显恢复,游动总距离增加,平均游动速度变快。以上各检测结果表明十肽YSQLENEFDR具有抗PD活性,且在浓度为50 mg·L-1时,其缓解PD的能力最佳。
蛋白质是生物体内主要发挥功能的物质,所以通过检测蛋白质表达变化从而研究药物、化合物发挥作用的靶点、上下游通路关系是比较直观的方法。但是市面上所售关于斑马鱼的抗体比较少,在没有合适抗体的情况下,检测基因表达变化是一个比较方便的方法,基因的上调和下调可以间接反映蛋白的变化过程。近年来的研究表明,参与PD发生发展的基因包括α-syn、parkin、dj1、uchl1、ulk1b、ulk2、pink1、LRRK2、ATP13A2。大量α-syn蛋白聚集形成LB,导致PD。本研究发现经MPTP处理后,α-syn的表达明显上升,而十肽YSQLENEFDR处理后,α-syn的表达明显下调,提示十肽YSQLENEFDR降低了α-syn蛋白聚集。parkin作为E3泛素连接酶,能从胞质转移到线粒体中,泛素化线粒体蛋白,形成自噬体,使损伤的线粒体通过自噬体被降解[6]。经MPTP处理后,parkin的表达上调,提示MPTP可能对线粒体造成损伤,机体自我保护从而提高parkin的表达。而十肽YSQLENEDR处理后,parkin的表达明显下调,提示十肽YSQLENEFDR能够缓解线粒体损伤。dj1具有抗氧化应激作用,在氧化应激下,dj1会向线粒体迁移富集,在线粒体中的dj1具有更强的细胞保护作用[8]。经MPTP处理后,dj1的表达上调,而十肽YSQLENEFDR处理后,dj1的表达明显下调,提示十肽YSQLENEFDR可能具有抗氧化应激的作用。uchl1参与调解细胞的增生、分化和凋亡[15]。经MPTP处理后,uchl1的表达上升,提示MPTP可能对细胞造成损伤,机体自我保护从而提高uchl1的表达,而十肽YSQLENEFDR处理后,uchl1的表达明显下调,提示十肽YSQLENEFDR能够缓解MPTP所造成的细胞损伤,对细胞有保护作用。ulk1b的过表达会抑制自噬[15],诱发PD。经MPTP处理后,ulk1b的表达明显上升,提示MPTP可能抑制自噬,十肽YSQLENEFDR处理后,ulk1b的表达明显下调,提示十肽YSQLENEFDR能够激活自噬。ulk2能阻止不溶性泛素化蛋白聚集物的积累[15]。经MPTP处理后,ulk2的表达明显下调,提示MPTP可能会导致不溶性泛素化蛋白无法降解而大量积累,使PD恶化,十肽YSQLENEFDR处理后,ulk2的表达无明显变化,提示十肽YSQLENEFDR可能不是通过调节ulk2的表达来缓解PD。以往研究表明pink1功能异常造成线粒体损伤[7]。经MPTP处理后,pink1的表达没有明显变化,十肽YSQLENEFDR处理后也并未对pink1的表达造成明显的影响,提示pink1在MPTP诱导的斑马鱼PD模型中未发挥重要作用。调节PD的重要基因还包括LRRK2、ATP13A2等。LRRK2和ATP13A2均参与调节多巴胺神经元损伤。LRRK2的突变能够造成多巴胺神经元的损伤[16]。ATP13A2的过表达能明显减少多巴胺神经元的变性丢失[17]。但十肽YSQLENEFDR是否能通过调节多巴胺神经元相关基因从而缓解PD,其具体机制仍需进一步研究。
本研究中MPTP诱导组的基因α-syn等表达下调,ulk1b等表达上调,与之前研究基因表达一致,同时也证明了斑马鱼PD模型建立的成功。不同浓度的十肽YSQLENEFDR能够调节与PD相关基因的异常表达,使各基因的表达趋平于空白对照组,推测十肽能够通过减少α-syn蛋白的聚集,缓解线粒体损伤,抗氧化应激作用等,来缓解PD,但具体的机制仍需要进一步的研究。
海螺来源的抗氧化活性十肽YSQLENEFDR能够保护斑马鱼DA神经元且对于脑部血管具有改善作用,能够缓解帕金森症行为,调控与帕金森症相关基因的异常表达,具有抗帕金森症活性。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志