
摘要: 目的 观察P3肽对RAW264.7巨噬细胞脂质沉积的影响,并探讨其作用机制。方法 采用MTT法筛选P3肽及氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)的作用浓度,并用80 mg·L-1的ox-LDL诱导RAW264.7细胞形成泡沫细胞;分别采用油红O染色和总胆固醇含量测定试剂盒,检测细胞内脂质沉积及总胆固醇含量;实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)及Western blot检测三磷酸腺苷结合盒转运体A1(ATP-binding cassette transporter A1,ABCA1)、三磷酸腺苷结合盒转运体G1(ATP-binding cassette transporter G1,ABCG1)的mRNA和蛋白表达变化;分别应用肝X受体(liver X receptor,LXR)的激动剂T0901317、GW3965,以及LXR抑制剂GSK2033进一步验证P3肽调控ABCA1、ABCG1表达的作用机制。结果 P3肽明显减少RAW264.7细胞内脂质沉积,降低细胞内总胆固醇含量,上调ABCA1、ABCG1mRNA和蛋白表达;P3肽上调ABCA1、ABCG1的作用与LXR激动剂T0901317、GW3965相似;加入抑制LXR基因转录的抑制剂GSK2033后,P3肽对ABCA1、ABCG1的基因表达无上调作用。结论 P3肽可减少RAW264.7巨噬细胞内脂质积聚,抑制泡沫细胞的形成,其作用机制可能与激活LXR-ABCA1/ABCG1通路有关。
动脉粥样硬化(Atherosclerosis,AS)是一种血管慢性炎症性疾病,是心脑血管疾病和外周血管疾病的病理基础。AS病理斑块主要由脂质、纤维和细胞组成。巨噬细胞和T细胞是参与动脉硬化斑块形成与发展的主要细胞类型[1]。AS的起因是血浆中含有载脂蛋白B(apolipoprotein B,apoB)的脂蛋白被吸收并沉积在动脉内膜上,脂蛋白中的低密度脂蛋白(low density lipoprotein,LDL)可被氧化或通过其他修饰而诱导动脉内膜上的内皮细胞活化,活化的内皮细胞募集单核细胞。一方面,单核细胞分化成促炎巨噬细胞,局部放大炎症反应;另一方面,巨噬细胞吞噬修饰的LDL,形成泡沫细胞。动脉内膜泡沫细胞的出现是AS斑块形成中不可缺少的一步,通常被认为是AS的早期表现之一。泡沫细胞的形成主要是巨噬细胞摄取过量修饰的LDL或巨噬细胞内胆固醇流出障碍所致,因此,抑制巨噬细胞对胆固醇的摄取、促进巨噬细胞内胆固醇的流出,可减少巨噬细胞内胆固醇的沉积,防止泡沫细胞的形成,对于干预早期AS具有重要意义[2]。在巨噬细胞中,三磷酸腺苷结合盒转运体A1(ATP-binding cassette transporter A1,ABCA1)和三磷酸腺苷结合盒转运体G1(ATP-binding cassette transporter G1,ABCG1)负责介导巨噬细胞内胆固醇流出。ABCA1和ABCG1基因表达上调可促进巨噬细胞内胆固醇流出,抑制泡沫细胞的形成[3]。
苦荞是蓼科(Polygonaceae)荞麦属(Fagopyrum)的一年生草本植物,分布于亚洲、欧洲及美洲,在中国主要种植在高寒的西北和西南山区。苦荞营养价值丰富,中国一直有将苦荞粉作为功能性食品或常规饮食,用于治疗心血管疾病和糖尿病的传统。苦荞中的苦荞蛋白,也具有预防高脂血症的作用。有研究发现,苦荞蛋白可明显降低仓鼠血浆总胆固醇水平,其效果优于大米蛋白和小麦蛋白[4]。P3肽来源于苦荞清蛋白,是课题组前期采用碱性蛋白酶酶解苦荞清蛋白,分离鉴定出的生物活性肽,具有抗氧化及调节炎症的作用,其氨基酸序列为Ala-Phe-Tyr-Arg-Trp,分子量为741.8 u[5-6]。本研究以巨噬细胞RAW264.7为研究对象,采用氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)诱导泡沫细胞形成,观察P3肽对巨噬细胞中脂质沉积的影响,并探讨其潜在作用机制,从而为寻找P3肽的作用靶点及其应用开发提供实验依据。
1 材料
RAW264.7巨噬细胞,购自美国典型培养物保藏中心(ATCC,Manassas,VA USA)。
P3肽(纯度≥98%);DMEM培养基、胎牛血清、胰蛋白酶,均购自美国HyClone公司;MTT、二甲基亚砜(dimethyl sulfoxide,DMSO)、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、油红O染料、BCA蛋白浓度测定试剂盒,均购自索莱宝公司;肝X受体(liver X receptor,LXR)激动剂T0901317、GW3965,LXR抑制剂GSK2033,均购自MedChemExpress公司;ox-LDL购自广州奕源生物科技有限公司;青霉素-链霉素双抗购自Sigma公司;总胆固醇(total cholesterol,TC)测定试剂盒,购自南京建成生物工程研究所;聚合酶链式反应(polymerase chain reaction,PCR)引物,购自生工生物工程(上海)股份有限公司;cDNA逆转录试剂盒、qRT-PCR试剂盒,购自TaKaRa公司;抗ABCA1兔多克隆抗体,购自Bioworld公司;抗ABCG1兔多克隆抗体、抗β-actin小鼠单克隆抗体、辣根过氧化物酶标记羊抗兔二抗、辣根过氧化物酶标记羊抗鼠二抗,均购自武汉三鹰生物技术有限公司;ECL化学发光液,购自上海碧云天生物技术有限公司。
JJ-CJ-1FD洁净工作台(江苏市金净净化设备科技有限公司);二氧化碳培养箱(日本松下公司);H4多功能酶标仪(美国Bio-Tek公司);TGL-16B台式离心机(上海安亭科学仪器厂);TS100F荧光倒置显微镜(日本尼康公司);CFX96 PCR扩增仪、Gel Doc XR凝胶成像仪(美国Bio-Rad公司);ND2000超微量紫外分光光度计(Thermo公司);H1650R台式高速冷冻离心机(上海卢湘仪离心机仪器有限公司);DYY-6C型稳压稳流电泳仪(北京六一仪器厂)。
2 方法
RAW264.7细胞常规培养于DMEM高糖培养基(含10%胎牛血清和1%青-链霉素双抗)中,置于37 ℃、5% CO2培养箱中培养。每天换液1次,待细胞融合度约为80%时,使用胰酶消化、传代。
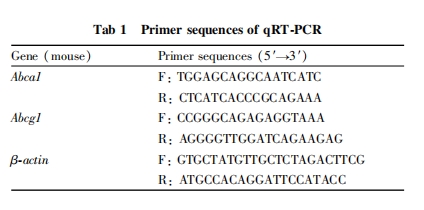
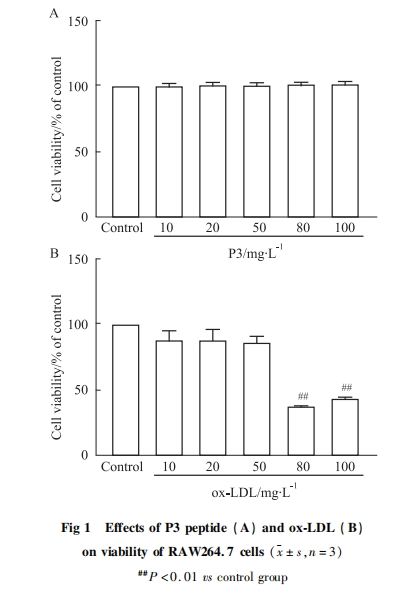
采用MTT法测定细胞活力。先观察P3肽、ox-LDL对细胞增殖的影响,根据MTT结果筛选出P3肽和ox-LDL的最佳作用浓度,而后在相应的浓度范围内,检测P3肽对ox-LDL诱导RAW264.7细胞活力的影响。将处于对数生长期的RAW264.7细胞传代,调整细胞密度为5×107·L-1,将细胞接种于96孔板。确定P3肽和ox-LDL作用浓度后,分组如下:空白组不接种细胞,不加ox-LDL和P3肽;对照组接种细胞,不加ox-LDL和P3肽处理;模型组接种细胞,并加入80 mg·L-1的ox-LDL;P3肽组接种细胞,加入浓度分别为10、20、50、80、100 mg·L-1的P3肽,以及80 mg·L-1的ox-LDL。于培养箱中孵育24 h后,弃培养基,每孔加入5 g·L-1 MTT 20 μL,继续孵育4 h后,弃上清,每孔加入DMSO 150 μL,培养箱中孵育10 min后,使用酶标仪在波长490 nm测定各孔的吸光度(absorbance,A)值,计算细胞存活率:细胞存活率=(A实验组-A空白组)/(A对照组-A空白组)×100%。
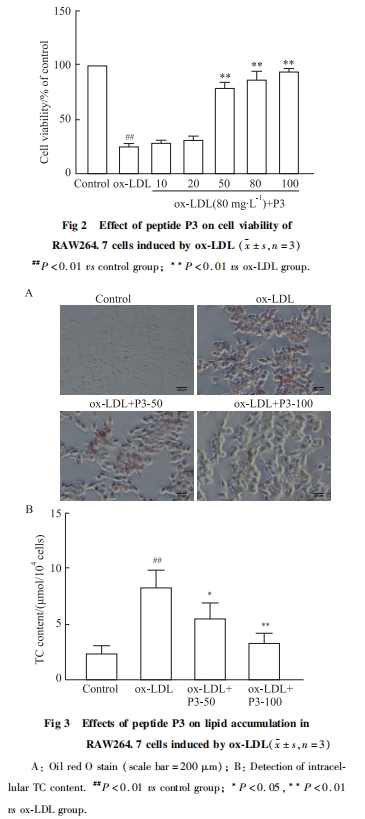
取对数生长期的细胞,以5×107L-1浓度接种于6孔板,培养24 h细胞贴壁后,参照文献[7]将细胞分为4组:对照组、模型组、P3肽低浓度组、P3肽高浓度组。对照组加入含2%胎牛血清的DMEM培养基,24 h后换成无血清DMEM培养基继续培养24 h;模型组加入含2%胎牛血清的DMEM培养基培养24 h后,在无血清DMEM培养基中加入80 mg·L-1 ox-LDL刺激24 h;P3肽低浓度组和P3肽高浓度组在含2%胎牛血清的DMEM培养基中分别加入50、100 mg·L-1的P3肽干预24 h后,在无血清DMEM培养基中加入80 mg·L-1 ox-LDL刺激24 h。培养结束后,弃培养液,用预冷的PBS洗3次,每孔加入1 mL 4%多聚甲醛固定20 min后,弃多聚甲醛,每孔加入1 mL PBS洗3次。然后每孔加入约1.5 mL油红O染色工作液(油红O基液∶ddH2O=3 ∶2)染色30 min,PBS洗3次,在光学显微镜下观察细胞脂质被油红O染色情况。
按照“2.3”对细胞进行分组处理后,弃培养液,用预冷PBS洗2次,每孔加入1 mL PBS吹打细胞,使细胞充分脱落,并将细胞悬液收集于预先做好标记的1.5 mL EP管中,1 000 r·min-1离心5 min,弃上清并留沉淀待用。细胞沉淀按照试剂盒说明书操作,测定各组TC含量。
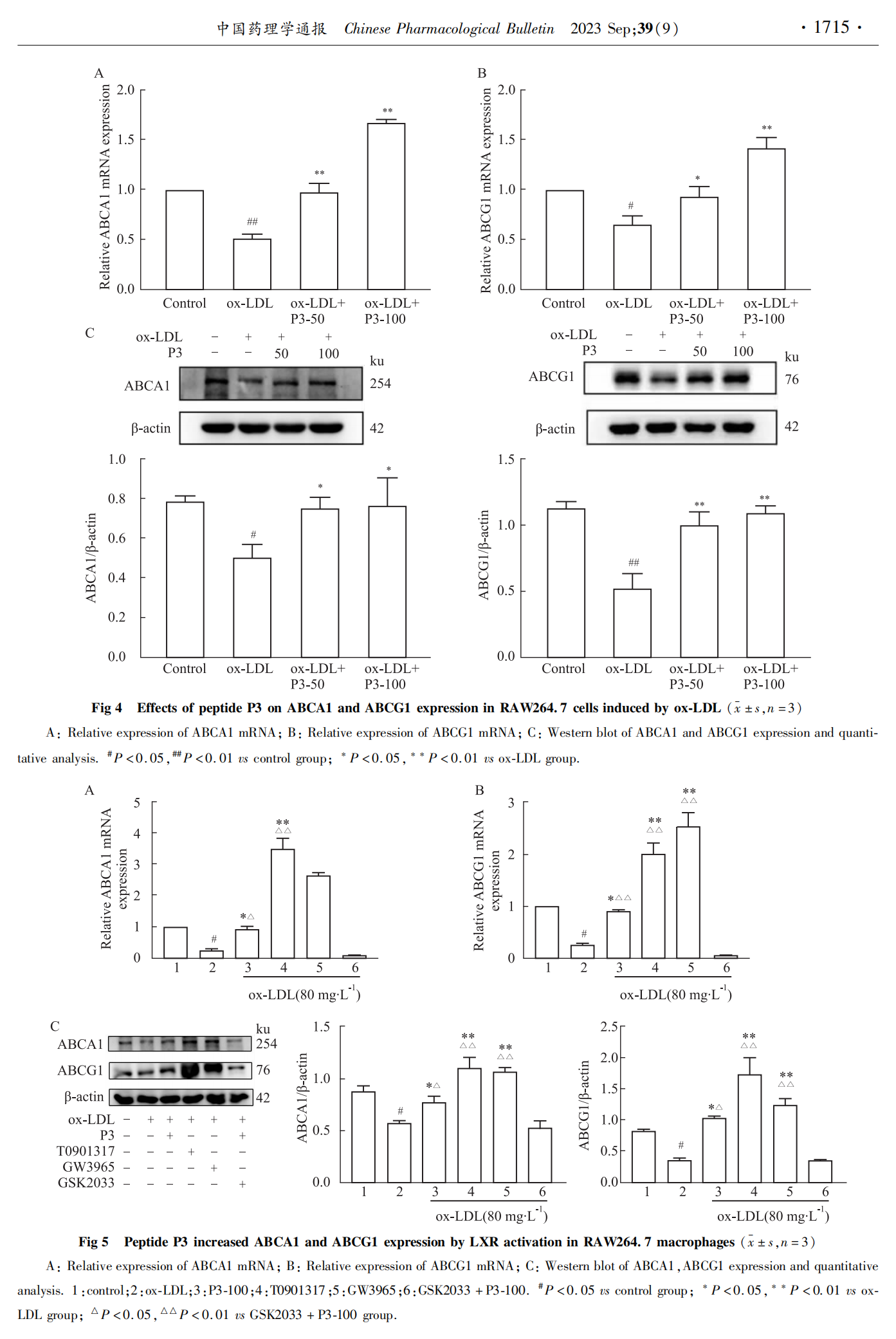
取对数生长期的细胞,以5×108·L-1的密度接种于6孔板中,培养24 h待细胞贴壁后,分为7组:对照组、模型组、P3肽低浓度组、P3肽高浓度组、LXR激动剂T0901317组、LXR激动剂GW3965组、LXR抑制剂GSK2033组。对照组、模型组、P3肽低浓度组、P3肽高浓度组的处理方式同“2.3”。LXR激动剂T0901317组与LXR激动剂GW3965组在含2%胎牛血清的DMEM培养基中分别加入1 μmol·L-1 T0901317和GW3965作用24 h;LXR抑制剂GSK2033组在含2%胎牛血清的DMEM培养基中加入10 μmol·L-1 GSK2033和100 mg·L-1P3肽作用24 h,然后3组在无血清DMEM培养基中加入80 mg·L-1ox-LDL作用24 h,收集细胞。LXR激动剂和抑制剂的浓度参考文献[8-9]。各组细胞加入细胞裂解液(RIPA ∶PMSF=100 ∶1)200 μL,冰上裂解30 min,4 ℃、9 710×g离心20 min,取上清液备用。BCA蛋白质量浓度测定试剂盒检测各组蛋白浓度,制备8%的分离胶和5%浓缩胶,20 μg总蛋白95 ℃煮沸10 min后,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,湿法转膜,5%牛血清白蛋白室温封闭2 h,一抗4 ℃孵育过夜,二抗室温孵育2 h,ECL试剂盒显影。ImageJ软件分析各条带的灰度值,以β-actin为内参蛋白,目标蛋白的相对表达量=目标蛋白的灰度值/β-actin的灰度值。
所有实验均重复3次,各组实验数据以x±s表示。采用SPSS 19.0软件进行统计学分析,通过单因素方差分析对多组数据之间的差异进行显著性检验,P < 0.05为差异具有显著性。利用GraphPad Prism 8.0.2软件进行绘图。
3 结果
4 讨论
由于高脂饮食和不健康的生活方式,以血浆胆固醇增高为特点的高胆固醇血症的发生率在全世界内持续上升。血浆胆固醇,特别是LDL的增高是AS发生的主要原因。食物胆固醇的摄取吸收、胆固醇的体内合成,以及胆固醇的分泌都会影响血浆胆固醇的水平。目前,已报道的降胆固醇肽的作用机制主要是减少外源性胆固醇的吸收、抑制体内胆固醇的生物合成及促进胆固醇转变成胆汁酸等[10]。在AS形成的早期阶段,活化的内皮细胞募集单核细胞到内膜下,分化为巨噬细胞,巨噬细胞吞噬ox-LDL引起细胞内脂质沉积,导致泡沫细胞形成。泡沫细胞形成的过程与巨噬细胞内胆固醇代谢密切相关,其中,胆固醇从巨噬细胞内流出是调节巨噬细胞胆固醇动态平衡的关键环节之一,对减少细胞内胆固醇沉积、防止泡沫细胞形成、预防AS具有重要意义。研究发现,减少巨噬细胞内脂质沉积可在早期干预AS的发生[11]。本研究通过ox-LDL诱导RAW264.7细胞形成泡沫细胞,发现P3肽可以减少巨噬细胞内脂质的沉积,降低细胞内的TC含量,说明P3肽具有抑制泡沫细胞形成的作用。
泡沫细胞的形成主要是由于细胞摄取胆固醇异常,或巨噬细胞胆固醇流出受损所致[12]。ABCA1和ABCG1是一类膜蛋白,是ATP结合盒转运体(ATP binding cassette transporter,ABC)超家族中一员,可利用ATP水解释放的能量来转运底物,两者相互配合,共同完成巨噬细胞胆固醇的流出。ABCA1的作用是将胆固醇和磷脂酰胆碱从巨噬细胞中转出,流向贫脂的载脂蛋白Apo A1,生成新生高密度脂蛋白(high-density lipoprotein,HDL),而ABCG1则介导胆固醇、磷脂酰胆碱和鞘磷脂流向新生和成熟HDL[13]。ABCA1和ABCG1表达减少或功能丧失,促进泡沫细胞形成和AS发生,而一些黄酮类物质,如二氢杨梅素可通过诱导ABCA1、ABCG1的表达抑制泡沫细胞的形成[14]。本研究中,P3肽可明显上调ABCA1和ABCG1的基因表达,提示P3肽降低ox-LDL诱导的RAW264.7细胞中胆固醇含量,可能是通过诱导ABCA1和ABCG1的表达,进而促进胆固醇从巨噬细胞流出。
LXR有LXRα和LXRβ两种亚型,是类固醇激活的转录因子,属于类固醇/甲状腺激素核受体超家族成员。LXR调控一系列涉及胆固醇吸收、转运和转化的基因转录,被称为胆固醇感受器。LXR的转录调控功能需要与类视黄醇X受体(retinoid X receptor,RXR)结合,形成LXR/RXR异二聚体才能发挥。无配体时,该异二聚体与核受体阻遏因子结合,抑制基因表达;当配体与之结合后,会导致异二聚体构象发生改变,释放出阻遏因子,并募集辅激活因子,LXR/RXR与靶基因启动子区域内的特定DNA序列,即LXR反应元件结合,调节下游靶基因的转录[15]。LXRα在巨噬细胞中高表达,ABCA1和ABCG1是LXRα在巨噬细胞中的靶基因,调节胆固醇从巨噬细胞流出[16]。研究认为,激活LXR可增加外周胆固醇流出、促进胆固醇向肝转运及转变成胆汁酸、促进胆汁酸分泌等,从而降低血浆胆固醇水平,发挥抗AS作用[17]。LXR激活剂T0901317通过氢键与LXR结合,募集LXR和辅激活因子结合,进而激活LXR,对LXRα和LXRβ均有激活作用;GW3965选择性与LXRα结合,进而激活LXRα[18]。本研究结果发现,P3肽单独与巨噬细胞作用时,与T0901317、GW3965一样,可明显上调ABCA1和ABCG1的表达,但先用GSK2033抑制LXR基因转录后,再与P3肽作用,发现P3肽对ABCA1、ABCG1的上调作用消失,提示P3肽可能是LXR的潜在激活剂,但其与LXR的具体作用机制还需要进一步研究。
综上,P3肽可减少ox-LDL诱导的RAW264.7巨噬细胞的脂质积聚,减少细胞内的TC含量,抑制泡沫细胞的形成,其机制可能是通过激活LXR,上调ABCA1和ABCG1的表达介导的。本研究结果可为P3肽的应用开发提供实验依据。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志