
摘要:氧化反应不仅与许多慢性疾病相关,同时亦是食品酸败的诱因之一,能够降低食品营养价值并缩短货架期。近年来,具有抗氧化活性的肽氨基酸组成、排列顺序及空间构象已被广泛报道。随着相关研究的不断深入,肽的构效关系已逐步成为阐明其抗氧化机制的核心问题。当前研究中,从陆地动物中分离的抗氧化肽,其抗氧化作用机制已基本明晰。然而,针对蛋白质含量的更高的鱼类资源,其抗氧化肽的构效关系研究甚少。因此,本文基于抗氧化肽电子转移清除自由基、氢原子转移清除自由基和螯合促氧化金属离子的作用机制,对鱼类源抗氧化肽的一级结构和二级结构对活性产生的重要影响进行综述。重点分析含硫氨基酸、芳香族氨基酸、部分疏水性氨基酸和部分中性氨基酸、酸性氨基酸和碱性氨基酸对抗氧化活性的影响,以期指导抗氧化肽相关食品的研发,深度拓展抗氧化肽产品的消费市场。
活性氧(reactive oxygen species,ROS)在有氧生物的新陈代谢和呼吸过程中自然产生[1],当自由基产生过多或产生后没有被完全清除时,它们可以攻击附近的分子,使其失去电子,缺少电子的分子会攻击其他分子,造成氧化损伤[2]。目前,天然或合成抗氧化肽[3-5]可以作为外源性抗氧化剂维持体内或油脂的氧化还原平衡、预防和治疗疾病。因它们比酶类抗氧化剂结构简单,更稳定,不会产生危险的免疫反应,从而备受青睐[6]。
利用自然资源筛选和获得具有明确结构的抗氧化效用的肽产品正在成为食品和医疗行业的动力。2021年我国鱼类总产量超过3561万吨,占水产品总产量的1/2以上[7],鱼类加工过程中产生了约占鱼体50%~70%的副产物[8],包括:头、皮肤、骨骼、鳞片、鳍和内脏等[9]。鱼蛋白是一种极佳的抗氧化肽来源,与微藻、鸡蛋、大豆等原料蛋白相比,鱼类蛋白富含Arg、Lys和Gly,从鱼的不同部位制备的水解液可以作为必需氨基酸的良好来源,且其容易被人体吸收[10]。因此,与其他蛋白资源相比,鱼蛋白具有不同的氨基酸的种类和水平[10],这为制备出不同结构的抗氧化肽带来更多的可能性。
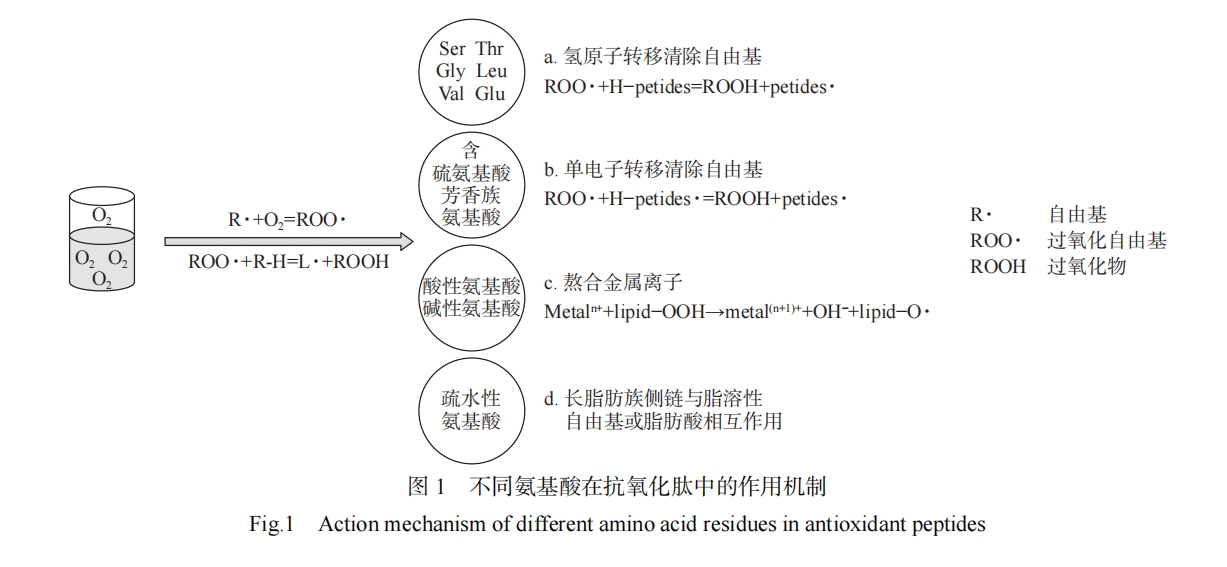
近年来,针对抗氧化肽制备、分离纯化和鉴定序列方面的研究较多,当前研究人员主要通过酶解或发酵[11]生产,并且可以与超声波[12]、微波[13]、高压脉冲电场[14]和超临界水萃取[14]等预处理技术结合,以获得更高的产量和投入更低的成本。当前关于抗氧化肽活性位点、结构特征与功能方面有一定的显示报道,但其构效关系与作用机制仍处于探索阶段。一直以来,氨基酸类型和序列被认为是决定肽的抗氧化性能的重要因素[15]。蛋白质中存在的20种氨基酸可以与自由基反应,表1罗列了近年来的鱼类抗氧化肽的作用机制,说明了氨基酸的结构特性与抗氧化能力的关系。此外,抗氧化肽的相互作用和二级结构影响抗氧化肽活性的高低,协同作用能增强整体抗氧化肽的活性,拮抗作用会减弱整体抗氧化肽的作用[16]。不论是一级结构的相互作用[17],还是混合肽之间的相互作用,都会影响肽作为抗氧化剂的能力强弱[16]。水解及预处理手段会使有序结构和无序结构二者发生转换,结果是造成了肽的二级结构含量与肽的活性成正相关或负相关。
1 一级结构与清除自由基能力的关系
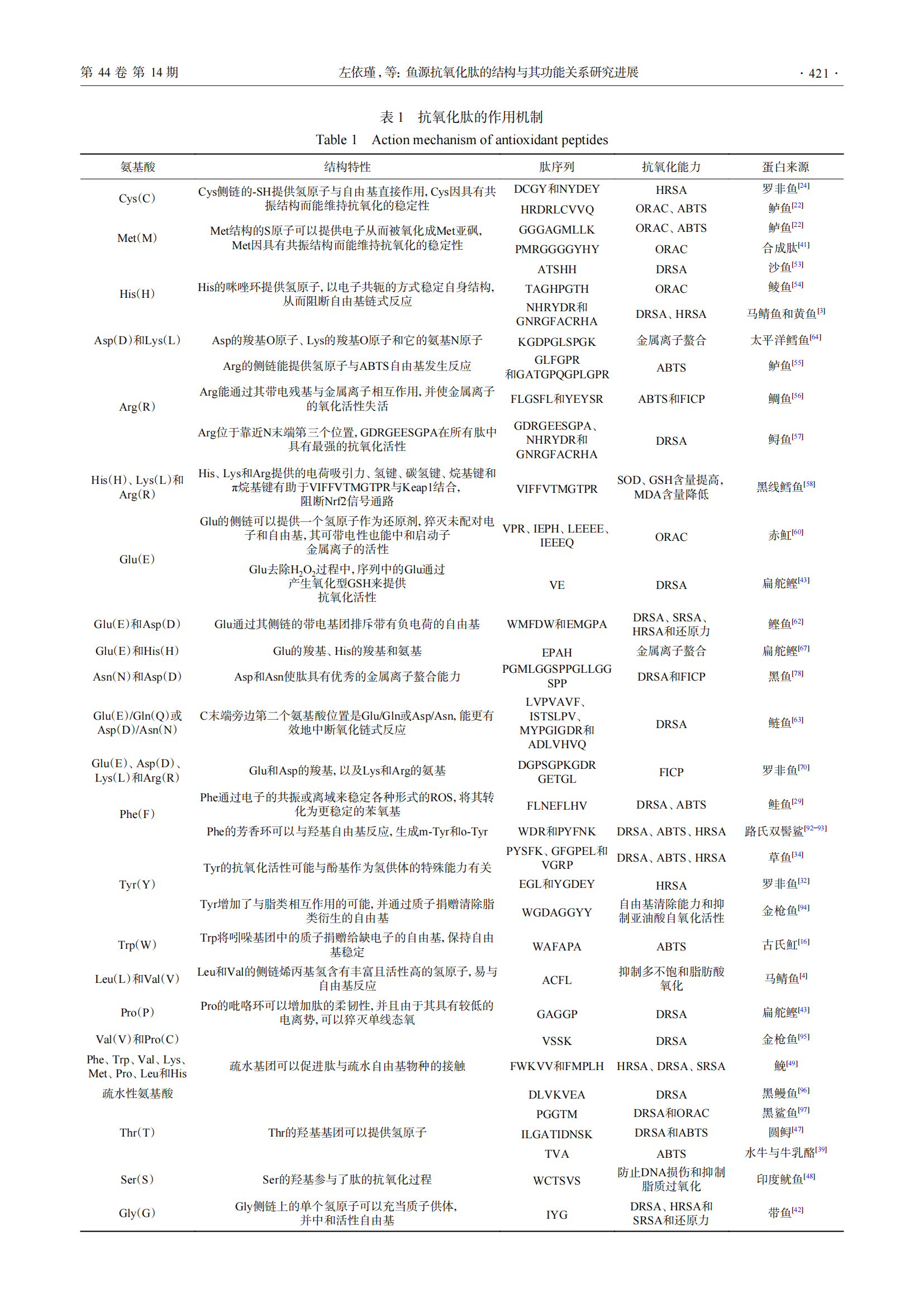
Phe、Tyr和Trp能通过其芳香环、酚羟基或吲哚基团赋予肽抗氧化活性,它们的作用机制是图1中的b途径,利用单电子转移去除自由基[25],而Tyr的作用机制还包括a途径。Phe的结构中含有芳香环和酚羟基,它可以通过电子的共振或离域来稳定各种形式的ROS,将其转化为更稳定的苯氧基,抑制自由基介导的过氧化链式反应的传播[27-28]。鲑鱼胸鳍蛋白肽FLNEFLHV(Phe-Leu-Asn-Glu-Phe-Leu-His-Val)具有较好的DRSA、ABTS(ABTS radicals scavenging activity,ABTS)自由基清除活性和还原力,肽序列中的Phe作为抗氧化活性位点使肽产生抗氧化效果[29]。Tyr在结构上与p-香豆酸相似,p-香豆酸是一种芳香环上存在一个羟基且具有强抗氧化活性的酚类化合物[30]。肽链中Tyr的抗氧化机制是其酚羟基能作为氢供体清除自由基,而且Tyr也对目标疏水蛋白有很强亲和力[31]。尼罗罗非鱼皮肽YGDEY(Tyr-Gly-Asp-Glu-Tyr)具有较强HRSA活性,序列中的活性位点是因为C端和N端存在的Tyr[32]。从鲤鱼皮肤蛋白中提取得到的肽AY(Ala-Tyr)具有较好的亚铁离子螯合能力(ferrous ion chelating capacity,FICP)、还原力和DRSA,经过体外消化后具有强稳定性,C端Tyr的存在增强了自由基的清除活性[33]。草鱼皮蛋白肽有PYSFK(Pro-Tyr-Ser-Phe-Lys)、GFGPEL(Gly-Phe-Gly-Pro-Glu-Leu)和VGRP(Val-Gly-Arg-Pro),其中PYSFK具有最强的DRSA和ABTS自由基清除能力,这归功于肽序列的芳香族氨基酸Tyr的酚羟基发挥作用,而肽序列中不含芳香族氨基酸的VGRP的抗氧化能力最弱[34]。Trp是一种侧链有吲哚基团的非极性芳香族氨基酸[35],吲哚基比过氧自由基更稳定,寿命更长,因此任何逆反应或自由基介导的过氧连锁反应的传播都会受到抑制[36]。Trp将吲哚基团中的质子捐赠给缺电子的自由基,从而保持自由基稳定,提高肽的自由基清除活性[36]。古氏魟蛋白肽WAFAPA(Trp-Ala-Phe-Ala-Pro-Ala)比GSH有更强的抗氧化活性,其中Trp发挥了重要作用[16]。
疏水性氨基酸包括Leu、Val、Gly、Pro、Met、Phe、Trp、Ala和Ile,疏水性氨基酸有利于提升肽在水油介质中的溶解度[16],增加对脂溶性自由基或多不饱和脂肪酸的可及性和相互作用[37-38],促进质子向脂质衍生的自由基的递送过程,抑制氧化损伤的产生[36]。如图1的作用机制d所示,含有Leu和Ala的肽的抗氧化能力归因于它的长脂族侧链[35],能够与易感脂肪酸的酰基链发生相互作用,马鲭鱼内脏肽ACFL(Ala-Cys-Phe-Leu)含有Leu和Ala,其抑制多不饱和脂肪酸的能力高于天然抗氧化剂α-生育酚[4]。此外,Leu和Val的侧链烯丙基氢含有丰富且活性高的氢原子,容易与自由基反应[39],因此,Leu和Val符合图1中a和b抗氧化机制。大黄鱼鱼鳞肽QRPPEPR(Gln-Arg-Pro-Pro-Glu-Pro-Arg)、EKVWKYCD(Glu-Lys-Val-Trp-Lys-Tyr-Cys-Asp)和VGLPGLSGPVG(Val-Gly-Leu-Pro-Gly-Leu-Ser-Gly-Pro-Val-Gly),它们的DRSA清除率分别为55.1%、55.1%和59.1%,肽序列中含有两个Val的VGLPGLSGPVG对DPPH自由基的清除效果最好[40]。
Gly和Pro通过其特殊结构赋予肽抗氧化活性,而且Gly和Pro能影响肽的二级构象[40-41],进而影响功能活性。Gly的抗氧化机制是图1中的a途径,氨基酸作为供氢体,通过转移氢原子清除自由基。Gly侧链由一个氢原子组成,为肽的主链提供高度灵活性,因而改变肽的空间结构。Wu等[41]发现随着合成肽序列PMRGGGGYHY(Pro-Met-Arg-Gly-Gly-Gly-Gly-Tyr-His-Tyr)中Gly的减少,肽键形成的分子内氢键的数量越少,抗氧化肽更多的活性位点暴露出来,ORAC逐渐增强。带鱼肌肉蛋白肽IYG(Ile-Tyr-Gly)之所以具有较高的自由基清除能力、还原能力和亚油酸模型体系中的抑制脂质过氧化能力,是因为Gly侧链上的单个氢原子可以充当质子供体,中和活性自由基,而且其肽链短的优势更容易让肽的活性位点接触到靶点,有助于肽发挥生物活性[42]。Pro可以诱导二级结构弯曲,增加氨基酸发挥作用的可用性[40]。Pro的作用机制是图1中的b途径,利用单电子转移去除自由基。扁舵鲣蛋白肽GAGGP(Gly-Ala-Gly-Gly-Pro)具有较好的DRSA活性[43],序列中的Pro有一个富含电子的吡咯烷酮环,由于其较低的电离势,可以增加肽链的灵活性,也可以淬灭单线态氧[43-44],从路氏双髻鲨软骨蛋白中提取得到含有Pro的肽GPE(Gly-Pro-Glu)在亚油酸模型体系中表现出类似于抗氧化剂BHT的脂质过氧化抑制活性,其芳香侧链在抗氧化反应中充当电子给体[45]。
如图1的a途径所示,Asn、Gln、Thr和Ser可以作为氢供体,通过提供氢原子阻碍抗氧化反应。在中性pH环境下,Asn和Gln可以提供氢原子,进而吸引带有正电荷的自由基来增加肽的抗氧化活性[20]。Thr和Ser都可以作为氢供体来中和自由基。黑鲨鱼皮中鉴定得到的含有Thr的五肽PGGTM(Pro-Gly-Gly-Thr-Met)被报道具有强DRSA和ORAC[46]。在圆鲟蛋白中鉴定得到的所有肽中,肽序列中Thr使肽ILGATIDNSK(Ile-Leu-Gly-Ala-Thr-Ile-Asp-Asn-Ser-Lys)具有最强的DRSA和ABTS自由基清除能力[47]。印度鱿鱼寡肽WCTSVS(Trp-Cys-Thr-Ser-Val-Ser)Ser的羟基参与了该肽的抗氧化活性,防止DNA损伤和抑制脂质过氧化[48]。而且,一同分离出的寡肽SVNVPLY(Ser-Val-Asn-Val-Pro-Leu-Tyr)被报道其还原力显著高于YRIVPL(Tyr-Arg-Ile-Val-Pro-Leu)的原因是前者的N端存在Ser[30]。
His、Lys和Arg是抗氧化肽序列中常见的碱性氨基酸。His的作用机制包括图1中的a、b和c途径[25]。His的咪唑基团和Arg的侧链能提供氢原子与自由基反应,使肽发挥抗氧化作用。His的咪唑基团是抗氧化肽的重要活性位点[28],因为它可以作为氢供体和脂质过氧自由基陷阱[49]。同时His可以通过给电子将自由基转化为稳定分子,同时通过共振结构保持自身的稳定性[50]。而且咪唑的氧化产物是咪唑啉酮,咪唑啉酮也具有抗氧化活性[51]。Chen等[52]发现,采用D-His取代抗氧化肽PHH(Pro-His-His)中的L-His会导致其活性下降,推测这与咪唑环的位置、方向和其供电子能力有关。沙鱼肌肉蛋白肽ATSHH(Ala-Thr-Ser-His-His)序列中含有两个His,在1 mg/mL的浓度下,寡肽对DPPH自由基的清除能力高达90%以上,这归因于His咪唑基团的供质子能力[53]。鲮鱼皮蛋白肽TAGHPGTH(Thr-Ala-Gly-His-Pro-Gly-Thr-His)具有ORAC活性,序列中His的咪唑环提供氢原子,以电子共轭的方式稳定自身结构,从而阻断自由基链式反应[54]。Lys的抗氧化机制如图1中的c途径所示,带正电荷的碱性氨基酸与带相反电荷的金属离子结合,阻碍氧化链式反应的进行。Arg的抗氧化机制包括图1中的a和c途径。Arg的侧链能提供氢原子与ABTS自由基发生反应,海鲈鱼皮肽GLFGPR(Gly-Leu-Phe-Gly-Pro-Arg)和GATGPQGPLGPR(Gly-Ala-Thr-Gly-Pro-Gln-Gly-Pro-Leu-Gly-Pro-Arg)具有较强的抗氧化能力,两个肽的C末端包含的Arg赋予肽抗氧化能力[55]。鲷鱼鱼糜肽FLGSFL(Phe-Leu-Gly-Ser-Phe-Leu)和YEYSR(Tyr-Glu-Tyr-Ser-Arg)具有较强的ABTS自由基清除能力和FICP,这是因为序列中的Arg能通过其带电残基与金属离子相互作用,并使金属离子失去氧化活性[56]。鲟鱼皮蛋白肽GDRGEESGPA(Gly-Asp-Arg-Gly-Glu-Glu-Ser-Gly-Pro-Ala)是鉴定中获得的所有肽中具有最强的DRSA活性的肽[57],Arg在肽序列中的存在和位置决定了肽的抗氧化活性,当Arg位于靠近N末端的第三个位置时具有较好抗氧化活性[3],而其他肽具有较低DRSA活性的原因是序列中缺乏Arg。除了图1中的抗氧化机制外,His、Lys和Arg也具有细胞内抗氧化能力,董丽莎等[58]采用分子对接发现黑线鳕鱼皮中鉴定的肽VIFFVTMGTPR(Val-Ile-Phe-Phe-Val-Thr-Met-Gly-Thr-Pro-Arg)与Keap1蛋白结合最稳定,序列中的His、Lys和Arg所提供的电荷吸引力、氢键、碳氢键、烷基键和π烷基键有助于二者紧密结合,阻断核转录因子(NF-E2-related factor 2,Nrf2)信号通路,实现对人表皮角质形成细胞(HaCaT)的抗氧化保护效应。
酸性氨基酸包括Glu和Asp,其抗氧化机制如图1的a和c途径所示,Glu和Asp既能清除自由基,还能螯合金属离子,减弱金属离子的促氧化作用,抵抗脂质氧化[20]。Glu的侧链还可以提供一个氢原子作为还原剂,猝灭自由基[59]。赤魟软骨蛋白肽VPR(Val-Pro-Arg)、IEPH(Ile-Glu-Pro-His)、LEEEE(Leu-Glu-Glu-Glu-Glu)和IEEEQ(Ile-Glu-Glu-Glu-Gln)具有强自由基清除能力,序列中的Glu是肽的主要活性位点[60]。甲鲶鱼水解液的ORAC值与蓝莓、苹果和橙子等水果的ORAC值相似,从中鉴定的多个肽序列都存在IEE(Ile-Glu-Glu)或IEEE(Ile-Glu-Glu-Glu)序列,IEE重复序列是高抗氧化活性的部分原因[61]。扁舵鲣蛋白肽VE(Val-Glu),在去除H2O2过程中,序列中的Glu通过产生氧化型谷胱甘肽(glutathione,GSH)来提供抗氧化活性[43]。鲣鱼鱼头蛋白肽WMFDW(Trp-Met-Phe-Asp-Trp)和EMGPA(Glu-Met-Gly-Pro-Ala),肽序列的Asp和Glu在清除羟基自由基的过程中起着关键作用[62]。鲢鱼肌肉蛋白肽MYPGIGDR(Met-Tyr-Pro-Gly-Ile-Gly-Asp-Arg)和ADLVHVQ(Ala-Asp-Leu-Val-His-Val-Gln)都具有较强DRSA,C末端旁边第二个氨基酸位置是Glu或Asp能更有效地对中断氧化链式反应,减少有害ROS的产生,有助于增强肽的自由基清除活性和还原能力[63]。
2 一级结构与金属离子螯合能力的关系
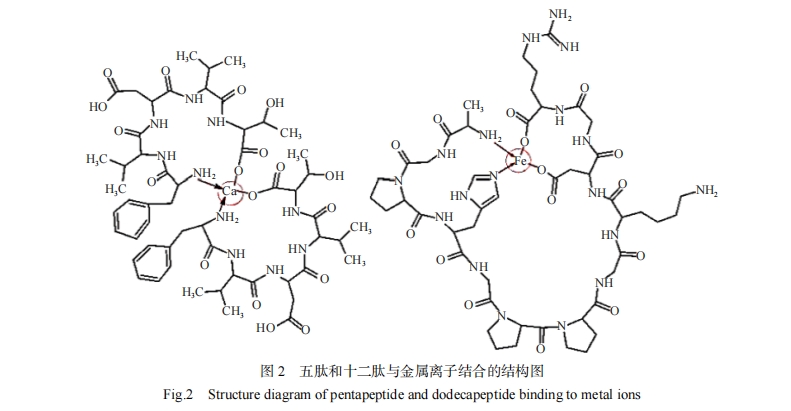
氨基酸侧链的基团与金属离子螯合活性有关,带正电的碱性氨基酸侧链上的羧基失去氧原子与金属离子形成络合物[60],带负电的酸性氨基酸侧链上的氨基失去氮原子,氮原子未共享的电子对与金属离子结合,酸性氨基酸螯合Fe2+的还原方式与抗坏血酸类似[61],生成具有三齿结构的稳定铁螯合物[73]。碱性氨基酸的羧基、Asp的游离γ-羧基和Glu的游离δ-羧基与金属离子结合[73],His的咪唑环、Cys的巯基、Trp的吲哚基和Thr的羟基[1]以及Ser的羟基[74]可以提供额外的金属离子结合位点。
3 二级结构与抗氧化活性的关系
肽的二级结构包括α-螺旋、β-折叠、β-转角、无规卷曲。来源于β-乳球蛋白的多肽WYSLAMAASDI(Trp-Tyr-Ser-Leu-Ala-Met-Ala-Ala-Ser-Asp-Ile)的ORAC活性比抗氧化剂BHA强,而且相对应的等摩尔游离氨基酸的混合物具有更高活性,而寡肽YVEEL(Tyr-Val-Glu-Glu-Leu)却正好相反,其氨基酸混合物的ORAC比寡肽低2倍[75]。这说明肽键或者肽链的空间结构既可能降低也可能提高多肽的抗氧化活性。
α-螺旋主要通过羰基氧(-CO)和氨基氢(NH-)两种基团之间的分子内氢键形成,氨基酸越多的肽更容易形成α-螺旋结构[28]。α-螺旋结构区域具有较高的两亲性,有助于肽在界面发挥抗氧化作用[76]。α-螺旋在肽的抗氧化能力中发挥着关键作用,鲑鱼皮水解液具有较好的自由基清除能力,采用红外光谱分析其二级结构,其中α-螺旋含量占比最高,无规卷曲含量占比最低,水解液的ABTS、HRSA和超氧自由基清除活性(superoxide anion radical scavenging capacity,SRSA)分别为1.86、1.65和2.72 mg/mL[77]。也有研究结果表现出α-螺旋比例越低,肽具有的抗氧化能力更强。由拉普光谱测定金线鲷肌肉水解物的二级结构,α-螺旋占比最大,为47.88%,无规卷曲占比最小,为10.3%。经200 W超声波处理后,α-螺旋比例降低至0.78%,无规卷曲含量增加至12.33%,酶解产物的DRSA的IC50值降低,说明抗氧化活性增加[12]。
β-折叠通过多肽链之间维持稳定性的链间氢键形成,有序结构α-螺旋和β-折叠主要位于蛋白质内部位置,β-转角结构由弱氢键结构产生[12]。肽的抗氧化活性与三维结构特征β-转角的贡献有关,黑鱼消化液中分离出的四个肽具有的β-转角结构的占总多肽二级结构的75%,其中鉴定出的肽PGMLGGSPPGLLGGSPP的DRSA活性与GSH相当,肽SDGSNIHFPN的FICP活性与EDTA相当[78]。东方鲀鱼皮和市售鱼皮肽的二级结构主要以β-折叠为主,两种肽再经消化酶水解后,β-折叠和无规卷曲含量降低,α-螺旋和β-转角含量增加,其中市售鱼皮肽的DRSA清除率由7.89%增加到28.77%,而东方鲀鱼皮肽的DRSA清除率减弱,东方鲀鱼皮经过消化,α-螺旋含量的增加造成了其DRSA清除率和总还原能力降低[79]。此外,Yang等[80]认为较高的β-折叠含量和较低的α-螺旋可能与肽的抗氧化活性有一定的相关性。
无规线圈由未折叠构象产生,它与肽链的灵活度有关[12]。关于无规线圈的含量与二级结构的关系不成正比或反比关系,比例高的无规卷曲能使肽的结构更加松散,暴露更多的活性位点,有利于和自由基结合[81]。有序结构向无序结构转变能使肽抗氧化活性增强[82],从三文鱼骨中提取的低聚肽粉具有较强ABTS和还原力,使用紫外光谱和圆二色谱分析其二级结构,α-螺旋和平行式β-折叠含量两类结构占比最小,无规卷曲含量占比最大。经过高压脉冲电场处理后的松仁蛋白肽Ac-QWFCT(Ac表示N端乙酰化Gln),其无规线圈含量与抗氧化活性成相反趋势[83]。当肽的无规卷曲含量为32.5%时,其具有最佳的抗氧化活性。王莹等[84]利用红外光谱、核磁共振光谱、Zeta电位和圆二色谱分析高压脉冲电场处理的寡肽KWFH(Lys-Trp-Phe-His),发现KWFH的羧酸羰基的C=O和苯环的氢质子发生变化,电位改变使二级结构变得更加无序,DRSA清除率较PEF处理前增强了13.92%。
4 一级结构与肽的相互作用
氨基酸或序列的增加或缺失可以增强肽的抗氧化活性,也可以削弱肽的抗氧化活性,这与抗氧化肽的分子量、肽键和氢键有关[85]。Gopinatth等[17]从金枪鱼骨干蛋白中提取出肽APTBP,将其任意一端替换Trp使肽的ABTS活性提高63.1%,而肽的两端都替换Trp后,ABTS活性降低10.3%。肽序列中氨基酸之间的协同效应在其抗氧化活性中发挥重要作用。通过自由基转移反应,被氧化的氨基酸可以将自由基损伤交换到邻近的氨基酸,使反应产物更稳定[86]。Liu等[87]认为肽链中Tyr的酚羟基的活性影响整体的抗氧化性能,当Tyr处于DD(Asp-Asp)或DQ(Gln-Asp)之间时抗氧化活性会增加,因为DD或DQ中的氨基酸侧链的羧酸基团的亲电性削弱了酚羟基的氧电子云密度,还增强了供应和释放氢质子的能力。同样,Bamdad等[86]认为五肽QPYPQ中的P和Y的交替序列对稳定自由基有积极作用。Najafian等[88]在罗马鱼(L. plantarum)水解液中鉴定了与之有相同结构基序PYP(Pro-Tyr-Pro)的肽AIPPHPYP(Ala-Ile-Pro-Pro-His-Pro-Tyr-Pro),此肽的DRSA、ABTS和还原力的IC50分别为1.38、0.873和0.456 mg/mL。因此,肽序列中的氨基酸存在的相互作用对肽的活性有一定影响,其影响程度还有待进一步研究。
单个肽与混合肽的抗氧化活性不同,古氏魟蛋白肽WAFAPA(Trp-Ala-Phe-Ala-Pro-Ala)和MYPGLA(Met-Tyr-Pro-Gly-Leu-Ala)清除ABTS自由基的实验值大于计算的理论值,两个肽之间潜在的协同作用能帮助它们在功能性食品中发挥更好的抗氧化作用[16]。同样,在半鳍鳀鱼肽NKVKGELD、EMSAGLHE和WRKKDPLND中,尽管单个肽NKVKGELD的DRSA活性很弱,但它与其他两个肽分别组合后的抗氧化活性增强[89]。金线鱼鱼糜多肽FLGSFLYEYSR的ABTS自由基清除率为2.448 mmol/L Trolox,与一同分离出的其他肽组合后,混合物的抗氧化能力降至1.962 mmol/L Trolox[56]。Halim等[90]在实验中发现,10000 Da的鳗鱼蛋白超滤液的DRSA活性超过了3000和5000 Da超滤液,尽管许多研究人员认为超滤液的分子量与其抗氧化活性成负相关[91],但多个肽的相互作用说明分子量不是唯一影响混合肽抗氧化活性的因素。
5 结论
抗氧化肽的活性归因于其立体空间结构,一级结构中氨基酸基团、酸碱性、亲疏水性、相互作用和二级结构对抗氧化肽活性产生重要影响。His、Arg、Lys、Glu和Asp作为极性带电氨基酸可以吸引带有异性电荷的自由基和金属离子,赋予肽抗氧化能力。含硫氨基酸的巯基,芳香族氨基酸的苯环、酚羟基、吲哚基团,部分疏水性氨基酸的长脂肪族侧链,部分中性氨基酸的羟基,酸性氨基酸和碱性氨基酸的羧基这些官能团都对抗氧化肽的活性有显著影响。具体来说,Gly,Asp、Glu、Leu、Val、Cys、Ser、Thr、Arg、Tyr和Glu清除自由基的作用机制是提供氢原子。Ile、Leu、Ala、Lys、Val和Met等疏水性氨基酸的抗氧化作用机制主要是清除脂类自由基和增强水油界面的溶解度,延缓脂质氧化。Met、Tyr、Trp、His、Phe、Pro和Trp的作用机制是通过提供电子稳定自由基。
鱼类抗氧化肽的结构鉴定不仅局限于鉴定氨基酸序列和二级结构,还应深入开发新型鉴定结构的方法。阐明肽与其抗氧化活性的构效关系,能够降低成本和增加经济效益。此外,未来探究多肽链的氨基酸增加、减少、替换等修饰处理,以及探究氨基酸序列、位置、组成和侧链糖基化程度对抗氧化活性的影响,有助于为抗氧化肽的应用提供理论基础,指导新型抗氧化肽开发市场。此外,利用生物信息学技术和同源建模方法对肽的氨基酸序列进行分析,能够更好地了解其构效关系。研发表征抗氧化肽在细胞中构效关系的相应工具,有助于进一步剖析肽的抗氧化机制,指导抗氧化肽的定制化设计。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志