
摘要 外泌体(exosomes)是一种由活细胞分泌并释放到胞外环境中、大小在60~100 nm的运输膜泡。外泌体以其天然的物质转运特性、相对较小的分子结构和优良的生物相容性, 可递送化学药物、蛋白质及肽配基和基因药物等多种药物, 在药物载体的领域具有巨大的潜力。该文重点介绍了外泌体运载多种药物的不同应用及靶向给药中三种主要策略和应用以及其他靶向给药的方向及应用, 阐述了外泌体作为药物载体的优势和挑战。
1981年, Trams等[1]在透射电镜下发现了一组比多泡体还要小的、直径在40~1 000 nm的囊泡样物质。1987年, Johnstone等[2]命名这种膜泡为外泌体(exosomes), 同时在网织红细胞的成熟过程中, 观测到了外泌体的形成并通过离心(100 000 ×g, 90 min)首次从网织红细胞中成功分离纯化了外泌体。1996年 , Skokos等[3]和 Bu等[4]发现 , 在人 B淋巴细胞中分离出来的一些膜泡具有呈递抗原的能力, 其膜表面含有丰富的主要组织相容性复合体 II(majorhistocompatibility complex II, MHCII), 可向T细胞呈递抗原并刺激T细胞激活。外泌体广泛存在于所有的体液中, 包括精液[5]、唾液[6]、血液[7]、尿液[8]、乳汁[9]等, 行使着多种功能。
1 外泌体的成分及功能
外泌体来源于细胞内源途径, 是由内含多个囊泡的多泡体(multivesicular body, MVB)向外出芽和胞膜融合后释放到胞外环境中、大小在60~100 nm之间的运输膜泡。外泌体膜由膜脂和膜蛋白组成, 膜脂中含有胆固醇、鞘磷脂、神经节苷脂(ganglioside,GM)[10], 可构成脂阀结构等, 这赋予了外泌体对非离子型去污剂的抵抗性, 具有抗去污剂膜(detergentresistant membranes, DRM)的特性[11]。而膜蛋白主要有四分子交联体家族[CD9(cluster of differentiation9)、CD63、CD81、CD82]、热休克蛋白[Hsp70(heatshock protein 70)、Hsp90]、跨膜运输和整合相关蛋白(如G蛋白、膜联蛋白、脂阀结构蛋白等), 尤其是CD9和CD63, 通常是外泌体的分子标志[12]。不同来源的外泌体也有着其特异的表面分子, 在细胞通讯、信息传递中起着重要的作用。例如, 人淋巴B细胞、树突状细胞(dendritic cell, DC)来源的外泌体表面高表达MHC, 以呈递抗原刺激T细胞激活[11], 网织红细胞来源的外泌体高表达转铁蛋白受体等[13]。外泌体内含物包括可溶性蛋白质、核酸(mRNA、miRNA、microRNA)和脂质等。通常作为药物载体的HEK293T细胞来源的外泌体成分已被探明, 包括蛋白质、mRNA和microRNA[14]。外泌体可以通过表面分子与受体细胞表面受体结合, 将其内含物递送至受体细胞内, 进行胞间的信息传递, 从而改变受体细胞的生理状态。近年来, 许多研究表明, 外泌体参与肿瘤的发展和转移, 在免疫应答及炎症反应方面有着重要地位[12]。也有研究表明, 和正常细胞来源的外泌体相比, 肿瘤细胞来源的外泌体在蛋白质、mRNA、miRNA等内含物的丰度和种类等都有差别,且外泌体在体液中分布非常广泛且易得, 因而成为早期肿瘤诊断的分子标志物[14]。此外, 近年来外泌体被广泛用作药物载体, 在生物治疗领域有着极大的潜力, 本文重点介绍外泌体作为药物载体的应用以及用作靶向药载体的策略。
2 外泌体作为药物载体的优势
近年来, 作为天然的胞间信息载体的外泌体,以其相对较小的分子结构、天然的分子转运特性和良好的生物相容性, 在药物载体领域具有巨大的应用潜力[15]。对于药物载体的选择, 有两个基本原则:保护内含药物在体内环境中不失活; 在不引发机体对药物载体产生免疫反应的情况下释放内含物[16]。较之现有的药物载体(如人工制造的脂质体), 外泌体有其显著的优越性。首先, 外泌体有自身天然的内含物, 可以转移至受体细胞并功能性改变受体细胞, 且不同来源的外泌体表面分子不一样, 对受体细胞有一定选择性, 在治疗上更有利[17]。其次, 相对于脂质体对亲水性物质较低的包装效率, 其在递送核酸方面受到限制, 而外泌体可以更好地亲和核酸分子, 显著提高包装效率[18]。再则, 较之人工制造的药物载体, 特殊细胞[如未成熟的DC细胞或者是充间质干细胞(mesenchymal stem cell, MSC)]来源的外泌体,由于它们特殊的表面分子能够避免与调理素蛋白、抗体、凝血因子等产生相互作用, 从而避免了体内产生免疫反应[19]。有研究表明, 经过人工设计的外泌体可以通过小鼠的血脑屏障发挥作用[20]。
3 外泌体作为药物载体的应用
利用外泌体装载药物的方式有多种, 可分为间接装载和直接装载两大类。间接装载指通过操作外泌体来源细胞来使外泌体装载药物, 该方式较为成熟、应用较多, 又分为以下两种方法。(1)将药物与外泌体来源细胞共培养, 使细胞分泌出的外泌体内自然包含有药物, 但转染效率不高, 主要应用于细胞毒性较低的小分子化学药物[21]。(2)通过化学方法(如脂质体转染法)转染外泌体来源细胞, 使其携带药物,但转染效率较低, 主要应用于基因药物[20]。直接装载法指通过操作外泌体, 直接将药物装入外泌体中,该方式转染效率较高, 但目前尚不够成熟, 主要分为以下三种方法。(1)将药物与提取出的外泌体共培养,主要应用于小分子化学药物[22]。(2)通过化学转染法如脂质体转染法将药物直接转入外泌体中, 主要应用于基因药物, 已有用于此种装载方法的商业化试剂盒。(3)通过电穿孔技术将药物转入外泌体中, 该方法通过电解质溶液施加弱电流脉冲于外泌体上,将磷脂双分子层击穿出一个可恢复的小孔, 便于药物的负载。该方法可应用于多种药物类型, 且参数易于控制, 有着广阔的应用前景。有研究表明, 在应用电穿孔技术装载基因药物时, 核酸分子的大小和外泌体的直径都对转染效率有着决定性作用[23]。
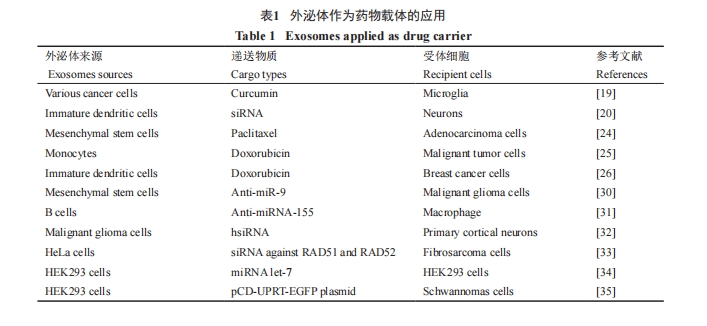
Pascucci等[24]通过将高剂量的紫杉醇和MSC混合培养, 使MSC来源的外泌体装载紫杉醇, 以胰腺癌细胞作为受体细胞, 有效地抑制了胰腺癌细胞的增殖, 证实了MSC来源的外泌体具有包裹和运送物质的能力。同时, 也证明不同细胞来源的外泌体具有特异性标记, 该标记有作为疾病诊断的潜能。Jang等[25]以单核细胞U937细胞为供体细胞, 将其与400 μg/mL的阿霉素混合培养, 通过超速离心获得了装载有阿霉素的U937细胞来源外泌体, 对癌细胞有明显的抑制作用, 但其安全性以及外泌体递送药物的效率都需要进一步研究。Tian等[26]将未成熟的DC细胞来源的外泌体分离出来, 以电转的方式使DC来源的外泌体装载阿霉素, 靶向治疗乳腺癌细胞。该研究首次将外泌体运用于递送阿霉素至小鼠实体瘤中, 为疏水性化学药物的递送提供新途径。Sun等[19]通过分别将多种细胞与姜黄素共培养, 成功获得了装载姜黄素的多种细胞来源的外泌体, 并以激活的髓样细胞为受体细胞, 成功地干预了免疫紊乱。外泌体天然的分子结构为小分子化学药物的摄取和运输都提供了基础, 降低了药物的毒副作用, 提高了药物的利用效率, 较之传统的化学药物递送系统有着天然的优越性。
外泌体可以装载内源蛋白质, 自体靶向受体细胞治疗或致病。Shimoda等[27]发现, CagA(cytotoxinassociated gene A)表达细胞来源的外泌体, 内含有毒性因子CagA, 可递送其至胃上皮细胞导致胃肠疾病。Altan-Bonnet等[28]发现, 病毒宿主细胞产生的外泌体可以通过包裹病毒基因组和病毒颗粒运送至新的易染的宿主细胞这一过程, 成为病毒扩散的新途径。外泌体包裹蛋白质类药物作为治疗途径主要是参与免疫治疗, 使用的外泌体往往是成熟的DC细胞来源的外泌体, 因其表面含有高丰度的MHC分子、细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)、四分子交联体蛋白家族和NK细胞的激活配体, 因此比未成熟的DC细胞来源的外泌体更具免疫刺激性[19]。在肿瘤的免疫治疗方向, 特殊细胞来源外泌体因其表面分子的特殊性有着很大优势。例如, 成熟的DC细胞来源的外泌体具有诱导T细胞和B细胞进行抗肿瘤免疫的能力, 外泌体作为肿瘤疫苗具有良好的发展前景。
外泌体装载的基因药物主要有mRNA、miRNA、siRNA三类, 其中以能够执行RNAi的siRNA居多。接下来将介绍外泌体在递送几种基因药物中的应用。外泌体可以通过自体携带的miRNA进行胞间信息交流, 如Chen等[29]发现外泌体可以通过携带能够沉默结缔组织生长因子2(connective tissue growthfactor 2, CCN2)mRNA的miRNA-214在人或鼠肝星状 细 胞(hepatic stellate cells, HSC)间 进 行miRNA-214的传递, 抑制了肝星状细胞的纤维化, 此外, 外泌体也可以通过装载外源的miRNA对受体细胞起作用。Munoz等[30]通过MSC来源的外泌体装载antimiR-9赋予恶性胶质瘤细胞化学敏感性。miR-9和药物转运蛋白的表达相关, 敲除miR-9有助于恶性胶质瘤细胞提高对化学药物TMZ(tribuzone)的敏感性。Momen-Heravi等[31]通过电转使B细胞来源的外泌体装载miRNA-155抑制剂, 作用于巨噬细胞, 降低了脂多糖诱导的TNF-α(tumor necrosis factor-α)产生,减轻了体内的炎症反应。该研究为B细胞来源外泌体作为药物载体的应用提供了证据, 但对于外泌体在体内是否可以长时间地发挥作用仍需进一步的研究。Didiot等[32]将疏水修饰的siRNA(hsiRNA)和恶性胶质瘤U87细胞来源的外泌体进行混合培养, 装载hsiRNA递送到原代培养的小鼠大脑皮层细胞中,通过沉默亨廷顿mRNA起到治疗亨廷顿舞蹈症的作用。该研究认为, 共培养是外泌体递送基因药物的一种可行、高效、高重复性的装载方法, 证明了外泌体递送基因药物的可行性。Shtam等[33]通过电转使HeLa细胞来源的外泌体装载RAD51和RAD52的siRNA, 诱导纤维素肉瘤细胞中两个基因沉默,RAD51是细胞周期相关蛋白, 与正常细胞非正常增殖为癌细胞相关, 是癌细胞的潜在靶点。
外泌体的靶向策略多样, 主要有修饰外泌体表面蛋白质以增强靶向作用, 导入在特定细胞发挥功能的mRNA, 选用自身趋向性强的外泌体种类等三类。Tian等[23]通过构建融合表达载体转入未成熟的DC细胞, 将可与肿瘤表面整合蛋白αv特异结合的肽iRGD(CRGDK\GPDC)融合在未成熟DC细胞来源的外泌体表面膜蛋白lamp2b(lysosomalassociatedmembrane protein 2b)上, 通过超速离心提取囊泡后, 通过电转将阿霉素转入带有iRGD的外泌体中, 达到靶向杀伤整合蛋白αv阳性癌细胞的目的。Alvarez-Erviti等[20]将未成熟DC细胞来源的外泌体膜蛋白lamp2b融合能够特异与乙酰胆碱受体结合的狂犬病毒糖蛋白配体RVG, 从而实现对神经细胞的靶向作用。同时, 还构建了lamp2b-MSP融合载体, 多肽MSP可以特异性靶向肌肉细胞。通过将lamp2b-RVG、lamp2b-MSP融合表达载体转入未成熟的DC细胞, 超速离心提取囊泡后, 通过电转使多种siRNA转入带有靶向肽的外泌体中, 实现了对靶细胞靶基因的沉默。该研究表明, 外泌体可以通过血脑屏障对神经细胞发挥作用。Ohno等[34]将可与EGFR(epidermal growth factor receptor)特异结合的多肽EGF和GE11分别克隆至pDisplay载体中, 转入HEK293T细胞后通过pDisplay载体中的血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)跨膜区域, 将EGF和GE11表达在293T细胞来源的外泌体膜表面, 收集外泌体后通过脂质体转染将肿瘤抑制剂miRNAlet-7转入外泌体中, 靶向EGFR高表达的乳腺癌细胞。该研究使用了脂质体转染而非先前常用的电转将微RNA装载入外泌体中, 是因为和之前研究团队使用的细胞种类不同, 其获得的外泌体不适合电转。
Mizrak等[35]在HEK293T细胞里转入含有胞嘧啶脱氨酶CD(产物为mRNA或蛋白质)和尿嘧啶磷酸核糖转移酶(uracil phosphoribosyl transferase, UPRT)融合基因的质粒。CD可以将前体药物5-氟胞嘧啶(5-FC)转化为5-氟尿嘧啶(5-FU), 而5-氟尿嘧啶会特异对表达UPRT的细胞产生毒性, 收集的293T细胞来源的外泌体内会含有高丰度的治疗性mRNA/蛋白质, 然后将该外泌体作用于神经鞘瘤细胞。在施加前体药物5-FC的情况下, 会特异性地杀伤同时表达CD和UPRT的肿瘤细胞, 实现靶向作用。该研究首次将pCD-UPRT-EGFP质粒和外泌体联系起来, 为外泌体在癌症及其他疾病的治疗领域提供了证据。
外泌体自身表达的配体与受体细胞受体相互作用赋予了特殊种类的外泌体自体趋向作用。Morelli等[36]发 现, DC细 胞 作 为 专 职APC(antigenpresenting cell), 其来源的外泌体表面表达的各种配体, 如抗体介导的CD11a、CD54、CD81、CD9的封闭, 或是受体细胞BMDC(bone marrow-deriveddendritic cell)表面αv和β3的同时封闭, 都会指导外泌体靶向到受体细胞BMDC或胞外基质蛋白。肿瘤细胞来源的外泌体在肿瘤转移的过程中起着重要的作用, 不同肿瘤细胞来源的外泌体对各自的作用部位或靶细胞都有着趋向性[37]。Hood等[38]将荧光标记的黑色素瘤细胞来源的外泌体注射入小鼠的脚垫中, 发现外泌体集中存在于注射位点附近的淋巴结中, 而相同处理的脂质体则平均分布在组织中且远离淋巴结, 并且黑色素瘤细胞来源的外泌体可以靶向造血基质细胞, 促进新生血管形成。外泌体的这种趋向性与外泌体膜成分相关, 原发性肿瘤中高表达整合蛋白α6β4和α6β1的外泌体会转移到肺组织中, 但是表达整合蛋白αvβ5的外泌体会转移到肝中。
此外, 一种新兴的利用磁纳米颗粒的外泌体靶向方法也正在兴起。Qi等[39]利用转铁蛋白和转铁蛋白受体的特异性结合, 将多个超顺磁性粒子和小鼠血清共同孵育。血清中的网织红细胞来源的外泌体表面有转铁蛋白受体, 磁性粒子会结合在外泌体表面的转铁蛋白受体上, 再通过外加磁场进行携带磁性粒子外泌体的收集, 将阿霉素装载至外泌体内后注射到荷癌小鼠体内, 在肿瘤部位外加磁场即可起到特异性杀伤肿瘤细胞的目的。在靶向给药领域中外泌体有巨大潜力, 靶向方法是关键, 现有最大问题是靶向效率较低, 且临床应用时易被自身免疫系统吞噬, 成为外泌体靶向给药领域一个亟待解决的问题。
4 存在的问题与展望
作为一种新兴的药物载体, 外泌体在应用方面还面临着许多挑战。外泌体无法实现临床广泛应用的最主要原因是传统培养的外泌体的产量较低, 且靶向给药时, 外泌体表面蛋白质修饰在体内也不稳定, 外泌体易被体内的巨噬细胞或者网状内皮系统吞噬, 在体内存在时间短。Watson等[40]使用中空纤维反应器高效生产具生物活性的胞外囊泡(extracellular vesicles, EV)较之传统细胞培养, 反应器培养的每mL培养基可以产生的EV量是后者的40倍。有研究表明, 单核细胞/巨噬细胞通过SRA(scavenger receptor class-A family)受体摄取表面含有SR-A的外泌体, 如果使用硫酸葡聚糖封闭小鼠体内的SR-A, 能显著减少肝对外泌体的摄取。Kundra等[41]通过在外泌体修饰常用膜蛋白lamp1、lamp2上进行N-糖基化(N-glycosylation)修饰, 有效地保护了lamp1、lamp2在体内不被水解, 增强了外泌体的稳定性。
在癌症及免疫治疗中, 往往需要靶向给药, 减少对正常细胞的毒害。外泌体作为一种有靶向潜力且可递送药物的天然载体, 具有内源的治疗机制、很好的免疫相容性及递送多种药物的能力, 在临床上有着巨大的应用潜力。外泌体的分离纯化方式有着局限性, 现有的分离纯化方式主要有超速离心, 蔗糖密度梯度离心, 利用试剂盒进行分离及免疫分离[42],在临床应用上均费时、费力。此外, 不同细胞来源的外泌体有着不同的组成, 即使是一种来源的外泌体对于受体细胞也会有多种功能, 在临床上不能普适或可控[15], 对外泌体的进一步研究和改造将有助于这些问题的解决并推动外泌体在临床上作为药物载体的应用。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志