
[摘要] 目的 合成能够与碳酸酐酶9(carbonic anhydrase Ⅸ,CAⅨ)蛋白多糖区特异性结合的多肽分子(proteoglycan-like region peptide, PGLR-P1), 并初步探讨其在体外的寻靶能力。方法 通过化学固相合成法合成多肽分子,对其纯度和相对分子质量进行分析,并初步探讨其与CAⅨ蛋白、表达CAⅨ的肿瘤细胞和相应移植瘤组织的结合能力以及携载多肽的靶向纳米泡的体外寻靶能力。结果 合成的多肽分子纯度高于98%,相对分子质量(1 722.2±0.4),其能与CAⅨ蛋白、表达CAⅨ的肿瘤细胞及相应移植瘤组织发生特异性靶向结合,且携载多肽的靶向纳米泡特异性靶向结合CAⅨ表达阳性的肿瘤细胞。结论 化学合成的多肽分子PGLR-P1在分子、细胞和组织水平均能与CAⅨ蛋白发生特异性结合。
碳酸酐酶9(carbonic anhydrase Ⅸ,CAⅨ)又称G250、MN,是一种位于多种恶性肿瘤细胞膜上,由酸性氨基酸组成的跨膜蛋白。其结构可以分为胞内区、跨膜区和胞外区,胞外区主要由酶催化区与蛋白多糖区组成。与其他碳酸酐酶同工酶相比,蛋白多糖区是CAⅨ所特有的结构,故特异性靶向于CAⅨ蛋白多糖区的配体,不会与其他碳酸酐酶同工酶相结合,引起交叉反应[1]。因此,构建和合成短小、稳定、特异性靶向于CAⅨ蛋白多糖区的配体,有利于多种恶性肿瘤(乳腺癌、胃癌、小细胞肺癌、肾癌、宫颈癌等)的靶向分子显像和靶向治疗。多肽是由α-氨基酸以肽键的方式连接成的化合物,通常由10~100个氨基酸分子脱水缩合而成。多肽分子化学结构简单、分布广泛、性质稳定,已广泛应用于医学诊断和药物开发中。Rana等[2]通过噬菌体展示库技术淘选出针对CAⅨ蛋白多糖区的多肽分子(proteoglycan-like region peptide, PGLR-P1,NMPKDVTTRMSS),并研究其与CAⅨ蛋白分子的结合能力和体内代谢分布,但尚未从病理学上证实其与肿瘤细胞和肿瘤组织的结合能力以及连接到超声纳米泡表面后是否改变其与CAⅨ的亲和力。因此,本实验通过化学固相合成法合成靶向于CAⅨ蛋白多糖区的特异性多肽分子PGLR-P1,并在分子、细胞和组织水平初步探讨其与CAⅨ特异性结合的能力,从而为恶性肿瘤的分子影像学提供一种理想配体。
1 材料与方法
人肾癌786-0细胞、人宫颈癌HeLa细胞和人胰腺癌BxPC-3细胞均购自中科院上海细胞库,胎牛血清和RPMI1640培养基均购自HyClone公司, 各型氨基酸购自苏州天马医药集团精细化学品有限公司, 小鼠抗人CAⅨ单克隆抗体购自Abcam公司, FITC标记山羊抗小鼠IgG、TMB显色液和DAPI染色液均购自碧云天生物技术有限公司, FITC标记链霉亲和素和链霉亲和素均购自博士德生物技术有限公司。
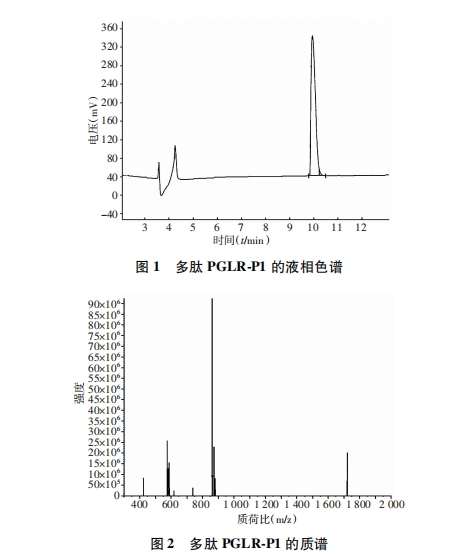
采用标准化学固相合成法合成生物素化多肽分子PLGR-P1[H2N-NMPKDVTTRMSSk(biotin)-CONH2]。具体步骤如下:二氯甲烷溶胀树脂后,接上第1个氨基酸(赖氨酸),脱除Fmoc保护,茚三酮检测树脂上氨基酸。重复上述步骤,从右至左依次连接序列中的氨基酸,最后进行生物素化标记。合成结束后,切割下多肽,乙醚洗涤后,得到多肽粗品。采用高效液相色谱法(HPLC)分离纯化多肽粗品,并进行纯度与相对分子质量检测。
用包被液稀释重组人CAⅨ蛋白胞外区至10 μg/mL,酶标板中每孔加入100 μL,4 ℃包被过夜,洗板,用5%的BSA封闭2 h。加入化学合成的生物素化多肽,100 μL/孔,37 ℃孵育1 h。洗板后加入1 ∶5 000的HRP-链霉亲和素,100 μL/孔,37 ℃孵育1 h。洗板后加入TMB显色液100 μL/孔,室温反应15 min,每孔再加入50 μL浓度为2 mol/L的浓硫酸终止反应,酶标仪上检测各孔的光密度值[D(450)]。以多肽溶液直接包被酶标板作为阳性对照,以包被液替代CAⅨ蛋白作为空白对照。
取对数生长的肾癌786-0、宫颈癌HeLa和胰腺癌BxPC-3细胞,按2×104/mL接种在96孔板,培养过夜。洗板后4%多聚甲醛固定15 min,每孔加入100 μL的3%的过氧化氢液阻断内源性过氧化物酶活性,37 ℃孵育30 min。洗板后加入5%的BSA封闭2 h,每孔加入100 μL的多肽,37 ℃孵育1 h,其后处理如上。以多肽溶液直接包被作为阳性对照,以PBS代替细胞作为空白对照。
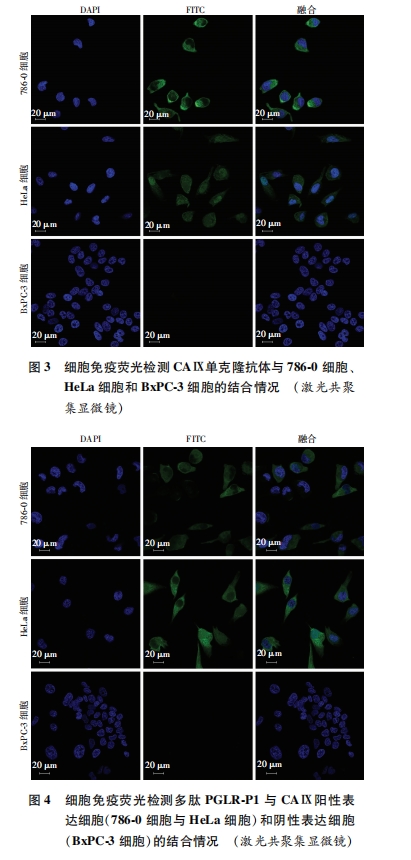
取对数生长的肾癌786-0、宫颈癌HeLa和胰腺癌BxPC-3细胞,按5×104/mL接种在铺有玻片的24孔板上,培养过夜。洗板后4%多聚甲醛固定15 min,加入5%的BSA封闭2 h,每孔加入100 μL的小鼠抗人CAⅨ单抗,4 ℃过夜孵育。PBS漂洗3次后,加入100 μL的FITC标记山羊抗小鼠IgG,37 ℃避光孵育2 h。PBS漂洗后用DAPI染色液进行复染3 min,漂洗后在激光共聚焦镜下观察。以同样的步骤使用多肽进行细胞免疫荧光测定,以检测多肽与表达CAⅨ细胞的结合力。
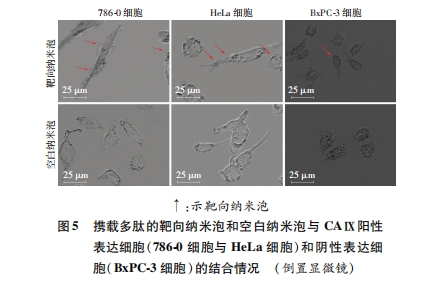
将DPPC、DPPG、DPPE、DPPA以及生物素化的DSPE-PEG(2000)按一定比例溶于有机溶剂中,振荡过夜后移至西林瓶,全氟丙烷置换瓶中空气,ST银汞胶囊调和器振荡后静置过夜。离心后分离得到空白纳米泡。通过生物素-亲和素系统将多肽连接到空白纳米泡表面得到携载多肽的靶向纳米泡。将对数生长的786-0、HeLa和BxPC-3细胞以5×104细胞/孔接种在24孔中,过夜培养后用4%多聚甲醛固定,漂洗后加入纳米泡。每种细胞分为2组,一组加入30 μL的靶向纳米泡,一组加入30 μL的等浓度空白纳米泡,4 ℃冰箱中孵育2 h。玻片清洗3次后,将玻片倒置于切片上,在普通光学显微镜(Olympus)下观察。
2 结果
3 讨论
恶性肿瘤严重影响人类的生命健康,据全国肿瘤登记中心统计,全国每年恶性肿瘤的发生率与致死率不断上升,早期诊断和及时治疗对于提高肿瘤患者生存质量和改善患者预后具有极为重要的价值[3-4]。由于常规的医学影像技术尚不能在组织发生解剖结构改变之前检测出恶性肿瘤的分子表达改变,因此肿瘤的早期诊断和特异性显像一直是近年来医学影像学研究的热点和难点,分子影像学的出现为早期发现恶性肿瘤分子表达改变提供了一种新方法和希望,其主要包括核素分子影像、磁共振分子影像、超声分子影像等[5]。其中,超声分子影像学是分子影像学的重要组成部分,目前用于肿瘤超声分子影像学的特异性靶点主要局限在血管内,如血管内皮生长因子受体-2(vascular endothelial growth factor receptor 2, VEGFR-2),只能实现肿瘤组织血池内显像,不能穿过肿瘤血管壁,到达肿瘤组织,实现肿瘤实质细胞特异性超声显像[6]。同时这些靶点不具有肿瘤特异性,如VEGFR-2在炎症反应时其表达量也会增加,故针对VEGFR-2的超声造影剂也能显著增强炎症组织显像效果,但尚不能真正实现肿瘤组织的特异性超声分子显像[7]。实现肿瘤分子显像的基础和关键环节是选择能与恶性肿瘤细胞特异性结合的靶点,在此基础上才能构建出特异性强、性能稳定的靶向分子探针。
恶性肿瘤由于组织高密度生长,易发生缺氧,导致缺氧诱导因子-1表达,进而多种实体恶性肿瘤组织的实质细胞膜上均高表达CAⅨ,而其在大多数正常组织中不表达[8]。同时CAⅨ胞外蛋白多糖区是其特有结构,有利于携载针对CAⅨ蛋白多糖区抗体的造影剂和药物直接特异性靶向结合恶性肿瘤细胞,而不会与正常组织细胞结合,故CAⅨ是恶性肿瘤靶向治疗和分子显像中理想靶点,因此本研究选择CAⅨ作为恶性肿瘤的特异性靶点,合成并研究能与CAⅨ蛋白多糖区特异性靶向结合的配体。
目前,有多种配体可与CAⅨ蛋白多糖区发生特异性结合,包括单克隆抗体M75、G250,重组合成的抗体片段A3和CC7,多肽CaⅨ-P1[9-11]。其中,抗CAⅨ单克隆抗体已进入临床试验阶段,如124I标记的嵌合单克隆抗体cG250诊断肾透明细胞癌的灵敏度和特异性分别达到94%和100%,同时cG250可作为抗体药物,延长肾癌患者生存时间[12]。然而,单克隆抗体具有相对分子质量大、免疫原性高等缺点,因此严重限制了其作为靶向配体在肿瘤特异性显像和治疗中的深入研究。与传统的单克隆抗体相比,
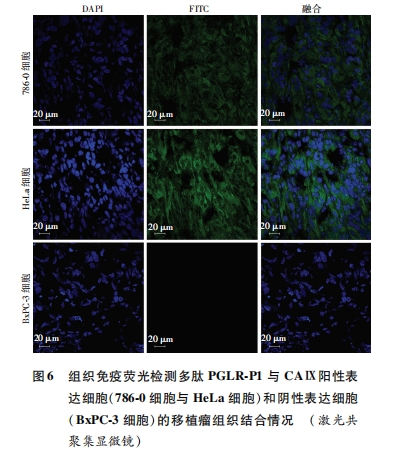
多肽分子具有相对分子质量低、选择性与特异性高、细胞渗透性强、易于修饰且不影响多肽自身特性、免疫原性低等优点,是分子影像学中理想配体[13]。目前,靶向于肿瘤血管的携载VEGFR-2多肽分子的超声造影剂(BR55)已用于二期临床试验,其能使丰富、紊乱的肿瘤血管特异性显像,表明以多肽为配体的靶向超声造影剂具有较好的临床应用前景[14]。结合上述研究进展,我们选择CAⅨ作为肿瘤细胞靶点,多肽PGLR-P1作为CAⅨ的靶向配体,通过免疫荧光法进一步发现生物素化的PGLR-P1特异性靶向结合CAⅨ表达阳性的786-0和HeLa细胞及其相应移植瘤组织,且与CAⅨ表达阴性的BxPC-3细胞及其移植瘤组织无结合能力,进而证实多肽PGLR-P1靶向结合CAⅨ表达阳性肿瘤细胞和肿瘤组织。同时我们制备了携载多肽的靶向纳米泡和空白纳米泡,发现携载多肽的靶向纳米泡能特异靶向聚集在CAⅨ表达阳性的肿瘤细胞周围,即连接到超声纳米泡表面后未明显改变多肽PGLR-P1对CAⅨ的亲和力,故其可作为恶性肿瘤超声分子影像学中的特异性配体,携载多肽PGLR-P1的靶向纳米泡可作为恶性肿瘤早期靶向诊断的一种新型靶向超声造影剂。
总之,我们通过化学合成的方法合成多肽PGLR-P1,并在体内外多水平探讨其与CAⅨ蛋白、CAⅨ表达阳性细胞以及相应移植瘤组织特异性靶向结合的能力,且初步探讨携载CAⅨ多肽靶向纳米泡的体外寻靶能力。然而本研究也存在不足,比如虽然酶联免疫吸附实验和细胞免疫荧光定性证实了多肽PGLR-P1靶向特异性,但是未进一步量化其与CAⅨ的亲和力。下一步,我们将研究携载多肽的靶向纳米泡的基本物理特点以及其在体内的靶向显像能力,实现恶性肿瘤实质细胞的超声分子显像。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志