
摘要:上皮/内皮细胞分子(EpCAM)是癌干细胞(CSC)重要的表面标记物分子。利用噬菌体展示肽库进行亲和消减富集生物淘筛(Biopanning), 经过5轮淘筛, 从最后一轮的噬菌体洗脱库中随机挑选47个克隆扩增, 通过ELISA方法初步确定30个阳性噬菌体克隆并进行测序, 序列分析后获得5个共有序列克隆群, 随后通过细胞免疫荧光实验验证和鉴定了其CSC靶向结合特异性。经综合分析, 确定R8噬菌体克隆的EpCAM结合特异性和敏感性最佳, 将其多肽序列命名为ESP1。该EpCAM靶向肽ESP1未来在癌化疗靶向递送药物研发方面具有潜在使用价值, 可使药物尽可能多地杀伤CSC, 进而提高疗效, 减少复发。
癌化疗药物缺乏靶向性或者靶向性不足而导致癌化疗效果不佳是目前癌症临床遇到的主要瓶颈问题之一[1-6], 特别是癌干细胞(cancer stem cell, CSC)是导致癌症增生、转移、复发的重要癌细胞群, 目前学界共识是化疗应尽可能多地杀灭CSC[7-10]。CSC具有多种高表达的表面标记分子, 其中上皮/内皮细胞分子(epithelial/endothelial cell adhesion molecule, EpCAM)是CSC细胞表面重要的标志性分子之一, 并且可能与癌的侵袭、转移等恶性表型的产生有密切关系[11-13], 已有多篇权威文献报道了以EpCAM为靶点的多种肿瘤化疗新药研发尝试策略, 包括以适配体(aptamer)作为导向元件等[14-15]。但是, 多肽以其分子量小、无毒、免疫原性低、易合成和高特异性等优势, 被认为是用于细胞/组织靶向导向元件的最佳选择[16-19], 而利用肽库淘筛(Biopanning)技术获得分子或细胞高特异性结合多肽是目前最常用的方法[20-21]。
噬菌体展示肽库(phage displayed peptide library)的淘筛(Biopanning)技术是一种快速简便的、目前最常用的细胞或分子靶向多肽的筛选方法, 由美国NEB(New England Biolabs, Boston, MT)出品的这类肽库也是目前世界上最被认可的、使用最多的肽库[22-25]。以此类方法筛选的癌靶向多肽作为靶向分子元件, 被广泛用于癌症早期分子影像学诊断、靶向纳米生物材料和靶向抗癌药物递送等研究[26-27]。
1 材料与方法
1.1 主要实验材料
(1) 噬菌体展示肽库: 噬菌体随机十二肽展示文库(Ph.D-12TM phage display peptide library kit)购自美国NEB。
(2) 细胞株 : 人胚肾 HEK293细胞株、肝癌HepG2细胞株、乳腺癌MCF-7细胞株, 均为本实验室储存。用含10%胎牛血清(fetal bovine serum, FBS)的DMEM培养基, 于37 °C、5% CO2的饱和湿度培养箱内培养。
(3) DMEM培养基: Gibco公司(New York, NY)。
(4) 宿主菌: E. coli ER2738购自New England Biolabs, 美国。以含50%甘油的菌体培养物形式贮存于–80 °C冰箱。
(5) 抗体: 鼠抗M13多克隆抗体购自Abcam(ab24229), 英国; 辣根过氧化物酶(HRP)标记山羊抗鼠多克隆抗体购自Abcam(ab6789)公司; 四甲基联苯胺(TMB)、DAPI细胞核染液购自西安沃尔森生物技术有限公司。
1.2 主要实验方法
1.2.1 肽库消减富集生物淘筛(Biopanning) 复苏宿主菌ER2738进行细菌培养, 按照试剂盒Ph.D-12说明书提供的实验步骤滴定Ph.D-12文库, 然后以EpCAM为靶点, 按照本实验室改良的Biopanning程序[2,19], 将EpCAM纯化蛋白(100 μg/mL)以及pH8.4的碳酸氢钠溶液, 以每孔100 μL包被于96孔板, 于4 °C孵育过夜。为使阳性克隆得到更好的富集, 进行5轮Biopanning并随机挑选若干噬菌体克隆, 再以ELISA进一步筛选阳性噬菌体克隆。
1.2.2 酶联免疫实验(enzyme-linked immunosorbent assay, ELISA) 使用常规96孔板法, 用ELX800全自动酶联免疫检测仪(BIO-TEK, Los Angeles, CA)进行检测, 把EpCAM的D值记为P, BSA的D值记为N。以P/N的A450比值≥2.1为阳性界定标准, 比值≤1.5界定为阴性。
1.2.3 噬菌体克隆测序 将ELISA法筛选的阳性克隆送苏州金唯智生物科技有限公司进行测序, 获得各克隆的十二肽序并通过分析获得共有序列 (consensus sequence)。
1.2.4 EpCAM的网络分析 为进一步确认筛选得到的阳性噬菌体克隆与EpCAM在细胞水平的靶向性, 通过CCLE数据库(https://portals.broadinstitute.org/)对EpCAM在多种癌症中的表达情况进行分析, 从而选择合适的细胞系进行细胞层面的验证。
1.2.5 细胞免疫荧光法
(1) 细胞爬片。取灭过菌的规格为5 mm×5 mm的盖玻片, 将其置于30 mm的培养皿中, 取处于指数期且生长状况良好的人胚肾细胞HEK293、乳腺癌细胞MCF-7以及肝癌细胞HepG2进行传代并计数, 将5×105个/mL的细胞悬液接种至30 mm的培养皿中, 每皿加2 mL RPMI-1640完全培养基, 于5% CO2、37 °C的恒温培养箱中培养24 h。
(2) 阳性噬菌体克隆对细胞表面EpCAM的亲和力分析。将MCF7细胞、HEK293细胞和HepG2细胞接种至30 mm细胞培养皿中, 长满单层后用PBS洗涤3次, 4%多聚甲醛固定30 min, 再次洗涤3次后加入1 mL 1% BSA, 于37 °C恒温培养箱中封闭30 min。弃封闭液, 分别加入阳性噬菌体克隆(1×1012 pfu), 每个克隆1皿, 于37 °C恒温培养箱孵育2 h。洗涤后加入鼠抗M13多克隆抗体(工作浓度1:1 000), 于4 °C中过夜孵育。次日以PBS洗涤3次后滴加FITC标记的山羊抗鼠多克隆抗体(工作浓度1:500), 37 °C避光孵育30 min。PBS洗涤3次后加入DAPI染液, 37 °C避光孵育15 min。PBS再次洗涤后用90%的甘油封片, 于倒置荧光显微镜下观察拍照。
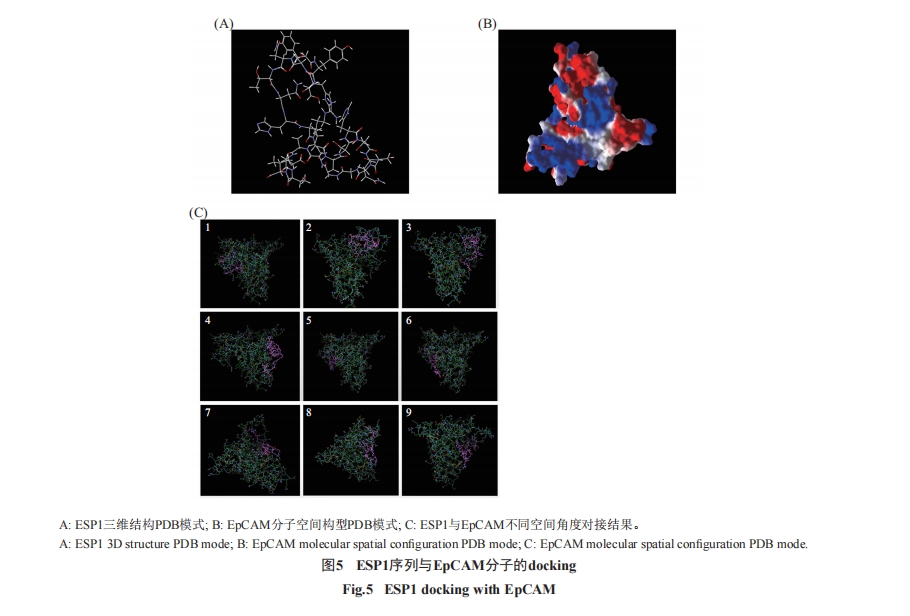
1.2.6 最佳克隆序列与EpCAM的分子对接(dock-ing) 通过SWISS-PDB viewer(v4.1)软件预测最佳克隆的肽序空间结构, 然后从PDB主页下载EpCAM的PDB模板文件, 最后利用AutoDock Vina软件(v4.2)将EpCAM与最佳克隆的肽序进行分子docking, 从分子空间构型模拟及docking参数多角度分析该多肽序列与EpCAM分子的靶向亲和力。
2 结果
2.1 经过5轮Biopanning, EpCAM靶向克隆明显富集扩增
噬菌体肽库滴定的结果为1.6×1013 pfu/mL, 首轮投入10 μL噬菌体/孔, 通过5轮“吸附→洗脱→富集”筛选, 得到五级洗脱的肽库, 计算每轮的产出与投入比, 结果(表1和图1)显示了良好的EpCAM靶向噬菌体的消减富集。
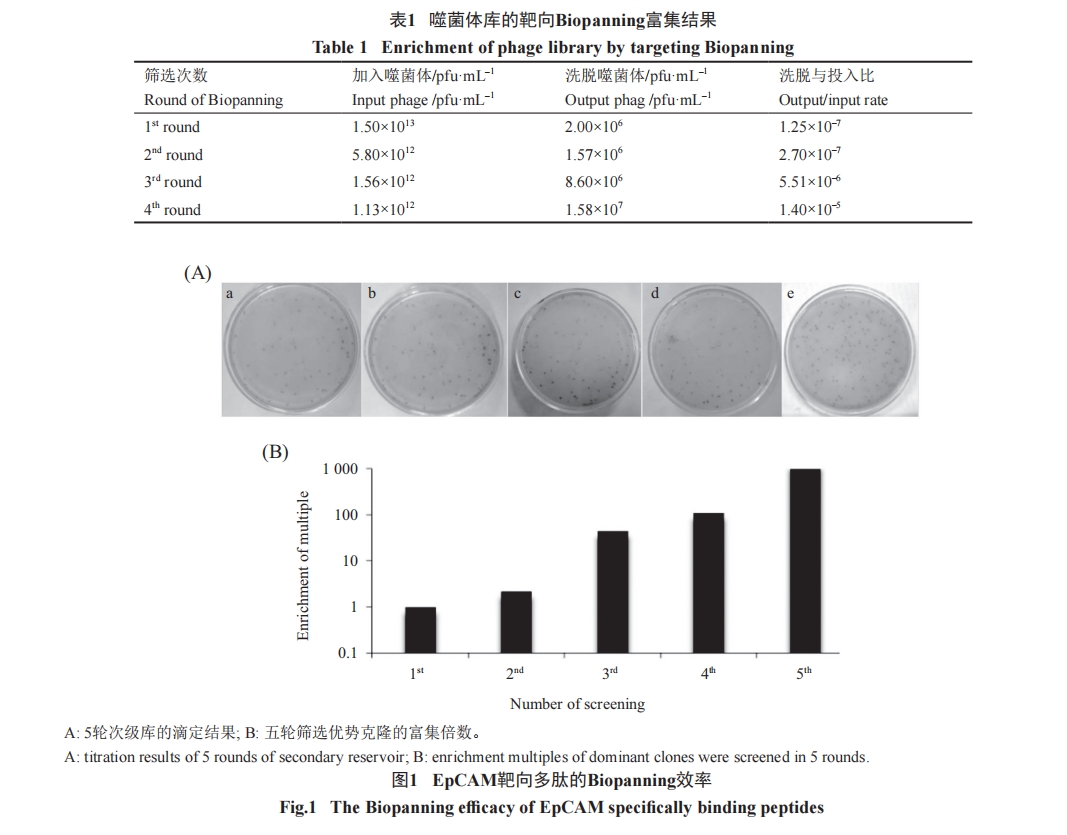
2.2 获得了足够数量的阳性噬菌体克隆
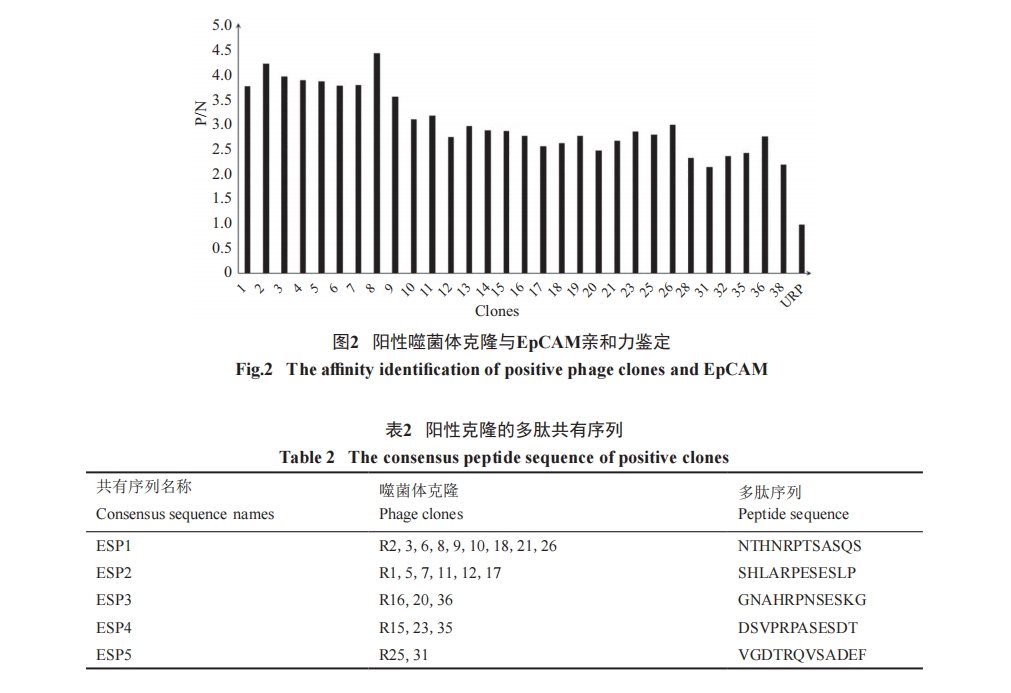
对第5轮筛选的洗脱肽库进行LB/IPTG/Xgal铺板显色, 并随机挑选了47个克隆进行扩增纯化, 利用ELISA方法, 按照阳性克隆界定标准共获得了30个阳性克隆, 对它们进一步的ELISA确认结果如图2所示。
结果确认了30个阳性克隆与EpCAM的结合力, 其中R8克隆结合能力最强。对30个阳性克隆及对照克隆进行测序, 结果分析发现了由23个克隆组成的5个共有序列群如表2所示。
2.3 阳性克隆及最佳克隆对细胞EpCAM具有敏感的特异结合特性
2.3.1 网络分析发现 EpCAM在常见癌细胞 /组织表达水平有明显差异
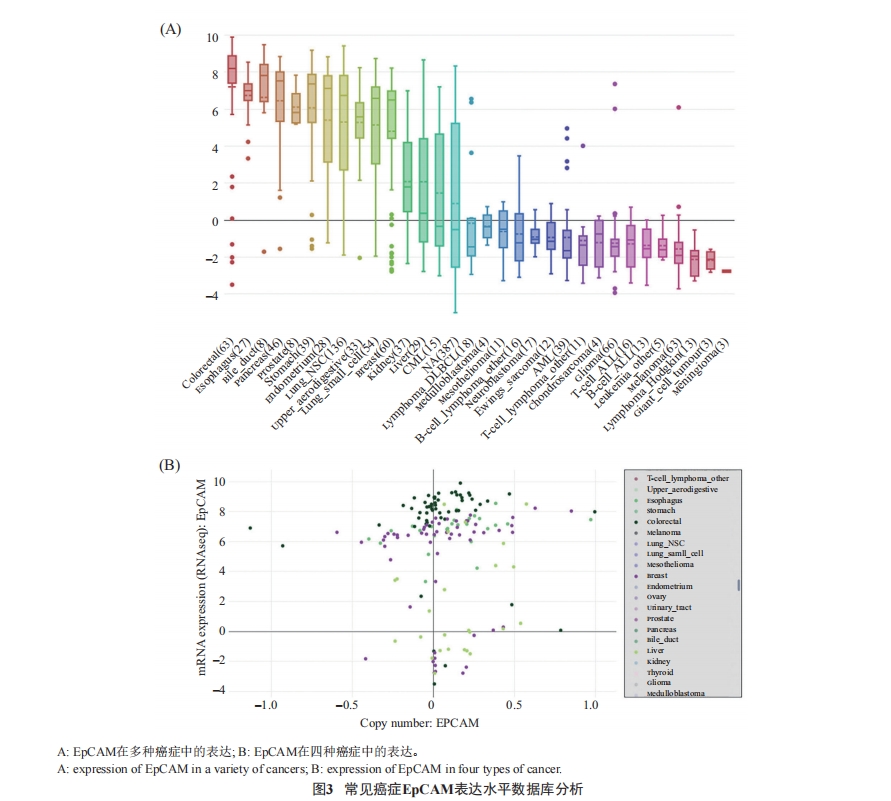
CCLE数据库分析发现EpCAM在常见癌症的表达情况 : EpCAM在乳腺癌、肺癌、食管癌、结直肠癌中表达较高, 而在肝癌、黑色素瘤、胶质瘤、淋巴瘤等癌症中表达较低(图3)。
2.3.2 R8克隆显示了最佳的细胞EpCAM特异性结合力 EpCAM是CSC细胞表面重要的标志物, 而CSC无论是在癌组织还是培养的癌细胞里都是极少数的, 上述数据库分析结果显示, 乳腺癌细胞中EpCAM表达水平相对较高(图3)。所以, 本研究将EpCAM表达水平较高的乳腺癌细胞 MCF-7、EpCAM, 表达水平较低的肝癌细胞HepG2和非癌细胞HEK293进行了细胞水平的噬菌体克隆结合特异性和敏感性的筛选鉴定。
在通过ELISA筛选的5个共有序列克隆群中, 每群选取一个P/N值最高的克隆R8(ESP1)、R5(ESP2)、R16(ESP3)、R15(ESP4)、R25(ESP5)做细胞免疫荧光实验, 进一步验证其与EpCAM在细胞水平上的结合特异性和敏感性, 结果显示, R8克隆(ESP1序列)与MCF-7细胞中EpCAM表达细胞(CSC细胞)的结合敏感性强于其他克隆(图4A)。将图4A中各克隆与MCF-7细胞中EpCAM表达细胞的检测结果局部放大观察, 结果显示, R8克隆与EpCAM的靶向特异性、敏感性最强(图4B)。
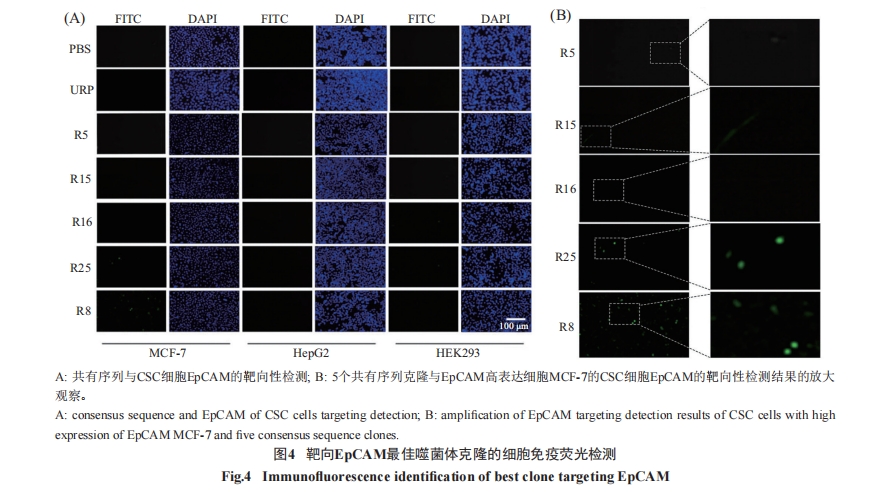
通过以上鉴定, 确定R8代表的ESP1多肽序列为最佳EpCAM靶向序列。
2.4 ESP1序列与EpCAM具有良好的分子模拟对接效应
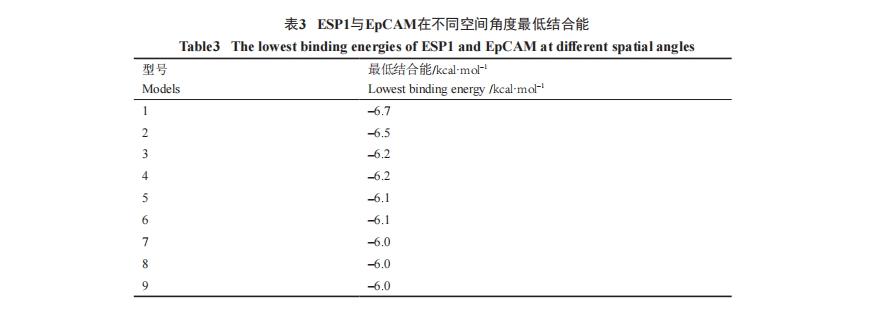
为了进一步确认最佳克隆序列与EpCAM的亲和力, 通过Autodock Vina软件对两者的亲和力进行了Docking模拟测试, 结果显示, ESP1序列与EpCAM分子在空间构型的多个角度都具有良好的对接效应(图5)和表3。
3 讨论
癌化疗药物缺乏靶向性或者靶向性不足导致癌化疗效果不佳是目前癌症临床遇到的主要瓶颈问题之一[28-29], 而癌干细胞(CSC)是导致癌症增生、转移、复发的重要癌细胞群, 目前学界共识是化疗应尽可能地杀灭CSC[14-15]。EpCAM是CSC表面重要的标志性分子之一, 可能与癌的侵袭、转移等恶性表型的产生有密切关系, 可以作为CSC的靶向标志物[14-15]。多肽分子具有低毒、分子量小、低免疫原性、结构简单、对肿瘤的高渗透性及易于被修饰等特点, 是被寄以厚望的癌靶向导向元件选择[16-19], 多肽可以与纳米材料、纳米药物等偶联而赋予其癌细胞/组织靶向特性从而进行肿瘤的靶向递送和治疗[30-33]。靶向多肽还可以被荧光素、同位素等标记而成为特异性探针, 用于癌症的早期分子影像诊断, 对于“早发现、早治疗”的癌防治策略具有重要意义[34]。但这些都取决于特异、敏感的多肽片段的获得。
本研究以EpCAM为Biopanning的靶分子, 从NEB12肽库以改良的Biopanning流程进行了5轮消减富集筛选, 以ELISA方法从末轮富集库随机挑选的47个克隆中鉴定了30个阳性克隆(图2), 通过测序获得了5条共有序列(ESP1、ESP2、ESP3、ESP4、ESP5)(表2)。
CSC无论是在癌组织还是培养的癌细胞里都是极少数, 其标志物EpCAM在各种癌细胞/组织中的表达水平差异较大, 在乳腺癌细胞/组织中表达水平较高(图3), 所以本研究选用EpCAM表达水平较高的乳腺癌细胞MCF-7和表达水平较低的肝癌细胞HepG2以及非癌细胞HEK293, 通过细胞免疫荧光实验检测了5个共有序列对乳腺癌细胞CSC细胞EpCAM的结合特异性和敏感性, 发现ESP1(R8)、ESP5(R25)序列对EpCAM高表达细胞(CSC细胞)具有明显的结合特异性和敏感性(图4A), 把5个共有序列克隆对MCF-7的检测结果进行放大处理的结果(图4B)显示ESP1(R8)序列的特异性和敏感性明显强于ESP5(R25), 从而确定其为最佳EpCAM靶向12肽序列。
以分子空间模拟构型的对接(docking)对ESP1与EpCAM的靶向亲和力进行的分析显示, ESP1肽序列在EpCAM分子不同空间构型角度都对EpCAM具有良好的靶向结合力(图5)。
以上研究结果充分显示了多肽序列 ESP1的EpCAM也即CSC的靶向结合特异性和敏感性, 这些特点赋予了ESP1在未来新型癌靶向化疗药物研发方面重要的使用价值, 通过对CSC的靶向杀伤, 有可能达到改善癌化疗效果、降低癌转移和复发的目标。
4 结论
本文以EpCAM为Biopanning靶分子, 从噬菌体12肽库筛选、鉴定获得了对CSC细胞EpCAM具有良好靶向特异性和敏感性的12肽序列ESP1, 细胞水平的检测和分子空间构型的模拟预测都证实了该多肽片段对CSC细胞EpCAM具有良好靶向性。该研究结果为未来高效、低毒、抗复发的新型癌症靶向化疗药物的研发提供了一个重要的靶向元件选择。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志






