
[摘要]:目的 探讨两条肿瘤靶向抑制肽(QKRKRKKSRKKH、RKRKRKKSRYIVLS)经化学修饰后(N端乙酰化、C端酰胺化)的稳定性,并初步探讨其作用靶点。方法 3H-TdR掺入法、CCK-8法分别探讨多肽修饰前后对A549细胞增殖、活力的影响;高效液相色谱法(HPLC)测定多肽在10%血清条件下,不同时间点(12、24 h)的剩余量,评价其修饰前后在血清中的稳定性;构建GST标签的多肽(GST-多肽)融合蛋白表达载体,在大肠杆菌中诱导表达、纯化;免疫共沉淀法鉴定GST-多肽融合蛋白能否与VEGFR-1、VEGFR-2结合。结果 多肽RKRKRKKSRYIVLS经化学修饰后在10%血清环境下对A549细胞增殖的抑制率由(2.63±6.19)%提高至(48.50±7.14)%(P<0.01),对A549细胞活力的抑制率由(1.30±7.90)%提高至(20.80±5.90)%(P<0.01),24 h后多肽在血清中的剩余量由(56.04±1.81)%提高至(64.64±0.30)%(P<0.01);多肽QKRKRKKSRKKH化学修饰前后在10%血清环境下对A549细胞增殖的抑制率分别为(28.38±5.63)%、(34.25±10.90)%(P>0.05),对A549细胞活力的抑制率分别为(8.09±5.84)%、(15.07±8.09)%(P>0.05),24 h后多肽在血清中的剩余量由(72.72±2.60)%提高至(77.43%±1.78)% (P<0.05);免疫共沉淀表明这两条多肽均能与VEGFR-1、 VEGFR-2结合。结论 VEGFR-1、VEGFR-2为这两条肿瘤靶向抑制肽的作用靶点;多肽RKRKRK KSRYIVLS、QKRKRKKSRKKH修饰后在血清环境下稳定性明显提高,修饰后的RKRKRKKSRYIVLS对A549细胞增殖及活力的抑制能力明显增强。
血管内皮生长因子(vascular endothelial growth factor,VEGF)为促血管生成最主要的因子,能够促进肿瘤的发生、发展及转移。本课题组此前运用生物信息学对VEGF片段VEGF125-136进行改造、筛选得到两条全新多肽QKRKRKKSRKKH、RKRKRKKSRYIVLS。初步研究发现这两条多肽在无血清环境下能够明显抑制肺腺癌细胞株A549的增殖、多肽经放射性核素99mTc或188Re标记后能够靶向聚集于荷A549裸鼠的肿瘤部位,提示这两条多肽有望作为分子探针或靶向药物用于肿瘤的分子显像及靶向治疗[1, 2, 3],但其确切作用靶点尚需进一步探讨。本研究旨在对这两条肿瘤靶向抑制肽进行化学修饰,进一步提高其在血清中的稳定性,并对其可能的作用靶点进行初步探讨,即能否与血管内皮生长因子受体(VEGFR)结合、是与VEGFR-1还是VEGFR-2结合,为其用于肿瘤的分子显像或靶向治疗奠定基础。
1 材料与方法
胎牛血清(HyClone),DMEM培养基(HyClone)、A549细胞(中国科学院上海典藏细胞库)、GST抗体(碧云天)、VEGFR-1与VEGFR-2抗体(Santa Cruz,美国)、Protein A+G Agarose(Santa Cruz,美国)、3H-TdR (中科院上海原子核研究所)、CCK-8(碧云天)、蛋白电泳常规设备由第三军医大学西南医院中心实验室提供。
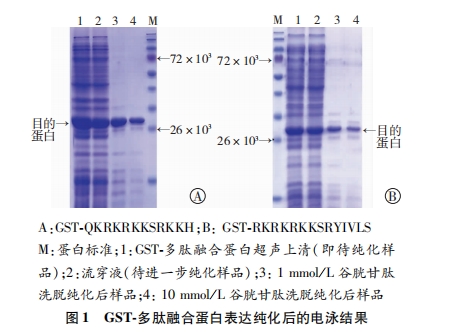
常规固相法合成多肽QKRKRKKSRKKH、RKRKRKK-SRYIVLS,化学修饰法对多肽N端乙酰化(Ac)、C端酰胺化(NH2),分别得到Ac-QKRKRKKSRKKH-NH2、Ac-RKRKRKKSRYIVLS-NH2。GST-多肽融合蛋白表达及纯化的简要步骤如下:体外人工合成编码多肽的全长基因,并定向插入到pGEX4T-1载体中,构建原核表达质粒pGEX4T-1-多肽,测序正确后转入大肠杆菌诱导表达,超声破碎后Glutathione Sepharose 4B进行纯化,蛋白电泳鉴定融合蛋白的表达、纯化效果。
A549细胞接种于75 cm2细胞培养瓶,密度约为1×104个/mL,共15 mL,DMEM培养基(含10%胎牛血清)常规培养。24 h后每个培养瓶中分别加入相应的GST-多肽融合蛋白GST-QKRKRKKSRK KH及GST-RKRKRKKSRYIVLS,其终浓度分别为80、185 nmol/L。继续培养12 h后弃培养基,PBS洗涤细胞1次,加入含蛋白酶抑制剂的IP细胞裂解液,4 ℃,30 min后离心,收集上清并行蛋白定量。取600 μg样品,加入1 μg GST抗体或VEGFR-1抗体或VEGFR-2抗体为实验组,1 μg IgG为阴性对照,4 ℃摇晃过夜。加入20 μL Protein A+G Agarose,4 ℃摇晃3 h,离心弃上清,IP细胞裂解液洗涤沉淀5次,弃上清,用1×SDS-PAGE上样缓冲液重悬沉淀,煮沸冷却后行SDS-PAGE电泳分离,转膜至PVDF,5%脱脂奶粉封闭2 h,TBST洗膜3次,一抗即VEGFR-1抗体或VEGFR-2抗体或GST抗体4℃孵育过夜,TBST洗膜3次,加入辣根过氧化物酶标记的二抗,室温下孵育2 h。TBST洗膜3次后ECL显影。
A549细胞接种于96孔板,约5 000个/孔,总体积100μL,DMEM培养基(含10%胎牛血清)常规培养24 h后弃上清。灭菌PBS洗涤细胞2次后加入DMEM培养基,血清终浓度分别为0%、10%,每孔(5个平行孔)分别加入修饰前后的多肽(终浓度240 μmol/L),空白对照加入相同体积PBS,总体积100 μL/孔,培养18 h后加入3H-TdR,37 kBq/孔,培养6 h。弃培养液,200 μL PBS洗涤2次,40 μL胰酶充分消化后加入超纯水200 μL/孔,静置20 min,多头细胞样品收集器收集细胞于玻璃纤维滤纸,双蒸水洗涤9次,次氯酸固定2次,80 ℃,40 min烘干,滤纸置于膜片闪烁液,避光2 h,液闪仪测量放射性计数率并换算成衰变率(Bq)。抑制率=(对照组Bq-实验组Bq)/对照组Bq×100%。
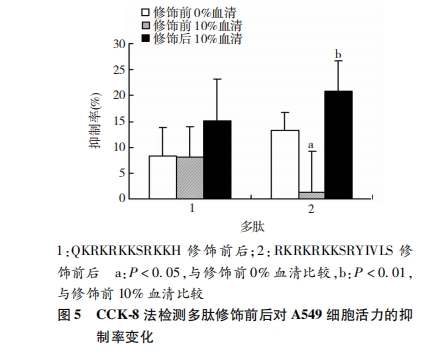
抑制率=[对照组D(450)值-实验组D(450)值]/对照组D(450)值×100%
A549细胞接种于96孔板,约5 000个/孔,总体积100 μL,DMEM培养基(含10%胎牛血清)中培养24 h后弃上清、灭菌PBS洗涤细胞。实验组加入DMEM培养基(含10%胎牛血清)、修饰前后多肽(终浓度240 μmol/L,总体积100 μL/孔,5复孔),继续培养12、24 h后分别取50 μL样品进行HPLC分析,得到实验组多肽浓度(μmol/L)。另设0 h组:DMEM培养基中不含胎牛血清,加入多肽后立即用HPLC法测量多肽浓度,其余同实验组。计算多肽剩余百分比=实验组多肽浓度(μmol/L)/0 h组多肽浓度(μmol/L)×100%。
数据以x±s表示,采用SPSS 19.0统计软件进行数据处理,两组计量资料采用独立样本t检验,多组计量资料数据采取单因素方差分析,组间两两比较采用LSD法。
2 结果
成功合成目标多肽并经化学修饰得到Ac-QKRK RKKSRKKH-NH2、Ac-RKRKRKKSRYIVLS-NH2,HPLC纯化,质谱鉴定,纯度达95%以上。

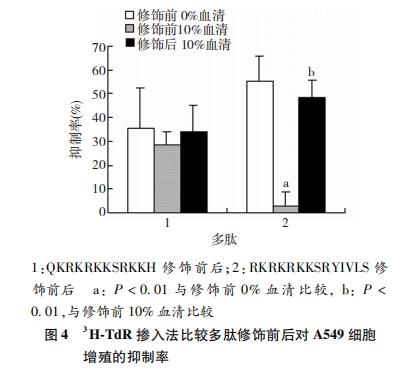
培养基中不含血清时,多肽RKRKRKKSRYIVLS对A549细胞活力的抑制率为(13.24±3.59)%,当培养基中血清浓度为10%时,RKRKRKKSRYIVLS对A549细胞活力的抑制率降为(1.30±7.90)%,修饰后提高至(20.80±5.90)%,三者间差异有统计学意义 (P<0.01),即多肽在10%血清环境下对A549细胞活力的抑制能力明显下降(P<0.05),经修饰后抑制能力明显提高(P<0.01,图 5),提示RKRKRKKSRYIVLS易被血清降解,经修饰后在血清中的稳定性明显提高。
3 讨论
肿瘤的发生、发展与血管生成密切相关,VEGF是促血管生成最主要的因子,其受体VEGFR高表达于肿瘤细胞及新生血管内皮细胞,在其他细胞中低表达或不表达,抑制VEGF/VEGFR通路能明显抑制肿瘤细胞的生长与转移,提示VEGF/VEGFR通路为肿瘤分子显像及靶向治疗的重要靶点[4, 5, 6, 7]。本课题组前期运用生物信息学方法对VEGF片段VEGF125-136改造,并经生物学实验筛选得到两条全新多肽QKRK-RKKSRKKH、RKRKRKKSRYIVLS,这两条多肽不但不会促进肿瘤细胞的增殖,反而在无血清环境下对A549细胞增殖的抑制能力分别达到了35.58%、55.49%,且荷瘤裸鼠SPECT显像表明其具有肿瘤靶向性[1, 2, 3]。
这两条多肽具有肿瘤靶向性,且能够明显抑制肿瘤细胞的增殖,但其作用靶点尚不十分清楚,而作用靶点的阐明对其用于肿瘤的分子显像及靶向治疗至关重要。课题组前期通过生物信息学方法预测发现,这两条多肽理论上的作用靶点可能包括VEGFR、EGFR、αvβ3、FLT-3、HGFR、Tie-2、VIPR-2等。GST融合蛋白作为工具蛋白被广泛应用于分子生物学研究,有研究报道可用于免疫共沉淀[12],本研究通过对多肽与GST进行融合表达,得到可溶性融合蛋白GST-QKRKRK KSRKKH、GST-RKRKRKKSRYIVLS,然后采用免疫共沉淀法证实这两条多肽均能与VEGFR-1、VEGFR-2结合,即VEGFR-1、VEGFR-2为这两条多肽的作用靶点,多肽可能通过封闭VEGFR-1、VEGFR-2对 A549细胞增殖起抑制作用。是否还存在VEGFR-1、VEGFR-2之外的其他作用靶点是下一步研究的方向。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志