
摘要:二硫键是一种与多肽及蛋白质结构和功能密切相关的化学键. 当多肽中存在多个半胱氨酸时, 形成的二硫键可能会存在多种配对方式. 快速且精准地定位多肽中多对二硫键对研究多肽的结构与功能间的关系十分重要. 本文开发了一种基于化学裂解和生物质谱的新方法, 对利那洛肽中3对二硫键进行了精准定位. 通过解析裂解后特异肽段的二级质谱图, 确定利那洛肽中3对二硫键的配对方式分别为Cys1-Cys6, Cys2-Cys10和Cys5-Cys13. 该方法为二硫键的定位研究提供了新思路.
二硫键(Disulfide bond)是多肽和蛋白质中一种常见的翻译后修饰, 它是氨基酸序列中2个半胱氨酸(Cysteine)残基的巯基基团(—SH)发生氧化反应失去2个氢(H)形成的共价键(—S—S—). 二硫键并不是非常稳定, 氧化形成的二硫键也可以被还原形成游离的巯基, 所以通常二硫键是动态变化的化学键[1]. 二硫键广泛存在于多肽和蛋白质中, 并不局限于蛋白质的大小、 功能和类型. 对于小于50个氨基酸的多肽, 可能含有少量的二硫键; 而对于一些大的蛋白质, 可能含有成百上千个二硫键[2]. 蛋白质和多肽中的二硫键对其热力学、 力学和化学稳定性至关重要, 同时也参与对蛋白酶的抗性和活性的调节[3]. 精准、 快速地定位蛋白质和多肽中二硫键配对方式是研究其结构与功能的重要内容之一.
早期定位二硫键的主要方法分为非片段法和片段法[4]. 非片段法包括 X 射线衍射晶体结构解析法和多维核磁共振波谱法等, 它们可以提供分子水平上的二硫键信息[3], 其最大的优势为检测方式非破坏性, 可以实现样品的重复利用[5]; 非片段法检测时需要的样品量较大且纯度要求较高, 由于该方法提供的结构信息有限, 所以不作为二硫键定位的典型方法. 片段法包括对角线法、 二硫键异构及突变分析法、 酶解法、 化学裂解法、 部分还原测序法和氰化半胱氨酸裂解法等[3]. 酶解法的应用种类繁多, 包括2种酶交叉酶切[6]、 复合酶切[7]及3种酶交叉组合[8]等方式, 可实现对蛋白或多肽碎裂的目的. 但是酶解法也有一定的局限性, 多数酶解的实验条件偏碱性, 会增加二硫键交换几率, 且一些蛋白质可能抗酶解或含有邻位Cys, 因而不适用于酶解法. 从虎纹捕鸟蛛粗毒中分离得到的多种虎纹捕鸟蛛毒素就属于不适合酶解法的多肽, 采用部分还原和分步序列测定法可有效解决此问题[9,10], 但是该方法的缺点是步骤多、 会产生中间产物且工作量大. 此外, 酶切质谱法联合氰基化裂解法也可以实现对临位Cys的二硫键的定位研究[11].
上述方法都属于Bottom-up法, 而传统的Top-down法不适用于二硫键的定位研究, 主要原因是二硫键封闭区域的碎片化不充分, 碎片提供的结构信息不足. 新的电子转移/高能碰撞解离技术可以提高碎片化效率, 使得Top-down法应用于二硫键定位研究成为可能. 该方法减少了对多肽或蛋白的前期处理, 简化了实验流程, 能更直观地表征二硫键的链接方式[18]. 但是, 该方法的缺点是仅限于多肽内单个二硫键, 对于多对二硫键的定位效果不佳.
利那洛肽是首个治疗便秘的鸟苷酸环化酶C激动剂[19,20], 它是由14个氨基酸构成的多肽, 其序列为H-Cys-Cys-Glu-Tyr-Cys-Cys-Asn-Pro-Ala-Cys-Thr-Gly-Cys-Tyr-OH, 其中含有6个Cys, 可形成3对二硫键, 在如此短的序列中可能存在的配对方式有15种. 在人工合成的过程中很重要的一个环节就是高效、 快速、 准确地完成二硫键的正确配对, 同时避免生成副产物影响其结构和功能[21,22,23]. 为了开发一种快速且精准地定位多对二硫键的方法, 本文以利那洛肽作为研究样本, 发展了一种基于化学裂解和生物质谱的新方法. 首先, 在酸性条件下用三(2-羧乙基)膦(TCEP)对利那洛肽部分还原, 用1-氰基-4-二甲氨基吡啶四氟硼酸酯(CDAP)进行氰基衍生化反应; 随后, 在碱性条件下进行化学裂解; 最后, 对碎裂肽段进行质谱检测, 所得谱图结果经人工分析明确多肽二硫键的配对方式.
1 实验部分
5800型基质辅助激光解吸电离飞行时间质谱仪(MALDI-TOF-MS, 美国AB SCIEX公司); 液相色谱-质谱联用系统: 液相系统为NanoAquity系列超高压液相色谱(美国Waters公司), 质谱检测系统为Q-Exactive系列四级杆-静电场轨道阱质谱(Quadrupole-Orbitrap, 美国Thermo Scientific公司); Centrifuge 5424型冷冻离心机(德国Eppendorff公司).
化学裂解反应在1 mol/L NH3·H2O溶液中进行. 取20 μL盐酸胍溶液(6 mol/L盐酸胍+1 mol/L NH3·H2O)复溶制备的冻干样品, 加入 50 μL 1 mol/L NH3·H2O溶液, 于25 ℃恒温静置反应1 h. 反应结束后, 立即将样品冷冻抽干. 最后, 加入50 μL TCEP溶液(0.1 mol/L)复溶冻干的样品, 于37 ℃恒温静置反应30 min.
1.2.3 MALDI-TOF质谱检测 选择10 mg/mL CCA溶液作为基质, 分别将还原前、 后的利那洛肽溶液与基质混合并取0.75 μL点在靶板上, 自然干燥后, 采用串联飞行时间质谱仪进行质谱分析, 激光源为335 nm波长的Nd:YAG激光器, 加速电压为20 kV, 分别采用正离子模式和自动获取数据的模式采集数据. 质谱仪先用Myoglobin酶解肽段进行外标校正. 样品反射模式质量扫描范围为800~3000. 对实验得到的谱图采用Data Explorer软件进行处理和分析.
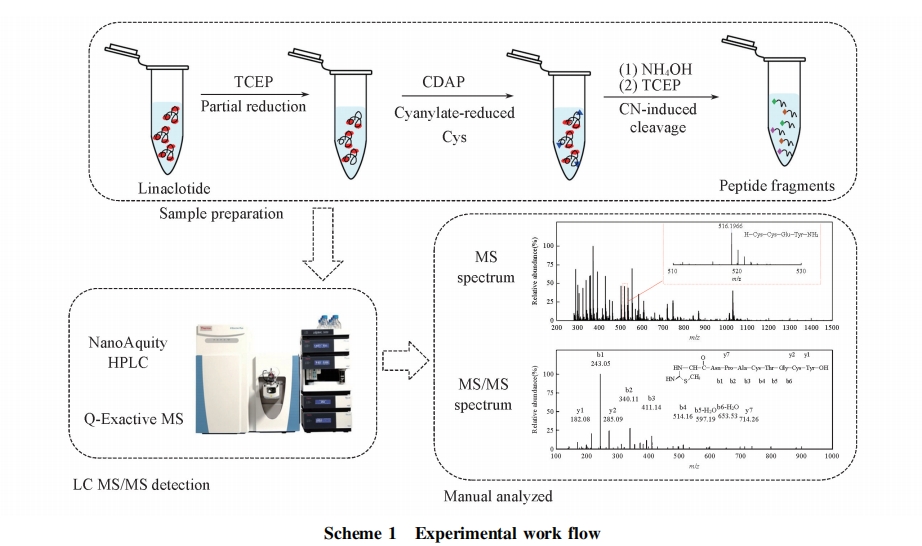
1.2.4 Q-Exactive液相色谱-质谱联用检测 将待测样品用流动相A稀释至10 pmol/μL. 液相系统色谱柱为PepMap C18(75 μm ×25 cm), 柱温为45 ℃. 流动相A为水相(含0.1% FA), 流动相B为有机相ACN溶液(含0.1% FA); 色谱流速为300 nL/min; 洗脱梯度为0~55 min 95%~70%A, 5%~30%B; 上样量为2 μL. 质谱扫描方式为正离子模式, 数据采集方式为数据依赖模式, 在一级全扫描和二级碎片离子扫描间进行自动切换. 一级扫描使用Orbitrap轨道离子阱, 扫描范围为m/z 200~2000, 分辨率为70000. 随后进行二级扫描, 自动选择一级强度前10位的母离子进行碎裂并用Orbitrap进行扫描, 碎裂方式为高能碰撞解离, 扫描起始范围为m/z 110, 分辨率为17500, 扫描采用动态排除模式, 动态排除时间为30 s. 最后, 用 Xcalibur Qual Browser打开质谱产生的原始RAW文件, 按照肽段的理论碎裂方式人工查找目标离子的一级和二级质谱图.
2 结果与讨论
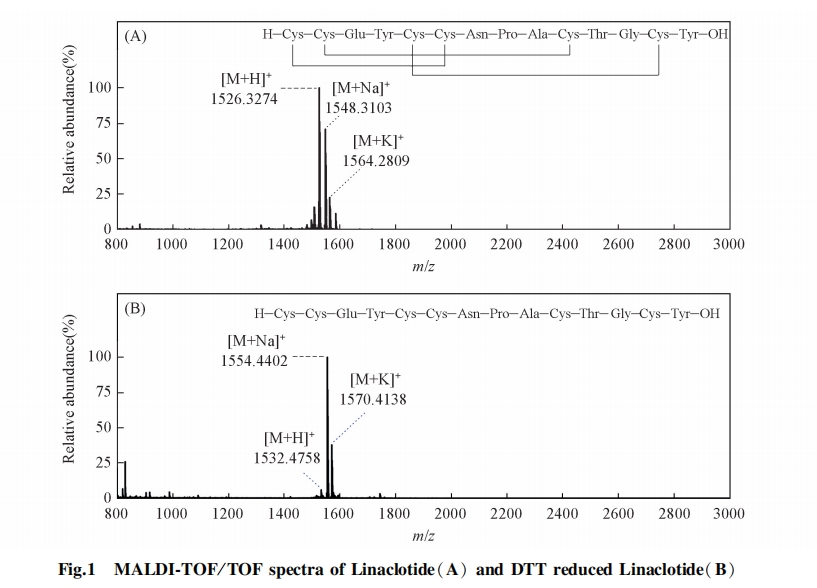
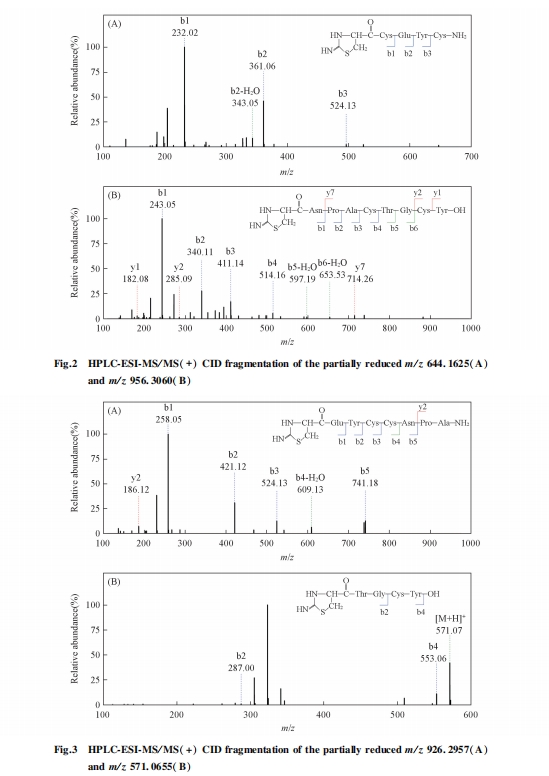
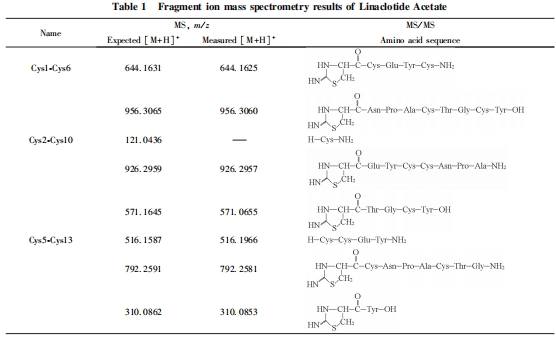
在确认利那洛肽存在3对二硫键后, 采用部分还原、 化学裂解结合生物质谱的方法对二硫键进行了定位研究. 多肽在酸性条件下加入还原剂TCEP会发生部分还原反应, 形成仅有1对二硫键被还原的3种结构形式. 在加入CDAP进行衍生化反应后, S原子连上1个氰基生成—SCN, 在碱性条件下裂解. 然后, 在部分还原条件下, 连有氰基的Cys左侧断裂形成新的肽段片段, 末端的Cys形成新的五元环[24,25]. 最后, 利用质谱分析这些新的肽段片段, 从而对多肽中二硫键进行定位. 对于含有3对二硫键的利那洛肽, 经过部分还原、 氰基化和碱性条件下化学裂解反应后, 理论上共计可以产生8个片段离子, 不同配对方式所产生8个片段离子的组合方式不同.
首先, 对部分还原后化学裂解样品的一级质谱进行分析, 找到肽段片段的母离子峰, 根据母离子的组合方式推测出潜在的二硫键配对方式. 然后, 对这些片段离子进行串联质谱分析, 确认这些片段离子对应的氨基酸序列.
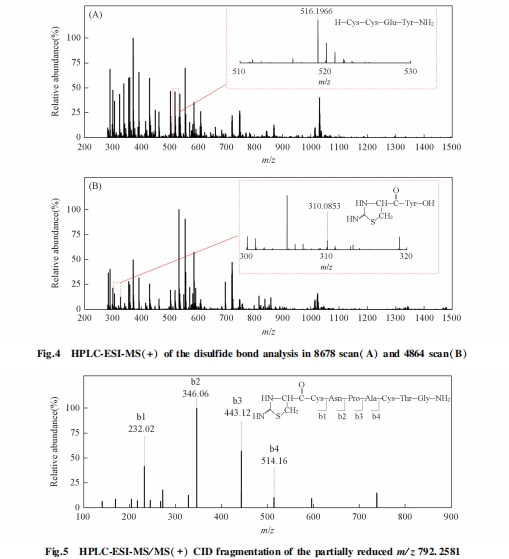
3 结论
构建了一种部分还原、 化学裂解结合生物质谱的新方法, 对利那洛肽中3对二硫键配对方式进行了精准定位. 通过还原前后利那洛肽分子量与氨基酸序列理论分子量的对比, 揭示其存在3对二硫键; 通过串联质谱分析解析了化学裂解后片段的序列信息及对应的二硫键配对信息. 实验结果显示, 利那洛肽的3对二硫键配对方式为Cys1-Cys6, Cys2-Cys10和Cys5-Cys13. 该方法具有样品需求量少、 耗时短、 步骤简单、 可操作性强、 重现性好及适用范围广等特点, 为多肽二硫键的配对定位分析提供了新思路.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志