
摘要:目的 研究蜂毒肽(Melittin,Mel)与依布硒啉(Ebselen,EbSe)对 金 黄 色 葡 萄 球 菌(Staphylococcusaureus,S.aureus)的协同抗菌活性和机制。方法 96微孔板实验结合分光光度法(visiblespectrophotometry,UV-vis)检测蜂毒肽-依布硒啉的抗金黄色葡萄球菌作用;电子显微镜(electronmicroscopy,EM)观察蜂毒肽-依布硒啉处理后金黄色葡萄球菌的细胞形态。通过5,5'-二硫代双(2-硝基苯甲酸)[5,5'-Dithiobis-(2-nitrobenzoicacid),DTNB]获得电子后显色的能力,观察蜂毒肽-依布硒啉对细菌硫氧蛋白还原酶(thioredoxinreductase,TrxR)活性的影响。通过流式细胞术(flowcytometry,FCM)检测蜂毒肽-依布硒啉对细菌胞内活性氧(reactiveoxygenspecies,ROS)产量的影响;使用活性氧清除剂二硫苏糖醇(dithiothreitol,DTT)复测上述指标。结果 蜂毒肽与依布硒啉具有协同杀菌作用,可协同抑制金黄色葡萄球菌 TrxR,显著上调金黄色葡萄球菌胞内活性氧产量。DTT挽救实验证明蜂毒肽-依布硒啉对细菌造成损伤是通过活性氧途径实现。结论 蜂毒肽可通过协同依布硒啉靶向金黄色葡萄球菌 TrxR,上调胞内活性氧的大量产生,介导细菌死亡。
金 黄 色 葡 萄 球 菌 (Staphylococcusaureus,S.aureus)是导致人类感染性疾病中最常见的病原菌之一[1]。流行病学调查显示,由金黄色葡萄球菌引起的感染占临床感染性疾病的第2位,仅次于大肠埃希菌[2]。而近年来越来越多耐药性金黄色葡萄球菌菌株的出现,已然成为临床治疗感染性疾病的棘手难题之一[3]。遗憾的是,目前大多一线抗生素已无法从容应对临床上日益严重的金黄色葡萄球菌感染现状。鉴于上述情况,找寻高效安全的抗生素或先导药物,已成为当今医疗卫生领域的迫切需求。
蜂毒肽(Melittin,Mel)是一种水溶性多肽,是蜂毒的主要活性成分。研究发现小剂量的蜂毒肽可产生广泛的抗炎作用[4-7]。不仅如此,蜂毒肽还对金黄色葡萄球菌、大肠埃希菌[8]甚至耐甲氧西林金黄色葡 萄 球 菌 (Methicillin-resistantStaphylococcusaureus,MRSA)等多种细菌表现出抗菌活性。且已有研究发现,与传统抗生素的联合使用可进一步提高蜂毒肽的抗菌活性[9],但其机制并不明确,仍待研者们进一步探索。
本团队长期致力于抗菌活性物质及其新靶标的筛选研究工作[10-16],且前期已以硫醇氧化还原系统(thiol-dependentredoxsystem,TDRS)作 为 靶 标,筛选出含硒化合物-依布硒啉(Ebselen,EbSe)。而我们的研究发现,依布硒啉可通过与金黄色葡萄球菌 的 硫 氧 还 蛋 白 还 原 酶 (thioredoxinreductase,TrxR)形成难以还原的硒硫键,以阻断电子流传递,破坏细菌胞内氧化还原稳态,诱导细菌死亡[13];同时,依布硒啉在哺乳动物细胞中则可作为宿主细胞TrxR的底物,帮助电子流的传递,维持细胞内氧化还原平衡[17]。此外,依布硒啉是一种已进入Ⅲ期临床试验的药物,具有良好的人体耐受性及生物安全性[18],是理想的抗菌活性候选药物。
基于团队前期研究基础,本文以金黄色葡萄球菌为研究对象,探究蜂毒肽的抗菌活性,并进一步探讨其是否可与依布硒啉共同靶向 TrxR 发挥协同抗菌活性。
1 材料与方法
金 黄 色 葡 萄 球 菌 (Staphylococcusaureus,S.aureus)ATCC25923TM 菌株,多重耐药金黄色葡萄球菌1072763、0883453、1074029菌株,由宜昌市中心人民医院检验科提供。根据细菌的起始数量不同,本文涉及到的不同实验选用低浓度药物组(2.5μmol/L蜂毒肽与1μmol/L依布硒啉)和高浓度药物组(10μmol/L 蜂毒肽与40μmol/L 依布硒啉)。其中,最小抑菌浓度,抗生素后效应及 DTT 挽救实验使用菌量较小,选用低浓度药物组;而5,5'-二硫代双(2-硝基苯甲酸)(DTNB)、透射电镜,流式细胞术实验所用菌量较大,选用高浓度药物组。
恒 温 培 养 箱 (中 国 BPX-52);恒 温 摇 床 (中 国TS-100C);-80℃超低温冰箱(美国 ThermoFisherScientific);纯水仪(美国 Milli-QIntegral);移液器(德国 Eppendorf);锥形瓶(中国蜀牛);瞬时离心机(德国 TOMOS);微型离心机(美国 Bio-Rad);电子天平(中国 TE212-L/TE2101-L);振荡混匀仪(美国 Vortex-2GenieSI);金属接种环(中国生工)。
依布 硒 啉 (美 国 Target MoleculeCorp;货 号60940-34-4;批 号 20210506);蜂 毒 肽 (美 国 Sell-eck);蛋白胨(英国 OXOID);酵母提取物(英国 OXOID);二甲基亚砜(Sigma-Aldrich);琼脂糖(西班牙BIOWEST),甘 油 (中 国 塞 维 尔 生 物 科 技 有 限 公司);硫氧还蛋白(瑞典IMOC);BCA 蛋白定量试剂盒(中国普利莱)。
取高压灭菌过后的洁净枪头,从生长金黄色葡萄球菌 ATCC25923TM 、1072763、0883453、1074029菌株的固体溶菌肉汤(Luria-Bertani,LB)培养基平板上挑取单克隆,分别置于提前分装好的 LB 培养液中,摇床培养8h(37 ℃,180r/min),取第二代对数生长期菌液用于后续实验。
取上述1.4金黄色葡萄球菌 ATCC25923TM ,用 LB培养液调整至 A600nm =0.4,按1∶1000稀释混匀后,加入不同浓度梯度的蜂毒肽、依布硒啉、蜂毒肽-依布硒啉混匀,处理完成后,转移混合液至96微孔板,每孔200μL。置于37 ℃恒温培养箱进行连续培养,并在不同时间点于酶标仪上测定 A600nm。
根据Bliss独立模型计算协同指数,以确定蜂毒肽与依布硒啉是否具有协同杀菌活性,使用计算公式如下[19]:S =(Fx/F0)(Fy/F0)-(Fxy/F0)。F0:无药物作用下细菌生长速率;Fx,Fy:x、y药物单独作用下细菌生长速率;Fxy:x、y药物联合作用下细菌生长速率;S:协同指数(S值大小在0 ~ 1之间表示两者具有协同作用,且数值越接近1表示两药协同作用越强)。
取上述1.4金黄色葡萄球菌 ATCC25923TM ,用 LB培养液调整至A600nm=0.4,分别加入蜂毒肽、依布硒啉、蜂毒肽-依布硒啉,置于37 ℃恒温培养箱孵育10min。4℃,8000r/min,5min离心处理后,弃去上清并用 PBS重复洗涤3次,2.5%戊二醛固定 PBS 重 悬 液,使 用 电 镜 (electron microscopy,EM)观察细菌形态结构,采集图像并保存。
取上述1.4金黄色葡萄球菌 ATCC25923TM ,用 LB培养液调整至 A600nm =0.4。1∶1000稀释混匀后,与不同浓度梯度的蜂毒肽、依布硒啉、蜂毒肽-依布硒啉孵育。处理完成后,转移混合液至96微孔板,每孔200μL。置于37 ℃恒温培养箱孵育24h,于酶标仪上每间隔2h测定A600nm。将96微孔板内菌液转移至1.5mLEP管中,4 ℃,8000r/min,离心5min处理后,弃去上清并用PBS重复洗涤3次。加入200μLLB培养液重悬菌体,重新置于96微孔板。于37 ℃恒温培养箱内孵育6h,于酶标仪上每间隔1h测定 A600nm。
取 上 述 1.4 中 金 黄 色 葡 萄 球 菌 ATCC25923TM ,用 LB培养液调整至A600nm=0.4。分别加入蜂毒肽、依布硒啉、蜂毒肽-依布硒啉,置于37 ℃恒温培养箱孵育10min。4 ℃,8000r/min,离心5min处理后,弃去上清并用 PBS重复洗涤3次。加入200μL裂解液(50mmol/LTris-HCl,2mmol/LEDTA,pH7.5)重悬菌体后,超声5min直至菌液澄清(2mm 变幅杆,20%功率。频率为超声3s,间隔6s),全程冰上操作。离心处理(4 ℃,10000r/min,20min)后取上清。取10μL 蛋白液按1∶10稀释后作为蛋白量待测样本。取标准 BSA 蛋白样品,依次稀释为 1 mg/mL、0.5 mg/mL、0.25 mg/mL、0.125 mg/mL、0.0625 mg/mL、0 mg/mL,取25μL标准蛋白样品、待测样品及200μLBCA 工作液加入96微孔板中混匀,置于37℃恒温培养箱内30min后,酶标仪上测定 A562nm。绘制标准曲线计算每组待测样品浓度,进行标记。
取待测样本(含25μg蛋白)定容至20μL,与90μL1 mmol/L DTNB、5μmol/L 硫 氧还蛋白(Trx)、200μmol/L NADPH,在50 mmol/L TrisHCl、2mmol/LEDTA(pH7.5)体系中反应。酶标仪上连续测定前10 min 的 A412nm,计 算 斜 率 代 表TrxR活性。同时,取待测样本(含25μg蛋白)定容至20μL,与90μL1mmol/LDTNB、100nmol/LTrxR、200μmol/L NADPH,在 50 mmol/L Tris-HCl、2mmol/LEDTA(pH7.5)体系中反应。酶标仪上连 续 测 定 前 10 min 的 A412nm,计 算 斜 率 代 表Trx活性。
取上述1.4 中金黄色葡萄球菌ATCC25923TM ,用LB培养液调整至 A600nm=0.4。加入蜂毒肽、依布硒啉、蜂毒肽-依布硒啉,置于37 ℃恒温培养箱孵育10min。4 ℃,8000r/min,离心5min处理后,弃 去 上 清 用 PBS 重 复 洗 涤 3 次,最 后 用PBS重悬。将10mmol/L活性氧荧光探针 H2DCFDA 加入800μL重悬液,于37℃孵育30min后,于流式细胞仪(FITC通道)检测荧光强度。
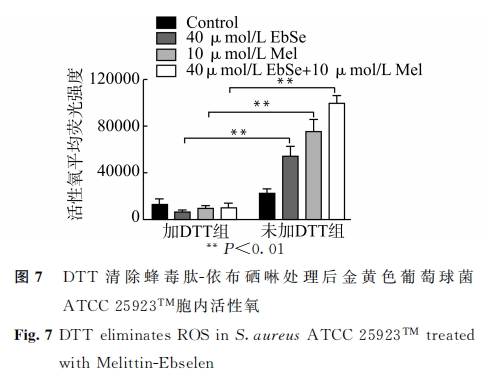
取 上 述 1.4 中 金 黄 色 葡 萄 球 菌 ATCC25923TM ,用 LB培养液调整至 A600nm =0.4。加入4mmol/LDTT 混 匀 后,再 与 不 同 浓 度 梯 度 的 蜂 毒肽、依布 硒 啉、蜂 毒 肽-依 布 硒 啉 孵 育 10 min。同1.9步骤处理后上机检测荧光强度。
使 用 GraphPad Prism 9.0(GraphPad Software)进行统计分析。计量资料用 x±s表示,组间均数比较采用Student’st检验,以P<0.05为差异具有统计学意义。
2 结果
分光光度法检测蜂毒肽与依布硒啉对金黄色葡萄 球 菌 ATCC 25923TM 作 用 的 最 小 抑 菌 浓 度(MIC)。结果显示,蜂毒肽可显著抑制金黄色葡萄球菌 ATCC25923TM 生 长 (P<0.01),MIC 为 10μmol/L。同样,依 布 硒 啉 作 用 于 金 黄 色 葡 萄 球 菌ATCC25923TM 的 MIC为20μmol/L;而2.5μmol/L蜂毒肽联合1μmol/L 依布硒啉则更加明显地抑制细菌生长(P<0.01),使蜂毒肽与依布硒啉的使用浓度分别降低4倍和20倍(图1)。
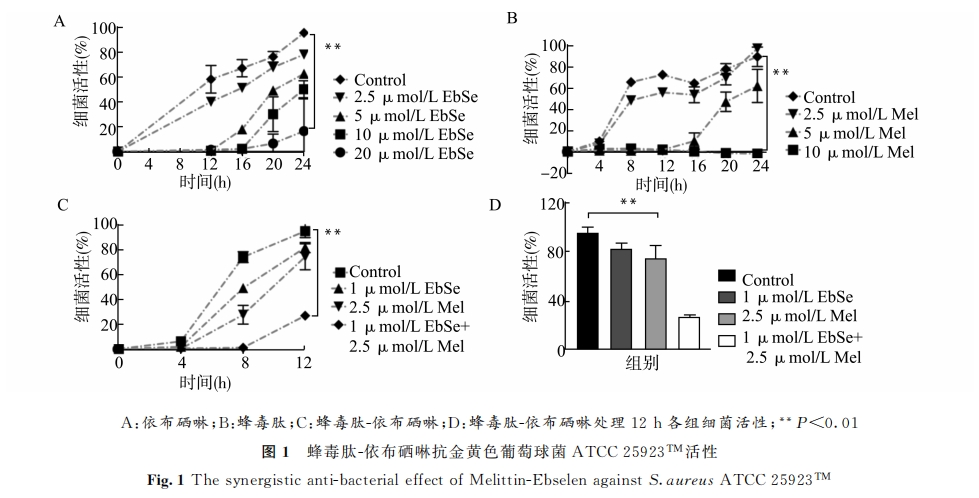
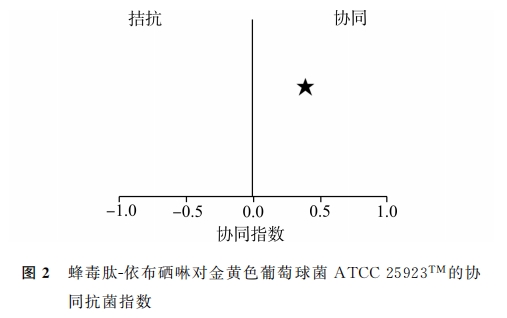
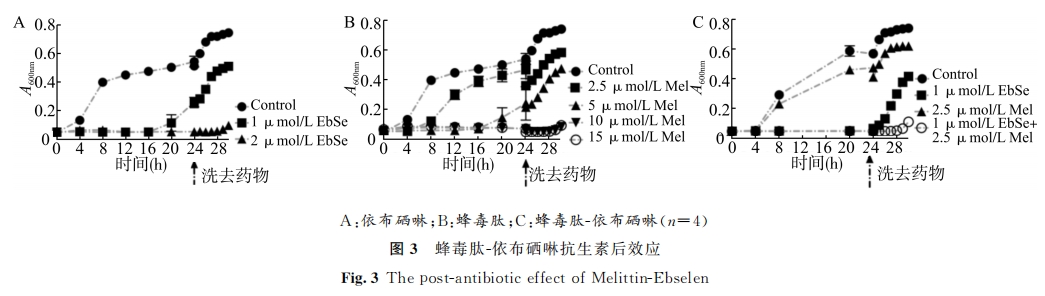
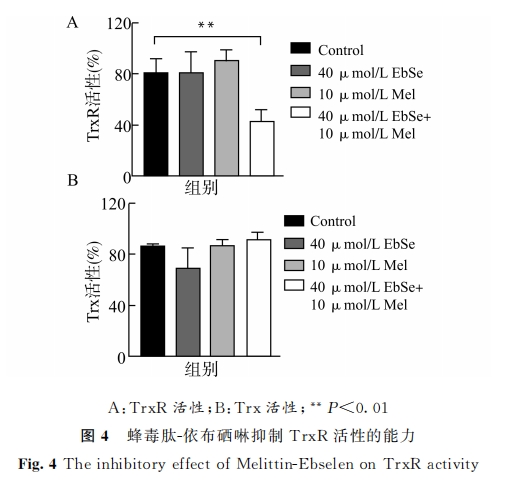

3 讨论
金黄色葡萄球菌作为一种重要的致病性微生物,可导致临床多种感染性疾病,包括骨髓炎、肺炎、心内膜炎等[21],已成为目前院 内 感 染 的 重 要 病 原菌。近年来,由于大量抗生素的广泛使用,由多重耐药性金黄色葡萄球菌引起的感染已对全人类的健康构成极大威胁。蜂毒肽作为抗菌活性物质,近年来备受国内外学者的关注,但其抗菌机制仍不明晰。本实验旨在团队前期研究基础上,首先探讨蜂毒肽的抗菌机制,并以此为契机,进一步联合使用依布硒啉,期待为治疗金黄色葡萄球菌导致的感染提供新的思路。
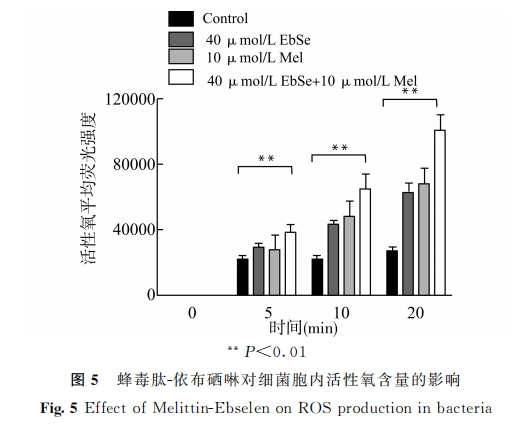
我们在实验中发现,蜂毒肽-依布硒啉组处理后的金黄色葡萄球菌胞内,活性氧产量呈现出先升高后降低的趋势。由此推测,蜂毒肽-依布硒啉可上调活性氧的产生,但随着处理时间延长,细胞膜穿孔破裂导致活性氧向外逸出。查阅文献发现,蜂毒肽不仅具有破坏生物膜的作用[8,22],还可协同膜通透剂或 ATPase抑制剂发挥抗菌活性[23]。同时,透射电镜下直接观察到的细胞膜损伤结果,也可进一步帮助我们解释细菌胞内活性氧产量先升高后降低的原因。
TDRS作为细菌胞内调控氧化还原平衡最重要的系统,与活性氧密切相关。对革兰氏阳性菌来说,其 TDRS就是 Trx系统[17]。因此,金黄色葡萄球菌的 Trx系统的活性可直接影响活性氧稳态。而 Trx系统作为金黄色葡萄球菌的看家基因系统之一,其活性的维持是细菌生长代谢所必需的。因此认为,Trx系统是潜在的抗生素作用靶点。我们团队的前期研究发现,依布硒啉作为一种含硒化合物,可通过影响 Trx系统电子流的传递,破坏细菌胞内氧化还原稳态来发挥抗菌活性[10-16]。这是由于 Trx系统中的 TrxR在原核生物与真核生物之间存在差异,其在原核生物中为低分子不含硒蛋白;同时,在哺乳动物中则为高分子含硒蛋白[24]。在本研究中,我们也通过 DTNB实验证实,蜂毒肽可与依布硒啉协同靶向金黄色葡萄球菌 TrxR。这些结果,进一步为将细菌 TrxR作为药物筛选靶点提供了理论与实践依据。
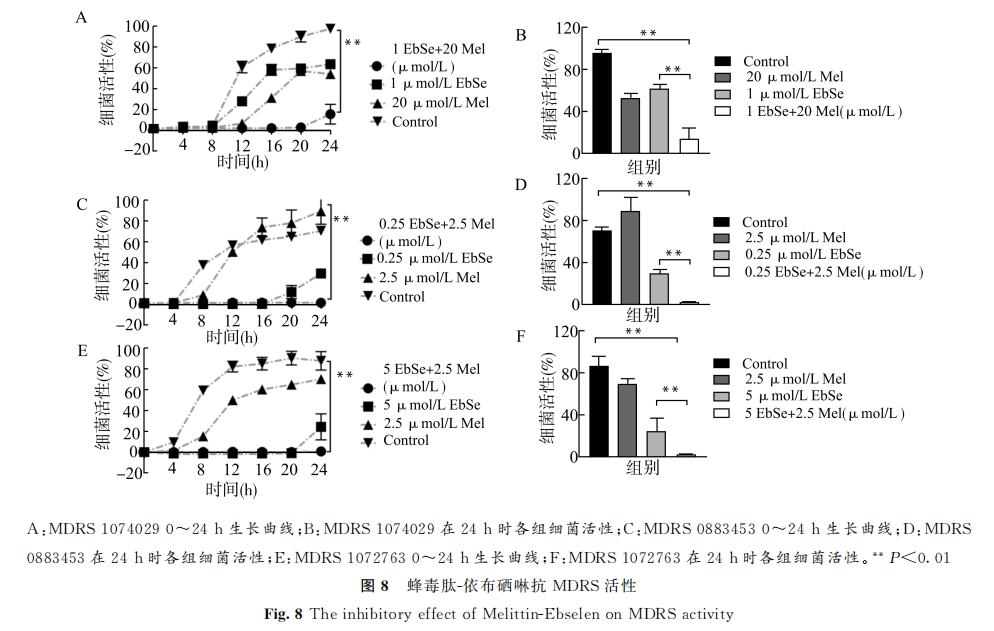
本实验不仅证明了蜂毒肽的强大抗菌活性,也发现其可与依布硒啉发挥协同抗菌活性,并证实蜂毒肽-依布硒啉的协同抗菌靶标为细菌 TrxR,可通过产生时间依赖的活性氧来抑制金黄色葡萄球菌活性。此外,在检测蜂毒肽-依布硒啉对3株临床分离MDRS抗菌活性时发现,由于不同分离株各自的耐药能力与耐抗生素的种类不同,因此蜂毒肽-依布硒啉对3株临床分离株的抑菌浓度各不相同。这一现象值得进一步思考和探索。
未来,笔者认为利用大分子标记和化合物文库构建等更先进技术,可有助于进一步发掘蜂毒肽-依布硒啉的协同抗菌靶点。并且通过基于结构的药物设计来改造先导药物的化学结构,可帮助筛选出更高效安全的抗菌化合物以供进一步的研究。此外,虽然本文的研究结果确认蜂毒肽-依布硒啉具有良好的体外抗金黄色葡萄球菌活性,但是否能在体内获得一致性结果,还有待进一步探索。期待在不久的将来,蜂毒肽-依布硒啉的协同抗菌作用可以得到更多的开发和研究,并深入到临床应用中。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志