
摘要:整合素αvβ3是一种能特异性识别RGD序列的膜受体蛋白,其与含RGD(Arg-Gly-Asp)模体的蛋白质结合的特异性在肿瘤细胞的粘附、迁移、浸润及肿瘤血管新生中起重要作用.由于整合素αvβ3在多种肿瘤细胞表面高表达而在正常细胞中低表达或不表达,因此其成为肿瘤治疗的理想靶点.肿瘤新生血管为肿瘤的生长提供营养,因此近年来抑制肿瘤血管新生也成为肿瘤治疗的重要途径.有研究显示,几种RGD毒素蛋白不但以整合素αvβ3为靶点靶向结合到肿瘤部位从而具有直接抗肿瘤细胞增殖、黏附、迁移及浸润功能,而且它们还具有抗肿瘤血管新生的作用,因此RGD毒素蛋白可从上述两方面抑制肿瘤生长与转移.本文就整合素αvβ3为靶向的RGD配体结构特点及其在肿瘤治疗中的靶向治疗和抗血管新生应用及前景加以综述.
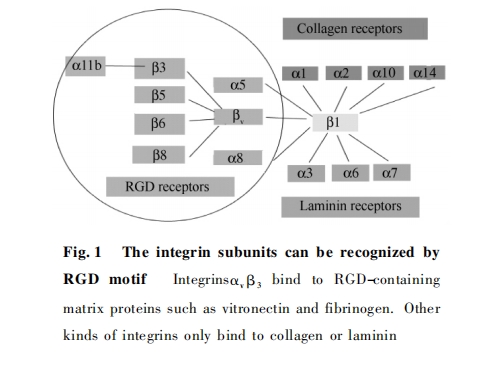
在新生血管内皮细胞和肿瘤细胞表面,最为广泛高表达的整合素是αvβ3.αvβ3与细胞外基质(extracellularmatrix,ECM)结合的配体,通常是ECM蛋白上的RGD模体(RGDmotif).
RGD模体是某些蛋白质分子中的3肽序列Arg-Gly-Asp,为细胞识别的最小结构单位.现已发现,RGD模体广泛存在于细胞外基质的玻连蛋白(vitronectin,VN)、纤连蛋白(laminin,LN)及层连蛋白(fibronectin,FN)中,是细胞表面整合素(integrins)与ECM的结合位点.
除细胞外基质中含有RGD模体外,RGD模体也能被病毒和细菌等病原体所利用[3-5].这些病原体通过RGD与宿主细胞的特定整合素结合,经过细胞吞噬作用进入宿主细胞.此外,在蛇毒、水蛭及蜱类毒腺分泌物质中也发现了RGD模体蛋白.这些来源于动物毒腺的RGD分泌蛋白,可凭借蛋白质一级结构上特有的RGD分子序列,成为细胞外基质与细胞整合素间结合的强效竞争性拮抗剂,进而通过封闭整合素的细胞信号转导通路而抑制血小板聚集,最终达到抑制血管新生,抗肿瘤细胞增殖、黏附、迁移和浸润等作用,并能诱导肿瘤细胞发生凋亡[6].模拟病原体,用人工合成产物研究RGD与整合素的靶向细胞识别和细胞内摄作用,已成为诊断治疗肿瘤,及其药物研发的目标.以整合素为靶点的RGD配体研究,已成为肿瘤病理学和药理学研究热点.
由于αvβ3是较为广泛表达于新生血管内皮细胞和肿瘤细胞表面,而在静止的血管内皮细胞和正常细胞中低表达的整合素,已成为抗血管新生和抗肿瘤药物的作用靶点,针对其进行的RGD配体研究也取得了较好的进展,
1 肿瘤血管新生与转移
肿瘤血管新生与生理性血管新生具有明显不同,这包括异常的血管构造、内皮细胞与周围细胞连接的改变、反常的血流、渗透性的增加、细胞成熟的延迟等.多数肿瘤的增长都起始于无血管小瘤,新血管的形成为肿瘤组织提供了必要的营养与氧气,使肿瘤得以快速生长.
肿瘤细胞通过转移向全身扩散.转移的发生经过几个步骤:首先,肿瘤细胞失去E-钙粘蛋白依赖的细胞间粘附,获得迁移表型并从相邻细胞中脱离,穿过基质膜并侵入到间质基质中;然后,肿瘤细胞穿入血管和淋巴管从而进入循环系统(这个过程叫内渗);最后,肿瘤细胞随血流运行,黏附于血小板和白血球并形成栓子,停留于靶器官的微循环中,从血流中退出(这个过程叫外渗),并在靶器官组织中疯狂生长.
2 αvβ3在肿瘤发展中的功能
能够调节血管新生的信号分子包括生长因子受体、酪氨酸激酶受体、G蛋白偶联受体及整合素,而整合素信号通路在肿瘤血管新生与肿瘤转移中发挥关键作用.整合素表达于血管内皮细胞表面,在血管新生期间调节细胞迁移与存活;而如果整合素表达于肿瘤细胞表面,将通过增强肿瘤细胞穿过血管壁的浸润和运动而促进肿瘤转移.有效的肿瘤浸润需要对浸润前沿处的细胞外基质进行部分降解,基质金属蛋白酶(MMPs)是此过程中起主要作用的酶.αvβ3整合素能与细胞间质成份(如:纤连蛋白、玻连蛋白、血小板反应蛋白)上的RGD序列相结合,可在血管新生期间发生显著上调,而在沉寂的内皮细胞中却无此反应.
整合素αvβ3在肿瘤浸润与转移中具有特异作用,是因为其具有招募和激活MMP-2和纤溶酶的能力,从而对基质膜和间质基质成份进行降解.研究表明,整合素αvβ3在肿瘤细胞表面的表达与多种恶性肿瘤(包括肺癌、乳腺癌、卵巢癌、胶质母细胞瘤及黑色素瘤)的发展进程呈正相关.大量的研究证实,整合素αvβ3在肿瘤生成、转移过程中发挥重要作用[7-8].
3 与αvβ3特异结合的RGD配体及其功能
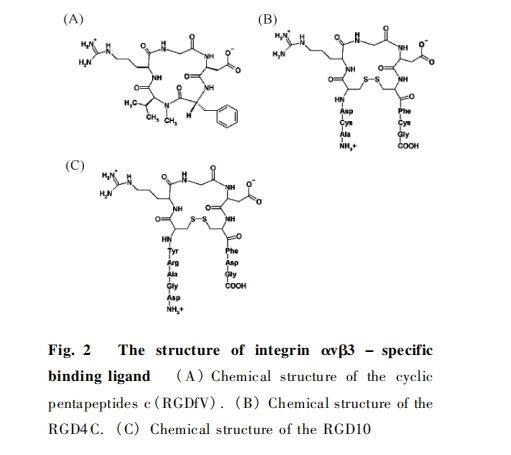
无论是天然的还是合成的RGD肽,其与整合素的亲和性和特异性都取决于RGD氨基酸残基侧链,特别是天冬氨酸的侧链[9].除此之外,这些残基与整合素及RGD周边基团的相互作用也能影响肽链的折叠,从而改变RGD序列的构象特点.RGD的三维构象有利于RGD序列突出分布于药物分子表面,使其发挥更好的靶向作用[10].大多数线形RGD肽在体内循环的半衰期较短,这是因为线形肽链的天冬氨酸残基容易被蛋白酶水解[11],而环化的结构则能够避免上述情况的发生,所以环形RGD肽类更加稳定,且具有更强的受体结合性和受体特异性,因此环化成为提高RGD肽结合能力常用的方法.
c(RGDf-N(Me)-V)又名EMD121974或Cilengitide,是一种环化RGD肽.Cilengitide能在nmol浓度下竞争性抑制玻连蛋白和纤维蛋白原与特定整合素的结合,其与整合素αvβ3的结合能力高于与αIIbβ3整合素结合能力的1000倍[12],这说明其能与αvβ3特异高效结合.Cilengitide的限制性环化结构和插入的D氨基酸残基改变了RGD序列的构象特点,使其更有利于与整合素αvβ3的结合.在Cilengitide的系列衍生物中,由于c(RGDFK)的赖氨酸残基(K)是进行下一步化学结合的理想结构位点,所以其常被用于医疗上的药物传输.
RGD4C是另一种含2个二硫键的RGD肽(ACDCRGDCFCG),其对肿瘤新生血管内皮细胞的抑制能力最强,其抑制能力是含单个二硫键RGD环肽的20倍,是线形RGD多肽的100倍[13].RGD4C已被作为化学药物的载体,成功用于肿瘤血管的靶向治疗[14].RGD4C可作为靶向配体被用于运送细胞增殖抑制药物,也可用重组的方法将其整合到蛋白或病毒中.但是,RGD4C还具有局限性,其能折叠出不同的环状结构,除了典型的二环结构,还有其它的单环和二环结构,而其它结构与整合素的亲和特异性低于典型的二环结构约10倍[15].
通过将RGD配体连接到不同载体系统,可以提高RGD配体的亲和能力和药代动力学.研究[17]表明,RGD多价聚合物在nmol浓度下,与人脐静脉内皮细胞(HUVEC)中的αvβ3整合素的亲和力比单独的RGD提高了250倍.用64Cu标记了2种RGD复合物———RGD肽四聚体和RGD肽八聚体,并在整合素αvβ3高表达的胶质细胞瘤动物模型中进行PET成像.结果显示,与RGD四聚体相比,RGD八聚体对整合素αvβ3的亲和力和结合特异性都明显提高[18].由此可见,RGD在体内的稳定性和药代动力学过程能通过合成RGD多聚体进行提高.此外,多聚体不仅能大幅度提高亲和能力,还能促进细胞的内吞作用,与脂质体、纳米颗粒、蛋白质和其他聚合物载体系统连接的RGD多价聚合物,比单独的RGD肽更有可能通过受体介导的内吞作用进入细胞[19-20].
血管生成是固体瘤生长和粘附的重要过程.激活整合αvβ3可能触发胞内信号通路,促进血管的生长和分化.因此,抑制血管生成被认为是一种很有前途的肿瘤治疗途径.
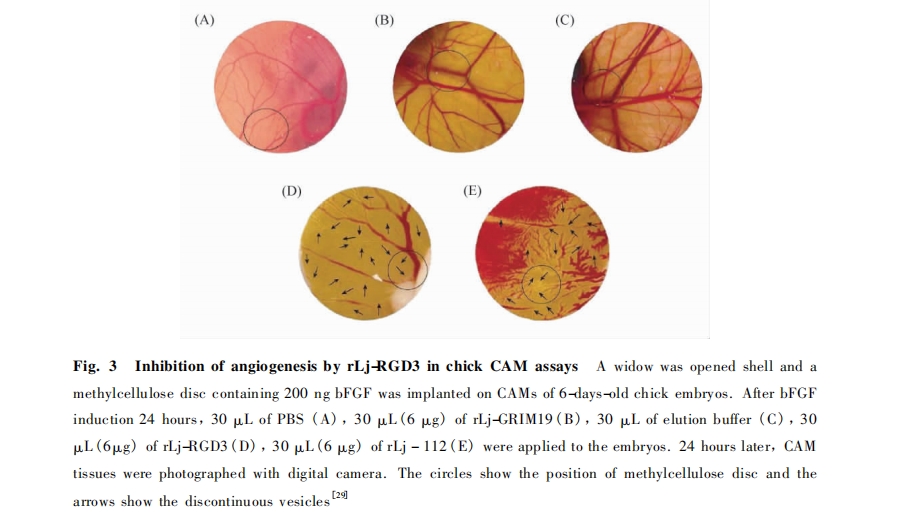
在蛇毒、水蛭及蜱类毒腺分泌物质中已发现了多种RGD模体蛋白.去整合素是指来源于蛇毒的RGD模体毒素蛋白,是目前被研究最为广泛的一种,其种类可根据蛇种来源分为数十种.Triflavin是从竹叶青蛇类分离出的RGD毒素蛋白,能够阻止和抑制人脐静脉内皮细胞的粘附和迁移,并且实验证明,其能通过抑制整合素αvβ3进而有效的抑制血管生成[21].另外,从蝮蛇体内分离出的Contortrostatin[22 RGD毒素蛋白,也是强效的整合素αvβ3拮抗剂,无论是体内还是体外都能强力抑制血管生成,业已证明,与docetaxel联合使用对前列腺癌有较好的抑制效用,此外,还有蛇毒obtustatin,仅包含41个氨基酸分子,是一种低分子量的整合素抑制剂.由于整合素在密集增殖的微血管内皮细胞上高度表达.Obtustain的这种性质显示,其非常适于发展成为抗血管生成途径的抗肿瘤药物[23].来源于水蛭类的Decorsin,是从北美水蛭体内发现的含有39个氨基酸的RGD模体蛋白,Ornatin在水蛭Placobdellaornata体内发现,与Decorsin有40%的同源性,纯化的与重组的Ornati 都含有6个半胱氨酸残基和1个RGD序列.Ornatin能有效的抑制纤维蛋白原与整合素的结[24].来源于蜱类Dermacentorvariabilis的RGD模体毒素蛋白Variabilin,仅有5kD并包含1个RGD模体,其能有效拮抗整合素αIIbβ3和αvβ3[25].Savignygrin从软体蜱Ornithodoros savignyi中发现,它含有1个RGD序列的血小板聚集抑制剂[26].但是,除了在蛇毒中发现的RGD毒素蛋白具有抗血管新生作用,另外的2类RGD毒素蛋白并没有直接的实验证据,表明其对抗血管新生也有效果.
RGD可运载阿霉素(doxorubicin,DOX)到血管新生内皮细胞.体外试验表明,doxo-RGD4C(doxorubicin-RGD4C复合物)和单纯的阿霉素具有相同的治疗作用,除同样具有抑制小鼠体内肿瘤生长、迁移和浸润的功能外[30],还能降低对正常细胞的毒副作用.这其中的原因便在于肿瘤细胞表面高表达某些整合素,尤其是整合素αvβ3高表达于肿瘤细胞表面,而正常细胞内整合素表达量则很低.RGD特异识别高表达的整合素αvβ3,从而造成肿瘤治疗中的靶向定位.现已成功合成了几种doxorubicinRGD4C复合物,以提高阿霉素的靶向治疗;同时,这些复合物还被设计成受肿瘤分泌的酶激活的药物前体,以进一步降低其毒副作用,并提高肿瘤靶向特异性[31].例如,现在已研究出一种具有纤溶酶特异作用位点的药物前体,使得药物前体在整合素αvβ3上积聚后由纤溶酶水解并释放母体药物,从而使阿霉素恢复细胞抑制活性.这种药物前体和纤溶酶的作用效果已经在体外细胞培养的实验中得到证实.几种RGD肽靶向的阿霉素药物前体中,单环的RGD4C配体比二环的RGD4C对整合素表现出更高的亲和性,此结果与3.1论述的结果相反[32].同时,单环RGD4C肽比二环RGD4C肽水溶性更佳,因此现在的阿霉素复合物均用RGD单环肽制备而成.
此外,紫杉醇(PTX)药物前体中含有二价的c(RGDyk)结构域.实验证实,复合物PTX-RGD2在MDA-MB-435乳腺肿瘤与整合素结合的积聚量,与单纯的PTX的RGD肽二聚体相同[33].因此,其可通过RGD与整合素αvβ3结合而提高肿瘤治疗的靶向性.
RGD与携带阿霉素的脂质体连接也可用于整合素αvβ3的靶向治疗.有研究者[34]对RGD類似物(RGDm)修饰的稳定脂质体(stabilizedliposomes,SL)携带阿霉素在肿瘤部位的积聚,以及向肿瘤细胞内传递的情况进行了研究.流式细胞实验和激光共聚焦的结果显示,与SL-DOX相比,细胞对RGDm-SL-DOX的结合及摄取均显著增加.这表明,RGDm修饰的SL可作为特定药物靶向载体,其通过受体介导的方式将药物分子有效靶向至特定肿瘤部位.除此之外,也有以聚乙二醇(PEG)作为连接物连接RGD和脂质体的报道.另有文献报道,上文中提到的RGD10被类脂分子改良后,更容易进入包含阿霉素的脂质体[35].而C26肿瘤模型实验也证明,这些脂质体的连接和内化比单纯的阿霉素具有更好的抑瘤效果.
3.3.2RGD介导的核酸靶向转染 RGD引导核酸转染的能力在体内体外都获得证实.RGD 引导核酸转染的方式有2种:一是RGD肽共价结合于PEI,然后再将RGD修饰的PEI与DNA或siRNA形成共聚物;另一种是将RGD肽链直接与聚合物主链合成在一起(RGD-PEG-PEI)[36].RGD靶向的核酸载体则包括非病毒类和病毒类2种,非病毒类核酸载体包括阳离子聚合物、阳离子脂质体和阳离子肽类等,病毒类核酸载体则有腺病毒途径和非腺病毒途径[37,38].
4问题与展望
自从发现血管新生是肿瘤生长的重要因素,肿瘤新生血管问题成为公认的治疗癌症的有效目标.αvβ3整合素在新生血管表面表达,但不是在EC细胞表面表达,这种有限的表达使其成为理想的靶点.为了开发这种靶向药物运输的特性,目前的研究将αvβ3整合素的识别序列RGD肽插入蛋白质、聚合物、脂质体、病毒和其他的基因运输载体,通过其靶向作用,将小分子药物、核酸类药物等运输至细胞内.而这种化学合成和重组体聚合物的途径都是可行的,都能促进药物靶向领域中RGD介导的药物运输的广泛应用.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志