
摘要 本文以三代聚谷氨酸肽类树枝状分子(G3-Glu)为大分子引发剂, 引发 N-羧基-L-苯丙氨酸-环内酸酐(NCA-Phe)的开环聚合反应, 制备聚谷氨酸树枝状大分子-聚苯丙氨酸嵌段共聚物. 嵌段共聚物通过自组装形成以聚苯丙氨酸链段为核, 聚谷氨酸树枝状大分子为壳的胶束. 将抗肿瘤药物阿霉素负载到高分子胶束中, 研究其药物释放性能及体外抗肿瘤效果. 结果表明, 共聚物胶束具有良好的生物相容性. 载药胶束具有药物缓释效果, 药物持续释放时间可达 60 h. 载药胶束的体外抗肿瘤实验表明其对肝癌细胞 HepG2 具有很好的杀灭效果, 共培养 48 h 后对癌细胞的杀死率可高达 75%.
自组装在新型功能材料的构筑中已显示出巨大的潜力[1, 2]. 合成多肽分子通过自组装形成的材料在其结构、形貌和性能上具有无可比拟的优势[3]. 合成多肽自组装材料不仅可以形成球形、棒状、线性及囊泡等不同的结构和形态[4~7], 并且还具有各种特异性的物理、化学或生物学功能[4, 8, 9]. 以天然氨基酸为原料的合成多肽, 由于其良好的生物相容性和生物降解性, 已成为一类重要的生物医用材料, 在疾病诊治和组织修复等生物医学领域发挥着重要的作用. 利用肽类大分子自组装构建的药物/基因传输载体材料可被赋予优越的智能环境响应和靶向功能性[10~12]; 多肽自组装水凝胶在组织修复中显示出很好的组织再生诱导效果[13~15].
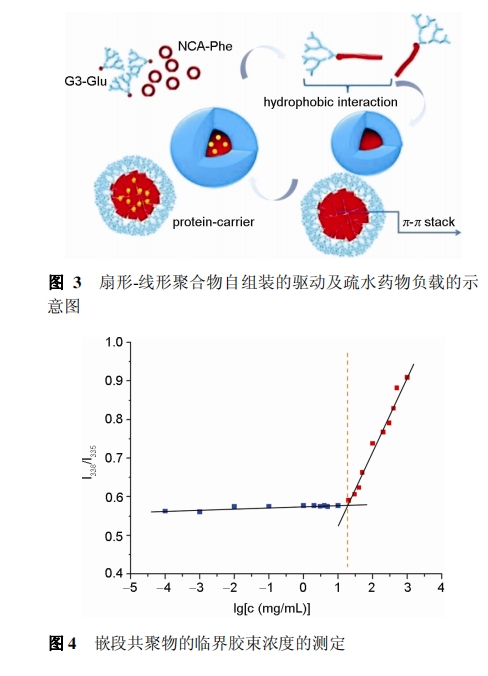
肽类树枝状大分子除了具有普通树枝状大分子特征如规整性、高度支化、表面高密度官能团、纳米尺度、分子量单一等外, 还具有类似蛋白的结构, 以及大量外围官能团赋予的良好水溶性[16]. 基于肽类树枝状大分子双亲性嵌段共聚物自组装构建的胶束与传统的线形双亲性嵌段共聚物自组装形成的高分子胶束相比, 不仅具有更高的稳定性, 其外围具有更多可供修饰的官能团, 有利于进一步进行智能、靶向等功能的修饰. 例如, 树枝状大分子嵌段聚合物在相行为上与线形嵌段聚合物就存在明显差异[17]; 通过外围的树枝状分子以改善自组装体的溶解性能, 从而改变了自组装体的物理、化学特性[18]; 利 用 dendron-like/linear/dendron-like 嵌段聚合可 构筑形态均一的自组装载体, 并用作药物缓释的载体[19].
2 实验部分
叔丁氧羰基-谷氨酸(Boc-Glu-COOH), 谷氨酸双苄酯(H-Glu(OBzl)-OBzl), 1-乙基-(3-二甲基氨基丙基)碳二亚胺(EDC), 1-羟基苯并三唑(HOBT), N,N-二异丙基乙胺(DIEA), 三氟乙酸(TFA), 苄氧羰基-苯丙氨酸(N-Cbz-Phe), 四氢呋喃, 二氯甲烷, 正己烷, 乙酸乙酯, 乙醇, NaHCO3, NaHSO4, NaCl, 无水 MgSO4, DMEM(高糖)细胞培养基等.
核磁共振波谱仪(NMR, Bruker AV-400); 傅立叶红外光谱仪(FTIR, Necolet PE Spectrometer); 时间飞行质谱(TOF, Bruker Autoflex III); 超声波清洗器(KQ-300DE); 扫描电子显微镜(SEM, JSM-5900LV); 透射电子显微镜(TEM, JEM-100CX); 动态光散射仪(DLS, Malvern Zetasizer Nano ZS); 激光共聚焦扫描显微镜(CLSM, Leica TCP SP5).
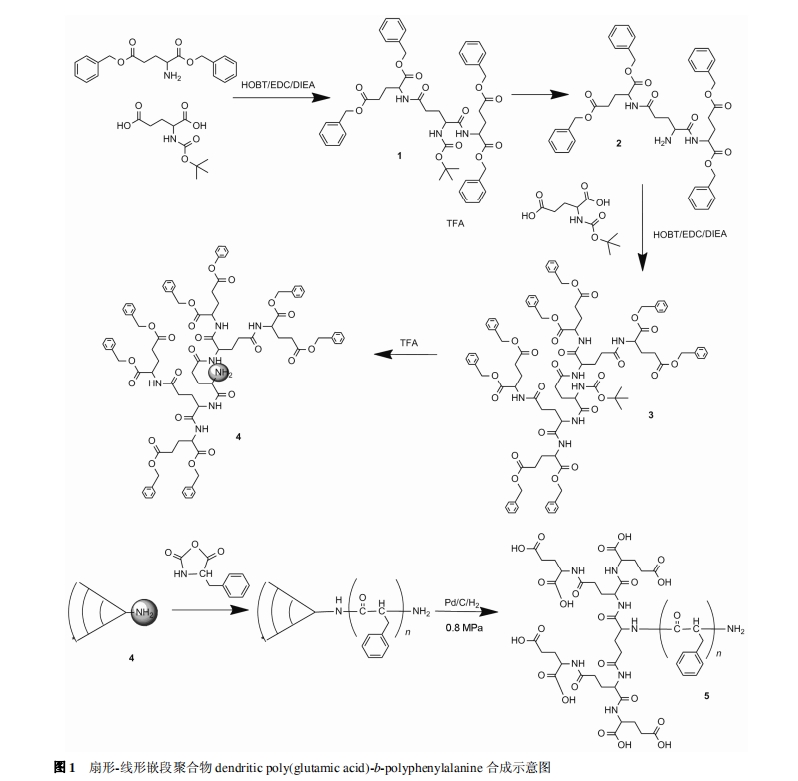
谷氨酸二代(G2-Glu)在氮气保护下, 用 TFA 脱除 Boc 保护, 减压除去 TFA, 得到产物 2. 产物 2 在氮气保护下加入到 Boc-Glu-COOH 中, 通过 HOBT/ EDC/DIEA 催化缩合 , 常温反应 24 h. 用饱和NaHCO3 溶液、NaHSO4 溶液、饱和 NaCl 溶液反复洗涤数次. 利用硅胶柱过柱分离, 得到聚谷氨酸三代树枝状大分子(G3-Glu)(产物 3, 图 1).
聚谷氨酸三代树枝状大分子(G3-Glu)在氮气的保护下, 用 TFA 脱除 Boc 保护, 减压除去 TFA 得到产物 4. 将产物 4 在 NaOH 醇溶液中调节 pH 值, 充分搅拌, 旋干溶剂, 将固体溶于 CH2Cl2, 滤除固体, 将滤液旋干待用.
2.4.2 N-羧基-L-苯丙氨酸-环内酸酐(NCA-Phe)的合成
称取无水干燥的苄氧羰基-苯丙氨酸(Cbz-Phe), 在氮气保护下溶于 20 mL 无水 THF 中, 升温至 40 ℃; 将 SOCl2 滴入上述反应体系, 反应 4 h. 把反应液加入过量无水正己烷中, 低温静置 12 h. 将得到的白色沉淀用无水乙酸乙酯/无水正己烷反复重结晶 3 次, 真空干燥得到白色针状晶体.
按照摩尔比 1:10 的比例, 准确称取干燥处理后的大分子引发剂和 L-Phe-NCA 投入反应瓶中, 抽真空后通入氮气保护. 加入 DCM/DMF 混合溶剂, 室温反应 48 h, 得到产物 5. 在压力约为 0.8 MPa 的高压釜中, 以 Pd/C 为催化剂, 加入 H2, 室温反应 24 h, 脱去 OBzl. 过滤分离, 减压除去溶剂和苄醇.
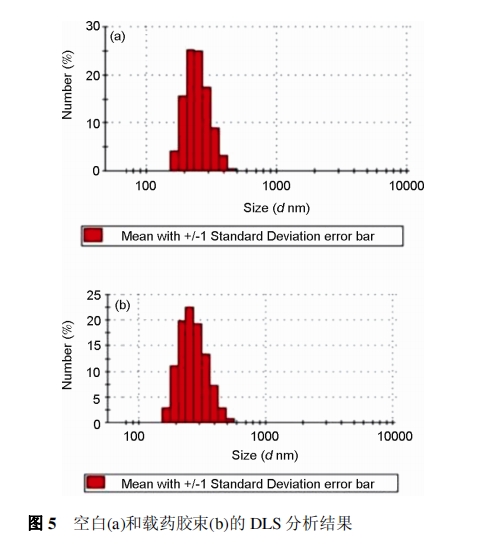
以芘为荧光探针测定自组装胶束的临界胶束浓度, 在固定的荧光激发波长下, 测定 I338 和 I335 处的荧光吸收值.
将嵌段共聚物溶于甲醇中, 在超声条件下缓慢滴加到去离子水中, 静置, 减压除去甲醇. 按照比例将嵌段共聚物和阿霉素配成甲醇溶液, 在超声条件下缓慢滴加到去离子水中, 在 4 ℃下透析 24 h, 冷冻干燥后备用.
准确称取一定量的载药胶束, 溶于良溶剂中, 测定该溶液在波长 485 nm 处的荧光吸收值, 依据标准吸收曲线计算载药胶束中阿霉素的量.
精确称取载药胶束溶于 PBS 缓冲溶液中(pH 7.4), 配成 1 mg/mL 溶液. 设置 3 组样, 在截留分子量为2000 Da 的透析袋中加入 1 mL 的缓冲溶液, 置于 25 mL 37 ℃的 PBS 中. 根据不同时间, 取出 1 mL 释放介质, 同时补充 1 mL PBS 溶液. 测定介质在波长 485 nm 处的荧光吸收值, 绘制载阿霉素胶束的体外释放曲线. 并测定对照组盐酸阿霉和阿霉素的释放曲线.
将 3T3 细胞接种于 3 块 96 细胞培养孔板(T = 12 h, 1×104个/孔; t = 24 h, 5×103个/孔; t = 48 h, 3×103个/孔). 培养 24 h 后, 加入空白胶束, 浓度分别为 150, 100 和 50 µg/mL, 每个浓度设置 3 个平行样, 并设置对照组. 3T3 细胞在培养基中分别培养 12、24 和 48 h后, 用 PBS 缓冲溶液(pH 7.4)冲洗后并更换新鲜的培养基, 加入 CCK-8, 继续培养 2 h, 在酶标仪测定 490 nm 处的吸光值, 计算细胞存活率.
取 HepG2 细胞, 加培养液稀释, 按 1 × 104 个/孔的细胞密度接种于玻璃培养皿中, 待细胞贴壁生长后, 加入载药胶束, 阿霉素的浓度为 10 µg/mL. 细胞培养2 h后, 用激光共聚焦显微镜(CLSM)观察体外细胞摄取载药胶束的情况. 激发光波长为 485 nm, 散射光波长为 595 nm.
取 HepG2 细胞, 按取点测定时间在每孔加培养液稀释 t = 12 h, 1 × 104 个/孔; t = 24 h, 5 × 103 个/孔; t = 48 h, 3 × 103 个/孔. 加入载药胶束, 控制阿霉素的终浓度分别为 15, 10 和 5 µg/mL. 分别培养 12、24 和48 h 后, 用 PBS 缓冲溶液清洗 3 次, 置换入新鲜的培养液, 加入 CCK-8 并轻微震荡, 继续培养 2 h, 在酶标仪 490 nm 测定吸光度, 计算细胞存活率.
3 结果与讨论
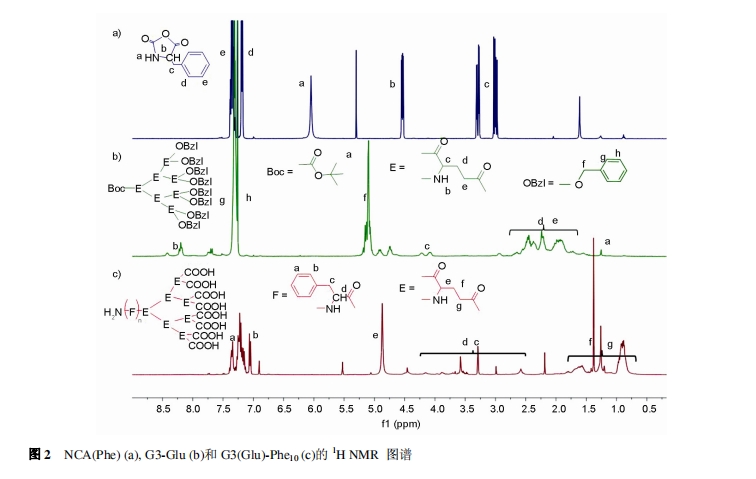
两亲性不对称拓扑结构的肽类树枝状嵌段聚合物, 通过以三代谷氨酸扇形分子 G3(Glu)-NH2 为大分子引发 NCA-Phe 的开环聚合合成, 如图 1 所示. 利用纯化过的 G3(Glu)-NH2 在严格无水的条件下引发NCA 的开环聚合. 利用 1H NMR 对合成过程中的重要产物进行结构表征.

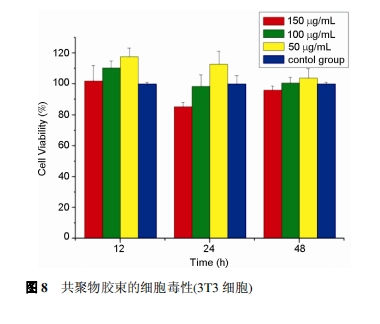
胶束细胞毒性的结果如图 8 所示. 通过 3 个浓度梯度(50, 100 和 150 μg/mL)及 3 个时间点(12、24 和48 h)的检测评价发现, 小鼠 3T3 成纤维细胞的存活率均未出现明显降低, 说明胶束对3T3细胞没有明显的细胞毒性, 具有很好的生物相容性.
阿霉素只有进入肿瘤细胞的细胞核才能发挥药效. 为了研究载药胶束是否具有抗肿瘤效果和细胞内缓释作用, 通过激光扫描共聚焦显微镜(CLSM)观察了肝癌细胞 HepG2 对载药胶束的吞噬.
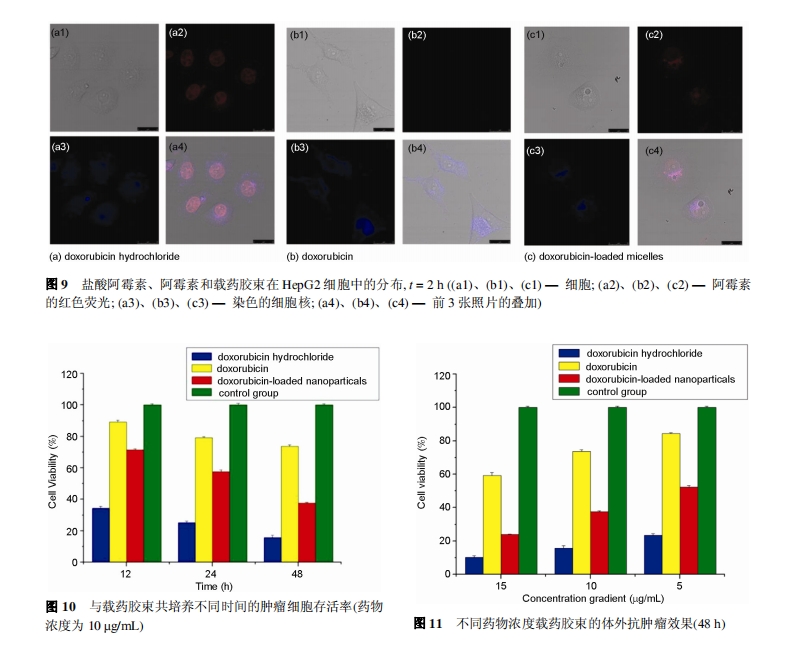
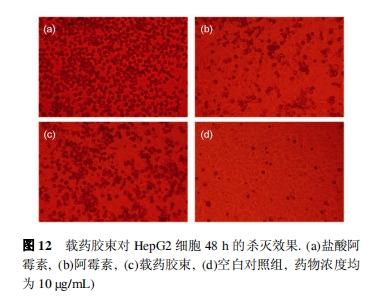
图 12 为 HepG2 肿瘤细胞在与盐酸阿霉素(a)、阿霉素(b)、载药胶束(c)及空白对照组(d)共培养 48h 时的光镜照片. 图 12(a)显示盐酸阿霉素导致大量的肿瘤细胞死亡, 悬浮在培养基中, 培养基底部基本没有附着生长的肿瘤细胞; 图 12(b)中有少量死亡的肿瘤细胞悬浮于培养基中, 但底部还有大量的细胞贴壁生长, 呈现良好的细胞形态; 图 12(c)中显示了载有阿霉素胶束的抗肿瘤效果明显好于阿霉素,有大量悬浮的死亡肿瘤细胞和少量贴壁生长的肿瘤细胞.
以聚谷氨酸树枝状大分子-聚苯丙氨酸嵌段共聚物为自组装单元构建的胶束, 具有良好的生物相容性. 与典型的线形高分子自组装载药胶束相比, 由不对称拓扑结构的嵌段聚合形成自组装胶束, 除了亲疏水作用外, 同时还协同了共轭作用、空间效应等作用, 显示出良好的稳定性、缓释及体外抗肿瘤效果. 自组装胶束外围大量的化学活性官能也为进一步功能化修饰提供了可能性.
4 结论
本文通过大分子引发剂合成了聚谷氨酸树枝状大分子-聚苯丙氨酸嵌段共聚物, 共聚物自组装成为高分子胶束. 共聚物胶束具有良好的生物相容性. 载药胶束具有药物缓释效果, 药物持续释放时间可达60 h. 载药胶束的体外抗肿瘤实验表明其对肝癌细胞HepG2 具有很好的杀灭效果, 共培养 48 h 后对癌细胞的杀死率可高达 75%. 通过对这类肽类树枝状大分子胶束的功能化, 可望赋予其智能、靶向等功能, 作为新型的药物释放载体.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志